Журнал неорганической химии, 2020, T. 65, № 3, стр. 334-359
Виды изомерии в солях и комплексах с кластерными анионами бора [B10H10]2– и [B20H18]2–
В. В. Авдеева a, *, Е. А. Малинина a, Н. Т. Кузнецов a
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
* E-mail: avdeeva.varvara@mail.ru
Поступила в редакцию 11.10.2019
После доработки 18.10.2019
Принята к публикации 28.10.2019
Аннотация
Рассмотрены виды изомерии, присутствующие в соединениях с кластерными анионами бора [B10H10]2– и [B20H18]2–: позиционная изомерия (встречается в комплексных соединениях кластерных анионов бора и связана с положением одного или двух атомов металла вокруг объемного борного кластера); изомерия положения функциональных групп заместителей в замещенных производных кластерных анионов бора; изомерия борного скелета, связанная с различным строением димерного борного кластера [B20H18]2–; связевая изомерия, возникающая при реализации различных типов связывания металла с кластерными анионами бора в комплексах. Кроме того, приведены примеры изомеров катионных комплексов при внешнесферном положении кластерного аниона бора, а также показана изомерия, связанная с дентатностью функционального заместителя в борном кластере. Геометрия борного кластера приводит к тому, что в кристаллах соединений могут сокристаллизовываться энантиомеры. Для каждого вида изомерии синтезированы пары изомеров, строение которых определено методом РСА монокристаллов.
ВВЕДЕНИЕ
В комплексах металлов зачастую можно встретить явление изомерии – способность образовывать соединения, обладающие одинаковой химической формулой и составом, но имеющие различное строение. В свою очередь, различие в строении обусловливает разные физико-химические свойства образующихся соединений, что объясняет интерес химиков к получению подобных соединений. Молекулярный дизайн изомеров предоставляет широкие возможности варьирования свойств соединений в зависимости от их строения.
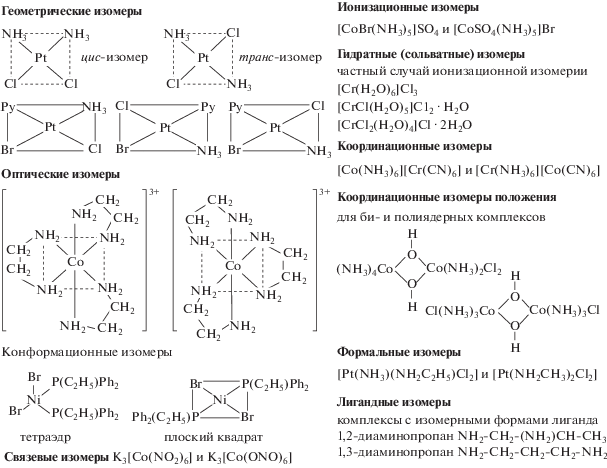
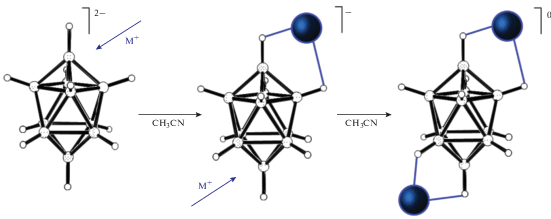
Можно выделить два вида изомерии: изомерию комплексов, при которой состав внутренней сферы металла и строение лигандов, координированных к металлу, не меняются (геометрическая или цис-транс, оптическая или зеркальная, связевая, конформационная изомерия), и изомерию, связанную с изменением состава координационной сферы металла или строения лигандов (гидратная, ионизационная, координационная, формальная, лигандная). Примеры соответствующих изомеров представлены на рис. 1.
Указанные виды изомерии комплексов подразумевают классический подход к координационным соединениям в рамках координационной теории А. Вернера, предложенной автором в 1893 г. Согласно этой теории, в центре комплексного соединения расположен металл-комплексообразователь, вокруг которого находятся координированные им лиганды. Взаимное расположение лигандов вокруг атома металла-комплексообразователя ведет к изменению внутренней координационной сферы металла и обусловливает существование различных видов изомеров.
Авторы [1–4] проводят систематические исследования реакционной способности кластерных анионов бора [BnHn]2– (n = 10, 12) в реакциях комплексообразования и замещения концевых атомов водорода на различные функциональные группы. На основании анализа полученных данных установлено, что кластеры бора образуют внутреннюю сферу металлов, которые относятся к “мягким кислотам” по Пирсону [5] (медь(I), серебро(I), золото(I), свинец(II) [6, 7]), что приводит к синтезу комплексов металлов, в том числе смешанолигандных. Наоборот, с металлами-комплексообразователями в высоких степенях окисления (Fe(III), Co(III), Cu(II)), которые относятся к “жестким кислотам” по Пирсону, кластерные анионы бора проявляют свойства восстановителей, снижая степень окисления металла, а в некоторых случаях (для клозо-декаборатного аниона) приводят к получению замещенных производных [8]. В комплексных соединениях металлов, занимающих промежуточное положение между “жесткими” и “мягкими” кислотами (Fe(II), Co(II), Ni(II), Mn(II)), кластерные анионы бора образуют внешнюю сферу.
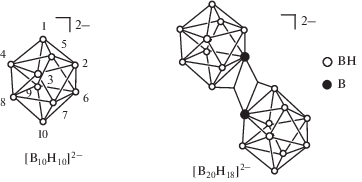
Для кластерных анионов [B10H10]2– и [B20H18]2–, представляющих собой объемные правильные многогранники (рис. 2), можно синтезировать позиционные изомеры комплексных соединений металлов с координированными кластерами бора, т.е. соединений с различным расположением атома/атомов металлов вокруг объемного борного кластера. Отметим, что аналогичные изомеры возникают в замещенных производных клозо-декаборатного аниона с различным расположением функциональных групп (одной или нескольких). Фактически изомеры комплексов [M2[B10H10]] (М – атом металла) и солей анионов [B10H8X2]2– (Х – функциональная группа заместителя) можно считать аналогами с точки зрения позиционной изомерии, связанной с различным положением двух атомов металла или двух функциональных групп заместителя вокруг полиэдра бора. При этом в кристаллах соединений с кластерными анионами бора присутствуют сокристаллизованные энантиомеры; для них в статье приводится положение координирующих атомов бора в скобках, а на рисунках указан вид сверху для энантиомерных пар.
Рис. 2.
Строение анионов [B10H10]2– и [B20H18]2–. Для аниона [B10H10]2– указана нумерация атомов по ИЮПАК.
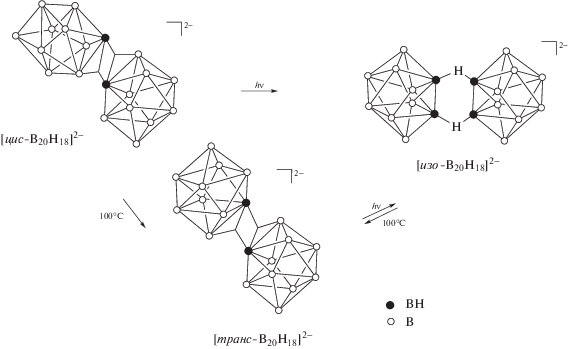
В соединениях с димерным кластером [B20H18]2– возможно существование нескольких видов изомерии. Помимо позиционной изомерии (расположение атомов металлов вокруг борного кластера) возможно образование связевых изомеров, так как кластер бора может быть связан с атомом металла не только трехцентровыми двухэлектронными связями (МНВ), когда все три атома вовлечены во взаимодействие друг с другом, но и трехцентровыми двухэлектронными связями через мостиковый атом водорода М–Н–В; при этом угол МНВ практически развернут. Кроме того, димерный кластер существует в виде трех изомеров: [цис-B20H18]2–, [транс-B20H18]2– (геометрические изомеры) и [изо-B20H18]2– (связевый изомер, в котором обнаруживается наличие новой связи ВНВ) [9–12], что позволяет говорить об изомерии борного скелета.
Помимо указанных видов изомерии, возникающих за счет особенностей строения борных кластеров, в результате различий в координационной сфере металла-комплексообразователя синтезированы соединения с внешнесферным клозо-декаборатным анионом. Образующиеся при этом изомеры согласуются с представленными на рис. 1.
Цель настоящей работы – обобщение данных, полученных на основании анализа строения ряда изомерных соединений с кластерными анионами бора, обсуждение способов синтеза и особенностей их строения на примере соединений с анионами [B10H10]2– и [B20H18]2–.
ПОЗИЦИОННАЯ ИЗОМЕРИЯ В ПОЛИМЕРНЫХ КОМПЛЕКСАХ С клозо-ДЕКАБОРАТНЫМ АНИОНОМ
Кластерные анионы [BnHn]2– (n = 10, 12) образуют полимерные анионные комплексы меди(I) и серебра(I) состава Cat[M[B10H10]] (M = Cu, Ag) с крупными органическими катионами (Cat), такими как Ph4P+, NHx${\text{R}}_{{4 - x}}^{ + }$ (x = 0–4), и катионами щелочных металлов K+ и Cs+. Структуры полимерных анионных комплексов построены из полимерных цепочек, образованных чередованием кластерных анионов бора, координированных атомами металла по ребрам борного кластера, которые выступают в роли мостиковых лигандов. Таким образом, в соединениях образуются полимерные цепи …кластер–металл–кластер–металл–…
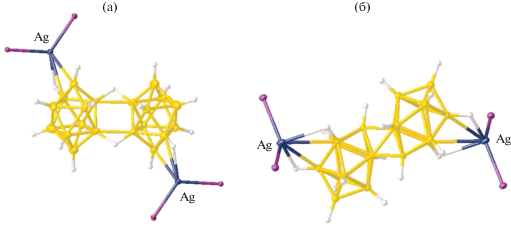
Методом РСА изучено строение анионных комплексов меди(I) {K[Cu[B10H10]}n [13], {Cs[Cu[B10H10]]}n [14], {Cs[Ag[B10H10]]}n [15] и {Me2NH2[Cu[B10H10]]}n [15]. В клозо-декаборатокупрате диэтиламмония {Me2NH2[Cu[B10H10]]}n [15] атомы меди координируют кластерные анионы бора по апикальным ребрам B1–B2 и 7(8)–10 (рис. 3а), а в клозо-декаборатокупрате цезия {(C2H5)3NH[CuB10Н10]}n – по апикальному ребру B1–B2 и ребру, соединяющему два экваториальных пояса 3–7 (5–8) (рис. 3б) [15]. Аналогичная координация аниона [В10Н10]2– к атому меди(I) по апикальному ребру 1–2 и ребру 3–7 (5–8) установлена для анионного комплекса {Cs[Cu[B10H10]]}n [16].
Рис. 3.
Фрагмент структуры комплексов меди(I) {(CH3)2NH2[CuB10H10]}n (а) и {(C2H5)3NH[CuB10Н10]}n (б).
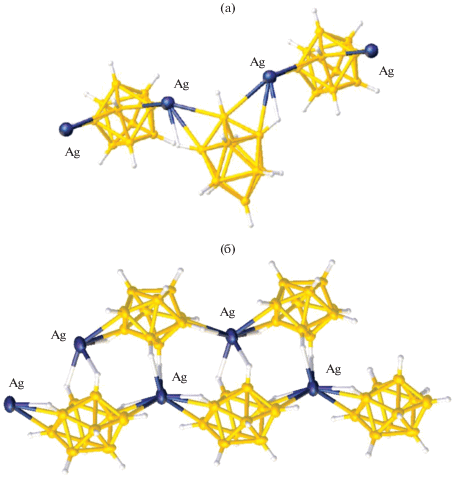
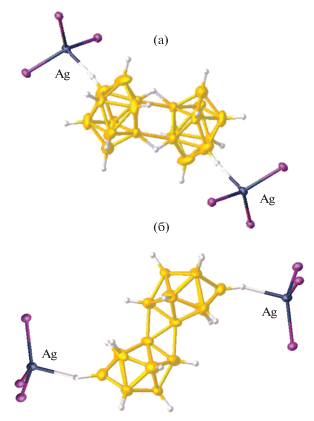
Полимерные анионные комплексы серебра Cat[Ag[B10H10]] построены из одинарных или двойных полимерных цепочек, аналогичных обнаруженным в комплексах меди(I). В окружение атома серебра в соединении {Cs[Ag[B10H10]]}n [15] входят апикальные ребра двух борных полиэдров и два более длинных взаимодействия с вершинами соседних кластерных анионов, что приводит к КЧ серебра 4 + 2 (рис. 4а). При этом каждый кластерный анион бора координирован к атомам металла апикальными ребрами 1–2 и 1–4 при одной апикальной вершине, что приводит к образованию зигзагообразной одинарной полимерной цепочки. В комплексе серебра(I) с органическим катионом {(C2H5)3NH[Ag[B10H10]]}n [15] атом металла координирует одновременно три клозо-декаборатных аниона по двум типам ребер (рис. 4б): два аниона ребрами при апикальных вершинах 1–2 или 7(8)–10 и один – ребром, соединяющим два экваториальных пояса 3–6 (5–9). При этом соединение построено из двойных полимерных цепочек, состоящих из атомов металла и координированных им клозо-декаборатных анионов.
Отметим, что наличие вторичного или третичного алкиламмониевого катиона в составе комплекса Cat[М[B10H10]] оказывает влияние на строение элементарной ячейки соединения. NH-группы катиона участвуют в катион-анионных взаимодействиях с ВН-группами бороводородного аниона, связывая анионные цепочки между собой.
Во всех описанных соединениях Cat[M[B10H10]] реализуется реберная координация клозо-декаборатного аниона к атомам металла. При этом кластерный анион бора координируется апикальными ребрами 1–2, 1–4, 7(8)–10 или ребрами, соединяющими экваториальные пояса 3–6 (5–9) и 3–7 (5–8). Во всех случаях в скобках указаны соответствующие энантиомеры.
Кроме того, синтезирован полимерный анионный комплекс меди(I) {Ph4P[Cu[B10H10]]}n [17] (рис. 5а). В структуре данного комплексного соединения обнаружено другое строение полимерной цепочки, образованной чередующимися клозо-декаборатными анионами, которые координированы атомами меди по двум экваториальным атомам – 2 и 7(8). В полученном соединении впервые обнаружена координация клозо-декаборатного аниона по атому. Таким образом, полученную полимерную цепочку можно рассматривать как связевый изомер описанных в литературе комплексов Cat[M[B10H10]].
Рис. 5.
Строение полимерных цепей {[M[B10H10]–}n в соединениях {Ph4P[Cu[B10H10]]}n (а) и {(Pr4N)[Ag(B10H10)]}n (б).
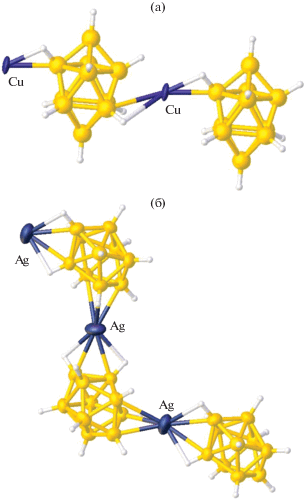
Координация атома металла в полимерных комплексах по грани борного полиэдра впервые обнаружена для комплекса серебра {(Pr4N)[Ag(B10H10)]}n [18]. В нем присутствует зигзагообразная полимерная цепочка, образованная анионами [B10H10]2–, которые координированы атомами серебра асимметрично по апикальным граням полиэдра 1–2–3 и 6–9–10 при противоположных апикальных вершинах (рис. 5б).
Таким образом, на настоящий момент для полимерных анионных комплексов {Cat[M[B10H10]]}n (M = Cu, Ag) известны примеры координации клозо-декаборатного аниона по атому, ребру и грани борного кластера.
ПОЗИЦИОННАЯ ИЗОМЕРИЯ В МОНОЯДЕРНЫХ КОМПЛЕКСАХ С клозо-ДЕКАБОРАТНЫМ АНИОНОМ
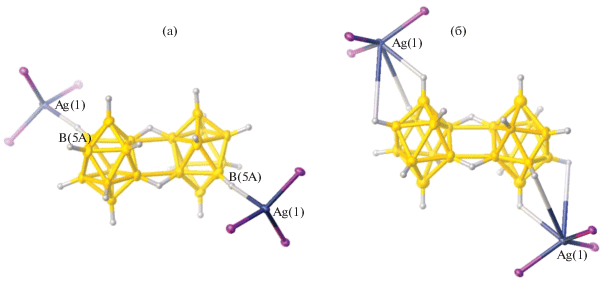
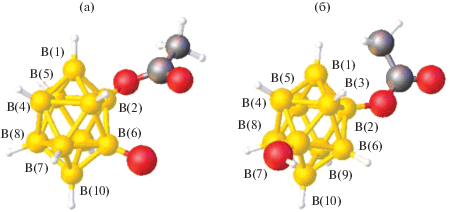
Клозо-декаборатный анион может образовывать большое число смешанолигандных моноядерных и биядерных комплексов металлов, в которых бороводородный кластер является мостиковым лигандом, а органические лиганды L выполняют роль концевых лигандов. При изучении реакций комплексообразования серебра в присутствии трифенилфосфина из смеси [Bu4N]2[B10H10] + [Bu4N]2[B10H9Cl], содержащей соль аниона [B10H10]2– и его монохлорзамещенного производного, синтезированы два позиционных изомера моноядерных анионных комплексов [Ag[B10H10](PPh3)2]− и [Ag[B10H9Cl](PPh3)2]−, сокристаллизующихся в составе [Ag(PPh3)4][Ag[B10H10 –xClx](PPh3)2] (x = 0 или 1). Катионная часть комплексов представляет собой катионный комплекс серебра(I) [Ag(PPh3)4]+ [19]. Комплексы [Ag(PPh3)4][Ag[B10H9.14Cl0.86](PPh3)2] и [Ag(PPh3)4][(PPh3)2Ag[B10H9.5Cl0.5]] селективно получены из растворов ацетонитрила и ДМФА соответственно. Строение изомеров замещенного аниона [Ag[B10H9Cl](PPh3)2]− в составе комплексов показано на рис. 6.
Рис. 6.
Строение моноаниона [9,10-Ag[2-B10H9Cl](PPh3)2]– – основного компонента кристалла [Ag(PPh3)4][Ag[B10H9.14Cl0.86](PPh3)2] (а); строение моноаниона [3,7-(PPh3)2Ag[2-B10H9Cl]]– в соединении [Ag(PPh3)4][(PPh3)2Ag[B10H9.5Cl0.5]] (б).
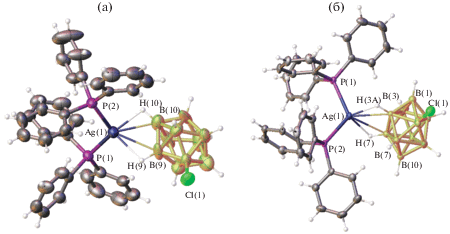
На рис. 7 схематично изображены соответствующие комплексы серебра с трифенилфосфином и кластерным анионом [B10H10]2– состава [Ag(PPh3)4][Ag[B10H10](PPh3)2]. Соединения состоят из катионного [Ag(PPh3)4]+ и анионного [Ag[B10H10](PPh3)2]− комплексов серебра с апикальной (рис. 7а) или экваториальной 3–7 (5–8) (рис. 7б) координацией борного кластера атомом металла-комплексообразователя по соответствующим ребрам 1–2 или 2–6(9). Эти соединения сокристаллизуются с анионными комплексами серебра с монохлорзамещенным производным клозо-декаборатного аниона [Ag[2-B10H9Cl](PPh3)2]−.
Рис. 7.
Схематическое изображение анионных комплексов серебра [Ag[B10H10](PPh3)2]– с апикальной (а) или экваториальной (б) координацией кластера (здесь и далее вид вдоль оси, образованной апикальными атомами борного полиэдра В1 и В10).
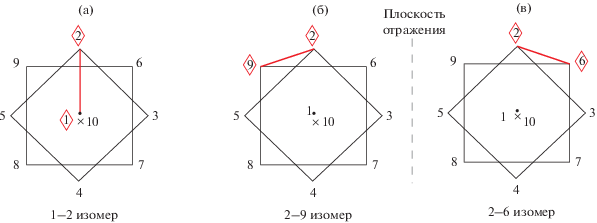
На рис. 6а представлено строение анионного комплекса [Ag[2-B10H9Cl](PPh3)2]–, содержащего монохлорзамещенное производное клозо-декаборатного аниона. По правилам ИЮПАК, нумерация атомов бора в замещенном производном должна быть проведена так, чтобы атом В, связанный с заместителем, имел наименьший порядковый номер, а именно В2. В этом случае полученный анионный комплекс можно описать формулой 9–10 [Ag(PPh3)2[2-B10H9Cl]]–, т.е. координирующее апикальное ребро 1–2 (пронумерованное так в отсутствие заместителей в борном кластере) становится 9–10. При этом атомы хлора разупорядочены по двум положениям, каждое из которых должно иметь наименьший порядковый номер, т.е. В2. В этом случае получится два борных полиэдра с разной нумерацией одних и тех же атомов. Кроме того, в соединении сокристаллизуется комплекс с незамещенным анионом [Ag(PPh3)2[B10H10]]. Было бы удобнее, если бы нумерация атомов бора в замещенном и незамещенном анионах совпадала. Во избежание возникающих трудностей и для наглядного представления структур обоих соединений на рис. 8 приведено схематичное изображение двух сокристаллизующихся комплексов с нумерацией относительно атома серебра (для [2-B10H9Cl]2– нумерация приведена не по правилам ИЮПАК). В этом случае становится понятно, что атом хлора разупорядочен по двум положениям – при атомах В9 и В6, а атом серебра координирует оба борных кластера по ребру 1–2.
Рис. 8.
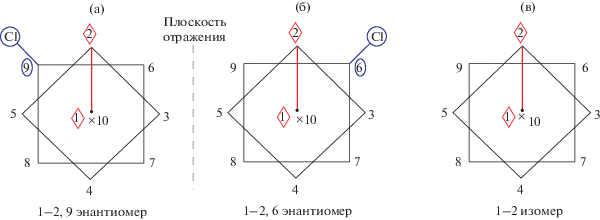
Схематическое изображение сокристаллизующихся 1–2, 6(9) энантиомеров анионного комплекса [Ag(PPh3)2[2-B10H9Cl]]– (слева) и 1–2 [Ag(PPh3)2[B10H10]]– (справа). В обоих соединениях нумерация начинается с координирующего ребра 1–2, связанного с атомом серебра.
В позиционном изомере, в котором кластерный анион бора координирован атомом серебра по экваториальному ребру, возникают такие же трудности с нумерацией. На рис. 6б представлено строение анионного комплекса 3–7 [(PPh3)2Ag[2-B10H9Cl]]− – основного компонента структуры. При рассмотрении строения комплекса с незамещенным клозо-декаборатным анионом очевидно, что ребро 3–7 (или 5–8 в случае энантиомера) должно иметь наименьший номер, т.е. должно быть 2–6 (энантиомер 2–9). При такой нумерации атом хлора разупорядочен по положениям 3 и 5, что схематично показано на рис. 9.
Рис. 9.
Схематическое строение сокристаллизующихся анионных комплексов серебра [Ag(PPh3)2[B10H10]]–: а – 2–9, 3 и 2–6, 5 энантиомеры; б – 2–6 и 2–9 энантиомеры. В обоих соединениях нумерация приведена не по правилу ИЮПАК от положения атома серебра (координирующие ребра борного кластера 2–6 и 2–9).
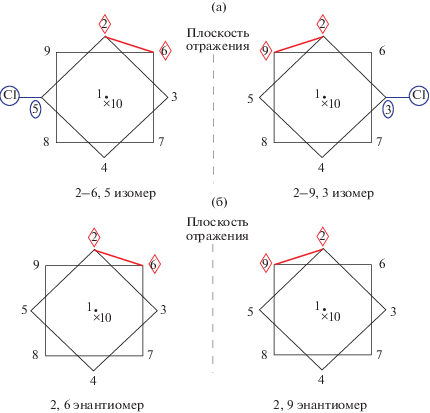
При реберной координации клозо-декаборатного аниона к одному атому металла возможны три различных положения металла относительно объемного кластерного аниона бора: по апикальному, экваториальному ребру, а также ребру, соединяющему два экваториальных пояса (рис. 10). Таким образом, для реберной координации клозо-декаборатного аниона синтезированы и охарактеризованы два (из трех возможных) изомера моноядерных комплексов с кластерным анионом бора.
ПОЗИЦИОННАЯ ИЗОМЕРИЯ В БИЯДЕРНЫХ КОМПЛЕКСАХ С клозо-ДЕКАБОРАТНЫМ АНИОНОМ
Позиционные изомеры [M2L4[B10H10]] c pеберной координацией борного кластера
Позиционная изомерия в биядерных комплексах металлов с реберной координацией клозо-декаборатного аниона впервые обсуждалась в [20] при получении первого биядерного комплекса меди(I) с трифенилфосфином состава 1–2, 6(9)–10 [Cu2(PPh3)4[B10Н10]] · CHCl3, синтезированного взаимодействием [Cat2B10H10] с [Cu(Ph3P)2Cl] в хлороформе. Расстояния Cu–P и Cu–B составляют 2.28(1) и 2.30(2) Å соответственно, Cu–Hа 2.08(7) Å, Cu–Hе 1.86(6) Å. В [20] указано, что при реберной координации кластерного аниона бора к двум атомам металла теоретически возможно образование 25 позиционных изомеров, 17 из которых будут оптически активны, т.е. будут иметь соответствующие энантиомеры. Позднее это же соединение 1–2, 6(9)–10 [Cu(Ph3P)2]2[B10H10] ⋅ CH3CN (другой сольват) получили при использовании в качестве растворителя ацетонитрила [21].
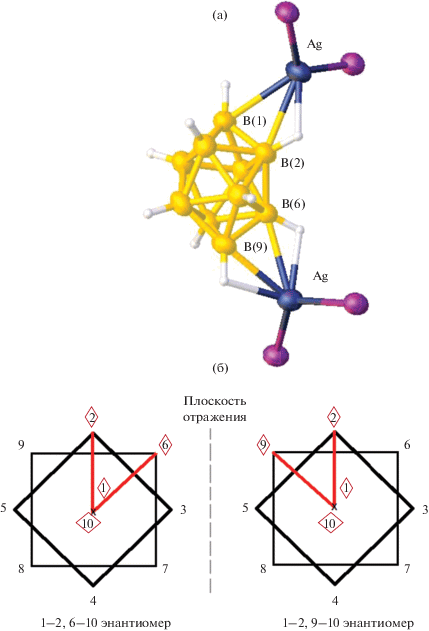
При взаимодействии соли (Et3NH)2[B10H10] с комплексом [Ag(Ph3P)3]NO3 в ацетонитриле получена аналогичная пара зеркальных изомеров комплекса серебра(I): 1–2, 6–10 и 1–2, 9–10 [Ag2(Ph3P)4B10H10] [21] (рис. 11а). В образующихся соединениях кластерный анион бора координируется к двум атомам металла двумя апикальными ребрами 1–2 и 6–10, находящимися при разных апикальных вершинах. Геометрия аниона [В10Н10]2– обусловливает наличие зеркального изомера этого комплекса, в котором координирующие ребра – 1–2 и 9–10. Схематично строение обоих энантиомеров при описываемой координации кластерного аниона бора показано на рис. 11б. Отметим, что в соединениях, помимо описанной пары зеркальных изомеров, не присутствуют другие позиционные изомеры, реакции протекают селективно с образованием 1–2, 6(9)–10 энантиомеров (рис. 11б).
Рис. 11.
Строение биядерного комплекса серебра 1–2, 6(9)–10 [Ag2(Ph3P)4[B10H10]] (а) (здесь и далее атомы H и C не показаны) и схематическое изображение 1–2, 6–10 и 1–2, 9–10 энантиомеров, сокристаллизующихся в кристалле (б).
Можно считать, что комплексы меди(I) и серебра(I) c трифенилфосфином в качестве лиганда являются изолобальными аналогами протона; принцип изолобальной аналогии описан в [22]. Известно, что клозо-декаборатный анион может удерживать возле себя протон с образованием стабильной протонированной формы – ундекагидродекаборатного аниона [B10H11]–. Образование моноаниона [B10H11]– наблюдается в системах, содержащих сильную карбоновую кислоту (трифторуксусную, муравьиную) и инертный органический растворитель (ацетонитрил, дихлорметан) [23–27]. Процесс образования аниона [B10H11]– легко контролировать методом 11В ЯМР-спектроскопии в динамике [27]. В растворе дополнительный атом водорода (протон) аниона [B10H11]– мигрирует вокруг апикальной вершины полиэдрического аниона, в каждый момент времени находясь над одной из прилегающих апикальных граней борного остова [26]. Из реакционного раствора протонированная форма клозо-декаборатного аниона выводится в составе крупного катиона. Методом РСА определены структуры Ph4P[B10H11] и Ph3PCH2Naph[B10H11] [27], в которых установлено, что дополнительный атом водорода находится над апикальной гранью борного кластера.
Исходя из принципа изолобальности [22] и принимая во внимание способность клозо-декаборатного аниона в кислотных условиях удерживать возле себя протон, было предположено, что введение конкурирующего акцептора (протона) в процесс комплексообразования окажет влияние на строение конечных соединений. Присутствие однозарядного катиона металла приводит, по-видимому, к конкуренции при образовании комплекса [MB10H10]– или протонированной формы [B10H11]–. Поэтому реакцию комплексообразования проводили не только в органическом растворителе (ацетонитриле), но и в условиях протонирования клозо-декаборатного аниона, т.е. в системе ацетонитрил–ТФУ, а также из предварительно полученной соли ундекагидродекаборатного аниона Cat[B10H11] в ацетонитриле.
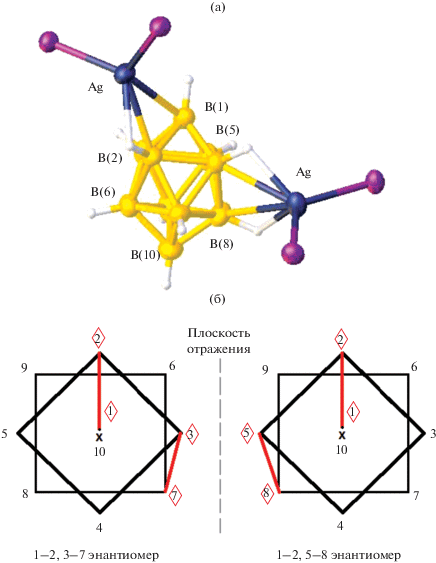
При проведении реакции [Ag2[B10H10]] с Ph3P в присутствии ТФУ получен комплекс 1–2, 3–7 и 1–2, 5–8 [Ag2(Ph3P)4[B10H10]] [28], в котором координация клозо-декаборатного аниона к металлу реализуется по апикальному ребру В1–В2 и ребру, соединяющему два экваториальных пояса В5–В8 (или В3–В7) (рис. 12а). Длины связей Ag–B(Н) в комплексе составляют 2.51–2.80 Å, Ag–H(В) – 2.06–2.34 Å, углы AgНВ равны 103°–112°. Комплекс 1–2, 5–8 [Ag2(Ph3P)4[B10H10]] – один из немногих примеров, когда координация клозо-декаборатного аниона осуществляется в том числе по ребру, соединяющему два экваториальных пояса.
Рис. 12.
Строение 1–2, 5–8 изомера комплекса [Ag(Ph3P)4B10H10] (а) и схематическое изображение сокристаллизующихся 1–2, 3–7 и 1–2, 5–8 энантиомеров (б).
При использовании в качестве исходного реагента ониевых солей ундекагидродекаборатного аниона был получен комплекс 1–2, 1–4 [Ag(Ph3P)4[B10H10]] [21], в котором клозо-декаборатный анион координирован атомами металла по апикальным ребрам 1–2 и 1–4 при одной апикальной вершине борного полиэдра. Длины связей Ag–B(Н) в комплексе составляют 2.642(3)–2.783(4) Å, Ag–H(В) 2.12–2.55 Å, углы AgНВ – ∼118°. Аналогичный 1–2, 1–4 изомер получен для комплекса меди(I) [Cu2(5NPhen)4B10H10] [29] при взаимодействии соли протонированного аниона [CatB10H11] с CuCl и фенантридином (рис. 13а). Схематично строение 1–2, 1–4 изомера представлено на рис. 13б.
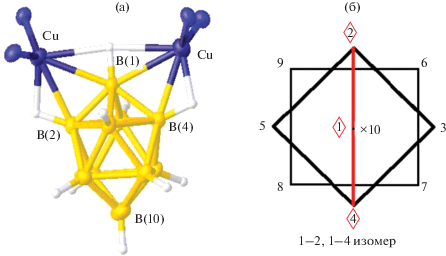
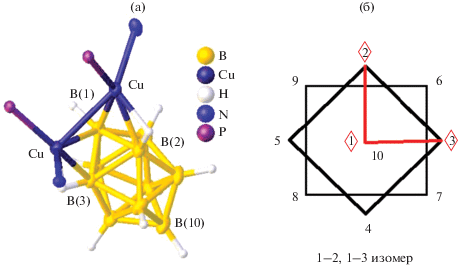
При использовании тетрадентатного лиганда dmapm (1,1-бис{ди-(o-N,N-диметиланилинил)фосфино}метан) синтезирован комплекс 1–2, 1–3 [Cu2(dmapm)[B10H10]] [30], в котором клозо-декаборатный анион координирован двумя атомами меди(I) по соседним апикальным ребрам 1–2 и 1–3 (рис. 14а), образуя относительно короткие контакты Cu…Cu (2.6631(5) Å). Расстояния Cu1–B2 и Cu2–B3 составляют 2.214(3) и 2.201(3) Å соответственно, углы CuHB1 и CuHB2 – ~100°. Вершина B(1) участвует в координации к металлу, расстояния Cu1–B1 и Cu2–B1 равны 2.227(3) и 2.541(3) Å соответственно. Комплекс получен при взаимодействии дистанна-клозо-декабората [Et4N][Sn2B10H10] с биядерным аддуктом [Cu2(CH3CN)2(dmapm)][BF4]2. В полученном соединении реализуется новая координация клозо-декаборатного бора – вынужденная координация борного кластера атомами меди по соседним апикальным ребрам 1–2 и 1–3 (рис. 14б).
Рис. 14.
Строение комплекса меди 1–2, 1–3 [Cu2(dmapm)[B10H10]] (а) и его схематическое изображение (б).
Последним на настоящий момент в ряду описываемых позиционных изомеров с реберной координацией клозо-декаборатного аниона выделен комплекс 1–2, 7(8)–10 [Cu2(5NPhen)4B10H10] (рис. 15а). Соединение получено при взаимодействии [Cu2B10H10] с фенантридином 5NPhen в ацетонитриле [29]. Сокристаллизующиеся энантиомеры представлены на рис. 15б. Интересно, что условия для получения 1–2, 7(8)–10 [Cu2(5NPhen)4B10H10] аналогичны синтезу комплексов Cu(I) и Ag(I) с Ph3P с координацией клозо-декаборатного аниона по ребрам 1–2, 6(9)–10.
Рис. 15.
Строение изомера 1–2, 8–10 [Cu2(5NPhen)4B10Н10] (а) и схематическое изображение сокристаллизующихся 1–2, 7(8)–10 энантиомеров (б).
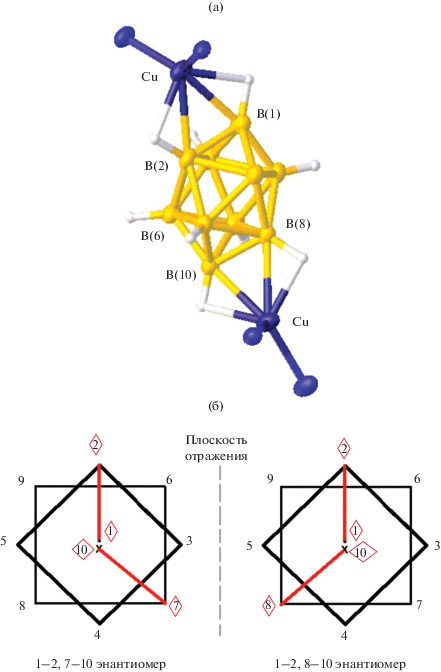
Координация по ребрам 1–2, 7(8)–10 обнаружена также в комплексе меди(I) с бидентатным лигандом 2,2'-бипиридиламином [Cu2(BPA)2B10H10] [31], полученном при взаимодействии [Cu2B10H10] с BPA в ацетонитриле при –20°С. Сокристаллизующиеся энантиомеры 1–2, 7(8)–10 схематично представлены на рис. 15б.
Таким образом, изучение строения комплексных соединений меди(I) и серебра(I) показало, что в реакциях комплексообразования в присутствии нейтральных органических лигандов в ацетонитриле можно получить целый ряд смешанолигандных биядерных комплексов общей формулы [M2L4B10H10] (M = Cu, Ag; L = 5NPhen или Ph3P). При этом объемный анион [В10Н10]2– может координироваться к двум атомам металла различными ребрами. Учитывая геометрическое строение клозо-декаборатного аниона, в образование комплексов могут быть вовлечены ребра, как находящиеся при апикальных вершинах полиэдра, так и соединяющие два экваториальных пояса между собой, что приводит к возможности образования позиционных изомеров биядерных комплексов с кластерным анионом бора [M2Lx[B10H10]] (x = 2 или 4).
Следует подчеркнуть, что во всех случаях, когда образуются энантиомеры, они не могут быть разделены синтетически; энантиомеры одновременно образуются в реакционной смеси и сокристаллизуются в кристалле. В свою очередь, каждый позиционный изомер выделяется селективно и с высоким выходом.
Анализируя зависимость строения комплексов меди(I) и серебра(I) с моно- и бидентатными лигандами Ph3P, 5NPhen и BPA от условий проведения реакций комплексообразования, можно отметить, что реакции, которые проводили в ацетонитриле при использовании солей [B10H10]2–, приводят к получению изомеров 1–2, 6(9)–10 или 1–2, 7(8)–10. Из солей протонированного аниона [B10H11]– образуется 1–2, 1–4 изомер; при проведении реакции в присутствии трифторуксусной кислоты координация клозо-декаборатного аниона реализуется по ребрам 1–2, 3–7 (5–8). Отметим, что при образовании 1–2, 7(8)–10 и 1–2, 6(9)–10 изомеров при проведении реакции комплексообразования в ацетонитриле в присутствии объемных лигандов (BPA, Ph3P, 5NPhen) оба атома металла максимально удалены друг от друга и расположены центросимметрично при апикальных ребрах разных апикальных вершин.
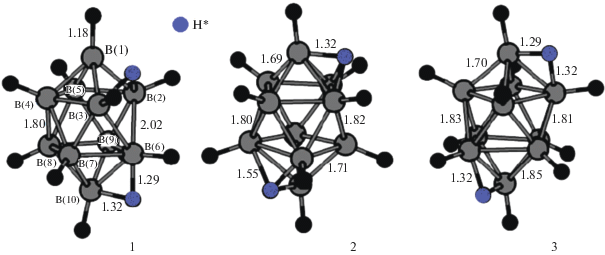
Представленные экспериментальные результаты коррелируют с расчетами, проведенными для нейтрального бороводородного кластера [В10Н12] [32], который можно рассматривать как модель комплекса [M2B10H10], так как фактически он представляет собой дважды протонированный декагидро-клозо-декаборатный анион H2[B10H10]. В работе [32] в рамках теории функционала электронной плотности (в приближении B3LYP/6-311++G**//B3LYP/6-31G*) выполнены расчеты электронных и геометрических структур изомеров кластера бора [В10Н12] с различным расположением двух атомов водорода вокруг борного полиэдра [32]. На рис. 16 приведены структуры трех наиболее энергетически выгодных изомеров из 18 возможных [32]. В наиболее предпочтительных изомерах 1–3 два дополнительных атома водорода H* расположены над противоположными апикальными ребрами или гранями. При этом координация реализуется следующим образом: 1–2–3, 6–10 (структура 1); 1–2–3, 7–8–10 (структура 2) или 1–2, 7–10 (структура 3). По данным проведенных расчетов, положение протонов по ребрам или граням, соединяющим экваториальные пояса борного кластера, энергетически менее выгодно.
Таким образом, расчеты, проведенные для нейтрального кластера [В10Н12], находятся в соответствии с экспериментальными результатами, полученными для комплексов [M2LxB10H10] (x = 2 или 4): в ацетонитриле образование 1–2, 6(9)–10 и 1–2, 7(8)–10 изомеров (рис. 11, 15) практически равновероятно; реакция протекает согласно схеме 1. Координация клозо-декаборатного аниона одним атомом металла осуществляется по апикальному ребру (при этом в присутствии крупного катиона можно выделить моноядерные комплексные соединения, рис. 6). Второй атом металла координирует кластерный анион бора по второй противоположной апикальной вершине. Отметим, что апикальные вершины клозо-декаборатного аниона (КЧ = 5) более реакционноспособны, чем экваториальные вершины (КЧ = 6). Получение того или иного позиционного изомера, по-видимому, связано со стерическими особенностями образования комплексов с крупными лигандами. В случае объемного Ph3P в координации к металлу участвуют апикальные ребра 1–2, 6(9)–10 борного полиэдра, а в случае плоских лигандов 5NPhen или BPA – апикальные ребра 1–2, 7(8)–10.
Схема 1. Предполагаемый механизм образования биядерных комплексов 1–2, 6(9)–10 и 1–2, 7(8)–10 в ацетонитриле исходя из солей [B10H10]2–.
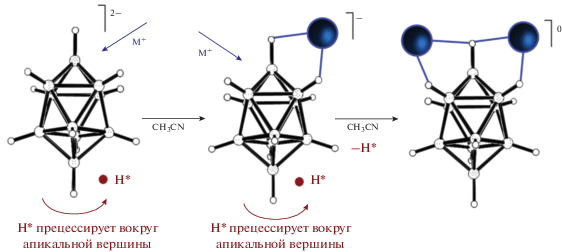
При проведении реакции комплексообразования с использованием протонированной формы клозо-декаборатного аниона процессы протонирования и комплексообразования конкурируют в реакционном растворе. По всей видимости, протон H*, который в растворе прецессирует вокруг апикальной вершины борного полиэдра, не позволяет атому металла координировать кластерный анион бора по этой вершине, так что из реакционного раствора выпадает 1–2, 1–4 изомер комплекса [M2LxB10H10] (схема 2).
Схема 2. Предполагаемый механизм образования биядерных комплексов 1–2, 1–4 в ацетонитриле исходя из солей [B10H11]–.
Проведение реакции в присутствии ТФУ, когда протоны, по-видимому, сосредоточены возле обеих апикальных вершин, способствует координации кластера металлом по ребру, соединяющему экваториальные пояса, так что образуется 1–2, 3–7 (5–8) изомер [M2LxB10H10]. Образование энергетически невыгодного изомера с расположением атомов металла по соседним апикальным ребрам 1–2 и 1–3, наблюдающееся в соединении [Cu2(dmapm)[B10H10]] (рис. 14), вероятно, объясняется стягивающим эффектом тетрадентатного лиганда, который удерживает атомы меди в непосредственной близости друг к другу, а также тенденцией апикальной вершины первой участвовать в реакциях комплексообразования.
Позиционные изомеры [M2L2[B10H10]] c граневой и реберно-граневой координацией борного кластера
В описанных выше позиционных изомерах комплексов [M2LxB10H10] (x = 2 или 4) наблюдается реберная координация клозо-декаборатного аниона двумя атомами металла по двум ребрам, апикальному и/или ребру, соединяющему два экваториальных пояса. Тем не менее рентгеноструктурные исследования солей аниона [B10H11]– [25, 26], проведенные при низкой температуре, показывают, что дополнительный атом водорода H* в анионе [B10H11]– находится над гранью ВВВ борного кластера. Расчеты дипротонированного кластера [В10Н12] [32] также указывают на приблизительно равную по энергии реберную и граневую координацию клозо-декаборатного аниона с двумя акцепторами (протонами) (рис. 16). Изучение реакций комплексообразования меди(I) с клозо-декаборатным анионом в присутствии нейтральных органических лигандов показывает, что в комплексах возможно расположение металла над треугольной гранью борного остова, а также реализация смешанной реберно-граневой координации борного кластера.
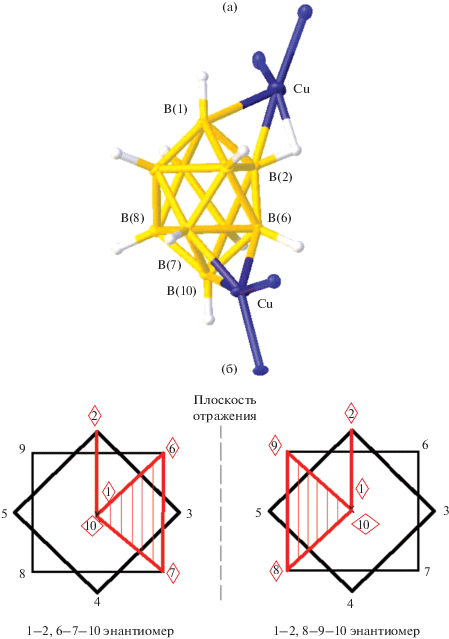
При взаимодействии [Cu2B10H10] с бидентатными лигандами Bipy и Phen в ацетонитриле получены комплексы меди(I) [Cu2L2[B10H10]], в которых наблюдается граневая или смешанная реберно-граневая координация клозо-декаборатного аниона. В комплексе [Cu2(Bipy)2B10H10] [33] (рис. 17а) атомы меди координируют клозо-декаборатный анион по апикальному ребру В1–В2 и грани при противоположной апикальной вершине. При этом в кристалле сокристаллизуются энантиомеры с координирующими гранями 6–7–10 и 8–9–10 (рис. 17б). Расстояния Cu–B составляют 2.156(7), 2.247(7) и 2.256(7) Å.
Рис. 17.
Строение 1–2, 6–7–10 (8–9–10) [${\text{Cu}}_{{\text{2}}}^{{\text{I}}}$(Bipy)2B10H10] (а) и схематическое изображение сокристаллизующихся энантиомеров с реберно-граневой координацией клозо-декаборатного аниона (б).
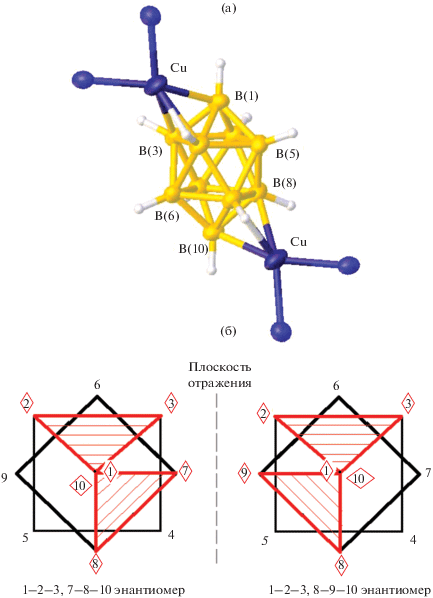
Методом РСА обнаружено, что комплекс [Cu2(Phen)2[B10H10]] [34] центросимметричный; два атома меди кристаллографически эквивалентны (рис. 18а). Клозо-декаборатный анион в комплексе [Cu2(Phen)2[B10H10]] координирован атомами меди по двум апикальным граням 1–2–3 и противоположной гранью 7–8–10 или 8–9–10; в кристалле сокристаллизуются энантиомеры (рис. 18б). Расстояния Cu–B с гранью ВВВ составляют 2.269(5), 2.119(5) и 2.497(6) Å, соответствующие расстояния Cu–H равны 2.27, 1.81 и 2.53 Å.
Рис. 18.
Строение 1–2–3, 8–9–10 [Cu2(Phen)2[B10H10]] (а) и схематическое изображение сокристаллизующихся 1–2–3, 7(9)–8–10 энантиомеров с граневой координацией клозо-декаборатного аниона (б).
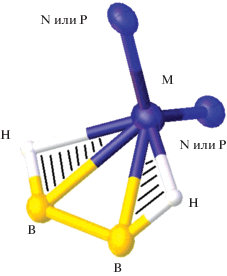
Анализируя строение всех описанных в данном разделе комплексов меди(I) и серебра(I), очевидно, что окружение металла-комплексообразователя в рамках реберной или граневой координации остается неизменным. В частности, при реберной координации клозо-декаборатного аниона [B10H10]2– в комплексах [M2LxB10H10] (L = BPA, Phen, Bipy, x = 2; L = Ph3P, 5NPhen, x = 4) атом металла находится в тетраэдрическом окружении, образованном ребром борного кластера и двумя атомами азота или фосфора молекул органического лиганда (рис. 19). Независимо от координирующих ребер борного полиэдра (апикальные, экваториальные) окружение металла-комплексообразователя остается неизменным.
Рис. 19.
Окружение металла в комплексах [M2L4B10H10] (M = Cu, Ag; L = атом P молекулы Ph3P либо атом N молекулы 5NPhen); трехцентровая двухэлектронная связь (МНВ) заштрихована для наглядности.
При описании связей, возникающих в рассматриваемых комплексах меди(I) и серебра(I), следует отметить, что в окружение металла-комплексообразователя входит, строго говоря, не ребро борного кластера, а две соответствующие ВН-группы. Координация клозо-декаборатного аниона во всех представленных комплексах с реберной координацией реализуется через трехцентровые двухэлектронные связи (MHB), в которые вовлечены все три атома, а именно: бора, водорода и металла. Угол МНВ составляет ~120°. Образование трехцентровых двухэлектронных связей (MHB) подтверждается методом ИК-спектроскопии. В ИК-спектрах комплексов с такими связями появляется новая дополнительная полоса валентных колебаний координированных металлом ВН-групп ν(ВН)МНВ в интервале 2100–2400 см–1 наряду с полосой ν(ВН) (максимум при ~2500 см–1), соответствующей валентным колебаниям “свободных” (некоординированных) ВН-групп. Полоса ν(ВН)МНВ наблюдается в ИК-спектрах всех описываемых в данной работе комплексов с внутрисферными декагидро-клозо-декаборатным [B10H10]2– и октагидроэйкозаборатным [B20H18]2– анионами.
Таким образом, анализ строения полимерных и биядерных комплексных соединений с декагидро-клозо-декаборатным анионом показал, что с учетом геометрических характеристик кластерный анион бора способен координироваться к металлу-комплексообразователю по-разному, что обусловливает возможность образования большого числа изомерных соединений. Полученные методом РСА данные позволяют нам выделить реберные и граневые изомеры, в которых координация кластерных анионов бора осуществляется соответственно по ребру или грани полиэдра. В соединениях может также наблюдаться смешанная реберно-граневая координация. Среди изомеров биядерных комплексов получен ряд соединений, в которых кластерный анион бора координирован по апикальным ребрам и ребрам, соединяющим экваториальные пояса с координацией борного кластера: 1–2, 1–4; 1–2, 6–10 (9–10); 1–2, 3–7 (5–8) (в скобках указаны соответствующие энантиомеры).
ИЗОМЕРИЯ ПОЛОЖЕНИЯ ФУНКЦИОНАЛЬНЫХ ГРУПП В СОЕДИНЕНИЯХ С ЗАМЕЩЕННЫМИ ПРОИЗВОДНЫМИ клозо-ДЕКАБОРАТНОГО АНИОНА
Описанные выше примеры позиционных изомеров, обнаруженные среди комплексов переходных металлов с клозо-декаборатным анионом, обусловлены различным взаимным расположением двух атомов металла вокруг объемного борного кластера. Аналогичные позиционные изомеры возникают и при введении различных функциональных групп в борный кластер и их различном взаимном расположении вокруг борного полиэдра. В этом случае изомерия может быть названа изомерией положения функциональных групп в борном кластере.
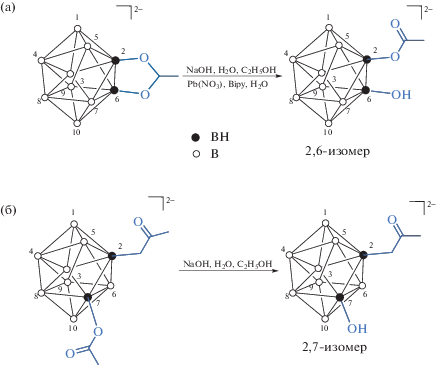
В ходе изучения процессов ацилирования клозо-декаборатного аниона синтезированы 2,6(9)- и 2,7(8)-изомеры положения двух функциональных групп в борном кластере [B10H8(OC(O)СH3)(OН)]2–, а именно гидроксо- и ацетатной групп [35]. Полученные изомеры выделены селективно и охарактеризованы методом РСА. Строение позиционных 2,6(9)- и 2,7(8)-изомеров (с соответствующими энантиомерами, сокристаллизующимися в кристаллах соединений) представлено на рис. 20.
Рис. 20.
Схематическое изображение 2,6(9)- (а) и 2,7(8)- (б) энантиомеров аниона [B10H8(OC(O)СH3)(OН)]2–.
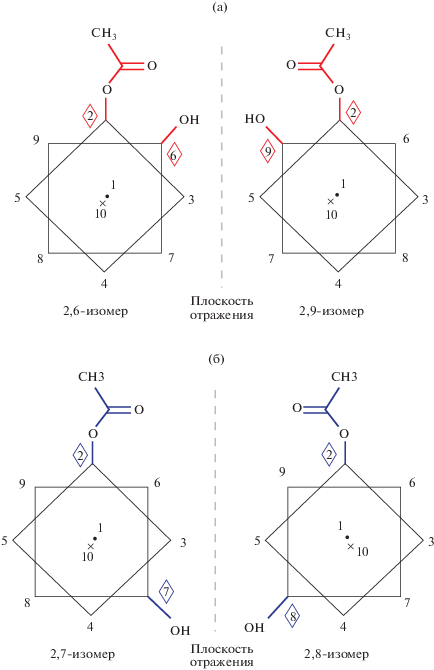
Анион [2,6(9)‑B10H8(OC(O)СH3)(OН)]2– получен в ходе щелочного гидролиза замещенного производного Cat[2,6(9)-B10H8>(O)2CCH3] (Cat = Ph4P+, Ph4As+) [36] с бидентатно координированной ацетатной группой и выделен в составе соли (Ph4As)2[2,6(9)-B10H8(OC(O)СH3)(OН)] [35]. При этом протекает частичный гидролиз производного [2,6(9)-B10H8 > (O)2CCH3]–: одна ацетатная группа остается связанной с борным кластером, а вторая гидролизуется с образованием ОН-группы (схема 3а). Более того, добавление ацетата свинца к раствору соли Cat[2,6(9)-B10H8>(O)2CCH3] также приводит к частичному гидролизу производного и получению комплекса {Pb(Bi py)2[2,6(9)‑B10H8(OC(O)СH3)(OН)]}2 [35], анионная часть которого представляет собой то же самое дизамещенное производное клозо-декаборатного аниона с расположением функциональных групп –OC(O)CH3 и –ОН в положениях 2 и 6(9) кластерного аниона бора (рис. 21а).
Схема 3. Синтез позиционных изомеров 2,6(9)-и 2,7(8)-[B10H8(OC(O)СH3)(OН)]2–.
Рис. 21.
Строение аниона в (Ph4As)2[2,6-B10H8(OC(O)СH3)(OН)] (а) и аниона в (Ph4As)2[2,7-B10H8(OC(O)СH3)(OН)] (б). Схематическое изображение 2,6(9) и 2,7(8) энантиомерных пар показано на рис. 20.
Позиционный изомер [2,7(8)‑B10H8(OC(O)СH3)(OН)]2– (схема 3б) получен в ходе щелочного гидролиза дизамещенного ацетатного производного [2,7(8)‑B10H8(OC(O)СH3)2]2– и выделен в виде соли (Ph4As)2[2,7(8)-B10H8(OC(O)СH3)(OН)] [35]. Строение 2,7-энантиомера аниона [2,7(8)‑B10H8(OC(O)СH3)(OН)]2– представлено на рис. 21б. Ацетатная группа в соединении связана с атомом В2, ОН-группа разупорядочена по двум положениям (О3 и О4), связанным с атомами В7 и В8 соответственно.
В литературе описан ряд позиционных изомеров с атомами галогена в качестве заместителей. В зависимости от способа иодирования выделены и охарактеризованы моноиодзамещенные производные [1-B10H9I]2–, [2-B10H9I]2– [37, 38] (оба возможных изомера), дизамещенные нейтральные бис-триметиламиновые производные 1,6-, 1,10-, 2,6(9)-, 2,7(8)-, 2,4- и 2,3-[B10H8(NMe3)2] [39–43] (шесть из семи возможных изомеров), тризамещенные иодопроизводные 1,2,10- и 1,6,8-[B10H7I3]2– [44–48].
Среди многочисленных замещенных производных клозо-декаборатного аниона в литературе представлена всего пара примеров изомеров положения двух разных функциональных групп в клозо-декаборатном анионе, а именно: Me3N- и СО-групп в [2,4-Me3NB10H8CO] и [2,7(8)-Me3NB10H8CO] [49], Me2S- и диазогрупп в [1,10-N2B10H8SMe2] и [1,6(9)-N2B10H8SMe2] [50].
Механизм синтеза замещенных производных остается за рамками данной работы. Отметим принципиальное сходство строения комплексных соединений [M2[B10H10]] и замещенных производных [B10H8X2]n– в виде изомеров, различающихся позицией атомов металлов или заместителей вокруг объемного борного кластера [B10H10]2–.
ИЗОМЕРИЯ В СОЛЯХ И КОМПЛЕКСАХ С ДИМЕРНЫМ КЛАСТЕРОМ [B20H18]2–
Димерный анион [B20H18]2– может существовать в виде трех изомерных форм: [цис-B20H18]2–, [транс-B20H18]2– и [изо-B20H18]2– (рис. 21). Строение димерных анионов и их взаимные превращения в растворе ацетонитрила, описанные в [9–12], представлены на схеме 4. Изомерные формы кластерных анионов бора различаются взаимным расположением десятивершинных борных кластеров друг относительно друга. При этом анионы [цис-B20H18]2– и [транс-B20H18]2– являются геометрическими изомерами, а анион [изо-B20H18]2– – связевым, так как (в отличие от двух других изоморфных форм) в изо-форме присутствует трехцентровая связь В–Н–В через мостиковый атом водорода, которой нет в двух других изомерах. Изомерию в димерном кластере [B20H18]2– можно также назвать изомерией борного скелета.
Схема 4. Переходы между тремя изомерными формами аниона [В20Н18]2–.
При образовании комплексов с анионом [B20H18]2– состава [M2[B20H18]] можно получить позиционные изомеры, аналогичные обнаруженным для [M2[B10H10]] и обусловленные различным взаимным расположением атомов металла вокруг объемного борного кластера. При этом можно варьировать не только способ координации борного кластера (положение металлов у ребер или граней борного остова), но и вид координационной связи между атомом металла и кластером бора ((MHB) или M–H–B), а также форму самого аниона [B20H18]2–.
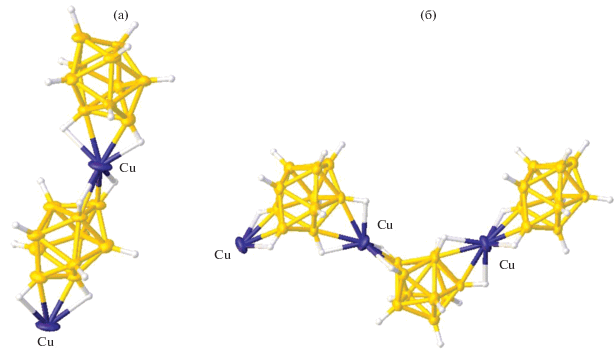
При использовании в качестве исходных реагентов солей анионов [транс-B20H18]2– и [изо-B20H18]2– в реакциях комплексообразования серебра(I) в присутствии Ph3P получены изомеры [Ag2(Ph3P)4[B20H18]] (рис. 22) [51], содержащие соответствующие изомерные формы димерного кластера. В окружение атомов серебра входят по две молекулы трифенилфосфина и ребро димерного борного кластера. Полученные соединения являются связевыми изомерами, так как в изо-изомере присутствует связь В–Н–В, которой не было в транс-изомере, и позиционными, так как в изо-изомере координирующее ребро димерного кластера апикальное, а в транс-изомере – ребро, соединяющее два экваториальных пояса десятивершинного кластера в составе димерного кластера.
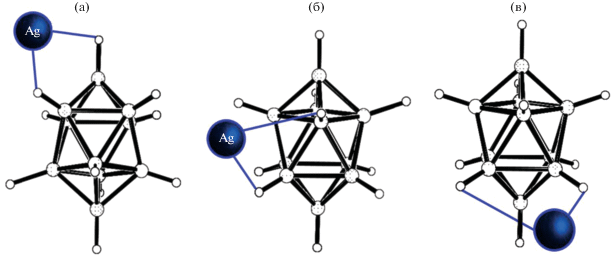
Аналогичные изомеры выделены для комплексов серебра состава [Ag2(Ph3P)6[B20H18]], в которых атом металла содержит по три молекулы трифенилфосфина (рис. 23) [51]. В комплексе [Ag2(Ph3P)6[изо-B20H18]] атом серебра координирует борный кластер по экваториальному атому, тогда как в комплексе [Ag2(Ph3P)6[транс-B20H18]] координация борного кластера реализуется по апикальному ребру. Таким образом, эти два изомера также являются позиционными и связевыми.
Анализируя строение комплекса [Ag2(Ph3P)6[изо-B20H18]] [52], полученное методом РСА, обнаружено, что в кристалле комплекса сокристаллизуются два связевых изомера. В основном изомере координация атома металла к борному кластеру осуществляется за счет образования мостиковой связи Ag–Н–В (угол AgHB равен 173.6°), в другом изомере (минорный компонент) атом серебра координирует апикальную грань В1–В4–В5 борного кластера. Строение обоих изомеров представлено на рис. 24. Отметим, что связь Ag–H–B через мостиковый атом водорода впервые обнаружена для комплексов с кластерными анионами бора.
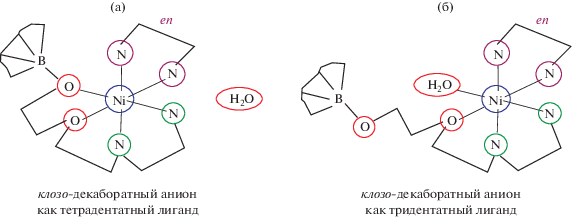
ГИДРАТНАЯ ИЗОМЕРИЯ, ОБУСЛОВЛЕННАЯ ИЗМЕНЕНИЕМ ДЕНТАТНОСТИ ЗАМЕСТИТЕЛЯ В БОРНОМ КЛАСТЕРЕ
В реакциях комплексообразования производных клозо-декаборатного аниона с пендантной этилендиаминовой (En) группой [53] получены гидратные изомеры комплексов никеля(II) [Ni(en)[2-B10H9O(CH2)2O(CH2)2NH(CH2)2NH2)]] · · H2O и [Ni(H2O)(en)3[2-B10H9O(CH2)2O(CH2)2NH(CH2)2NH2)]] (рис. 25). Комплексы получены при гетерофазном (с применением NiCO3–Ni(OH)2) и гомофазном пути проведения реакции. В одном из комплексов окружение атома никеля(II) представляет собой искаженный октаэдр, построенный из двух атомов азота и одного атома кислорода заместителя, двух атомов азота координированного этилендиамина и атома кислорода координированной молекулы воды. Во втором комплексе из внутренней сферы никеля(II) молекула воды переходит во внешнюю сферу, а ее место занимает атом кислорода, непосредственно связанный с борным кластером. Длина связи Ni–N(l) изменяется от 2.13 до 2.08 Å, а Ni–О(2) – от 2.09 до 2.22 Å. Длина остальных связей практически не меняется (в том числе Ni–О(3) 2.15 Å, Ni–O(1) 2.15 Å).
ИЗОМЕРИЯ В КАТИОННОЙ ЧАСТИ КОМПЛЕКСОВ С ВНЕШНЕСФЕРНЫМ ПОЛОЖЕНИЕМ КЛАСТЕРНЫХ АНИОНОВ БОРА
Конформационная изомерия мостикового лиганда
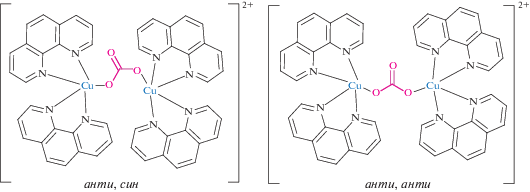
В ходе изучения реакций комплексообразования меди(II) с Phen в присутствии клозо-декаборатного аниона получены два изомера комплекса [(Phen)2Cu(μ-CO3)Cu(Phen)2][В10Н10], строение которых установлено методом РСА [54]. Соединения [Cu2(Phen)4(μ-CO3)][B10H10] ∙ 4DMF и [Cu2(Phen)4(μ-CO3)][B10H10] ∙ 2.5DMSO ∙ 2H2O различаются строением катионной части. В обеих структурах ион ${\text{СО}}_{{\text{3}}}^{{{\text{2}}--}}$ служит мостиковым лигандом между двумя атомами меди(II), бидентатно координируясь к металлу двумя атомами кислорода. Различие в способе координации СО3-групп заключается в разном расположении связей Сu–O относительно концевой связи С–О во фрагменте C–O–C–O–Cu: анти,син (комплекс с ДМФА) и анти,анти (комплекс с ДМСО) (рис. 26). Расстояния Cu…Cu в димерах с анти,син-конфигурацией (4.441 Å) существенно короче, чем в димерах с анти,анти-конфигурацией (5.288 Å). Различие в конфигурации карбонатной группы приводит к различию в расстоянии металл–металл, что сказывается на магнитных свойствах комплексов [54].
Изомерия положения несимметричного бидентатного лиганда
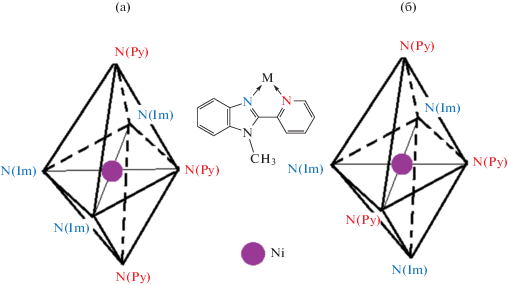
При взаимодействии соли клозо-декаборатного аниона с хлоридом никеля и пиридиновым производным бензимидазола получено комплексное соединение никеля(II) [Ni(C13N3H11)3][B10H10] ∙ 1.797CH3CN [55]. Методом РСА обнаружено, что в катионном комплексе [Ni(C13N3H11)3]2+ сокристаллизуются два геометрических изомера (рис. 27). Комплексы, в которых разупорядоченные молекулы органического лиганда занимают основные позиции, имеют меридиональную конфигурацию. В этих комплексах связи Ni–N с имидазольными атомами азота N(Im) (2.010(4)–2.076(3) Å) короче, чем с пиридиновыми атомами азота N(Py) (2.132(4)–2.179(5) Å). Молекулы органического лиганда имеют уплощенное строение. Комплекс c минорным компонентом молекулы лиганда имеет граневую конфигурацию.
Рис. 27.
Схематическое строение меридионального (а) и граневого (б) изомеров катиона [Ni(C13N3H11)3]2+, сокристаллизованных в [Ni(C13N3H11)3][B10H10] ∙ 1.797CH3CN.
В настоящей работе рассмотрены различные виды изомерии в соединениях с кластерными анионами бора на примере всего двух анионов – [B10H10]2– и [B20H18]2–. Между тем аналогичные примеры можно найти и для соединений с другими кластерными анионами бора, например, анионами [B12H12]2–, [B11H14]–, карборанами и соответствующими замещенными производными (например, [56–60]). В реакциях комплексообразования и замещения концевых атомов водорода ввиду геометрии представителей этих классов соединений участие тех или иных вершин, ребер и граней полиэдров приводит к возможности синтеза изомерных соединений, что открывает широкие возможности для молекулярного дизайна.
ЗАКЛЮЧЕНИЕ
В работе описано многообразие видов изомерии, возникающей в солях и комплексных соединениях клозо-декаборатного аниона и его производных. Приведены примеры специфической позиционной изомерии, которая возникает в смешанолигандных моно- и биядерных комплексах металлов Cu(I) и Ag(I) с мостиковым клозо-декаборатным анионом [B10H10]2– или димерным анионом [B20H18]2– и терминальными органическими лигандами и связана с различным расположением атомов металла вокруг объемного борного остова. Такие же изомеры обнаружены в полимерных анионных комплексах с клозо-декаборатным анионом. Описан аналогичный вид изомерии, связанный с различным положением функциональных групп заместителей вокруг объемного борного кластера. Кроме того, описаны связевые изомеры, обнаруженные в комплексах серебра с димерным кластером бора [B20H18]2–, которые отличаются природой координационной связи между атомом металла и борным кластером (связи (МНВ) или М–Н–В), а также изомерия борного скелета димерного борного кластера. Приведены геометрические и конформационные изомеры, обнаруженные в комплексах металлов с внешнесферным клозо-декаборатным анионом, а также гидратные изомеры, обусловленные разной дентатностью введенного в борный кластер заместителя, который координируется к атому металла.
Список литературы
Kuznetsov N.T. // Russ. J. Inorg. Chem. 2002. V. 47. S68.
Zhizhin K.Yu., Zhdanov A.P., Kuznetsov N.T. // Russ. J. Inorg. Chem. 2010. V. 55. № 14. P. 2089. https://doi.org/10.1134/S0036023610140019
Sivaev I.B., Prikaznov A.V., Naoufal D. // Coll. Czech. Chem. Commun. 2010. V. 75. № 11. P. 1149. https://doi.org/10.1135/cccc2010054
Sivaev I.B., Bregadze V.I., Sjöberg S. // Collect. Czech. Chem. Commun. 2002. V. 67. P. 679. https://doi.org/10.1135/cccc20020679
Пирсон Р.Дж. // Успехи химии. 1971. Т. 40. Вып. 7. С. 1259.
Avdeeva V.V., Malinina E.A., Sivaev I.B. et al. // Crystals. 2016. V. 6. № 5. Art. 60. https://doi.org/10.3390/cryst6050060
Avdeeva V.V., Malinina E.A., Goeva L.V., Kuznetsov N.T. // Russ. J. Inorg. Chem. 2010. V. 55. № 14. P. 2148. https://doi.org/10.1134/S0036023610140032
Avdeeva V.V., Malinina E.A., Kuznetsov N.T. // Russ. J. Inorg. Chem. 2017. V. 62. № 13. P. 1673. https://doi.org/10.1134/S0036023617130022
Kaczmarczyk A., Dobrott R.D., Lipscomb W.N. // Proc. Nat. Acad. Sci. USA. 1962. V. 48. P. 729.
Hawthorne M.F., Pilling R.L., Stokely P.F., Garrett P.M. // J. Am. Chem. Soc. 1963. V. 85. P. 3704.
Curtis Z.B., Young C., Dickerson R., Kaczmarczyk A. // Inorg. Chem. 1974. V. 13. P. 1760.
Li F., Shelly K., Knobler C.B., Hawthorne M.F. // Angew. Chem. Int. Ed. 1998. V. 37. P. 1865.
Малинина Е.А., Жижин К.Ю., Гоева Л.В. и др. // Докл. АН. 2001. Т. 378. № 3. С. 351.
Полякова И.Н., Малинина Е.А., Кузнецов Н.Т. // Кристаллография. 2003. Т. 48. № 1. С. 89.
Малинина Е.А., Жижин К.Ю., Полякова И.Н. и др. // Журн. неорган. химии. 2002. Т. 47. № 8. С. 1275.
Малинина Е.А., Дроздова В.В., Полякова И.Н., Кузнецов Н.Т. // Журн. неорган. химии. 2008. Т. 53. № 2. С. 238. [Malinina E.A., Drozdova V.V., Polyakova I.N., Kuznetsov N.T. // Russ. J. Inorg. Chem. 2008. V. 53. P. 197.] https://doi.org/10.1134/S0036023608020083
Vologzhanina A.V., Avdeeva V.V., Malinina E.A., Kuznetsov N.T. // Z. Kristallogr. 2013. V. 228. P. 565. https://doi.org/10.1524/zkri.2013.1647
Малинина Е.А. Автореф. дис… д-ра хим. наук. М., 2009. 45 с.
Avdeeva V.V., Polyakova I.N., Vologzhanina A.V. и дp. // Polyhedron 2017. V. 123. P. 396. https://doi.org/10.1016/j.poly.2016.12.009
Gill J.T., Lippard S.J. // Inorg. Chem. 1975. V. 14. № 4. P. 751. https://doi.org/10.1021/ic50146a010
Дроздова В.В., Малинина Е.А., Полякова И.Н., Кузнецов Н.Т. // Докл. АН. 2008. Т. 418. № 4. С. 489. [Drozdova V.V., Malinina E.A., Polyakova I.N. et al. // Dokl. Chem. 2008. V. 418. P. 30.] https://doi.org/10.1134/S001250080802002X
Hoffmann R. // Angew. Chem. 1982. V. 21. P. 711.
Мустяца В.Н., Вотинова Н.А., Солнцев К.А., Кузнецов Н.Т. // Докл. АН СССР. 1988. Т. 301. № 6. С. 1396.
Пономарев В.И., Солнцев К.А., Мустяца В.Н., Кузнецов Н.Т. // Коорд. химия. 1991. Т. 17. С. 640.
Пономарев В.И., Солнцев К.А., Мустяца В.Н., Кузнецов Н.Т. // Коорд. химия. 1992. Т. 18. С. 372.
Полякова И.Н., Мустяца В.Н., Жижин К.Ю., Кузнецов Н.Т. // Кристаллография. 2004. Т. 49. С. 767.
Мустяца В.Н., Солнцев К.А., Сахаров С.Г., Кузнецов Н.Т. // Докл. АН. 1998. Т. 358. № 1. С. 68.
Авдеева В.В., Полякова И.Н., Гоева Л.В. и др. // Докл. АН. 2011. Т. 437. № 3. С. 341. [Avdeeva V.V., Polyakova I.N., Goeva L.V. et al. // Dokl. Chem. 2011. V. 437. P. 63.] https://doi.org/10.1134/S0012500811030074
Дзиова А.Э., Авдеева В.В., Полякова И.Н. и др. // Изв. АН. Сер. хим. 2011. № 8. С. 1583. [Dziova A.E., Avdeeva V.V., Polyakova I.N. et al. // Russ. Chem. Bull. 2011. V. 60. P. 1608.] https://doi.org/10.1007/s11172-011-0240-6
Scheel H., Wiederkehr J., Eichele K. et al. // Dalton Trans. 2014. V. 43. P. 11 867. https://doi.org/10.1039/C4DT01242A
Дзиова А.Э., Авдеева В.В., Полякова И.Н. и др. // Докл. АН. 2011. Т. 440. № 3. С. 351. [Dziova A.E., Avdeeva V.V., Polyakova I.N. et al. // Dokl. Chem. 2011. V. 440. P. 253.] https://doi.org/10.1134/S0012500811090035
Кочнев В.К., Авдеева В.В., Малинина Е.А., Кузнецов Н.Т. // Журн. неорган. химии. 2013. Т. 58. С. 896. [Kochnev V.K., Avdeeva V.V., Malinina E.A., Kuznetsov N.T. // Russ. J. Inorg. Chem. 2013. V. 58. P. 793.] https://doi.org/10.1134/S0036023613070152
Vologzhanina A., Korlyukov A., Avdeeva V. et al. // J. Phys. Chem. Part A. 2013. V. 117. № 49. P. 13 138. https://doi.org/10.1021/jp405270u
Avdeeva V.V., Dziova A.E., Polyakova I.N. et al. // Inorg. Chim. Acta. 2015. V. 430. P. 74. https://doi.org/10.1016/j.ica.2015.02.029
Авдеева В.В., Полякова И.Н., Гоева Л.В. и др. // Журн. неорган. химии. 2014. Т. 59. № 11. С. 1491. [Avdeeva V.V., Polyakova I.N., Goeva L.V. et al. // Russ. J. Inorg. Chem. 2014. V. 59. P. 1247. https://doi.org/10.1134/S0036023614110047]
Сафронова Е.Ф., Авдеева В.В., Полякова И.Н. и др. // Докл. АН. 2013. Т. 453. № 1. С. 235. [Safronova E.F., Avdeeva V.V., Polyakova I.N. et al. // Dokl. Chem. 2013. V. 452. P. 240. https://doi.org/10.1134/S0012500813110013]
Zakharkin L.I., Guseva V.V., Petrovskii P.V. // Russ. J. Gen. Chem. 2001. V. 71. P. 1017.
Schmitt A.P., Middaugh R.L. // Inorg. Chem. 1974. V. 13. P. 163.
Дроздова В.В., Малинина Е.А., Полякова И.Н. и др. // Журн. неорган. химии. 2007. Т. 52. № 7. С. 1072. [Drozdova V.V., Zhizhin K.Y., Malinina E.A. et al. // Russ. J. Inorg. Chem. 2007. V. 52. P. 996. https://doi.org/10.1134/S0036023607070042]
Hertler W.R., Knoth W.H., Muetterties E.L. // J. Am. Chem. Soc. 1964. V. 86. P. 5434.
Knoth W.R., Sauer J.C., Balthis J.H. et al. // J. Am. Chem. Soc. 1967. V. 89. P. 4842.
Hertler W.R. // Inorg. Chem. 1964. V. 3. P. 1195.
Hertler W.R. // J. Am. Chem. Soc. 1964. V. 86. P. 2949.
Bührens K.-G., Preetz W. // Angew. Chem. Int. Ed. Engl. 1977. V. 16. P. 173.
Bührens K.-G., Preetz W. // J. Chromatogr. 1977. V. 139. P. 291.
Preetz W., Srebny H.-G., Marsmann H.C. // Z. Naturforsch., B: Chem. Sci. 1984. V. 39. P. 189.
Bührens K.-G., Preetz W. // Angew. Chem. Int. Ed. Engl. 1977. V. 16. P. 398.
Knoth W.K., Miller H.C., Sauer J.C. et al. // Inorg. Chem. 1964. V. 3. № 2. P. 159.
Hertler W.R., Knoth W.H., Muetterties E.L. // Inorg. Chem. 1965. V. 4. P. 288.
Leyden R.N., Hawthorne M.F. // J. Am. Chem. Soc. 1973. V. 95. P. 2032.
Avdeeva V.V., Vologzhanina A.V., Buzin M.I. et al. // Chem. Eur. J. 2017. V. 23. № 66. P. 16819. https://doi.org/10.1002/chem.201703285
Avdeeva V.V., Buzin M.I., Malinina E.A. et al. // Cryst. Eng. Comm. 2015. V. 17. P. 8870. https://doi.org/10.1039/C5CE00859J
Kubasov A.S., Matveev E.Yu., Retivov V.M. et al. // Russ. Chem. Bull. 2014. V. 63. P. 187. https://doi.org/10.1007/s11172-014-0412-2
Дзиова А.Э., Авдеева В.В., Полякова И.Н. и др. // Журн. неорган. химии. 2014. Т. 59 № 1. С. 45. [Dziova A.E., Avdeeva V.V., Polyakova I.N. et al. // Russ. J. Inorg. Chem. 2013. V. 58. P. 1527.] https://doi.org/10.1134/S0036023614010045
Авдеева В.В., Полякова И.Н., Гоева Л.В. и др. // Журн. неорган. химии. 2015. Т. 60. № 7. P. 901. [Avdeeva V.V., Polyakova I.N., Goeva L.V. et al. // Russ. J. Inorg. Chem. 2015. V. 60. P. 817.] https://doi.org/10.1134/S0036023615070037
Sivaev I.B. // Russ. J. Inorg. Chem. 2019. V. 64. P. 955. https://doi.org/10.1134/S003602361908014X
Matveev E.Y., Limarev I.P., Nichugovskii A.I. et al. // Russ. J. Inorg. Chem. 2019. V. 64. P. 977. https://doi.org/10.1134/S0036023619080084
Kochneva I.K., Avdeeva V.V., Goeva L.V. et al. // Russ. J. Inorg. Chem. 2018. V. 63. P. 591. https://doi.org/10.1134/S0036023618050066
Avdeeva V.V., Vologzhanina A.V., Malinina E.A. et al. // Russ. J. Coord. Chem. 2019. V. 45. P. 295. https://doi.org/10.1134/S1070328419040018
Zhdanov A.P., Voinova V.V., Klyukin I.N. et al. // Russ. J. Coord. Chem. 2019. V. 45. P. 563. https://doi.org/10.1134/S1070328419080098
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии