Журнал неорганической химии, 2020, T. 65, № 3, стр. 384-390
Фазовые равновесия в системе LiBr–Li2CO3–Li2SO4 и анализ систем LiHal–Li2CO3–Li2SO4 (Наl = F, Cl, Br, I)
Е. И. Фролов a, b, *, А. А. Финогенов a, И. К. Гаркушин a, В. И. Сырова a
a Самарский государственный технический университет
443100 Самара, ул. Молодогвардейская, 224, Россия
b Уральский федеральный университет
620002 Екатеринбург, ул. Мира, 19, Россия
* E-mail: frolov_zhenya@inbox.ru
Поступила в редакцию 10.10.2019
После доработки 27.10.2019
Принята к публикации 30.10.2019
Аннотация
Методом дифференциального термического анализа изучены фазовые равновесия в трехкомпонентной солевой системе LiBr–Li2CO3–Li2SO4. Определены координаты эвтектики (мол. %): LiBr – 65.0, Li2CO3 – 20.0, Li2SO4 – 15.0, температура плавления 429°С. Уточнены данные двухкомпонентных систем LiBr–Li2CO3, Li2CO3–Li2SO4. Методом дифференциальной сканирующей калориметрии (ДСК-500) определена удельная энтальпия плавления состава эвтектики, равная 97.0 ± 2.3 кДж/кг. Проведен анализ ряда систем LiHal–Li2CO3–Li2SO4 (Наl = F, Cl, Br, I) и построены модели ликвидусов систем LiBr–Li2CO3–Li2SO4 и LiI–Li2CO3–Li2SO4. Перед экспериментальным исследованием определена ожидаемая температура плавления эвтектик этих систем, рассчитанная по зависимости от порядкового номера галогена и температуры плавления эвтектик ограняющих двухкомпонентных систем в указанном выше ряду. Эвтектический состав солевой системы LiBr–Li2CO3–Li2SO4 может быть рекомендован для возможного использования в качестве расплавляемого электролита для химического источника тока.
ВВЕДЕНИЕ
Многокомпонентные солевые системы на основе солей лития имеют большое практическое значение для создания многофункциональных материалов, таких как электролиты для химических источников тока, теплоаккумулирующие и теплопроводящие композиции, а также для теории ионных расплавов. Особый интерес представляют эвтектические системы, так как эвтектики характеризуются конгруэнтным типом плавления при фиксированном значении температуры плавления [1–4].
Выбор области использования конкретной солевой композиции основан на фазовых диаграммах соответствующих систем, надежные данные по которым можно получить с помощью дифференциального термического анализа (ДТА) [5–8].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Солевая система LiBr–Li2CO3–Li2SO4 была исследована методом ДТА [9–11]. Для измерения температур использовали платина-платинородиевые термопары, в качестве регистрирующего прибора – аналого-цифровой преобразователь ЛА-И24USB, подключенный к персональному компьютеру. Исследования проводили в стандартных платиновых микротиглях (изделия № 108-2 по ГОСТ 13498-68). Холодные спаи термопар термостатировали при 0°C в сосуде Дьюара с тающим льдом. Скорость нагрева (охлаждения) образцов составляла 10–15 град/мин. Индифферентным веществом служил свежепрокаленный оксид алюминия. Градуировку термопар проводили по температурам плавления и полиморфным превращениям безводных неорганических солей. Масса навесок исходной смеси составляла 0.3 г. Исходные реактивы LiBr, Li2CO3, Li2SO4 квалификации “х. ч.” были предварительно обезвожены.
Данные по двухкомпонентным ограняющим системам трехкомпонентной системы приведены в табл. 1.
Таблица 1.
Экспериментальные данные по нонвариантным точкам двухкомпонентных систем
| Система | Характер точки | Символ | Состав, мол. % | t, °C | Источник | |
|---|---|---|---|---|---|---|
| вещество 1 | вещество 2 | |||||
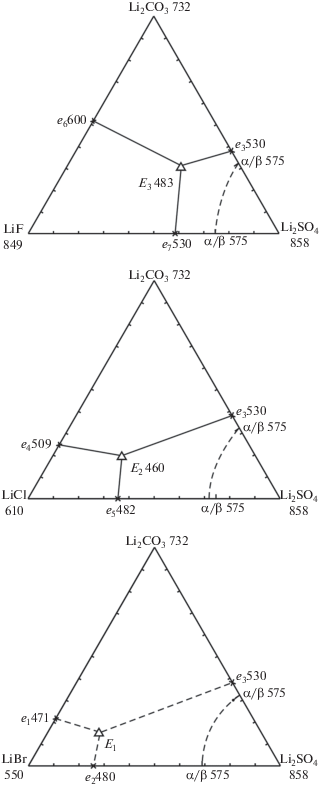
| LiBr–Li2CO3 | Эвтектика | e1 | 87 | 13 | 476 | [12] |
| e1 | 79 | 21 | 471 | Наст. работа | ||
| LiBr–Li2SO4 | Эвтектика | e2 | 75 | 25 | 480 | [13] |
| α/β-переход Li2SO4 | p1 | 30.5 | 69.5 | 575 | ||
| Li2CO3–Li2SO4 | Эвтектика | e3 | 38 | 62 | 530 | [12] |
| α/β-переход Li2SO4 | p2 | 33 | 67 | 575 | Наст. работа | |
Полиморфные переходы существуют у карбоната и сульфата лития при 410 и 575°C соответственно, что оказывает влияние на фазовый состав двух- и трехкомпонентных систем. Все двухкомпонентные системы были исследованы ранее [12, 13]. Однако при проверке систем выявлены расхождения с литературными данными, поэтому в настоящей работе использованы и полученные нами результаты (табл. 1). Двухкомпонентные системы, входящие в состав трехкомпонентной системы, эвтектического типа, поэтому трехкомпонентная система тоже будет эвтектического типа.
Для изучения трехкомпонентной солевой системы LiBr–Li2CO3–Li2SO4 необходимо выбрать рациональный политермический разрез. Поэтому вначале были рассчитаны координаты трехкомпонентной эвтектики методом Мартыновой–Сусарева по программе, предложенной в [14]: LiBr – 47.8 мол. %, Li2CO3 – 19.8 мол. %, Li2SO4 – 32.4 мол. %, температура плавления 353.6°C.
Температура плавления трехкомпонентной эвтектики системы LiBr–Li2CO3–Li2SO4 рассчитана c помощью прямолинейной зависимости в двух вариантах:
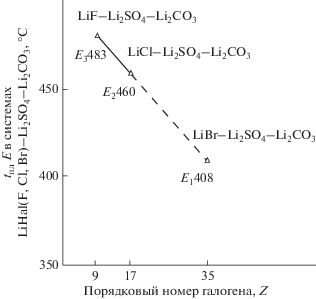
1) от порядкового номера галогена (Z) в ряду LiHal–Li2CO3–Li2SO4 (Наl = F, Cl, Br), tE = = 681 K/408°С по уравнению tE = –2.875Z + 781.8, графически расчет изображен на рис. 1;
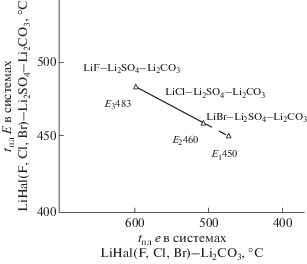
2) от температуры плавления эвтектик ограняющих двухкомпонентных систем (n) Li2СO3–Li(F, Cl, Br) в ряду LiHal–Li2CO3–Li2SO4 (Наl = F, Cl, Br), tE = 723 K/450°С по уравнению tE = 0.252n + + 535.3, графически расчет изображен на рис. 2.
Рис. 2.
Зависимость температуры плавления эвтектик от температуры плавления ограняющих двухкомпонентных систем.
Модель ликвидуса системы LiBr–Li2CO3–Li2SO4 представлена четырьмя полями кристаллизации: LiBr, Li2СO3 и α/β-модификацией Li2SO4 (рис. 3). Максимальные поля кристаллизации принадлежат тугоплавким компонентам Li2SO4 и Li2СO3. С увеличением порядкового номера галогена температура плавления трехкомпонентных эвтектик в ряду снижается от LiF к LiBr: E483 > E460 > > E450 (408)°С, а содержание LiHal в эвтектиках ряда увеличивается.
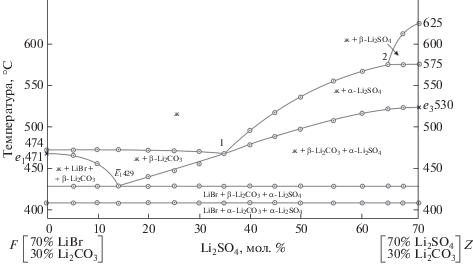
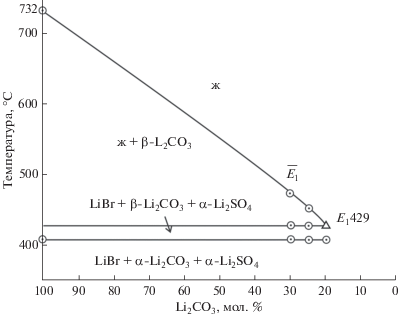
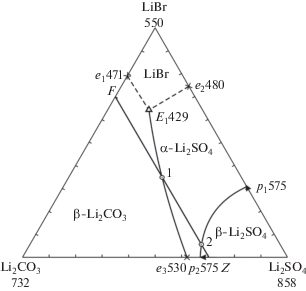
С учетом указанных выше данных проведен прогноз фазового комплекса, и в треугольнике состава выбран для исследования политермический разрез FZ с постоянной концентрацией Li2CO3: F[70 мол. % LiBr, 30 мол. % Li2CO3]; Z[70 мол. % Li2SO4, 30 мол. % Li2CO3], который должен пересекать два поля кристаллизации компонентов Li2CO3 и Li2SO4. В ходе исследования разреза FZ построена его диаграмма, позволившая найти проекцию тройной эвтектической точки на плоскость указанного разреза и температуру плавления тройной эвтектики – 429°С (рис. 4). При исследовании нонвариантного разреза (рис. 5), соединяющего вершину компонента Li2CO3 c проекцией трехкомпонентной эвтектики ${{\bar {E}}_{1}},$ при последовательном уменьшении концентрации карбоната лития и сохранении соотношения бромида и сульфата лития определен состав эвтектической смеси: 65.0% LiBr, 20.0% Li2CO3, 15.0% Li2SO4 (рис. 6). Из T–x-диаграммы разреза FZ определены также координаты опорных точек 1 (на моновариантной кривой e3E1) и 2 (на кривой p1p2), последняя отвечает α/β-полиморфному переходу Li2SO4.
Для определения удельной энтальпии плавления эвтектического состава использован метод дифференциальной сканирующей калориметрии (ДСК). Метод основан на измерении теплового потока между исследуемым образцом и эталоном в строго контролируемых температурных условиях. Для измерения применяли установку ДСК‑500 [15, 16].
Для исключения промахов из числа рассматриваемых результатов использовали метод с Q-критерием [17]. Для этого рассчитывали величину Qэксп, равную отношению разности выпадающего (xm = = 105) и ближайшего к нему результата (xk = 103) к размаху варьирования. Размах варьирования определяли как разность наибольшего (xm = 105) и наименьшего (xj = 87) значений из результатов выборочной совокупности:
Полученное значение 0.111 сравнивали с критическим значением Qкрит, равным 0.568. Поскольку Qэксп < Qкрит, при данном числе измерений и доверительной вероятности 0.95 нет сильно выпадающего значения (xm). Для выборки из семи (n = 7) приведенных результатов рассчитывали среднее значение ∆mH:
дисперсию:Границы доверительного интервала определяли по выражению:
где f = n – 1 – число степеней свободы; P – доверительная вероятность; tP,f – критерий Стьюдента, равный 2.45 при P = 0.95 и f = 6. С помощью методов математической статистики определяли границы доверительного интервала (±2.3 кДж/кг) и удельную энтальпию плавления (97.0 кДж/кг). Значение удельной энтальпии плавления равно 97.0 ± 2.3 кДж/кг (при выбранном количестве измерений и доверительной вероятности 0.95).Рассчитана молярная энтальпия плавления сплава эвтектического состава по формуле [18]:
Проведен также расчет энтальпии плавления эвтектики по формуле [19]:
где Mср – средняя молярная масса эвтектического состава.РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Экспериментально определены температура плавления и состав трехкомпонентной эвтектики системы LiBr–Li2CO3–Li2SO4. Сравнение расчетных и экспериментальных данных по методу Мартыновой–Сусарева показало среднее отклонение по содержанию компонентов 11.6%. Отклонение по температуре плавления представлено в табл. 2.
Таблица 2.
Отклонение расчетных данных по температуре плавления эвтектик от экспериментальных
| Экспериментальные данные | 702 K/429°С | |
|---|---|---|
| Метод Мартыновой–Сусарева |
Расчетные данные температуры плавления эвтектики | 626 K/353.6°С |
| Погрешность абсолютная |Δ|, K (относительная, δ, %) | 75.4 (10.7) | |
| Зависимость от порядкового номера галогена | Расчетные данные температуры плавления эвтектики | 681 K/408°С |
| Погрешность абсолютная |Δ|, K (относительная, δ, %) | 21 (2.9) | |
| Зависимость от температуры плавления эвтектик ограняющих двухкомпонентных систем | Расчетные данные температуры плавления эвтектики | 723 K/450°С |
| Погрешность абсолютная |Δ|, K (относительная, δ, %) | 21 (2.9) | |
Полученные расчетные данные температуры плавления эвтектики системы LiBr–Li2CO3–Li2SO4 в зависимости от порядкового номера галогена в ряду LiHal–Li2CO3–Li2SO4 и от температуры плавления ограняющих двухкомпонентных систем не уступают расчету по методу Мартыновой–Сусарева (относительная ошибка 2.9%).
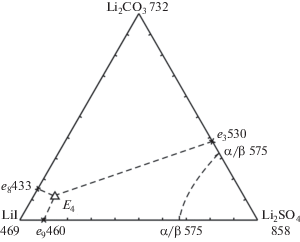
Данные по системе LiBr–Li2CO3–Li2SO4 позволяют сделать предварительный прогноз топологии ликвидусов системы LiI–Li2CO3–Li2SO4 (рис. 7). Температура плавления эвтектики ограняющей двухкомпонентной системы LiI–Li2CO3 также рассчитана с помощью построения зависимости от температуры плавления двухкомпонентных систем в ряду и по зависимости от порядкового номера галогена. Температура плавления и состав эвтектики системы LiI–Li2SO4 взяты из [20]. Получены расчетные данные температуры плавления тройной эвтектики системы LiI–Li2CO3–Li2SO4 в ряду по зависимости от порядкового номера галогена и по зависимости от температуры плавления ограняющих двухкомпонентных систем. В системе также ожидается образование эвтектики. Данные представлены на рис. 7.
Расчет показывает снижение температуры плавления трехкомпонентных эвтектик в ряду систем LiHal–Li2CO3–Li2SO4 (Наl = F, Cl, Br, I): 483°С (LiF) > 460°С (LiCl) > 429°С (LiBr) > 398°С (LiI).
ЗАКЛЮЧЕНИЕ
1. Рассчитана температура плавления тройной эвтектики в системе LiBr–Li2CO3–Li2SO4 методом Мартыновой–Сусарева и по прямолинейным зависимостям в ряду LiHal–Li2CO3–Li2SO4 (Наl = F, Cl, Br) от порядкового номера галогена и от температуры плавления двойных эвтектик. Последние два метода дают минимальное относительное отклонение.
2. Методами ДТА и ДСК определены координаты тройной эвтектики и ее удельная энтальпия плавления.
3. Экспериментальные данные по координатам эвтектики в изученной системе LiBr–Li2CO3–Li2SO4 позволили рассчитать температуру плавления тройной эвтектики в системе LiI–Li2CO3–Li2SO4.
4. Анализ топологии ликвидусов ряда систем LiHal–Li2CO3–Li2SO4 (Наl = F, Cl, Br, I) показал, что температура плавления тройных эвтектик снижается от фтора к иоду, так как уменьшается температура плавления LiHal от LiF к LiI. Снижаются площади поверхности кристаллизации LiHal в проекции на треугольник составов с одновременным возрастанием площадей кристаллизации Li2CO3 и Li2SO4.
5. Исходя из экспериментально полученного значения удельной энтальпии плавления эвтектики трехкомпонентной системы LiBr–Li2CO3–Li2SO4 (97.0 ± 2.3 кДж/кг) можно сделать вывод, что данный эвтектический состав более целесообразно использовать в качестве расплавляемого электролита для химических источников тока [6, 21].
Список литературы
Medvedeva A.E., Pechen L.S., Makhonina E.V. et al. // Russ. J. Inorg. Chem. 2019. V. 64. № 7. P. 8290. [Медведева А.Е., Печень Л.С., Махонина Е.В. и др. // Журн. неорган. химии. 2019. Т. 64. № 7. С. 6779.] https://doi.org/10.1134/S003602361907012X
Ismailova E.N., Mashadieva L.F., Bakhtiyarly I.B. et al. // Russ. J. Inorg. Chem. 2019. V. 64. № 6. P. 801. [Исмаилова Э.Н., Машадиева Л.Ф., Бахтиярлы И.Б., Бабанлы М.Б. // Журн. неорган. химии. 2019. Т. 64. № 6. С. 646.] https://doi.org/10.1134/S0036023619060093
Gasanova U.A., Aliev O.M., Bakhtiyarly I.B. et al. // Russ. J. Inorg. Chem. 2019. V. 64. № 2. P. 242. [Гасанова У.А., Алиев О.М., Бахтиярлы И.Б., Мамедов Ш.Г. // Журн. неорган. химии. 2019. Т. 64. № 2. С. 196.] https://doi.org/10.1134/S0036023619020074
Делимарский Ю.К. Химия ионных расплавов. Киев: Наук. думка, 1980. 327 с.
Kochkarov Z.A., Sokurova Z.A., Kochkarov Z.Z. // Russ. J. Inorg. Chem. 2018. V. 63. № 7. С. 944. [Кочкаров Ж.А., Сокурова З.А., Кочкаров З.Ж. // Журн. неорган. химии. 2018. Т. 63. № 7. С. 903.] https://doi.org/10.1134/S0036023618070094
Багоцкий В.С., Скундин А.М. 1Химические источники тока. М.: Энергоиздат, 1981. 360 с.
Коровин Н.В. Электрохимическая энергетика. М.: Энергоатомиздат, 1991. 264 с.
Варыпаев Н.Н. Химические источники тока: учебное пособие для химико-технологических специальностей вузов. М.: Высшая школа, 1990. 240 с.
Уэндландт У. Термические методы анализа. М.: Мир, 1978. 528 с.
Гаркушин И.К., Кондратюк И.М., Егорцев Г.Е., Истомова М.А. Теоретические и экспериментальные методы исследования многокомпонентных систем. Самара: Самар. гос. техн. ун-т, 2012. 125 с.
Егунов В.П., Гаркушин И.К., Фролов Е.И., Мощенский Ю.В. Термический анализ и калориметрия. Самара: Самар. гос. техн. ун-т, 2013. 583 с.
Диаграммы плавкости солевых систем / Под ред. Посыпайко В.И., Алексеевой Е.А. Ч. III. М.: Металлургия, 1977. 204 с.
Фролов Е.И. Фазовые равновесия в пятикомпонентной системе LiF–LiBr–LiVO3–Li2MoO4–Li2SO4. Дис. … канд. хим. наук. Самара: СамГТУ, 2010. 156 с.
Мощенская Е.Ю. Программный комплекс для моделирования фазовых диаграмм состав–температура и состав–ток в физико-химическом анализе солевых и металлических систем. Свидетельство об официальной регистрации программы для ЭВМ № 2006612377 от 05.09.2006.
Мощенский Ю.В. // Приборы и техника эксперимента. 2003. Т. 46. № 6. С. 143.
Федотов С.В., Мощенский Ю.В. Интерфейсное программное обеспечение DSCTool. Самара: Самар. гос. техн. ун-т, 2004. 23 с.
Фадеева В.И., Барбалат Ю.А., Гармаш А.В. и др. Основы аналитической химии. Задачи и вопросы. М.: Высш. шк., 2002. 412 с.
Garkushin I.K., Dvoryanova E.M., Aphanasieva O.U. // Abstracts of the XVII International conference on thermodynamics in Russia: In 2 V. 1. Kazan: Innovation Publishing House “Butlerov Heritage” Ltd, 2009. P. 337.
Краткий справочник физико-химических величин / Под ред. Мищенко К.П., Равделя А.А. Л.: Химия, 1874. С. 109.
Мощенская Е.Ю., Гаркушин И.К., Фролов Е.И. Расчет составов и температур плавления эвтектик в тройных системах. Самара: Самар. гос. техн. ун-т, 2013. 112 с.
Гаркушин И.К., Фролов Е.И., Губанова Т.В. // Электрохимическая энергетика. 2011. Т. 11. № 2. С. 93.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии