Журнал неорганической химии, 2020, T. 65, № 3, стр. 327-333
Комплексообразование европия(III) с фотодитазином по данным люминесцентной и ИК-спектроскопии
Н. И. Стеблевская a, *, М. А. Медков a, М. В. Белобелецкая a
a Институт химии ДВО РАН
690022 Владивосток, пр-т 100-летия Владивостока, 159, Россия
* E-mail: steblevskaya@ich.dvo.ru
Поступила в редакцию 05.09.2019
После доработки 31.10.2019
Принята к публикации 31.10.2019
Аннотация
По данным люминесцентной и ИК-спектроскопии изучено комплексообразование европия(III) с фотодитазином – фотосенсибилизатором в методе фотодинамической терапии. Люминесценция растворов европия с фотодитазином и твердого комплекса характеризуется полосами эмиссии в области спектра 400–700 нм, характерной как для комплексных соединений Eu3+, так и для фотодитазина. Показано увеличение интенсивности люминесценции иона Eu3+ в красной области при комплексообразовании с фотодитазином. С учетом перекрывания полос люминесценции при 400–700 нм растворов с полосами поглощения фотодитазина при добавлении хлорида европия увеличивается передача энергии возбуждения фотодитазину. Комбинированный препарат из соли европия и фотосенсибилизатора – фотодитазина может быть использован для направленного подведения светового излучения к фотодитазину при возбуждении УФ-светом, что приведет к более эффективному образованию реактивных форм кислорода и может быть перспективным для использования в методе наружной фотодинамической терапии.
ВВЕДЕНИЕ
Комплексные соединения редкоземельных элементов (РЗЭ) используются в аналитической практике для обнаружения микроколичеств последних, в технике при получении оптических, в том числе светотрансформирующих материалов, в качестве прекурсоров для синтеза ряда функциональных композитов с практическими свойствами, в медицине в качестве люминесцентных агентов для ранней диагностики и лечения некоторых патологий [1–5].
В методе фотодинамической терапии, применяемой при лечении поверхностно расположенных злокачественных новообразований [6–11], используется селективно накапливающийся в опухолевых клетках фотосенсибилизатор. При облучении опухоли светом фотосенсибилизатор начинает вырабатывать активный кислород (синглетный кислород, пероксиды, другие подобные соединения), уничтожающий клетки опухоли [9, 11, 12]. В качестве фотосенсибилизатора широко используется отечественный препарат фотодитазин (ФД) на основе глюкаминовой соли хлорина Е6 [11, 12]. Недостатком метода фотодинамической терапии является его ограничение для применения в лечении полостных новообразований, поскольку видимый свет не способен проникать через ткани организма и, следовательно, не может активировать фотосенсибилизатор. Для преодоления этого недостатка было предложено [11] создать препарат, который наряду с фотосенсибилизатором включает коллоидный раствор нанолюминофора, испускающего под действием рентгеновского излучения видимый свет с длиной волны в области поглощения фотосенсибилизатора. После введения такого препарата в организм проводится локальное облучение злокачественной опухоли, при этом нанолюминофор преобразует излучение в видимый свет, необходимый для возбуждения флюоресценции фотосенсибилизатора и, как следствие, активации его фотодинамического действия на опухолевые клетки. В качестве нанолюминофоров были синтезированы образцы состава Zn3(PO4)2:Mn2+ и Ba3(PO4)2:Eu2+, обладающие малой токсичностью и наиболее высокой интенсивностью свечения при возбуждении жестким рентгеновским излучением с λ = 0.12–0.31 Å, что соответствует излучению медицинских терапевтических установок [11]. Для использования в составе медицинских препаратов при лечении онкологических заболеваний методом фотодинамической терапии необходимы нанолюминофоры, излучающие в видимой области с λ = 650 и 400 нм [7, 9]. В качестве нанолюминофоров могут быть использованы синтезированные нами соединения на основе фосфатов, содержащие двух- и трехвалентный европий: метафосфат Eu(PO3)3:Eu2+ и ортофосфат EuPO4:Eu2+ [12, 13]. Указанные люминофоры проявляют люминесценцию в области спектра от 400 до 700 нм, характерной как для Eu3+ (полосы 5Dо–7Fj (j = 0, 1, 2, 3, 4)-переходов), так и для Eu2+ (полоса перехода 4f65d 8S7/2 → 8S7/2) [14]. Ранее были изучены оптические свойства фотодитазина [12]. Однако для расширения возможностей фотодинамической терапии необходимы также сведения о механизме взаимодействия фотосенсибилизатора и вводимого в раствор нанолюминофора.
Цель настоящей работы – исследование комплексообразования европия(III) методами люминесцентной и ИК-спектроскопии с одним из используемых в методе фотодинамической терапии для лечения онкологических заболеваний фотосенсибилизаторов – фотодитазином.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для исследования комплексообразования европия с ФД использовали водный раствор хлорида европия, концентрация Eu(III) в котором составляла 6.6 × 10–3 моль/л. Исходный рабочий водный раствор ФД с концентрацией 5 × 10–3 моль/л готовили разбавлением концентрата “Фотодитазин для инфузий” 8 × 10–3 моль/л (ООО “Вета-Гранд”, Россия). Соотношение Eu : ФД варьировали от 1 : 2.5 до 10 : 1. Синтез твердого комплексного соединения европия с фотодитазином проводили при рН 7–7.5 и соотношении Eu : ФД = 1 : 3. Полученное соединение отфильтровывали и высушивали. Исследование соединения на дифрактометре D8 Advance “BrukerAXS” (Германия) в СuKα-излучении показало его рентгеноаморфность.
В каждом случае при добавлении определенных мольных количеств раствора Eu3+ к ФД регистрировали спектры люминесценции растворов при длине волны возбуждения λex = 406 нм. Спектры люминесценции растворов и твердого образца при 300 K регистрировали на спектрофлуориметре Shimadzu RF-5301 PC. Выбор длины волны возбуждения люминесценции λex = 406 нм был сделан по наиболее интенсивной линии после регистрации спектров возбуждения люминесценции образцов. ИК-спектры растворов и твердого образца, подготовленного в виде суспензии в вазелиновом масле на стекле KRS-5я, записывали при комнатной температуре на приборе Vertex 70 в области 4000–400 см–1. Для исследования качественного и количественного элементного состава и морфологии образцов применяли метод сканирующей электронной микроскопии (СЭМ). СЭМ-изображения образцов получали на электронном сканирующем микроскопе высокого разрешения Hitachi S 5500 (Япония), который использует in-lens технологию для получения как сверхвысокого разрешения, так высокой чувствительности EDS-анализа. Микроскоп оборудован EDS-спектрометром и позволяет проводить рентгенофлуоресцентный анализ и картирование образца.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Комплексообразование европия(III) с ФД в растворе происходит в узком интервале рН – от 6 до 7. При рН < 6 фотодитазин выпадает в осадок, в то время как гидролиз хлорида европия происходит при рН 7.5–8. Первоначальное значение рН исходного раствора ФД равно 8.9. Для предотвращения образования при таком значении рН осадка гидроксида европия при добавлении к данному раствору водного раствора хлорида или нитрата европия рН рабочего раствора ФД доводили до 6.5 добавлением разбавленной соляной или азотной кислоты.
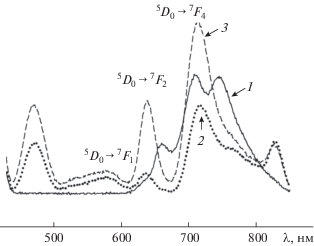
Данные о комплексообразовании европия с фотодитазином можно получить при сравнительном изучении спектрально-люминесцентных характеристик полученных растворов и исходных cоединений – хлорида европия и фотодитазина. Образование в растворе комплексных соединений европия с фотодитазином подтверждается сравнительным изучением спктрально-люминесцентных характеристик ФД и иона Eu3+. Следует отметить, что спектры люминесценции растворов соединений европия(III) по сравнению со спектрами твердых образцов отличаются обусловленной влиянием растворителя незначительной диффузностью. Кроме того, спектры люминесценции всех образцов регистрировали в идентичных условиях, что позволяет корректно использовать их для интерпретации. Европий в комплексных соединениях с неорганическими и органическими лигандами демонстрирует интенсивную люминесценцию красного цвета в области 550–700 нм с λmax ≈ 620 нм [15, 16]. Ион Eu3+ имеет относительно простую картину расщепления 5D0–7Fj-уровней (j = 0, 1, 2, 3, 4) в поле лигандов, что позволяет использовать данные люминесценции для изучения образования комплексных соединений в растворе [15, 16]. При постепенном добавлении к раствору ФД водного раствора европия в различных мольных соотношениях происходят изменения в положении полос переходов и распределении интенсивностей полос в спектрах люминесценции иона Eu3+. При этом в спектрах люминесценции растворов при увеличении соотношения Eu : ФД от 3 : 1 до 10 : 1 регистрируются характерные для иона Eu3+ полосы в области 5D0–7Fj-переходов (j = 0, 1, 2, 4). На рис. 1 для сравнения приведены спектры люминесценции растворов при соотношении Eu : ФД = = 5 : 1 и 8 : 1 и исходного фотодитазина.
Рис. 1.
Спектры люминесценции фотодитазина (1) и растворов европия с фотодитазином: Eu : ФД = 5 : 1 (2) и 8 : 1 (3); (λeх = 406 нм), 300 K.
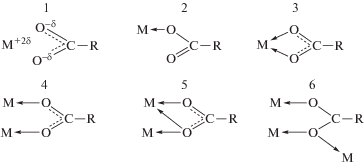
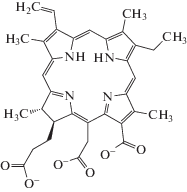
Учитывая сложное строение молекулы ФД (рис. 2 [17]) и наличие в его составе нескольких координационных центров (шесть атомов кислорода в составе трех карбоксильных групп и четыре атома азота в порфириновом кольце), можно предположить многообразие его координации с ионами Eu3+. Лиганды, содержащие карбоксильные группы, могут присоединяться к иону металла одним из следующих способов:
Согласно [18–21], наиболее вероятна бидентатная (циклическая или мостиковая) и тридентатная мостиково-циклическая координация карбоксилатного лиганда к лантанидам для реализации наиболее характерных для них КЧ 8–12. Осуществление той или иной координации при учете стремления РЗЭ к высоким КЧ зависит от количества карбоксильных групп. По мере увеличения числа карбоксильных групп, входящих в состав комплекса, их координация меняется от тридентатной мостиково-циклической к бидентатно-мостиковой, а затем к бидентатно-циклической и монодентатной [21]. Принимая во внимание, что для европия в комплексных соединениях КЧ > 6 [3, 15, 18], можно предположить возможность реализации в растворе разных способов присоединения ионов Eu3+ к ФД, в том числе образование димерных или полимерных комплексов, в которых в качестве мостиковых групп выступают карбоксилат-ионы, координируясь к иону Eu3+ по типу 5 [19, 20]. Так, при изменении соотношения реагентов и температуры из реакционной смеси при рН 6 выделены [20] трис-хелаты европия с пиромеллитовой (1,2,4,5-бензолтетракарбоновой) кислотой (ПМ), содержащей в своем составе четыре СООˉ-группы: Eu4(ПМ)3(Н2О)16, Eu2(ПМ)3(Н2О)6, Eu4(ПМ)3(Н2О)9(L)m, где L – нейтральный лиганд: фенантролин (ФЕН), трифенилфосфиноксид (ТФФО), триизобутилфосфат (ТИБФ), трибутилфосфат (ТБФ), диметилформамид (ДМФА); m = 1, 2, 3 для ФЕН; m = 1 для ТФФО и ДМФА; m = 3 для ТИБФ и ТБФ. Молекулярные массы полученных полиядерных соединений, рассчитанные по содержанию концевых групп, имеют значения (8–20) ×103. На молекулярную массу и состав полимера большое влияние оказывает соотношение исходных веществ. Полихелаты европия с пиромеллитовой кислотой наибольшей молекулярной массы получаются при эквимольном соотношении реагентов.
Как уже отмечалось, для всех растворов европия(III) с ФД регистрируется характерная для иона Eu3+ люминесценция в области 5D0–7Fj-переходов (j = 0, 1, 2, 4), максимум которой приходится на 5D0–7F2.4-переходы. Следует учесть также возможность образования в растворах фотодитазина с европием различных по составу комплексов при изменении соотношения Eu : ФД от 3 : 1 до 10 : 1, что сказывается на изменении положения полос переходов и распределении их интенсивностей в отсутствие расщепления полос в спектрах люминесценции (рис. 1), а также в изменении относительной интенсивности люминесценции иона Eu3+. При этом наибольшую относительную интенсивность люминесценции в равных условиях регистрации спектров показывают комплексы в растворах при отношении Eu : ФД = = 10 : 1. Интенсивность полосы 5D0–7F2-перехода при λ ~ 640 нм в спектре люминесценции указанного раствора на три порядка больше, чем в спектре раствора хлорида европия. Таким образом, об образовании комплексных соединений европия(III) с фотодитазином свидетельствуют не только значительные изменения в характере расщепления штарковских компонент иона Eu3+ и в положении полос переходов по сравнению с этими характеристиками в спектрах люминесценции иона Eu3+ в водном растворе хлорида европия и исходного раствора фотодитазина, но и значительный рост относительной интенсивности люминесценции (рис. 3).
Рис. 3.
Спектры люминесценции фотодитазина (1, вставка – увеличение); растворов хлорида европия (2) и европия с фотодитазином Eu : ФД = 10 : 1 (λeх = 406 нм), 300 K.
По данным РФА, выделенный из раствора комплекс европия(III) с фотодитазином рентгеноаморфен. Энергодисперсионный спектр показывает наличие в составе комплекса четырех элементов: углерода, кислорода, азота и европия. Количество элементов в составе выделенного комплексного соединения составляет: С – 54.66 вес. % или 75.56 ат. %; О – 12.85 вес. % или 13.33 ат. %; N – 7.51 вес. % или 8.89 ат. %; Eu – 20.35 вес. % или 2.22 ат. %. ИК-спектр комплекса европия(III) с фотодитазином существенно отличается от спектра исходного лиганда – ФД (табл. 1). Это отличие заключается в заметном сдвиге частот колебаний и изменении характера поглощения в области 480–1560 и 3100–3300 см–1. По сравнению с ИК-спектром исходного фотодитазина в ИК-спектре комплекса европия с ФД в области 480–630 см–1 наблюдаются дополнительные полосы поглощения, обусловленные колебаниями связи Eu–О, деформационными колебаниями групп СОО– и С–СN [21]. Дополнительные полосы поглощения и изменения в положении отдельных полос поглощения регистрируются также в области 770–1300 и 1540 –1630 см–1, что, вероятно, обусловлено изменениями валентных и деформационных колебаний колец ФД, групп СН–, СОО–, С=N, металлоцикла в результате координации с ионом Eu3+ в комплексном соединении. Известно [22], что при образовании комплексных соединений РЗЭ с порфиринами с участием атомов азота происходит деформация порфиринового цикла, вызывающая сдвиг частот колебаний азомостиковых и пиррольных фрагментов. В ИК-спектре комплекса европия с ФД в области валентных симметричных колебаний νas(COO–) появляется полоса при 1406 см–1, отсутствующая в ИК-спектре свободного фотодитазина. При этом положение полос νas(COO–) при 1306, 1377 и 1462 см–1 не изменяется. В ИК-спектре комплекса появляются дополнительные полосы поглощения при 1600 и 1631 см–1, которые можно отнести к колебаниям ν(С=О) карбоксильных групп. В этой области проявляются также колебания связи С=N порфиринового цикла. Полоса νas(COO–) при 1564 см–1 в ИК-спектре свободного ФД при образовании комплекса европия с ФД сдвигается к 1544 см–1. Сложная структура полос поглощения в области валентных асимметричных νas(COO–) (1500–1580 см–1) и симметричных νs(COO–) (1300–1420 см–1) колебаний связей координированных карбоксильных групп [21] свидетельствует, по-видимому, о наличии химической неэквивалентности различных СОО-групп ФД в изучаемом соединении. Фотодитазин содержит четыре атома азота в составе –NH- и =N-групп. В области частот валентных колебаний этих групп, проявляющихся, согласно [21], в интервале 3200–3500 см–1, в ИК-спектре комплекса наблюдаются изменения в положении полос (3186, 3267, 3280 см–1) по сравнению с ИК-спектром исходного фотодитазина (3152, 3165, 3285 см–1). Дополнительные полосы поглощения и изменения в положении отдельных полос в ИК-спектре комплекса европия(III) с ФД в области валентных и деформационных колебаний СОО–- и NH-групп фотодитазина свидетельствуют об участии этих групп в образовании связей с ионом европия. Приведенные в обзоре [23] структурные данные указывают на возможность образования лантанидами в комплексных соединениях с порфиринами, имеющими в боковых цепях карбоксильные группы, связей как с атомами азота порфиринового цикла, так и с атомами кислорода этих карбоксильных групп. Данные элементного анализа указывают на образование комплексного соединения европия с фотодитазином в соотношении Eu : ФД = 1 : 1. С учетом вышесказанного и наиболее вероятных для лантанидов КЧ от 8 до 12 в полученном комплексном соединении может быть реализована координация европия четырьмя атомами азота и бидентатная координация атомами кислорода карбоксильных групп фотодитазина.
Таблица 1.
Важнейшие колебательные частоты (в см–1) в ИК-спектрах фотодитазина и комплексного соединения европия с фотодитазином
| Фото-дитазин | Комплекс Eu с ФД | Отнесение |
|---|---|---|
| 3285 | 3281 | ν(NH) |
| 3165 | 3267 | |
| 3152 | 3186 | |
| 1631 | ν(C=О) + ν(–N=) | |
| 1600 | + ν(–C=C–N=)пиррольный фрагмент | |
| 1545 | + νаs(COO−) | |
| 1564 | 1462 | |
| 1462 | 1406 | |
| ν(C–О) + νs(COO–) | ||
| 1377 | + ν(C–C) + ν(–CН2) | |
| 1377 | 1306 | + δ(C–OH) |
| 1306 | 1242 | + νas(CCN) |
| 1240 | 1194 | + δ(C–H) |
| 1155 | ν(C C) | |
| 1167 | 1119 | + ν(С–С) |
| 1080 | + ρ(СН3) | |
| 1078 | 1065 | + δ(NН) + ν(ССN) |
| 1028 | + δ(C–OH) | |
| 1028 | 985 | |
| 985 | 964 | δ(–C=C–N=)пиррольный фрагмент |
| 962 | δ(СН) | |
| 914 | 895 | |
| 893 | 831 | δ пиррольного кольца |
| 847 | 804 | + δ(СН) |
| 800 | ||
| 769 | 721 | δ(С–СН) |
| 721 | 671 | +δ(СОО−) |
| 665 | 629 | |
| 611 | +δ хелатного кольца | |
| 604 | 565 | + ν(М–О) + δ(С–СN) |
| 579 | 511 | |
| 486 | ||
| 478 | ||
| 442 |
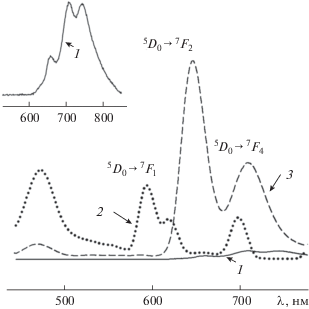
Сравнительный анализ спектрально-люминесцентных характеристик европия(III) в растворах в присутствии фотодитазина (рис. 3, кривая 3) и твердого образца комплексного соединения, выделенного из раствора при pH 7.3 и соотношении Eu : ФД = 10 : 1 (рис. 4а, кривая 1), показывает значительное сходство в положении полос переходов и интенсивностей линий по переходам 5D0–7Fj. При этом соотношение интенсивностей полос переходов между собой в сравниваемых спектрах люминесценции идентично. Основная доля энергии излучения европия приходится на 5D0–7F1,2-переходы. Интенсивность полос, соответствующих 5D0–7Fl-переходу, на столько же порядков ниже интенсивности линий перехода 5D0–7F2, как и 5D0–7F4-перехода. Следует отметить, что в области ~700 нм в спектрах люминесценции растворов и твердого образца помимо полос 5D0–7F4-перехода иона европия может проявляться самая интенсивная полоса люминесценции фотодитазина. Различия в спектрах люминесценции раствора и твердого образца комплекса наблюдаются лишь в характере расщепления полос переходов 5D0–7Fj на компоненты в спектре твердого образца комплексного соединения. Уширение полос 5D0–7Fj-переходов в спектре люминесценции раствора связано с влиянием растворителя. В длинноволновой области 450–500 нм в спектрах люминесценции и раствора, и твердого образца имеется полоса люминесценции, обусловленная, по-видимому, внутриконфигурационными f–f-переходами иона Eu3+ [16]. Таким образом, сравнение спектрально-люминесцентных характеристик раствора и кристаллического образца комплекса свидетельствует, по-видимому, об образовании в растворе комплексных соединений европия(III) в присутствии ФД.
Рис. 4.
Спектры (а) люминесценции твердого образца европия с фотодитазином (1) (λeх = 406 нм, 300 K) и поглощения фотодитазина (2); зависимость относительной интенсивности полосы 5D0–7F2-перехода в спектре люминесценции иона Eu3+ в растворе с фотодитазином (б) при возбуждении УФ-излучением (λeх = 406 нм, 8 ч, 300 K).
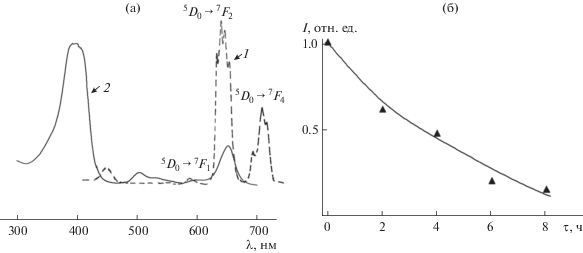
В методе фотодинамической терапии длина волны излучения нанолюминофора должна быть близка к длине волны поглощения фотосенсибилизатора для обеспечения эффективной работы препарата [6–11]. Фотодитазин, широко применяемый в последнее время в медицинской практике фотосенсибилизатор, имеет полосы поглощения в области 350–700 нм (рис. 4а, кривая 2). При облучении фотодитазина светом с длиной волны λeх = 406 нм наблюдается люминесценция в области 650–800 нм с λmax = 680 нм (рис. 3, кривая 1). С учетом перекрывания полос люминесценции λ ~ ~ 400–700 нм растворов (рис. 3, кривые 2 и 3) и кристаллического образца (рис. 4а, кривая 1) с полосами поглощения ФД (рис. 4а, кривая 2) при добавлении хлорида европия к фотодитазину увеличивается передача энергии возбуждения фотодитазину. Следует добавить, что значительное уменьшение интегральной интенсивности полосы 5D0–7F2-перехода в спектре люминесценции иона Eu3+ в растворе с ФД (λeх = 406 нм) наблюдается после 8 ч (рис. 4б) при облучении мягким γ- излучением от спектрометрического источника 60Co, активность которого по паспорту составляет 18.1 кБк. Кроме того, при диспергировании выделенного твердого комплекса европия(III) с ФД в воде образуется суспензия, что как раз необходимо для применения в методе фотодинамической терапии. Следовательно, такой комбинированный препарат из соли европия в сочетании с фотосенсибилизатором – фотодитазином способен более эффективно генерировать реактивные формы кислорода, чем сам фотодитазин, и может быть перспективным для использования в методе наружной фотодинамической терапии. К тому же использование подобных препаратов приводит, как показано в [11], к уменьшению количества выживших после облучения опухолевых клеток в 12–16 раз по сравнению с контрольным образцом.
ЗАКЛЮЧЕНИЕ
Комплексообразование европия с фотодитазином при добавлении хлорида европия к фотодитазину подтверждается как ИК-спектроскопическим, так и сравнительным спектрально-люминесцентным исследованием. Об образовании комплексных соединений европия с фотодитазином свидетельствуют не только значительные изменения в характере расщепления штарковских компонент иона Eu3+ и в положении полос переходов по сравнению с этими характеристиками в спектрах люминесценции иона Eu3+ в водном растворе хлорида европия и исходного раствора фотодитазина, но и значительный рост относительной интенсивности люминесценции. При постепенном добавлении к раствору фотодитазина водного раствора хлорида европия в различных мольных отношениях происходят изменения в положении полос переходов и распределении интенсивностей полос в спектрах люминесценции иона Eu3+. При этом в спектрах люминесценции растворов при увеличении соотношения Eu : ФД от 3 : 1 до 10 : 1 регистрируются характерные для иона Eu3+ полосы в области 5D0–7Fj-переходов (j = 0, 1, 2, 3, 4). Максимум люминесценции Eu3+ приходится на 5D0–7F2,4-переходы. Учитывая сложное строение молекулы ФД и наличие в его составе нескольких координационных центров (шесть атомов кислорода в составе трех карбоксильных групп и четыре атома азота в порфириновом кольце), можно предположить многообразие его координации с ионами Eu3+. Полосы люминесценции (λ ~ 400–700 нм) растворов и твердого образца перекрываются с полосами поглощения фотодитазина, что приводит к увеличению передачи энергии возбуждения фотодитазину при возбуждении УФ-светом и более эффективному генерированию реактивных форм кислорода. Добавление хлорида европия к раствору фотодитазина может быть использовано для направленного подведения светового излучения к фотодитазину при возбуждении УФ-светом.
Список литературы
Hao H.X., Chu Y., Yu Z.J. et al. // Opt. Mater. 2017. V. 72. P. 8. https://doi.org/10.1016/j.optmat.2017.04.013
Мешкова С.Б., Кирияк А.В., Топилова З.М. и др. // Вестн. Харьк. ун-та. Вып. Химия. 2008. Т. 16. № 820. С. 59.
Dobrokhotova Zh.V., Fomina I.G., Aleksandrov G.G. et al. // Russ. J. Inorg. Chem. 2009. V. 54. № 5. P. 668. [Доброхотова Ж.В., Фомина И.Г., Александров Г.Г. и др. // Журн. неорган. химии. 2009. Т. 54. № 5. С. 727.]
Steblevskaya N.I., Belobeletskaya M.V., Medkov M.A. et al. // Theor. Found. Chem. Eng. 2018. V. 52. № 4. P. 591. [Стеблевская Н.И., Белобелецкая М.В., Медков М.А. и др. // Хим. технология. 2017. № 2. С. 96.]
Khol’kin A.I., Patrusheva T.N. // Theor. Found. Chem. Eng. 2016. V. 50. № 5. P. 785. [Холькин А.И., Патрушева Т.Н. // Хим. технология. 2015. Т. 16. № 10. С. 576.]
Кузнецов В.В. // Исследования и практика в медицине. 2015. Т. 2. № 4. С. 98.
Hillemans P., Garcia F., Petry K.U. et al. // J. Obstet Gynecol. 2015. V. 4. № 212. P. 465. https://doi.org/10.1016/j.ajog.2014.10.1107
Филоненко Е.В. // Фотодинамическая терапия. 2014. № 1. С. 3.
Agostinis P., Berg K., Cengel K.A. et al. // CA Cancer J. Clin. 2011. V. 61. № 4. P. 250. https://doi.org/10.3322/caac.20114
Гельфонд М.Л. // Практическая онкология. 2007. Т. 8. № 4. С. 204.
Бахметьев В., Сычев М., Орлова А. и др. // Наноиндустрия. 2013. № 8. С. 46.
Винниченко М.Я., Софронов А.М., Фирсов Д.А. и др. // Научно-техн. ведомости СПбГПУ. Физ.-мат. науки. 2014. Т. 201. № 3. С. 110.
Стеблевская Н.И., Медков М.А., Белобелецкая М.В. Пат. RU № 2 651 028. Опубл. 18.04.2018. // Бюл. изобр. 2017. № 11.
Steblevskaya N.I., Belobeletskaya M.V., Ustinov A.Yu. et al. // Russ. J. Inorg. Chem. 2019. V. 64. № 2. P. 179. [Стеблевская Н.И., Белобелецкая М.В., Устинов А.Ю. и др. // Журн. неорган. химии. 2019. Т. 64. № 2. С. 146.]https://doi.org/10.1134/S0036023619020219
Золин В.Ф., Коренева Л.Г. Редкоземельный зонд в химии и биологии. М.: Наука, 1980.
Bunzli J.C.G., Eliseeva S.V. // Chem Sci. 2013. V. 4. P. 1939.
Жиентаев Т.М., Мелик-Нурбанов Н.С., Литманович Е.А. и др. // Высокомолекулярные соединения. Сер. А. 2009. Т. 51. № 5. С. 757.
Ionova G.V. // Russ. J. Inorg. Chem. 2002. V. 47. № 4. P. 529. [Ионова Г.В. // Журн. неорган. химии. 2002. Т. 47. № 4. С. 601.]
Кавун В.Я., Сергиенко В.И., Костин В.И. и др. // Журн. неорган. химии. 1985. Т. 30. № 2. С. 341.
Steblevskaya N.I., Medkov M.A., Belobeletskaya M.V. // Russ. J. Inorg. Chem. 2012. V. 57. № 7. P. 1045. [Стеблевская Н.И., Медков М.А., Белобелецкая М.В. // Журн. неорган. химии. 2012. Т. 57. № 7. С. 1119.]
Nakamoto K. Infrared and Raman Spectra of Inorganic and Coordination Compounds: Part A – Theory and Applications in Inorganic Chemistry. N.-Y.: John Wiley and Sons Inc., 2009.
Зиминов А.В., Рамш С.М., Теруков Е.И. и др. // Физика и техника полупроводников. 2006. Т. 40. № 10. С. 1161.
Bulach V., Sguerra F., Hosseini M.W. Porphyrin lanthanide complexes for NIR emission // Coordination Chem. Rev. 2012. № 256. P. 1468.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии