Журнал неорганической химии, 2020, T. 65, № 4, стр. 534-541
Твердый раствор со структурой α-NaFeO2 в системе Li1 + yCoO2–Li1 + yMnO2–Li1 + yNiO2–Li1 + yFeO2
Г. Д. Нипан a, М. Н. Смирнова a, *, Д. Ю. Корнилов b, М. А. Копьева a, Г. Е. Никифорова a, Н. П. Симоненко a, С. П. Губин a
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
b ООО “АкКо Лаб”
129110 Москва, ул. Гиляровского, 65/1, Россия
* E-mail: smirnova_macha1989@mail.ru
Поступила в редакцию 21.10.2019
После доработки 21.11.2019
Принята к публикации 27.11.2019
Аннотация
Методом рентгенофазового анализа (РФА) исследованы образцы номинальных составов Li1.1Mn1 – x(Ni0.33Co0.33Fe0.33)xO2 (0 ≤ х ≤ 1), синтезированные методом сжигания геля с крахмалом. Получен гомогенный образец состава Li1.1Ni0.27Mn0.20Co0.27Fe0.27O2 со структурой α-NaFeO2. По данным РФА оценена протяженность твердого раствора со структурой α-NaFeO2 вдоль концентрационных медиан изобарно-изотермического тетраэдра Li1 + yNiO2–Li1 + yMnO2–Li1 + yCoO2–Li1 + yFeO2. Выявлена непрерывность твердого раствора Li(Ni,Mn,Co,Fe)O2 для коноды Li1 + yCoO2–Li1 + yNi0.33Mn0.33Fe0.33O2, ограниченность для коноды Li1 + yNiO2–Li1 + yMn0.33Co0.33Fe0.33O2 и узкий интервал гомогенности для коноды Li1 + yMnO2–Li1 + yNi0.33Co0.33Fe0.33O2. Проанализировано изменение параметров элементарной ячейки Li(Ni,Mn,Co,Fe)O2 в зависимости от катионного состава. Образцы Li1.1Ni0.10Mn0.10Co0.70Fe0.10O2, Li1.1Ni0.70Mn0.10Co0.10Fe0.10O2 и Li1.1Ni0.60Mn0.13Co0.13Fe0.13O2 протестированы в качестве катодов литий-ионного аккумулятора.
ВВЕДЕНИЕ
Снижение содержания кобальта в слоистой структуре LiCoO2 (R$\bar {3}$m), послужившей основой при создании катодных материалов литий-ионных аккумуляторов (ЛИА) [1], привело к получению твердого раствора Li(Ni0.33Mn0.33Co0.33)O2 [2], а затем целого спектра составов, в которых доля Co не превышает 10% от общего числа катионов [3]. В качестве основного заместителя используется более дешевый и менее токсичный никель [4], однако Ni2+ из-за близости ионных радиусов способен замещать Li+ и разупорядочивать структуру α-NaFeO2, ухудшая электрохимические характеристики ЛИА. Для компенсации эффекта разупорядочения вводится литий сверх стехиометрии, что при номинальном составе Li1 + x(Ni,Mn,Co)1 – xO2, начиная с x = 0.2, приводит к образованию второй фазы Li2MnO3 (C2/m), не участвующей в электрохимическом процессе [5]. Избыточный литий не способствует снижению стоимости и пожароопасности ЛИА, между тем как замещение на Fe любого элемента из триады Ni, Mn, Co при сохранении гомогенности твердого раствора Li(Ni,Mn,Co,Fe)O2 позволит сделать ЛИА более дешевыми и экологически безопасными.
В образцах Li(Ni,Mn,Co,Fe)O2, синтезированных в ряде работ, доля железа не превышает 10%. Исходя из классического состава Li Ni0.33Mn0.33Co0.33O2 [2], кобальт частично замещен до LiNi0.33Mn0.33Co0.17Fe0.17O2 [6], Li Ni0.33Mn0.33Co0.22Fe0.11O2 [7], Li Ni0.33Mn0.33Co0.23Fe0.1O2 [8] и Li Ni0.33Mn0.33Co0.25Fe0.08O2 [9], а также никель и марганец до LiNi0.3Mn0.3Co0.3Fe0.1O2 [8, 10, 11]. Кроме того, проведено допирование железом с получением составов LiNi0.6Mn0.2Co0.15Fe0.05O2 [12] и LiNi0.4Mn0.4Co0.15Fe0.05O2 [13].
Введение Fe приводит к образованию концентрационного объема Li(Ni,Mn,Co,Fe)O2 в тетраэдре составов Li1 + yNiO2–Li1 + yMnO2–Li1 + yCoO2– Li1 + yFeO2 при постоянном давлении и температуре с новыми границами гомогенности по катионам относительно Li(Ni,Mn,Co)O2. Ранее в изобарно-изотермическом тетраэдре Li1 + yNiO2–Li1 + yMnO–Li1 + yCoO2–Li1 + yFeO2 нами определены фазовые состояния для образцов составов Li1.05Fe1 – x(Ni,Mn,Co)xO2, Li1.1Co1 – x(Ni,Mn,Fe)xO2 и Li1.1Ni1 – x(Mn,Co,Fe0)xO2 с шагом х = 0.1 вдоль медиан Li1 + yFeO2‒Li1 + yNi0.33Mn0.33Co0.33O2 [14], Li1 + yCoO2–Li1 + yNi0.33Mn0.33Fe0.33O2 [15], Li1 + yNiO2–Li1 + yMn0.33Co0.33Fe0.33O2 [15] и ноды Li1 + yFeO2–Li1 + yNi0.60Mn0.20Co0.20O2 [14]. Установлена возможность получения однофазных образцов со структурой α-NaFeO2 при содержании Fe 15–20% от общего числа катионов [14, 15].
В настоящей работе исследован фазовый состав вдоль концентрационной медианы Li1 + yMnO2–Li1 + yNi0.33Co0.33Fe0.33O2 и установлены границы объема гомогенности стабильного Li(Ni,Mn,Co,Fe)O2 в изобарно-изотермическом тетраэдре Li1 + yNiO2–Li1 + yMnO2–Li1 + yCoO2–Li1 + yFeO2. Протестированы отдельные образцы граничных составов твердого раствора в качестве катодов литий-ионных аккумуляторов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Потери лития в процессе синтеза могут составлять 5–7% [16], поэтому в исходную реакционную смесь добавляли 10%-ный избыток лития. Образцы Li1.1Mn1 – x(Ni0.33Co0.33Fe0.33)xO2 (0 ≤ х ≤ 1) синтезировали методом сжигания геля на основе крахмала [14, 15], который выступал в качестве восстановителя, способствовал процессу гелеобразования за счет термической клейстеризации и обеспечивал горение геля в самоподдерживающем режиме с образованием мелкодисперсных порошков.
Для приготовления исходных смесей использовали нитраты соответствующих металлов и крахмал с содержанием основных веществ >99.9% (х. ч.). Концентрацию металлов в нитратах определяли гравиметрическим методом. Растворы нитратов в расчете на 10 г конечного продукта Li1.1Mn1 – x(Ni0.33Co0.33Fe0.33)xO2 c шагом х = 0.1 переносили в мерные колбы на 200 мл и доводили дистиллированной водой до метки. Для синтеза 2 г каждого образца соответствующего состава 40 мл раствора переносили в керамическую чашу, добавляли раствор рассчитанного количества крахмала в 10 мл воды и упаривали при 90–120°С до образования геля. Дальнейшее повышение температуры до ~150°С приводило к интенсивному выделению газообразных продуктов и образованию черных губчатых хлопьев. Этот промежуточный порошкообразный продукт перетирали и поэтапно отжигали при температурах 300°С (5 ч), 500°С (5 ч) и 800°С (5 ч), а затем охлаждали в режиме выключенной печи.
Рентгенофазовый анализ (РФА) порошков выполняли на дифрактометре Bruker Advance D8 (CuKα-излучение) в интервале углов 2θ = 10°–70° с шагом сканирования 0.0133°. Обработку результатов проводили с помощью программного пакета DIFFRAC.EVA с использованием оборудования ЦКП ФМИ ИОНХ РАН.
Рентгеноспектральный микроанализ (РСМА) структуры образцов Li(Ni,Mn,Co,Fe)O2 и соотношения Ni : Mn : Co : Fe (с помощью энергодисперсионной приставки) осуществляли с использованием микроскопа Carl Zeiss NVision 40, оснащенного анализатором Oxford Instruments X-Max, при ускоряющих напряжениях 3–20 кВ.
Электрохимические испытания Li(Ni,Mn,Co,Fe)O2 проводили на автоматизированном зарядно-разрядном измерительно-вычислительном комплексе компании “АК БУСТЕР” (Россия) по двухэлектродной схеме в сборно-разборных тефлоновых ячейках, где в качестве анода и электрода сравнения применялся металлический литий марки ЛЭ-1 (ГОСТ 8774-75). Катоды для электрохимических испытаний готовили следующим образом: гомогенизированную смесь (порошок Li(Ni,Mn,Co,Fe)O2 90%, ацетиленовая сажа (Timcall) 5%, поливинилиденфторид (PVDF), растворенный в N-метилпироллидоне, 5%) наносили на алюминиевый токосъем размером 15 × 27.5 мм и сушили при температуре 80°С в течение 1 ч, затем осуществляли вакуумную термообработку при 120°С в течение 12 ч. Сборка тестовых электрохимических ячеек происходила в среде высокочистого аргона с использованием перчаточного бокса PureLab HE Glovebox (США), в работе применялся электролит марки SelectiLyte LP71 (США) и сепаратор Dreamweaver Silver ARTM40 (США).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
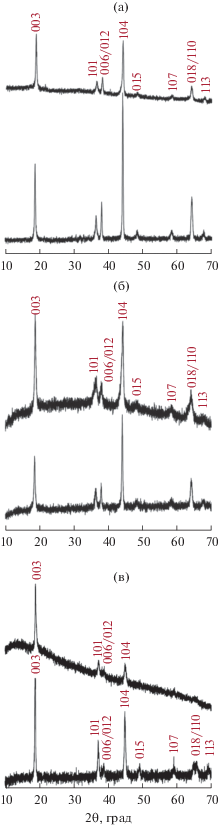
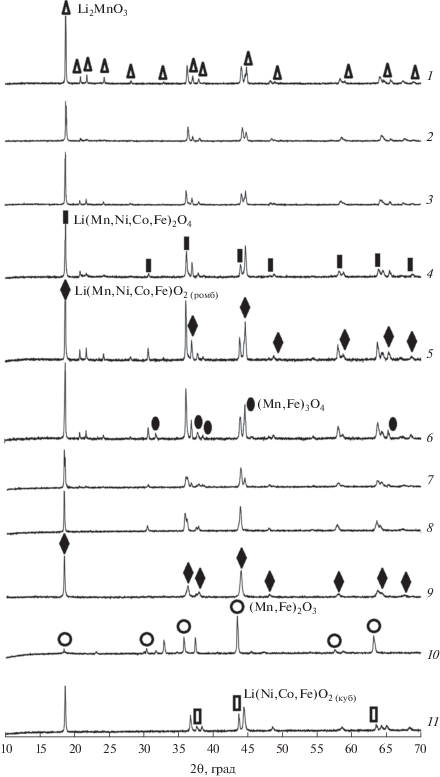
В серии Li1.1Mn1 – x(Ni0.33Co0.33Fe0.33)xO2 (0 ≤ х ≤ 1) только состав Li1.1Ni0.27Mn0.20Co0.27Fe0.27O2 (рис. 1, кривая 9) принадлежит области гомогенного твердого раствора Li(Ni,Mn,Co,Fe)O2. Начиная с Li1.1MnO2 сосуществуют шпинель Li(Ni,Mn,Co,Fe)2O4 и фаза с моноклинной структурой на основе Li2MnO3 (рис. 1, кривые 1–3). В интервале составов Li1.1Ni0.10Mn0.70Co0.10Fe0.10O2–Li1.1Ni0.17Mn0.50Co0.17Fe0.17O2 проявляется фаза со структурой α-NaFeO2 (рис. 1, кривые 4–6). В образцах Li1.1Ni0.20Mn0.40Co0.20Fe0.20O2 и Li1.1Ni0.23Mn0.30Co0.23Fe0.23O2 вместо ромбоэдрической фазы обнаруживается шпинель (Mn,Fe)3O4 (рис. 1, кривые 7–8), которая в образце Li1.1Ni0.27Mn0.20Co0.27Fe0.27O2 исчезает вместе с Li2MnO3, уступая место ромбоэдрической фазе (рис. 1, кривая 9). После прохождения области гомогенности для Li1.1Ni0.30Mn0.10Co0.30Fe0.30O2 образуется четырехфазная смесь с участием шпинели Li(Ni,Mn,Co,Fe)2O4, биксбиита (Mn,Fe)2O3 и кубической фазы на основе LiFeO2 (рис. 1, кривая 10). В отсутствие Mn образец Li1.1Ni0.33Co0.33Fe0.33O2 представляет собой смесь ромбоэдрической и кубической фаз (рис. 1, кривая 11).
Рис. 1.
Дифрактограммы образцов состава Li1.1Mn1–x(Ni0.33Co0.33Fe0.33)xO2:
1 – Li1.1MnO2, 2 – Li1.1Ni0.03Mn0.90Co0.03Fe0.03O2, 3 – Li1.1Ni0.07Mn0.80Co0.07Fe0.07O2, 4 ‒ Li1.1Ni0.10Mn0.70Co0.10Fe0.10O2, 5 – Li1.1Ni0.13Mn0.60Co0.13Fe0.13O2, 6 – Li1.1Ni0.17Mn0.50Co0.17Fe0.17O2, 7 ‒ Li1.1Ni0.20Mn0.40Co0.20Fe0.20O2, 8 – Li1.1Ni0.23Mn0.30Co0.23Fe0.23O2, 9 – Li1.1Ni0.27Mn0.20Co0.27Fe0.27O2, 10 ‒ Li1.1Ni0.30Mn0.10Co0.30Fe0.30O2, 11 – Li1.1Ni0.33Co0.33Fe0.33O2.
В табл. 1 приведены результаты расшифровки дифрактограмм для гомогенных образцов серий Li1.1Co1 – x(Ni0.33Mn0.33Fe0.33)xO2 (0 ≤ х ≤ 0.9), Li1.1Ni1 – x(Mn0.33Co0.33Fe0.33)xO2 (0.3 ≤ х ≤ 0.7) и Li1.1Ni0.27Mn0.20Co0.27Fe0.27O2. Дублеты пиков (006)/(102) и (108)/(110) подтверждают наличие cлоистой структуры α-NaFeO2 (рис. 1) [17]. Параметры гексагональной ячейки с уменьшением содержания Co увеличиваются от Li1.1Ni0.03Mn0.03Co0.90Fe0.03O2 (a = 2.8199, c = = 14.1189 Å) до Li1.1Ni0.30Mn0.30Co0.10Fe0.30O2 (a = = 2.9012, c = 14.3601 Å). Характеристическое отношение между интенсивностями I003/I104 (табл. 1) достигает величины 2.44 для Li1.1Ni0.27Mn0.27Co0.20Fe0.27O2, указывая на катионное упорядочение в литиевом слое [18], но для Li1.1Ni0.30Mn0.30Co0.10Fe0.30O2 резко падает до 0.96. Параметр R = (I006 + I102)/I101, не превышающий 0.50, свидетельствует о наиболее выраженной гексагональной структуре для Li1.1Ni0.23Mn0.23Co0.30Fe0.23O2 в Co-ряду [19].
Таблица 1.
Параметры элементарной ячейки твердого раствора Li1 + y(Ni,Mn,Co,Fe)O2
| Номинальный состав | a, Å | c, Å | c/a | V, Å3 | I003/I104 | (I006 + I102)/I101 |
|---|---|---|---|---|---|---|
| Li1.1CoO2 | 2.8162 | 14.0540 | 4.9904 | 92.528 | 2.06 | 0.31 |
| Li1.1Ni0.03Mn0.03Co0.90Fe0.03O2 | 2.8199 | 14.1189 | 5.0069 | 97.230 | 1.85 | 0.55 |
| Li1.1Ni0.07Mn0.07Co0.80Fe0.07O2 | 2.8210 | 14.0917 | 4.9953 | 97.118 | 2.09 | 0.51 |
| Li1.1Ni0.10Mn0.10Co0.70Fe0.10O2 Li1.1Ni0.10Mn0.10Co0.70Fe0.10O2* | 2.8397 2.8453 |
14.1804 14.2370 |
4.9936 5.0037 |
99.029 99.821 |
1.88 2.58 |
0.54 – |
| Li1.1Ni0.13Mn0.13Co0.60Fe0.13O2 | 2.8521 | 14.2309 | 4.9896 | 100.252 | 2.24 | 0.72 |
| Li1.1Ni0.17Mn0.17Co0.50Fe0.17O2 | 2.8606 | 14.2726 | 4.9894 | 101.146 | 1.94 | 0.77 |
| Li1.1Ni0.20Mn0.20Co0.40Fe0.20O2 | 2.8751 | 14.3019 | 4.9744 | 102.384 | 2.17 | 0.66 |
| Li1.1Ni0.23Mn0.23Co0.30Fe0.23O2 | 2.8861 | 14.3377 | 4.9678 | 103.427 | 2.29 | 0.50 |
| Li1.1Ni0.27Mn0.27Co0.20Fe0.27O2 | 2.8934 | 14.3559 | 4.9616 | 104.083 | 2.44 | 0.52 |
| Li1.1Ni0.30Mn0.30Co0.10Fe0.30O2 | 2.9012 | 14.3601 | 4.9497 | 104.675 | 0.96 | – |
| Li1.1NiO2 | 2.8980 | 14.2367 | 4.9126 | 103.547 | 0.66 | – |
| Li1.1Ni0.70Mn0.10Co0.10Fe0.10O2 Li1.1Ni0.70Mn0.10Co0.10Fe0.10O2* | 2.8935 2.9030 |
14.2321 14.2684 |
4.9186 4.9151 |
103.192 104.14 |
0.49 0.99 |
– – |
| Li1.1Ni0.60Mn0.13Co0.13Fe0.13O2 Li1.1Ni0.60Mn0.13Co0.13Fe0.13O2* | 2.8902 2.9033 |
14.2348 14.3125 |
4.2332 4.9297 | 102.976 104.482 |
0.59 1.17 |
– – |
| Li1.1Ni0.50Mn0.17Co0.17Fe0.17O2 | 2.8873 | 14.2731 | 4.9434 | 103.046 | 0.88 | – |
| Li1.1Ni0.40Mn0.20Co0.20Fe0.20O2 | 2.8884 | 14.2945 | 4.9489 | 103.280 | 1.03 | – |
| Li1.1Ni0.30Mn0.23Co0.23Fe0.23O2 | 2.8956 | 14.3389 | 4.9520 | 104.118 | 1.19 | – |
| Li1.1Ni0.27Mn0.20Co0.27Fe0.27O2 | 2.8976 | 14.3501 | 4.9525 | 104.340 | 1.88 | – |
Для образцов Li1.1Ni1 – x(Mn0.33Co0.33Fe0.33)xO2 (0.3 ≤ х ≤ 0.7) явное расщепление пиков (006)/(102) и (108)/(110) отсутствует. Подобная картина наблюдается в системе Li–Mn–Ni–O [20]. Влияние Co в серии Li1.1Co1 – x(Ni0.33Mn0.33Fe0.33)xO2 и Ni в серии Li1.1Ni1 – x(Mn0.33Co0.33Fe0.33)xO2 на структуру R$\bar {3}$m, как видно из табл. 1, заметно отличается. При снижении содержания Со соотношение c/a монотонно уменьшается от 5.0069 до 4.9497, что свидетельствует об искажении гексагональной ячейки [21], а отношение I003/I104, характеризующее упорядочение в литиевом слое, возрастает до 2.44 для Li1.1Ni0.27Mn0.27Co0.20Fe0.27O2 и резко падает до 0.96 для Li1.1Ni0.30Mn0.30Co0.10Fe0.30O2. При снижении содержания Ni соотношение c/a, в свою очередь, увеличивается от 4.9186 до 4.9520, что указывает на снятие искажения в гексагональной структуре, однако отношение I003/I104 едва достигает критической величины 1.2 для Li1.1Ni0.30Mn0.23Co0.23Fe0.23O2.
Для Li1.1Ni0.27Mn0.20Co0.27Fe0.27O2 параметры a = = 2.8976, c = 14.3501 Å и I003/I104 = 1.88 (табл. 1).
Согласно PCMA, содержание никеля, марганца, кобальта и железа в синтезированных образцах Li(Ni,Mn,Co,Fe)O2 отклоняется от заданного значения не более чем на 1 ат. %. На рис. 2 представлена микроструктура Li1.1Ni0.30Mn0.23Co0.23Fe0.23O2, которая характеризуется однородными частицами с размером не более 100 нм.
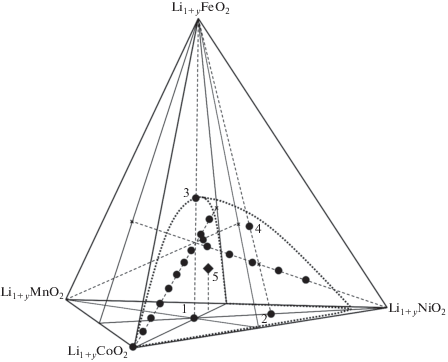
Тетраэдр составов псевдочетырехкомпонентной системы Li1 + yNiO2–Li1 + yMnO2–Li1 + yCoO2–Li1 + yFeO2 не позволяет представить многофазные равновесия с участием шпинели Li(Ni,Mn,Co,Fe)2O4, галита Li(Ni,Mn,Co,Fe)O, биксбиита (Mn,Fe)2O3 и α-Li(Fe,Mn)5O8. В отсутствие расплава в качестве квазибинарной системы можно рассматривать медиану Li1 + yCoO2–Li1 + yNi0.33Mn0.33Fe0.33O2, но не медианы Li1 + yNiO2–Li1 + yMn0.33Co0.33Fe0.33O2 и Li1 + yMnO2–Li1 + yNi0.33Co0.33Fe0.33O2. Однако с помощью тетраэдра можно оценить положение полиэдра гомогенности Li(Ni,Mn,Co,Fe)O2 в концентрационном пространстве системы Li1 + yNiO2–Li1 + yMnO2–Li1 + yCoO2–Li1 + yFeO2. На рис. 3 в изобарно-изотермическом тетраэдре Li1 + yNiO2–Li1 + yMnO2–Li1 + yCoO2–Li1 + yFeO2 (t = 800°C, ${{p}_{{{{{\text{O}}}_{2}}}}}$ = 21 кПА) исследованные однофазные составы Li1.1Co1 – x(Ni0.33Mn0.33Fe0.33)xO2, Li1.1Ni1 – x(Mn0.33Co0.33Fe0.33)xO2 и Li1.1Mn1 ‒ x(Mn0.33Co0.33Fe0.33)xO2 (0 ≤ х ≤ 1) показаны черными кружками. Для удобства восприятия составы твердого раствора приведены на медианах Li1 + yCoO2–Li1 + yNi0.33Mn0.33Fe0.33O2, Li1 + yNiO2–Li1 + yMn0.33Co0.33Fe0.33O2 и Li1 + yMnO2–Li1 + yNi0.33Co0.33Fe0.33O2. Фазовый объем Li(Ni,Mn,Co,Fe)O2 включает в себя составы Li1 + yNi0.33Mn0.33Co0.33O2, Li1 + yNi0.60Mn0.20Co0.20O2, Li1 + yNi0.20Mn0.20Co0.20Fe0.40O2, Li1 + yNi0.42Mn0.14Co0.14Fe0.30O2 (рис. 3, точки 1–4) [14], Li1 + yNi0.33Mn0.33Co0.17Fe0.17O2 (рис. 3, точка 5) [6] и находится по одну сторону от плоскости Li1 + yCoO2–Li1 + yNi0.5Mn0.5O2–Li1 + yFeO2.
Рис. 3.
Составы твердого раствора Li(Ni,Mn,Co,Fe)O2 в тетраэдре Li1 + yNiO2–Li1 + yMnO2–Li1 + yCoO2–Li1 + yFeO2. Отмечены точки: 1 – Li1 + yNi0.33Mn0.33Co0.33O2, 2 – Li1 + yNi0.60Mn0.20Co0.20O2, 3 – Li1 + yNi0.20Mn0.20Co0.20Fe0.40O2 [14], 4 – Li1 + yNi0.42Mn0.14Co0.14Fe0.3O2 [14] и 5 – Li1 + yNi0.33Mn0.33Co0.17Fe0.17O2 [6].
Содержание Fe в твердом растворе Li(Ni,Mn,Co,Fe)O2 изменяется вместе с гомогенным фазовым объемом в зависимости от соотношения Li : Ni : Mn : Co, температуры, парциального давления кислорода, а также от методики синтеза, которая позволяет получить однофазный метастабильный материал наряду со стабильным. При использовании метода сжигания геля и последующего отжига до температуры 800°С на воздухе получены однофазные образцы Li(Ni,Mn,Co,Fe)O2 c 15% Fe в слоистой структуре α-NaFeO2, при этом содержание Co может снижаться до 5%.
Допирование Li(Ni,Mn,Co)O2 железом в пределах 2.5% от общего числа катионов с образованием моноклинной фазы Li2MnO3 [22, 23] не решает проблему принципиального улучшения материалов ЛИА. В то же время обнаруженная растворимость 15% железа в твердом растворе Li(Ni,Mn,Co,Fe)O2 позволяет рассчитывать на создание более дешевых и безопасных ЛИА.
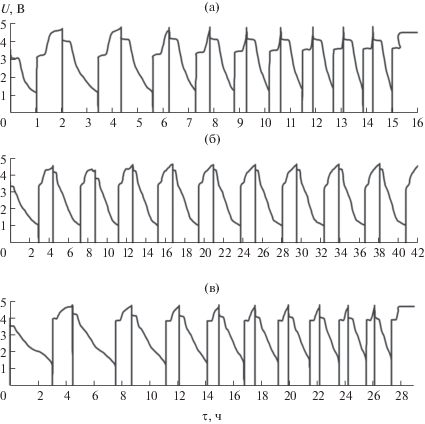
В табл. 2 представлены результаты электрохимического тестирования образцов составов Li1.1Ni0.70Mn0.10Co0.10Fe0.10O2, Li1.1Ni0.60Mn0.13Co0.13Fe0.13O2 и Li1.1Ni0.10Mn0.10Co0.70Fe0.10O2 в модельных литиевых ячейках в интервале напряжений 1.0–4.5 В при токе заряда 1С и разряда С/2 (рис. 4). После 10 циклов заряда–разряда емкость образца Li1.1Ni0.60Mn0.13Co0.13Fe0.13O2 сохранилась на уровне 95% и составила 66 мА ч/г, для образца состава Li1.1Ni0.70Mn0.10Co0.10Fe0.10O разрядная емкость не превышала 36 мА ч/г, а для Li1.1Ni0.10Mn0.10Co0.70Fe0.10O2 значения емкости материала в первых циклах разряда составили 95 мА ч/г, но к 10-му циклу емкость материала снизилась до 37 мА ч/г.
Таблица 2.
Результаты электрохимического тестирования образцов Li1+y(Ni,Mn,Co,Fe)O2
| Состав образца | Масса, г | Емкость, мА ч/г | Число циклов | Ток заряда/разряда, мкА |
|---|---|---|---|---|
| Li1.1Ni0.70Mn0.10Co0.10Fe0.10O2 | 0.0194 | 36–19 | 10 | 1000/500 |
| Li1.1Ni0.60Mn0.13Co0.13Fe0.13O2 | 0.0203 | 69–66 | 10 | 1000/500 |
| Li1.1Ni0.10Mn0.10Co0.70Fe0.10O2 | 0.0161 | 95–37 | 10 | 1000/500 |
Рис. 4.
Заряд-разрядные кривые для десяти циклов при токе заряда 1С и токе разряда С/2: а – Li1.1Ni0.70Mn0.10Co0.10Fe0.10O2, б – Li1.1Ni0.60Mn0.13Co0.13Fe0.13O2, в – Li1.1Ni0.10Mn0.10Co0.70Fe0.10O2.
Согласно результатам РФА (рис. 5), в образце Li1.1Ni0.70Mn0.10Co0.10Fe0.10O2 после циклирования снизилось содержание примесей. Как видно из табл. 1, в результате электрохимического воздействия отношение I003/I104, характеризующее упорядочение в литиевом слое структуры α-NaFeO2, увеличилось примерно вдвое.
ЗАКЛЮЧЕНИЕ
Методом сжигания геля с крахмалом впервые получен гомогенный образец состава Li1.1Ni0.27Mn0.20Co0.27Fe0.27O2 со структурой α-NaFeO2. Методом рентгенофазового анализа определен фазовый состав образцов Li1.1Mn1 ‒ x(Ni0.33Co0.33Fe0.33)xO2 (0 ≤ х ≤ 1). Определено положение (и границы) объема гомогенности твердого раствора Li(Ni,Mn,Co,Fe)O2 в изобарно-изотермическом тетраэдре Li1 + yNiO2–Li1 + yMnO2–Li1 + yCoO2–Li1 + yFeO2. Экспериментально показано, что в твердом растворе состава Li Co1/3Ni1/3Mn1/3O2 переходные металлы, взятые в эквимолярном отношении, могут быть замещены на Fe (до 25%) без разрушения структуры α-NaFeO2.
Список литературы
Mizushima K., Jones P.C., Wiseman P. J. et al. // Mater. Res. Bull. 1980. V. 15. № 6. P. 783. https://doi.org/10.1016/0025-5408(80)90012-4
Ohzuku T., Makimura Y. // Chem. Lett. 2001. V. 30. № 7. P. 642. https://doi.org/10.1246/cl.2001.642
Nipan G.D., Klyndyuk A.I. // Inorg. Mater. 2019. V. 55. № 2. P. 135. https://doi.org/10.1134/S0020168519020080
Noh H.-J., Youn S., Youn C.S. et al. // J. Power Sources. 2013. V. 233. P. 121. https://doi.org/10.1016/j.jpowsour.2013.01.063
Zhang X., Yu C., Huang X. et al. // Electrochim. Acta. 2012. V. 81. P. 233. https://doi.org/10.1016/j.electacta.2012.07.069
Meng Y.S., Wu Y.W., Hwang B.J. et al. // J. Electrochem. Soc. 2004. V. 151. P. A1134. https://doi.org/10.1149/1.1765032
Samarasingha P.B., Wijayasinghe A., Behm M. et al. // Solid State Ionics. 2014. V. 268. P. 226. https://doi.org/10.1016/j.ssi.2014.07.012
Idemoto Y., Matsui T. // Electrochem. Japan. 2007. V. 75. № 10. P. 791. https://doi.org/10.5796/electrochemistry.75.791
Wilcox J., Patoux S., Doeff M. // J. Electrochem. Soc. 2009. V. 156. № 3. P. A192. https://doi.org/10.1149/1.3056109
Hilmi J.M., Sabirin M.N., Yahya R. et al. // Adv. Mater. Res. 2012. V. 501. P. 56. https://doi.org/10.4028/www.scientific.net/AMR.501.56
Son J.-T., Cairns E. // Korean J. Chem. Eng. 2007. V. 24. № 5. P. 888. https://doi.org/10.1007/s11814-007-0060-4
Mofid W. El, Dissertation. Synthesis and characterization of novel cathode material with improved specific capacity and safety for lithium ion batteries. Techniscen Universität Ilmenau. 2016. 121 p. urn:nbn:de:gbv:ilm1-2016000524
Wilcox J. D., Rodrigues E.E., Doeff M.M. // J. Electrochem. Soc. 2009. V. 156. № 12. P. A1011. https://doi.org/10.1149/1.3237100
Nipan G.D., Smirnova M.N., Kop’eva M.A. et al. // Russ. J. Inorg. Chem. 2019. V. 64. № 10. P. 1304. [Нипан Г.Д., Смирнова М.Н., Копьева М.А. и др. // Журн. неорган. химии. 2019. Т. 64. № 10. С. 1111.]https://doi.org/10.1134/S0036023619100103
Nipan G.D., Smirnova M.N., Kop’eva M.A. et al. // J. Phase Equilibria and Diffusion. 2019. V. 40. № 5. P. 725. https://doi.org/10.1007/s11669-019-00758-4
Shunmugasundaram R., Arumugam R.S., Dahn J.R. // Chem. Mater. 2015. V. 27. № 3. P. 757. https://doi.org/10.1021/cm504583y
Lee S.-W., Kim H., Kim M.-S.J. et al. // Power. Sources. 2016. V. 315. P. 261. https://doi.org/10.1016/j.jpowsour.2016.03.020
Zhang X., Jiang W.J., Mauger Qilu A. et al. // J. Power. Sources. 2010. V. 195. № 10. P. 1292. https://doi.org/10.1016/j.jpowsour.2009.09.029
Mohanty D., Gabrish H. // J. Power. Sources. 2012. V. 220. P. 405. https://doi.org/10.1016/j.jpowsour.2012.08.005
McCalla E., Rowe A.W., Shunmugasundaram R. et al. // Chem. Mater. 2013. V. 25. № 6. P. 989. https://doi.org/10.1021/cm4001619
Antaya M., Ceams K., Preston J.S. et al. // J. Appl. Phys. 1994. V. 76. P. 2799. https://doi.org/10.1063/1.357514
Li H., Chen G., Zhang B. et al. // Solid State Commun. 2008. V. 146. P. 115. https://doi.org/10.1016/j.ssc.2008.02.006
Nayak P.K., Grinblat J., Levi M. et al. // J. Solid State Electrochem. 2015. V. 19. P. 2781. https://doi.org/10.1007/s10008-015-2790-2
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии