Журнал неорганической химии, 2020, T. 65, № 4, стр. 482-486
Фторсодержащие карбоксилаты тетраарилсурьмы. Синтез и строение
В. В. Шарутин a, О. К. Шарутина a, А. Н. Ефремов a, *, Е. В. Артемьева a
a Национальный исследовательский Южно-Уральский государственный университет
454080 Челябинск, пр-т им. В.И. Ленина, 76, Россия
* E-mail: efremov_an94@mail.ru
Поступила в редакцию 09.10.2019
После доработки 29.10.2019
Принята к публикации 28.11.2019
Аннотация
Взаимодействием пентаарилсурьмы Ar5Sb (Ar = Ph, 4-MeC6H4) с фторсодержащими карбоновыми кислотами получены карбоксилаты тетраарилсурьмы Ph4SbOC(O)R (R = CF2Br (I), CF2CF2CF3 (II)), (4-MeC6Н4)4SbOC(O)CF2CF3 (III) и (4-MeC6Н4)4SbOC(O)CF2CF2CF3 (IV). Несмотря на избыточное количество карбоновой кислоты в реакционной смеси, сольваты карбоксилатов тетраарилсурьмы Ar4SbOC(O)R ⋅ HOC(O)R с ней не образуются. Методом рентгеноструктурного анализа установлено, что в соединениях I−IV атомы Sb имеют координацию искаженной в разной степени тригональной бипирамиды. Кристаллы III и IV содержат по два типа кристаллографически независимых молекул. Аксиальные углы СSbO в I, II, III, IV равны 175.32(14)°, 178.87(8)°, 178.56(13)° и 178.33(10)°, 178.16(13)° и 179.58(15)° соответственно. Длины связей Sb−O и Sb−С равны 2.333(3) и 2.106(4)−2.151(5) Å в I; 2.340(2) и 2.101(2)−2.154(3) Å в II; 2.364(3), 2.411(3) и 2.096(4)−2.159(4) Å в III; 2.376(3), 2.367(3) и 2.105(4)−2.161(4) Å в IV. Внутримолекулярные расстояния Sb⋅⋅⋅O с карбонильным атомом кислорода составляют 3.506(4) Å (I), 3.517(6) Å (II), 3.565(6) Å (III), 3.527(6) Å (IV), что меньше суммы ван-дер-ваальсовых радиусов Sb и O на ∼0.2 Å. Вторые карбонильные атомы кислорода в кристаллах III и IV не участвуют в координации с центральным атомом металла.
ВВЕДЕНИЕ
Известно, что карбоксилаты тетра- и триарилсурьмы являются биологически активными веществами, активность которых зависит от типа арильного радикала при атоме металла и природы заместителей в карбоксилатных лигандах [1, 2].
Другие примеры практического использования карбоксилатов тетраарилсурьмы связаны с их фотокаталитической активностью [3] и эффективным использованием в качестве реагентов органического синтеза [4].
К настоящему времени известен ряд карбоксилатов тетраарилсурьмы [5–13], синтез которых осуществляли по реакции замещения из галогенидов тетраарилсурьмы и соли карбоновой кислоты [5–9] или карбоновой кислоты в присутствии триэтиламина [10] либо деарилированием пентаарилсурьмы карбоновыми кислотами и по реакции перераспределения лигандов из пентаарилсурьмы и дикарбоксилатов триарилсурьмы [11–14].
О получении и особенностях строения карбоксилатов тетраарилсурьмы с атомами фтора в карбоксилатных лигандах ранее не сообщалось.
В продолжение исследований особенностей синтеза и строения карбоксилатов тетраарилсурьмы нами получены дифторбромацетат тетрафенилсурьмы (I), гептафторбутанат тетрафенилсурьмы (II), пентафторпропанат тетра-пара-толилсурьмы (III) и гептафторбутанат тетра-пара-толилсурьмы (IV).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Соединение I. Смесь 200 мг (0.394 ммоль) пентафенилсурьмы и 69 мг (0.394 ммоль) бромдифторуксусной кислоты в 20 мл бензола выдерживали в течение 24 ч при 20°C. После удаления растворителя твердый остаток перекристаллизовывали из смеси бензол–октан (2 : 1 объемн.). Получили 227 мг (95%) светло-желтых кристаллов I, tразл = 104°С. ИК-спектр (ν, см−1): 3151, 3086, 3057, 3018, 2991, 1971, 1882, 1818, 1697, 1625, 1575, 1479, 1431, 1354, 1332, 1307, 1267, 1184, 1141, 1070, 997, 937, 813, 736, 729, 709, 692, 655, 607, 528, 459, 443.
Аналогично синтезировали соединения II, III, IV.
Соединение II. Выход 90%, бесцветные кристаллы, tпл = 107°С. ИК-спектр (ν, см−1): 3068, 3026, 2991, 1961, 1888, 1822, 1691, 1577, 1481, 1436, 1379, 1327, 1273, 1226, 1209, 1161, 1138, 1116, 1066, 1020, 997, 960, 927, 848, 808, 763, 734, 717, 692, 655, 638, 613, 590, 518, 468, 459, 451, 418.
Соединение III. Выход 85%, бесцветные кристаллы, tпл = 152°С. ИК-спектр (ν, см–1): 3024, 2924, 2868, 1707, 1591, 1495, 1449, 1395, 1375, 1317, 1209, 1190, 1169, 1139, 1065, 1024, 845, 800, 731, 700, 581, 573, 488, 417, 405.
Соединение IV. Выход 88%, бесцветные кристаллы, tпл = 155°С. ИК-спектр (ν, см–1): 3022, 2924, 2870, 1913, 1705, 1591, 1493, 1449, 1395, 1377, 1325, 1269, 1225, 1209, 1190, 1159, 1117, 1067, 1040, 1015, 962, 928, 844, 799, 762, 741, 718, 700, 648, 637, 585, 577, 542, 529, 466, 407.
ИК-спектры соединений I–IV регистрировали на ИК-спектрометре Shimadzu IR Affinity-1S в области 4000–400 см–1 (таблетки KBr).
Рентгеноструктурный анализ (РСА) кристаллов I–IV проведен на дифрактометре D8 QUEST фирмы Bruker (MoKα-излучение, λ = 0.71073 Å, графитовый монохроматор) при 296(2) K. Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены по программам SMART и SAINT-Plus [15]. Все расчеты по определению и уточнению структур выполнены по программам SHELXL/PC [16], OLEX2 [17]. Структуры определены прямым методом и уточнены методом наименьших квадратов в анизотропном приближении для неводородных атомов. Положения атомов водорода определены геометрически по модели “наездника”. Кристаллографические данные и результаты уточнения структур приведены в табл. 1. Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№ 1 877 553 (I), 1 876 829 (II), 1 880 007 (III), 1 882 043 (IV); deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk/data_request/cif).
Таблица 1.
Кристаллографические данные, параметры эксперимента и уточнения структур I–IV
| Параметр | I | II | III | IV |
|---|---|---|---|---|
| М | 604.08 | 643.19 | 1298.57 | 1398.59 |
| Сингония | Моноклинная | Моноклинная | Триклинная | Триклинная |
| Т, K | 293.15 | 293.15 | 293.15 | 293.15 |
| Пр. гр. | P21/c | P21/n | P | P |
| a, Å | 12.816(12) | 10.088(5) | 12.868(9) | 10.361(4) |
| b, Å | 10.986(12) | 17.296(7) | 12.966(6) | 15.949(8) |
| c, Å | 17.706(16) | 15.780(7) | 17.998(9) | 19.633(9) |
| α, град | 90.00 | 90.00 | 85.356(18) | 80.79(3) |
| β, град | 102.45(2) | 105.361(15) | 86.58(2) | 79.549(17) |
| γ, град | 90.00 | 90.00 | 89.37(2) | 83.569(15) |
| V, Å3 | 2434(4) | 2655(2) | 2988(3) | 3138(2) |
| Z | 4 | 4 | 2 | 2 |
| ρвыч, г/см3 | 1.648 | 1.609 | 1.443 | 1.480 |
| μ, мм−1 | 2.810 | 1.112 | 0.980 | 0.947 |
| F(000) | 1184.0 | 1272.0 | 1304.0 | 1400.0 |
| Размер кристалла, мм | 0.33 × 0.14 × 0.1 | 0.56 × 0.32 × 0.24 | 0.61 × 0.59 × 0.35 | 0.39 × 0.26 × 0.21 |
| 2θ, град | 5.76–43.12 | 5.84–73.04 | 5.7–65.14 | 5.9–59.28 |
| Интервалы индексов отражений | –13 ≤ h ≤ 13, –11 ≤ k ≤ 11, –18 ≤ l ≤ 18 | –16 ≤ h ≤ 16, –28 ≤ k ≤ 28, –26 ≤ l ≤ 26 | –19 ≤ h ≤ 19, –19 ≤ k ≤ 19, –26 ≤ l ≤ 26 | –14 ≤ h ≤ 14, –22 ≤ k ≤ 22, –27 ≤ l ≤ 27 |
| Всего отражений | 19325 | 85941 | 189242 | 169068 |
| Независимых отражений | 2798 (Rint = 0.0277) | 12 980 (Rint = 0.0405) | 20 883 (Rint = 0.1371) | 17 662 (Rint = 0.0568) |
| Отражений с I > 2σ(I) | 2500 | 8307 | 14186 | 11423 |
| Число уточняемых параметров | 289 | 344 | 712 | 765 |
| GOOF | 1.052 | 1.037 | 1.084 | 1.043 |
| R-факторы по F2 > 2σ(F2) | R1 = 0.0279, wR2 = 0.0656 | R1 = 0.0459, wR2 = 0.1063 |
R1 = 0.0627, wR2 = 0.1390 |
R1 = 0.0580, wR2 = 0.1474 |
| R-факторы по всем отражениям | R1 = 0.0333, wR2 = 0.0691 | R1 = 0.0862, wR2 = 0.1236 |
R1 = 0.0971, wR2 = 0.1638 |
R1 = 0.0975, wR2 = 0.1732 |
| Остаточная электронная плотность (max/min), e/Å3 | 0.78/–1.09 | 0.62/–0.63 | 0.69/–0.82 | 1.30/–0.69 |
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Наиболее эффективными способами синтеза карбоксилатов тетраарилсурьмы являются методы, основанные на реакциях пентаарилсурьмы с дикарбоксилатами триарилсурьмы [18] или карбоновой кислотой [19]. Преимущества данных методов синтеза – одностадийность, мягкие условия протекания реакций, высокий выход и чистота целевого продукта. Соединения I−IV, представляющие собой кристаллические соединения, хорошо растворимые в ароматических углеводородах и полярных растворителях, получали по методике, приведенной в работе [19].
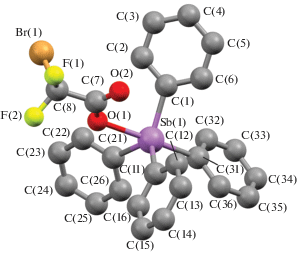
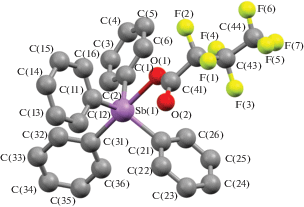
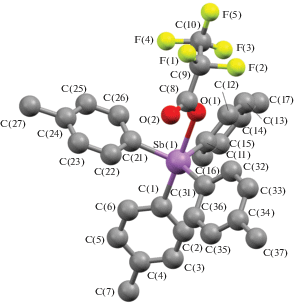
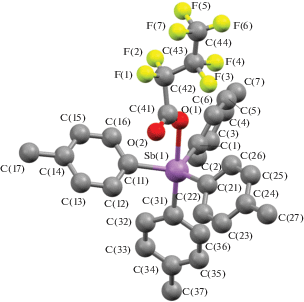
По данным РСА, в соединениях I−IV атомы Sb имеют искаженную в разной степени тригонально-бипирамидальную координацию с электроотрицательными карбоксилатными лигандами в аксиальных позициях (рис. 1–4).
В кристаллах соединений III и IV присутствует по два типа кристаллографически независимых молекул (а и б). Аксиальные углы СSbO в I, II, III, IV равны 175.32(14)°, 178.87(8)°, 178.33(10)° и 178.56(13)°, 178.16(13)° и 179.58(15)° соответственно. Суммы углов СSbС в экваториальной плоскости составляют 355.62(17)° (I), 355.37(10)° (II), 355.18(13)° (IIIа) и 353.65(13)° (IIIб), 354.06(13)° (IVа) и 354.85(13)° (IVб). Атом Sb в I, II, III и IV выходит из плоскости [C3] в сторону аксиального атома углерода на 0.257, 0.263, 0.270 и 0.310, 0.300, 0.279 Å соответственно, однако аксиальные арильные заместители по сравнению с экваториальными лигандами более удалены от центрального атома (2.151(5), 2.154(3), 2.171(3) и 2.159(4), 2.161(4), 2.154(4) Å). Плоские арильные кольца в структурах I−IV развернуты вокруг связей Sb−C таким образом, чтобы свести к минимуму внутри- и межмолекулярные контакты.
Среднее значение длин экваториальных связей Sb−C в соединении I (2.120(3) Å) несколько меньше, чем в II, III, IV (2.121(3), 2.124(3), 2.123(4) Å), что можно объяснить пониженной концентрацией электроотрицательных атомов фтора в карбоксильном заместителе соединения I по сравнению с производными II−IV. Расстояние Sb−O в молекуле I (2.333(3) Å), очевидно, по этой же причине меньше наблюдаемых значений в II (2.340(2) Å), III (2.364(4) и 2.411(3) Å), IV (2.376(3) и 2.367(3) Å). Внутримолекулярные расстояния Sb⋅⋅⋅O с карбонильным атомом кислорода в молекулах I (3.506(5) Å), II (3.517(6) Å), IIIа (3.565(6) Å), IVа (3.527(7) Å) примерно одинаковы и меньше суммы ван-дер-ваальсовых радиусов Sb и O (3.7 Å [20]), что указывает на координацию центрального атома с карбонильным атомом кислорода. Вторые карбонильные атомы кислорода в кристаллах III и IV не участвуют в координации с центральным атомом металла.
Известно, что карбоксилаты тетраорганилсурьмы являются прекурсорами для синтеза другого типа комплексов с шестикоординированным атомом сурьмы [19].
О выделении подобного сольвата с азотной кислотой, полученного по реакции пентафенилсурьмы с избыточным количеством кислоты, сообщалось в [21]. По данным РСА, в полученных сольватах нет свободного гидроксила, но присутствуют сильные водородные связи O⋅⋅⋅H−O [21, 22].
Предполагая получить подобные аддукты с карбоксилатами тетраарилсурьмы I−IV, исследовали реакции I−IV с перечисленными выше фторсодержащими кислотами, однако из реакционной смеси мы неизменно выделяли только исходные вещества.
Список литературы
Hadjikakou S.K., Ozturk I.I., Banti C.N. et al. // J. Inorg. Biochem. 2015. V. 153. P. 293. https://doi.org/10.1016/j.jinorgbio.2015.06.006
Ali M.I., Rauf M.K., Badshah A. et al. // Dalton Trans. 2013. V. 42. P. 16733. https://doi.org/10.1039/C3DT51382C
Zhang X.Y., Cui L.S., Zhang X. et al. // J. Mol. Struct. 2017. V. 1134. P. 742. https://doi.org/10.1016/j.molstruc.2017.01.039
Гущин А.В., Грунова Е.В., Моисеев Д.В. и др. // Изв. РАН. Сер. хим. 2003. № 6. С. 1302.
Quan L., Yin H.-D., Cui J.-C. et al. // J. Organomet. Chem. 2009. V. 694. № 23. P. 3708. https://doi.org/10.1016/j.jorganchem.2009.07.040
Wen L., Yin H., Li W. et al. // Inorg. Chim. Acta. 2010. V. 363. № 4. P. 676. https://doi.org/10.1016/j.ica.2009.11.022
Li J.-S., Ma Y.-Q., Cui J.-R. et al. // Appl. Organomet. Chem. 2001. V. 15. P. 639. https://doi.org/10.1002/aoc.200
Ma Y.-Q., Li J.-S., Xuan Z.-A. et al. // J. Organomet. Chem. 2001. V. 620. P. 235. https://doi.org/10.1016/S0022-328X(00)00799-3
Yin H.-D., Wen L.-Y., Cui J.-C. et al. // Polyhedron. 2009. V. 28. P. 2919. https://doi.org/10.1016/j.poly.2009.06.065
Li J.-S., Liu R.-C., Chi X.-B. et al. // Inorg. Chim. Acta. 2004. V. 357. P. 2176. https://doi.org/10.1016/j.ica.2003.12.012
Sharutin V.V., Sharutina O.K. // Russ. J. Inorg. Chem. 2017. V. 62. № 7. P. 905. [Шарутин В.В., Шарутина О.К. // Журн. неорган. химии. 2017. Т. 62. № 7. С. 925.] https://doi.org/10.1134/S003602361707021X
Sharutin V.V., Sharutina O.K., Senchurin V.S. // Russ. J. Coord. Chem. 2014. V. 40. № 2. P. 109. [Шарутин В.В., Шарутина О.К., Сенчурин В.С. // Коорд. химия. 2014. Т. 40. № 2. С. 108. https://doi.org/10.7868/ S0132344X14020108]https://doi.org/10.1134/S1070328414020109
Sharutin V.V., Sharutina O.K., Kotlyarov A.R. // Russ. J. Inorg. Chem. 2015. V. 60. № 4. P. 465. [Шарутин В.В., Шарутина О.К., Котляров А.Р. // Журн. неорган. химии. 2015. Т. 60. № 4. С. 525. https://doi.org/10.7868/S0044457X15040236]https://doi.org/10.1134/S0036023615040221
Sharutin V.V., Sharutina O.K., Gubanova Yu.O. et al. // Russ. J. Inorg. Chem. 2019. V. 64. № 9. P. 1138. [Шарутин В.В., Шарутина О.К., Губанова Ю.О. // Журн. неорган. химии. 2017. Т. 64. № 9. С. 957.] https://doi.org/10.1134/S0036023619090195
Bruker (1998). SMART and SAINT-Plus. Versions 5.0. Data Collection and Processing Software for the SMART System. Bruker AXS Inc., Madison, Wisconsin, USA.
Bruker (1998). SHELXTL/PC. Versions 5.10. An Integrated System for Solving, Refining and Displaying Crystal Structures from Diffraction Data. Bruker AXS Inc., Madison, Wisconsin, USA.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Crystallogr. 2009. V. 42. P. 339. https://doi.org/10.1107/S0021889808042726
Шарутин В.В., Сенчурин В.С., Шарутина О.К. и др. // Журн. общ. химии. 1996. Т. 66. Вып. 10. С. 1755.
Schmidbaur H., Mitschke K.H. // Angew. Chem. 1971. № 83. P. 149. https://doi.org/10.1002/zaac.19713860204
Batsanov S.S. // Russ. J. Inorg. Chem. 1991. V. 36. P. 1694.
Sharutin V.V., Senchurin V.S., Sharutina O.K. et al. // Russ. J. Inorg. Chem. 2008. V. 53. № 7. P. 1110. [Шарутин В.В., Сенчурин В.С., Шарутина О.К. и др. // Журн. неорган. химии. 2008. Т. 53. № 7. С. 1194.] https://doi.org/10.1134/S0036023608070206
Bone S.P., Sowerby D.B. // Phosphorus, Sulfur Silicon Relat. Elem. 1989. V. 45. P. 23. https://doi.org/10.1080/10426508908046072
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии