Журнал неорганической химии, 2020, T. 65, № 4, стр. 554-563
Количественная оценка радикал-перехватывающих свойств и СОД-подобной активности наночастиц диоксида церия в биохимических моделях
М. М. Созарукова a, *, М. А. Шестакова b, М. А. Теплоногова c, Д. Ю. Измайлов c, Е. В. Проскурнина d, В. К. Иванов a
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
b Российский национальный исследовательский медицинский университет им. Н.И. Пирогова
117997 Москва, ул. Островитянова, 1, Россия
c Московский государственный университет им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
d Медико-генетический научный центр им. академика Н.П. Бочкова
115522 Москва, ул. Москворечье, 1, Россия
* E-mail: S_MadinaM@bk.ru
Поступила в редакцию 13.11.2019
После доработки 21.11.2019
Принята к публикации 27.11.2019
Аннотация
Методом активированной хемилюминесценции в сочетании с математическим моделированием впервые проведена количественная оценка антиоксидантных свойств и исследована супероксиддисмутазоподобная (СОД-подобная) активность цитрат-стабилизированного коллоидного раствора ультрамалых наночастиц (3 нм) CeO2 в биохимических моделях. Антиоксидантная емкость 1 мкмоль/л золя CeO2 относительно тролокса – водорастворимого аналога витамина Е – составила 0.049 ± 0.004 мкмоль/л; таким образом, способность CeO2 выступать в качестве перехватчика свободных радикалов примерно в 20 раз ниже тролокса. Методом математического моделирования оценена антиоксидантная активность. Константы скорости перехвата свободных радикалов равны 2000 нМ–1 мин–1 для тролокса и k1 = 300 нМ–1 мин–1, k2 = 4 нМ–1 мин–1 для диоксида церия. СОД-подобная активность 1 ммоль/л СеО2 в единицах активности СОД составила 2.00 ± 0.03 нмоль/л. Следовательно, активность CeO2 как миметика СОД примерно на 6 порядков ниже активности нативного фермента.
ВВЕДЕНИЕ
В последнее десятилетие одной из наиболее динамично развивающихся областей науки является наномедицина. Разработка нанотехнологий и нанопрепаратов для профилактики, диагностики и лечения заболеваний привлекает все большее внимание исследователей, о чем свидетельствует резкий рост числа публикаций по данной тематике. Так, начиная с 1999 г., когда был впервые предложен термин “наномедицина” [1], в базе данных Pubmed появилось почти 48 тыс. статей, включающих слова “наномедицина” или “наноматериалы”, при этом одних только обзоров опубликовано более 2000. Вместе с тем число официально зарегистрированных нанопрепаратов на порядок меньше, чем описано в литературе [2], и составляет около 50 [3].
Нанопрепараты для медицинского применения можно классифицировать следующим образом: 1) инкапсулированные препараты на основе давно и успешно применяющихся липосом, 2) неорганические наночастицы, 3) полимерные наносистемы, 4) лекарственные конъюгаты с антителами или белками, 5) конструкции на основе вирусов и фагов. Исследования структурных и функциональных особенностей наноматериалов расширяют область их биомедицинского применения не только в качестве лекарств, но и как биосовместимых агентов для адресной доставки лекарственных препаратов [4, 5], биосенсоров [6] и составляющих компонентов при изготовлении имплантов в тканевой инженерии [7, 8].
В 2009 г. экспертной группой по наномедицине Европейского медицинского агентства было определено, что 90% предлагаемых исследователями наноматериалов непригодны для дальнейшего биомедицинского использования, что связано с недостаточно полным анализом их безопасности – как прямой токсичности, так и воздействия на гомеостаз [9]. В этих вопросах, несмотря на большой объем исследований, остается много белых пятен: плохо изучены механизмы биодеградации, накопления и выведения из организма, краткосрочные и отложенные эффекты, участие в метаболизме на клеточном уровне.
Повреждающее действие свободных радикалов (активных форм кислорода, АФК) по отношению к биомолекулам известно с 50-х гг. прошлого века [10–13]. Окислительная модификация белков, окислительное повреждение ДНК, перекисное окисление липидов – все эти биохимические процессы приводят к повреждению клеток и нарушению их функции, что дало основание Г. Зису в 1985 г. ввести понятие окислительного стресса [14]. В последние годы роль свободных радикалов подверглась существенному пересмотру – они привлекают внимание не только в отношении патологического процесса, но и с точки зрения их участия в нормальной жизнедеятельности клеток. Следовательно, любые потенциальные диагностические или терапевтические фармацевтические препараты должны быть охарактеризованы в отношении их про- или антиоксидантной активности.
Наночастицы диоксида церия обладают комплексом уникальных физико-химических свойств, среди которых особый интерес вызывает ферментоподобная активность [15]. Наночастицы СеО2 способны выполнять функции супероксиддисмутазы (СОД) [16], каталазы [17], пероксидазы [18], оксидазы [19] и фосфатазы [20]. Одним из важнейших первичных радикалов является супероксид-анион-радикал, постоянно образующийся при дыхании митохондрий и участии ряда ферментов, таких как ксантиноксидаза и НАДФН-оксидаза. Ферментом, метаболизирующим супероксид-анион-радикал, является СОД. СОД-подобная активность была продемонстрирована для диоксида церия одной из первых [16, 21–23]. С учетом низкой токсичности СеО2 можно надеяться на сравнительную безопасность применения этого препарата in vivo.
Антиоксидантную ферментоподобную активность СеО2 целесообразно исследовать как по отношению к дисмутации супероксидного анион-радикала, так и с точки зрения радикал-перехватывающих свойств наночастиц СеО2. Общепринятым подходом к количественному описанию антиоксидантных свойств низкомолекулярного перехватчика радикалов является количественное определение какого-либо параметра относительно единиц концентрации стандартного соединения, отражающего способность веществ обрывать цепи свободнорадикальных реакций. Такой подход использует, например, метод TRAP (Total Radical-Trapping Antioxidant Potential), основанный на способности перехватывать радикалы, образующиеся при распаде термолабильных азосоединений [24]. Вместе с тем такой подход является неполным и не учитывает индивидуальных физико-химических характеристик антиоксиданта. Разные по химической природе антиоксиданты имеют различный характер хемилюминесцентных кривых, что делает невозможным применение какого-либо универсального параметра для характеристики количества или активности антиоксидантов различной химической природы. Другой способ описания антиоксидантных свойств основан на определении не только концентрации антиоксиданта, но и константы скорости перехвата радикалов [25, 26].
В настоящей работе для исследования антиоксидантных свойств диоксида церия впервые применен метод активированной хемилюминесценции (ХЛ) в сочетании с математическим моделированием кинетических кривых. Антиоксидантная емкость препарата в единицах водорастворимого аналога витамина Е, тролокса, была определена модифицированным методом TRAP [27]. Для этого использовали биохимическую модель, в которой контролируемым источником свободных радикалов выступает 2,2'-азо-бис(2-амидинопропан) дигидрохлорид (АБАП). Математическое моделирование кинетики полученных хемилюминограмм проводили с помощью программы Kinetic Analyzer. В результате определяли константы скорости перехвата радикалов, характеризующие антиоксидантную активность. Супероксиддисмутазную активность оценивали в стандартной биохимической модели генерации супероксидного анион-радикала на основе фермента ксантиноксидазы и субстрата ксантина, используя СОД в качестве стандартного соединения.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Рентгенофазовый анализ образцов СеО2 проводили с использованием дифрактометра Bruker D8 Advance (CuKα-излучение, геометрия θ–2θ). Для расшифровки рентгенограмм использовали банк данных ICDD PDF2. Средний гидродинамический диаметр наночастиц СеО2 оценивали методом динамического рассеяния света с применением анализатора Photocor Complex. Анализ образцов методом просвечивающей электронной микроскопии (ПЭМ) был проведен с использованием микроскопа Leo 912 AB Omega при ускоряющем напряжении 100 кВ.
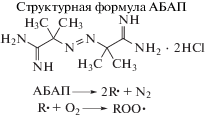
Антиоксидантную емкость препаратов определяли методом активированной ХЛ в системе генерации свободных радикалов 2,2'-азо-бис(2-амидинопропан) дигидрохлоридом (АБАП, Sigma-Aldrich, США) в присутствии активатора хемилюминесценции – люминола (Sigma-Aldrich, США) согласно методике, описанной нами ранее [27]. В результате термолиза АБАП разлагается мономолекулярно на два симметричных свободных радикала, которые быстро вступают в реакцию с кислородом с образованием алкилпероксильных радикалов (рис. 1) [28].
В качестве стандарта использовали водорастворимый аналог витамина Е – тролокс (Sigma-Aldrich, США). Исходный 100 мМ раствор тролокса готовили в 100 мМ фосфатном буферном растворе (ФБР, рН 7.4), рабочие концентрации получали разбавлением исходного раствора буферным (100 мМ, рН 7.4).
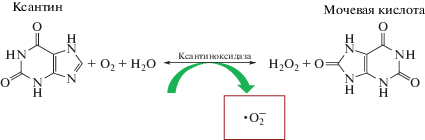
СОД-подобную активность определяли методом активированной ХЛ в системе ксантин/ксантиноксидаза. Фосфатные буферные растворы с концентрацией 100 мМ и pH 7.4 или 8.6 готовили растворением навески KH2PO4 (Sigma-Aldrich, США) в 1.00 л дистиллированной воды с последующим доведением до нужного значения рН, контролируя кислотность при помощи pH-метра HANNA pH-211 (США).
Ксантин (3,7-дигидропурин-2,6-дион, Sigma-Aldrich, США) с концентрацией 1 мМ готовили растворением соответствующей навески в ФБР (pH 8.6). Рабочий раствор ксантиноксидазы (Sigma-Aldrich, США, X4875-10UN) с активностью a = 0.27 ед/мл получали разбавлением исходной суспензии ФБР (рН 7.4). Ксантиноксидаза представляет собой комплекс молибден- и железосодержащих нестабильных цитозольных ферментов с широкой субстратной специфичностью, содержащихся в различных органах и тканях. Ксантиноксидаза участвует в метаболизме пуринов (гипоксантина и ксантина) с образованием мочевой кислоты, а также в окислении пиримидинов, жирных кислот, катехоламинов, глутатиона, дегидрировании восстановленных форм никотинамидадениндинуклеотида (НАД) и никотинамидадениндинуклеотидфосфата (НАДФ) [29]. По определению каталитической активности, одна единица фермента превращает 1.0 мкмоль ксантина в мочевую кислоту за 1 мин при 25°C и рН 7.5 (рис. 2).
Селективный ХЛ-зонд на супероксид анион-радикал, люцигенин (10,10'-диметил-9,9'-биакридиния динитрат, Sigma-Aldrich, США), с концентрацией 1 мМ готовили растворением навески в ФБР (pH 7.4).
В ХЛ-кювету помещали необходимое количество ФБР (рН 7.4) до конечного объема 1.000 мл, аликвоту люцигенина (с = 100 мкМ), ксантина (с = 40 мкМ) и пробы наночастиц СеО2 в разных конечных концентрациях и перемешивали. Регистрировали фоновое свечение в течение 60–100 с, затем добавляли ксантиноксидазу (а = 0.027 ед/мл). В качестве аналитического сигнала использовали площадь под ХЛ-кривой, пропорциональную количеству перехваченных радикалов. ХЛ-измерения проводили при 37°С.
Градуировочную зависимость строили по супероксиддисмутазе (Sigma-Aldrich, США). Исходный раствор активностью 4600 ед/мл получали растворением навески в дистиллированной воде. Растворы с рабочими концентрациями получали разбавлением маточного раствора дистиллированной водой.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В результате синтеза по методике, основанной на термогидролизе водного раствора гексанитратоцерата(IV) аммония [30], был получен электростатически стабилизированный золь нанокристаллического диоксида церия. Концентрация полученного золя СеО2 составила 23 г/л (по диоксиду церия). По данным рентгенофазового анализа высушенного образца золя, он содержал однофазный диоксид церия (PDF2 34-0394). Размер частиц CeO2, определенный по соотношению Шеррера, составил 3 нм. Методом динамического рассеяния света была определена величина среднего гидродинамического диаметра наночастиц, равная 10–11 нм. Результаты анализа образца золя СеО2 методом просвечивающей электронной микроскопии и электронной дифракции подтверждают данные о размере частиц и фазовом составе полученного материала (рис. 3).
Для проведения биохимических экспериментов полученный золь был дополнительно стабилизирован цитратом аммония (мольное соотношение цитрат аммония : CeO2 = 1 : 1).
Определение антиоксидантной емкости
Градуировочную зависимость строили по тролоксу – стандартному соединению, которое реагирует со свободными радикалами в соотношении 1 : 2 в соответствии с наличием двух гидроксильных групп в структуре. Форма аналитического сигнала и градуировочная зависимость по тролоксу приведены на рис. 4а и 4б соответственно.
Расчет концентрации проводили по площади области подавления свечения после добавления антиоксиданта к системе (заштрихованная площадь на рис. 4а). Полученное уравнение градуировочной прямой имело вид:
Рис. 4.
(а) – Хемилюминограммы тролокса в системе 2.5 мМ АБАП + 2.0 мкМ люминол, стрелкой показан момент добавления тролокса, заштрихована область подавления свечения на ХЛ-кривой, пропорциональная количеству перехваченных радикалов; (б) – градуировочная зависимость площади области подавления свечения (S, усл. ед.) от концентрации тролокса (с, нмоль/л) в системе.
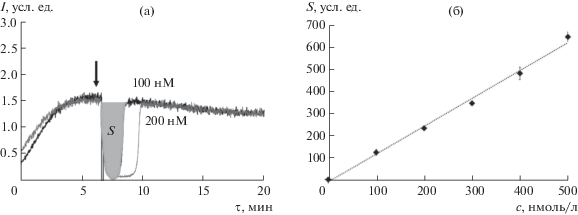
Влияние тролокса на кинетику ХЛ выражается в полном подавлении свечения в течение фиксированного интервала времени, который определяется как латентный период. Такое действие характерно для сильных антиоксидантов, полностью перехватывающих все свободные радикалы, образующиеся в системе. Завершение латентного периода связано с полным истощением антиоксиданта и характеризуется крутым ростом интенсивности ХЛ и возвращением на прежний стационарный уровень, наблюдаемый в отсутствие антиоксиданта (рис. 4а).
Для диоксида церия получили кривые другого вида, когда после добавления антиоксиданта наблюдалось существенное, но неполное подавление интенсивности, что качественно свидетельствует о более слабой антиоксидантной активности диоксида церия по сравнению с тролоксом (рис. 5).
Рис. 5.
Хемилюминограммы цитрат-стабилизированного коллоидного раствора CeO2 в системе 2.5 мМ АБАП + 2.0 мкМ люминол, стрелкой показан момент добавления образца СеО2; I0 – начальный уровень свечения до добавления образца, I – стационарный уровень свечения после добавления образца.
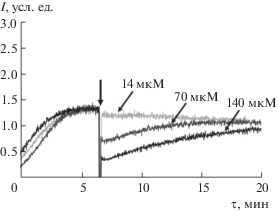
Площадь области подавления свечения (S) линейно зависит от концентрации диоксида церия, уравнение градуировочной прямой имеет вид: S = = (0.27 ± 0.01) × c (СеО2, мкмоль/л) + (69 ± 10), r = 0.986 (P = 0.95, n = 5). По площади области подавления рассчитана антиоксидантная емкость 1 мкмоль/л диоксида церия в единицах концентрации тролокса, мкмоль/л (число параллельных опытов n = 9), равная 0.049 ± 0.004. Таким образом, способность CeO2 выступать в качестве перехватчика свободных радикалов примерно в 20 раз ниже тролокса. В нашем исследовании цитрат аммония обладал собственной незначительной антиоксидантной активностью, вклад которой учитывали при расчете антиоксидантной емкости наночастиц СеО2.
Применение нанодисперсного СеО2 в качестве регулятора уровня АФК и акцептора свободных радикалов как in vitro, так и in vivo подробно рассмотрено в обзорах [18, 31, 32]. Многочисленные исследования были проведены на биохимических, субклеточных, клеточных и животных моделях. В случае исследований в биологических системах (субклеточный, клеточный, организменный уровни) антиоксидантную активность оценивали качественно по наличию или отсутствию соответствующего эффекта. Так, в работе Квона и соавт. [33] сообщается о подавлении гибели нейронов у трансгенных мышей 5xFAD (модель болезни Альцгеймера) модифицированными трифенилфосфином наночастицами СеО2, локализующимися в митохондриях. Продемонстрировано применение наночастиц СеО2 в условиях окислительного стресса и при нарушениях митохондриального метаболизма на первичной культуре фибробластов кожи человека [34]. Показано значительное снижение роста опухоли яичников при воздействии нанодисперсного СеО2, модифицированного фолиевой кислотой (модель ксенотрансплантата рака) [35]. В последнем исследовании мышам делали внутрибрюшинные инъекции нативных и модифицированных фолиевой кислотой наночастиц СеО2, а также цитотоксического препарата – цисплатина. Наилучший терапевтический эффект был получен в серии опытов с введением модифицированных наночастиц СеО2 в сочетании с цисплатином. Кроме того, модифицированные наночастицы СеО2 восстанавливали экспрессию виментина, что указывает на потенциальную способность ограничивать метастазирование опухоли. Вонг и соавт. [36] использовали крыс линии P23H-1 (модель аутосомно-доминантной формы пигментного ретинита) для анализа клеточных механизмов защитного действия наночастиц СеО2, предотвращающих потерю клетками фоторецепторной функции, и продолжительности их каталитической активности. После инъекции наблюдалось восстановление функции клеток палочек и колбочек, а при систематическом введении нанодисперсного СеО2 – уменьшение числа апоптотических клеток и замедление процессов перекисного окисления липидов в сетчатке. Это исследование дополняет собой ряд известных моделей заболеваний сетчатки грызунов, демонстрирующих эффективное защитное действие наночастиц СеО2 против прогрессирования патологического процесса. Известны результаты успешных исследований антиоксидантных свойств наночастиц СеО2 при лечении ожирения (на примере крыс линии Wistar) [37] и ишемического реперфузионного повреждения гепатоцитов (крысы линии Sprague-Dawley) [38].
В экспериментах на биохимических моделях проводились не только качественные, но и количественные оценки радикал-перехватывающей способности наночастиц СеО2. В частности, было изучено влияние диаметра наночастиц СеО2 и их поверхностной модификации на реакционную способность наночастиц в отношении пероксида водорода (один из видов АФК) на молекулярной и клеточной моделях [39]. Было обнаружено, что наибольшей реакционной способностью обладают частицы СеО2 диаметром 3.8 нм, модифицированные олеиновой кислотой. Сравнительный анализ антиоксидантной активности методом ORAC (Oxygen Radical Absorbance Capacity) показал, что радикал-перехватывающая способность наночастиц СеО2 превышает аналогичную характеристику тролокса в 9 раз. Эти данные свидетельствуют о том, что органические лиганды, используемые для стабилизации наночастиц СеО2, не препятствуют проявлению последними антиоксидантных свойств. Тиан и соавт. [40] установили взаимосвязь между поверхностными свойствами наночастиц СеО2 и их способностью нейтрализовывать свободные радикалы на модели окислительного стресса, вызванного доксорубицином, являющимся противоопухолевым препаратом. Было установлено, что пористые наностержни СеО2 с большой площадью поверхности (141 м2/г) и значительной концентрацией поверхностных ионов Се3+ (32.8%) в 15.5 раз превосходят тролокс по своим антиоксидантным свойствам.
В настоящей работе нам впервые удалось надежно оценить антиоксидантные свойства наночастиц СеО2 с применением оригинального подхода, заключающегося в использовании модифицированного метода TRAP в сочетании с математическим моделированием. Необходимо отметить, что предшествующие работы, основанные на измерении длительности латентного периода, степени подавления интенсивности свечения или угла наклона начального участка хемилюминесцентной кривой, не позволяют проводить достоверное сравнение активности антиоксидантов различной химической природы, даже если такую активность выражают в единицах активности эталонного антиоксиданта. Использованный нами способ позволяет определить действительную начальную концентрацию антиоксиданта в реакционной смеси, а значение константы скорости реакции взаимодействия антиоксиданта с радикалом является универсальной мерой антиоксидантной активности любого вещества, независимо от химической природы. Константа скорости реакции позволяет удовлетворительным образом предсказать характер влияния антиоксиданта с известной начальной концентрацией на протекание свободнорадикальных процессов, в частности, позволяет рассчитать период защитного действия и степень окисленности компонентов реакционной смеси в зависимости от длительности свободнорадикального процесса и т.п.
Оценка антиоксидантной активности методом математического моделирования
Для оценки антиоксидантной активности диоксида церия был применен метод математического моделирования, включающий построение математической модели системы химических реакций и вычисление констант скоростей этих реакций путем решения прямой задачи и поиска констант, при которых совпадение рассчитанной по предложенной модели кинетической и экспериментальной кривых будет удовлетворительным.
Для упрощения математического моделирования брали временной участок длительностью 40 мин. Экспериментальные кривые, полученные для 100 нМ тролокса и диоксида церия, использованные для математического моделирования, приведены на рис. 4а и 5 соответственно.
Для моделирования стационарного уровня ХЛ (контроль без антиоксидантов) была использована простая математическая модель, состоящая из двух реакций: 1) реакция генерирования свободных радикалов и 2) хемилюминесцентная реакция:
1) АБАП + Lum → R• (константа kR),
2) R• → P + свет (константа kLum),
где R• – свободный радикал или продукт реакции в электронно-возбужденном состоянии, с которым реагирует антиоксидант.
Для моделирования действия антиоксидантов в систему уравнений добавляли реакцию для одного антиоксиданта. Такая модель удовлетворительно описывала кинетику антиоксидантного действия тролокса, для которого известен механизм перехвата радикалов 1 : 1:
3) R• + In→ P (константа kIn).
Для диоксида церия эта модель оказалась недостаточной, поэтому учитывали две независимые реакции перехвата радикалов:
4) R• + In1→ P (константа kIn1),
5) R• + In2→ P (константа kIn2).
На рис. 6 приведены совмещенные расчетная и экспериментальная кривые для СеО2.
Рис. 6.
Экспериментальная (сплошная линия) и расчетная (пунктирная линия) хемилюминограммы для диоксида церия.
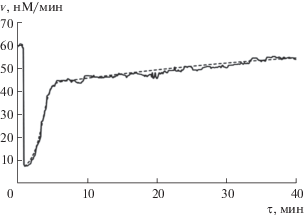
Для тролокса оценена константа скорости перехвата свободных радикалов, равная kIn = 2000 нМ–1 мин–1. Для диоксида церия были получены следующие константы скорости: kIn1 = 300 нМ–1 мин–1, kIn2 = 4 нМ–1 мин–1.
Определение СОД-подобной активности
СОД-подобную активность определяли в модельной системе, содержащей ксантин (40 мкМ), ксантиноксидазу (0.027 ед/мл) и люцигенин (100 мкМ) в ФБР 100 мМ (рН 7.4). Добавление к системе диоксида церия приводило к снижению стационарного уровня хемилюминесценции, что свидетельствует о его СОД-подобной активности (рис. 7а).
Рис. 7.
(а) – Хемилюминограммы коллоидного раствора диоксида церия (концентрации указаны на рисунке) в системе 40 мкМ ксантин + 0.027 ед/мл ксантиноксидаза + 100 мкМ люцигенин; (б) – разность площадей под хемилюминесцентными кривыми, пропорциональная числу перехваченных супероксидных анион-радикалов, как функция концентрации коллоидного раствора диоксида церия.
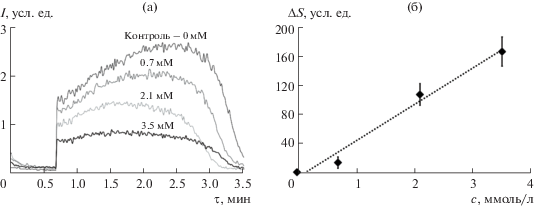
Разности площадей под кривыми для контрольного опыта и эксперимента (с добавлением диоксида церия) линейно зависели от концентрации СеО2 (рис. 7б):
Добавление супероксиддисмутазы к системе генерации супероксидного анион-радикала приводило к подавлению ХЛ, аналогичному действию диоксида церия (рис. 7а). Уравнение аппроксимирующей функции: ΔS = (22 ± 3) × c (СОД, нмоль/л) + + (7.33 ± 0.84), r = 0.996 (P = 0.95, n = 5).
Анализ зависимостей ∆S(c) позволяет провести сопоставление диоксида церия и супероксиддисмутазы по их антиоксидантной активности по отношению к супероксидному анион-радикалу (табл. 1).
Таблица 1.
Антиоксидантная активность диоксида церия и СОД, приводящая к одинаковому подавлению свечения ∆S = 100 усл. ед.
| Антиоксидант | Концентрация или активность |
|---|---|
| СОД | 4.13 ± 0.04 нМ |
| СеО2 | 2.00 ± 0.02 мМ |
Антиоксидантная активность 1 ммоль/л диоксида церия в единицах активности СОД, нмоль/л (n = 5) составила 2.00 ± 0.03.
Таким образом, экспериментально показана и количественно оценена активность наночастиц стабилизированного золя диоксида церия по отношению к первичному свободному радикалу живых систем – супероксидному анион-радикалу. По сравнению с СОД его активность была примерно на 6 порядков ниже. Сам по себе супероксидный анион-радикал не проявляет сильных деструктивных или модифицирующих свойств по отношению к биомолекулам, однако он может реагировать, например, с NO с образованием чрезвычайно токсичного пероксинитрита. С другой стороны, дисмутация супероксидного анион-радикала приводит к образованию пероксида водорода – соединения, играющего ключевую роль в поддержании редокс-статуса и редокс-зависимых клеточных сигнальных путей. Таким образом, поддержание определенного уровня генерации супероксидного анион-радикала является важным компонентом в обеспечении нормальной жизнедеятельности клетки. При патологии его продукция может резко возрастать. Это случается, например, при реперфузионном повреждении, когда поступление кислорода к тканям после ишемии ведет к реэнергизации электрон-транспортной цепи в митохондриях, ее активации и неконтролируемой продукции большого количества супероксидного анион-радикала, липидному окислительному стрессу и, как следствие, повреждению мембран и апоптозу клеток.
Единственным природным ферментом, катализирующим дисмутацию супероксидного анион-радикала, является супероксиддисмутаза. Многочисленные исследования доказали эффективность использования этого фермента при терапии воспалительных заболеваний респираторного тракта, при повреждении нервной ткани (на модели крыс), при воспалении суставов, инфекционных и токсических поражениях [41]. Сходное действие оказывают миметики СОД – соединения, обладающие СОД-подобной структурой, например, комплексы Cu(II), Zn, Mn(II), Co(II), Co(III) [42]. Как правило, СОД-миметики обладают более низкой (на два–четыре порядка) активностью, чем нативный фермент [43], однако легче проникают в клетку вследствие меньшего размера (что очень важно, поскольку главным источником супероксидного анион-радикала являются клеточные органеллы – митохондрии), а также обладают меньшей иммуногенностью.
СОД-подобная активность нанодисперсного СеО2 была впервые оценена Корсвиком и соавт. с использованием феррицитохрома С in vitro (${\text{O}}_{2}^{ - }$ + + Ce4+ → O2 + Ce3+, ${\text{O}}_{2}^{ - }$ + Ce3+ + 2H+ → H2O2 + + Ce4+) [16]. Было установлено, что наночастицы СеО2 с высоким соотношением Ce3+/Ce4+ демонстрируют более высокую СОД-подобную активность, что было впоследствии подтверждено работой Селардо и соавт. [44]. Были рассчитаны константы скоростей восстановления феррицитохрома С СОД и наночастицами СеО2, которые оказались равными 1.1 × 105 и 3.6 × 109 М–1 с–1 соответственно [16]. Результаты этого исследования позволили сделать вывод о большей энзимоподобной активности наночастиц СеО2 в сравнении с нативным ферментом. Батинич–Хаберле и соавт. [45] подробно исследовали и сопоставили СОД-подобную активность диоксида церия с рядом СОД-миметиков, включая соединения марганца, производные порфирина и металлопорфирины, фуллерены, оксиды металлов и др. СОД-подобная активность наночастиц диоксида церия оказалась практически сопоставима с активностью нативного фермента. Следует отметить, что наноматериалы могут взаимодействовать с биомолекулами, что вызывает модификацию их поверхности и приводит к снижению каталитической активности [46, 47]. Взаимодействие наночастиц СеО2 с культуральными средами и различными буферными растворами было всесторонне изучено в [47]. Было показано, что взаимодействие наночастиц СеО2 с фосфатным буферным раствором, обычно используемым для работы с клеточными культурами и животными моделями, приводит к потере СОД-подобной активности и дозозависимому возрастанию каталазоподобной активности. Использование сульфатных и карбонатных буферных растворов не оказывало влияния на ферментоподобную активность наночастиц. С учетом того, что фосфат-ионы в значительном количестве присутствуют в цитоплазме клетки, фосфатный буферный раствор (ФБР) был выбран нами с целью исследования свойств наночастиц СеО2 в условиях, максимально приближенных к организму. Можно видеть, что использование ФБР действительно приводит к сравнительно невысокой СОД-подобной активности СеО2, которая, тем не менее, оказывается сопоставимой с активностью других СОД-миметиков.
ЗАКЛЮЧЕНИЕ
Методом активированной хемилюминесценции в сочетании с математическим моделированием впервые выполнена количественная оценка антиоксидантных свойств и исследована СОД-подобная активность стабилизированного цитратом аммония коллоидного раствора ультрамалых наночастиц (3 нм) CeO2. Антиоксидантная емкость 1 мкмоль/л золя CeO2 относительно тролокса – водорастворимого аналога витамина Е – составила 0.049 ± 0.004 мкмоль/л. На основании математического моделирования предложен механизм антиоксидантного действия и оценены константы скорости перехвата свободных радикалов, равные 2000 нМ–1 мин–1 для тролокса и k1 = 300 нМ–1 мин–1, k2 = 4 нМ–1 мин–1 для наночастиц диоксида церия. Количественно проанализирована СОД-подобная активность СеО2: активность 1 ммоль/л коллоидного раствора диоксида эквивалентна активности 2.00 ± 0.03 нмоль/л СОД.
Список литературы
Weber D.O. // Health Forum J. 1999. V. 42. № 4. P. 36.
Fornaguera C., Garcia-Celma M.J. // J. Pers. Med. 2017. V. 7. № 4. P. 1. https://doi.org/10.3390/jpm7040012
British society for nanomedicine. https://www.britishsocietynanomedicine.org/existing–nanomedicines/
De Jong W.H., Borm P.J. // Int. J. Nanomedicine. 2008. V. 3. № 2. P. 133. https://doi.org/10.2147/ijn.s596
Naderi S., Morsalir A., Bozorgmehr M.R. et al. // Russ. J. Inorg. Chem. 2019. V. 64. № 4. P. 503. https://doi.org/10.1134/S0036023619040156
Neelam, Chhillar A.K., Rana J.S. // Anal. Biochem. 2019. V. 581. P. 1. https://doi.org/10.1016/j.ab.2019.113345
Ezhova Zh.A., Zakharov N.A., Koval’ E.M. et al. // Russ. J. Inorg. Chem. 2018. V. 63. № 8. P. 1001. [Ежова Ж.А., Захарова Н.А., Коваль Е.М. и др. // Журн. неорган. химии. 2018. Т. 63. № 8. С. 961.]https://doi.org/10.1134/S0036023618080065
Priyadarsini S., Mukherjee S., Mishra M. // J. Oral. Biol. Craniofac. Res. 2018. V. 8. № 1. P. 58. https://doi.org/10.1016/j.jobcr.2017.12.004
Owen A. // Br. J. Pharmacol. 2014. V. 171. № 17. P. 3961. https://doi.org/10.1111/bph.12820
Roubal W.T., Tappel A.L. // Arch. Biochem. Biophys. 1966. V. 113. № 1. P. 5. https://doi.org/10.1016/0003-9861(66)90150-0
Borg D.C., Schaich K.M., Elmore J.J. Jr. et al. // Photochem. Photobiol. 1978. V. 28. № 4. P. 887. https://doi.org/10.1111/j.1751-1097.1978.tb07037
Dixit R., Mukhtar H., Bickers D.R. // J. Invest. Dermatol. 1983. V. 81. № 4. P. 369. https://doi.org/10.1111/1523-1747.ep12519980
Mittag T. // Exp. Eye Res. 1984. V. 39. № 6. P. 759. https://doi.org/10.1016/0014-4835(84)90075-7
Sies H., Cadenas E. // Philos. Trans. R. Soc. Lond. B. Biol. Sci. 1985. V. 311. № 1152. P. 617. https://doi.org/10.1098/rstb.1985.0168
Dhall A., Self W. // Antioxidants. 2018. V. 7. № 8. P. 1. https://doi.org/10.3390/antiox7080097
Korsvik C., Patil S., Seal S. et al. // Chem. Commun. 2007. № 10. P. 1056. https://doi.org/10.1039/b615134e
Pirmohamed T., Dowding J.M., Singh S. et al. // Chem. Commun. (Camb.). 2010. V. 46. № 16. P. 2736. https://doi.org/10.1039/b922024k
Ivanov V.K., Usatenko A.V., Shcherbakov A.B. // Russ. J. Inorg. Chem. 2009. V. 54. № 10. Р. 1522. [Иванов В.К., Усатенко А.В., Щербаков А.Б. // Журн. неорган. химии. 2009. Т. 54. № 10. С. 1596.]https://doi.org/10.1134/S0036023609100039
Asati A., Santra S., Kaittanis C. et al. // Angew. Chem. Int. Ed. Engl. 2009. V. 48. № 13. P. 2308. https://doi.org/10.1002/anie.200805279
Dowding J.M., Das S., Kumar A. et al. // ACS Nano. 2013. V. 7. № 6. P. 4855. https://doi.org/10.1021/nn305872d
Tarnuzzer R.W., Colon J., Patil S. et al. // Nano Lett. 2005. V. 5. № 12. P. 2573. https://doi.org/10.1021/nl052024
Heckert E.G., Karakoti A.S., Seal S. et al. // Biomaterials. 2008. V. 29. № 18. P. 2705. https://doi.org/10.1016/j.biomaterials.2008.03.014
Gil D., Rodriguez J., Ward B. et al. // Bioengineering (Basel). 2017. V. 4. № 1. P. 1. https://doi.org/10.3390/bioengineering4010018
Lissi E., Salim-Hanna M., Pascual C. et al. // Free Radic. Biol. Med. 1995. P. 18. № 2. P. 153. https://doi.org/10.1016/0891-5849(94)00117-3
Magin D.V., Izmailov D.Yu., Popov I.N. et al. // Vopr. Med. Khim. 2000. V. 46. № 4. Р. 419. [Магин Д.В., Измайлов Д.Ю., Попов И.Н. и др. // Вопр. мед. химии. 2000. Т. 46. № 4. С. 419.]
Vladimirov Y.A., Proskurnina E.V., Izmailov D.Iu. // Biofizika. 2011. V. 56. № 6. Р. 1055. [Владимиров Ю.А., Проскурнина Е.В., Измайлов Д.Ю. // Биофизика. 2011. Т. 56. № 6. С. 1081.]https://doi.org/10.1134/S0006350911060200
Alekseev A.V., Proskurnina E.V., Vladimirov Y.A. // Moscow Univ. Chem. Bull. 2012. V. 67. № 3. P. 127. [Алексеев А.В., Проскурнина Е.В., Владимиров Ю.А. // Вестн. Моск. ун-та. Сер. 2. Химия. 2012. Т. 53. № 3. С. 187.]https://doi.org/10.3103/S0027131412030029
Lissi E., Pascual C., Del Castillo M.D. // Free Radic. Res. Commun. 1992. V. 17. № 5. P. 299. https://doi.org/10.3109/10715769209079523
Goldin L.R., Pfeiffer R.M., Li X. et al. // Blood. 2004. V. 104. № 6. P. 1850. https://doi.org/10.1182/blood-2004-01-0341
Shcherbakov A.B., Teplonogova M.A., Ivanova O.S. et al. // Mater. Res. Express. 2007. V. 4. № 5. P. 4. https://doi.org/10.1088/2053-1591/aa6e9a
Shcherbakov A.B., Ivanov V.K., Zholobak N.M. et al. // Biophysics. 2011. V. 56. № 6. Р. 987. [Щербаков А.Б., Иванов В.К., Жолобак Н.М. и др. // Биофизика. 2011. Т. 56. № 6. С. 995.]https://doi.org/10.1134/S0006350911060170
Das S., Dowding J.M., Klump K.E. et al. // Nanomedicine (Lond.). 2013. V. 8. № 9. P. 1483. https://doi.org/10.2217/nnm.13.133
Kwon H.J., Cha M.Y., Kim D. et al. // ACS Nano. 2016. V. 10. № 2. P. 2860. https://doi.org/10.1021/acsnano.5b08045
Pezzini I., Marino A., Del Turco S. et al. // Nanomedicine (Lond.). 2017. V. 12. № 4. P. 403. https://doi.org/10.2217/nnm-2016-0342
Hijaz M., Das S., Mert I. et al. // BMC Cancer. 2016. V. 16. V. 220. P. 1. https://doi.org/10.1186/s12885-016-2206-4
Wong L.L., Pye Q.N., Chen L. et al. // PloS One. 2015. V 10. № 3. P. 1. https://doi.org/10.1371/journal.pone.0121977
Rocca A., Moscato S., Ronca F. et al. // Nanomedicine. 2015. V. 11. № 7. P. 1725. https://doi.org/10.1016/j.nano.2015.05.001
Manne N.D.P.K., Arvapalli R., Graffeo V.A. et al. // Cell. Physiol. Biochem. 2017. V. 42. № 5. P. 1837. https://doi.org/10.1159/000479540
Lee S.S., Song W., Cho M. et al. // ACS Nano. 2013. V. 7. № 11. P. 9693. https://doi.org/10.1021/nn4026806
Tian Z., Li X., Ma Y. et al. // ACS Appl. Mater. Interfaces. 2017. V. 9. № 28. P. 23342. https://doi.org/10.1021/acsami.7b04761
Пушкина Т.А., Токаев Э.С., Попова Т.С. и др. // Журн. НМП. 2016. № 4. С. 42.
Batinic-Haberle I., Spasojevic I. // Antioxid. Redox Signal. 2014. V. 20. № 15. P. 2323. https://doi.org/10.1089/ars.2014.5921
Zhidkova T.V., Proskurnina E.V., Parfenov E.A. et al. // Anal. Bioanal. Chem. 2011. V. 401. № 1. P. 381. https://doi.org/10.1007/s00216-011-5070-8
Celardo I., De Nicola M., Mandoli C. et al. // ACS Nano. 2011. V. 5. № 6. P. 4537. https://doi.org/10.1021/nn200126a
Batinic-Haberle I., Reboucas J.S., Spasojevic I. // Antioxid. Redox Signal. 2010. V. 13. № 6. P. 877. https://doi.org/10.1089/ars.2009.2876
Singh S., Dosani T., Karakoti A.S. et al. // Biomaterials. 2011. V. 32. № 28. P. 6745. https://doi.org/10.1016/j.biomaterials.2011.05.073
Singh R., Singh S. // Colloids Surf. B Biointerfaces. V. 2015. № 132. P. 78. https://doi.org/10.1016/j.colsurfb.2015.05.005
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии