Журнал неорганической химии, 2020, T. 65, № 5, стр. 603-608
Низкотемпературные термодинамические свойства трис-дипивалоилметаната кобальта
И. С. Черняйкин a, b, *, М. А. Беспятов a, С. И. Доровских a, b, Т. М. Кузин a, Н. В. Гельфонд a, Н. Б. Морозова a
a Институт неорганической химии им. А.В. Николаева СО РАН
630090 Новосибирск, пр-т Академика Лаврентьева, 3, Россия
b Новосибирский государственный университет
630090 Новосибирск, ул. Пирогова, 2, Россия
* E-mail: cherny@niic.nsc.ru
Поступила в редакцию 15.11.2019
После доработки 02.12.2019
Принята к публикации 24.12.2019
Аннотация
Теплоемкость трис-дипивалоилметаната кобальта Co(C11H19O2)3 измерена адиабатическим методом в интервале температур 8.18–301.61 K. Анализ функциональной зависимости теплоемкости не выявил каких-либо тепловых аномалий в поведении. Термодинамические функции (энтропия, энтальпия и приведенная энергия Гиббса) рассчитаны с использованием полученных экспериментальных данных по теплоемкости в интервале температур 0–300 K. Значение абсолютной энтропии использовано для расчета энтропии образования Co(C11H19O2)3 при Т = 298.15 K.
ВВЕДЕНИЕ
Тонкие пленки оксида кобальта (Co3O4) являются перспективными функциональными материалами благодаря каталитическим [1], магнитным [2] и электрохромным [3] свойствам. В настоящее время они рассматриваются для изготовления устройств преобразования солнечной энергии [4], датчиков монооксида углерода [5, 6], электродов в литий-ионных аккумуляторах [7].
Одним из способов получения тонких пленок является химическое осаждение из паровой фазы (Chemical vapor deposition, CVD). Ключевой задачей для разработки эффективного и воспроизводимого процесса CVD является поиск молекулярных предшественников (прекурсоров) с четко определенными химико-физическими свойствами.
Трис-дипивалоилметанат кобальта является перспективным прекурсором для получения тонких пленок оксида кобальта методом CVD [8]. Этот комплекс обладает высокой летучестью и термической стабильностью газовой фазы [9, 10] в необходимом для CVD-технологий диапазоне температур. Однако многие другие важные термодинамические свойства этого комплекса, необходимые для оптимизации технологических CVD-процессов, все еще не изучены. В частности, отсутствуют данные о низкотемпературной теплоемкости для трис-дипивалоилметаната кобальта.
Эти данные позволяют определять такие важные фундаментальные свойства, как энтропия, энтальпия, приведенная энергия Гиббса, температура Дебая, характеристики фазовых переходов и др. [11–13]. На базе низкотемпературных данных возможен расчет теплоемкости во всей области существования твердой фазы [14].
Настоящая работа посвящена экспериментальному исследованию адиабатическим методом термодинамических свойств (теплоемкость, энтропия, энтальпия, приведенная энергия Гиббса) трис-дипивалоилметаната кобальта в интервале температур 8.18–301.61 K. Проведенные исследования выполнены впервые.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез трис-дипивалоилметаната кобальта Co(C11H19O2)3 проводили по методике [15]. В качестве исходных реагентов применяли CoCl2 ⋅ 6H2O (≥99.9%) и C11H20O2 (≥99%); все химические вещества, использованные в синтезе, коммерчески доступны (табл. 1). После синтеза образец дополнительно очищали с помощью сублимации в вакуумной (p = 7 Па) градиентной печи при 413–423 K.
Таблица 1.
Характеристика химических веществ, используемых в этом исследовании
| Вещество | Источник | Состояние | Массовая доля чистоты |
|---|---|---|---|
| CoCl2 ⋅ 6H2O | Ltd ‘‘Component-reaktiv’’ | Твердый | ≥0.999 |
| C11H20O2 | Dalchem | Жидкий | ≥0.99 |
| NaOH | Ltd ‘‘Component-reaktiv’’ | Твердый | ≥0.98 |
| H2O2 | Ltd ‘‘Component-reaktiv’’ | Жидкий | 0.30 в воде |
| C2H5OH | Ltd ‘‘Component-reaktiv’’ | Жидкий | ≥0.95 |
| CHCl3 | Ltd ‘‘Component-reaktiv’’ | Жидкий | ≥0.9995 |
| Co(C11H19O2)3 | Синтезирован | Твердый | ≥0.99 |
Образец Co(C11H19O2)3 при комнатной температуре представляет собой темно-зеленый кристаллический порошок с типичным размером кристаллитов ~0.2 мм. Температура плавления полученного образца, определенная на столике Кофлера, составляет 519 ± 1 K, что согласуется с данными, представленными в [16]. Химический анализ (Carlo-Erba-11008) очищенного соединения на С и Н показал, что его состав соответствует расчетному в пределах точности эксперимента (С, Н – 0.2%):
По данным рентгенофазового анализа (дифрактометр Shimadzu XRD-7000, CuKα-излучение, Ni-фильтр, 2θ = 5°–45°), соединение однофазно, и структура полученных кристаллов соответствует установленной в [10] для Co(C11H19O2)3: Pnma; a = 19.239 ± 0.001, b = 18.880 ± 0.001, с = = 10.781 ± 0.001 Å; α = β = γ = 90°.
Метод измерения теплоемкости. Теплоемкость образца была измерена адиабатическим методом на установке, подробно описанной в [17, 18]. Использовали разборный никелевый калориметр. Калориметрическую ампулу с образцом заполняли газообразным гелием (р = 1 кПа) для улучшения теплопередачи. Температуру калориметра измеряли эталонным платиновым термометром сопротивления (R100/R0 = 1.3925), изготовленным и проградуированным в ФГУП “ВНИИФТРИ”. Стандартная неопределенность температуры u(T) = 0.01 K. Разрешающая способность термометрической аппаратуры составляла 5 × 10–5 K выше 50 K, уменьшаясь до 1.5 × 10–3 K при 11 K. Система адиабатического контроля обеспечивала температурную стабильность калориметрической ампулы в пределах 0.0001 град/мин. Измерения теплоемкости проводили импульсным методом нагрева. Перед проведением измерений теплоемкости образца проводили градуировку установки. Результаты градуировки по стандартному веществу (бензойной кислоте) показали хорошее согласие с данными [19]. Отклонение полученных данных по теплоемкости бензойной кислоты от стандартных значений [19] составило ≤1% в интервале 5–20 K, ≤0.3% в интервале 20–80 K и ≤0.15% в интервале 80–300 K.
В калориметр было загружено 4.1161 г вещества. Молярная масса, использованная для представления теплоемкости, была вычислена на основании формулы Co(C11H19O2)3 и составила 608.72 г/моль.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
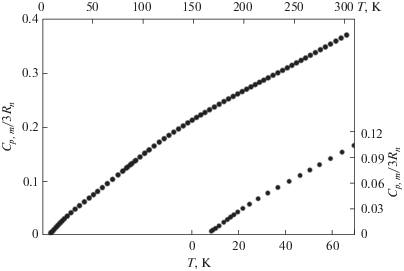
Теплоемкость Co(C11H19O2)3 была измерена адиабатическим методом в интервале температур от 8.18 до 301.61 K. Две серии измерений теплоемкости Cp, m(T) представлены в хронологическом порядке в табл. 2. Серия 1 была выполнена после охлаждения образца от комнатной температуры до температуры кипения жидкого азота (~77.4 K), серия 2 – после охлаждения образца от комнатной температуры до температуры кипения жидкого гелия (~4.2 K). Обе серии измерений теплоемкости хорошо (в пределах неопределенности измерений) согласуются между собой. Анализ функционального поведения теплоемкости Cp, m(T) (рис. 1) не выявил никаких тепловых аномалий. При температуре 301.61 K теплоемкость Co(C11H19O2)3 достигает лишь ~37% от предельного значения закона Дюлонга и Пти, указывая на тенденцию дальнейшего роста. Это свидетельствует о высокой граничной частоте и значительной плотности мод в высокочастотной области фононного спектра.
Таблица 2.
Экспериментальные значения теплоемкости для кристаллического Co(C11H19O2)3 (М = 608.72 г/моль) при давлении р = 1 кПа
| T, K | Cp, m, Дж/(моль K) | T, K | Cp, m, Дж/(моль K) | T, K | Cp, m, Дж/(моль K) |
|---|---|---|---|---|---|
| Серия 1 | 198.02 | 642.4 | 11.48 | 27.94 | |
| 79.49 | 288.1 | 202.39 | 653.1 | 13.51 | 37.84 |
| 83.35 | 302.5 | 206.72 | 663.3 | 15.03 | 45.39 |
| 87.25 | 316.8 | 211.00 | 673.4 | 16.45 | 52.20 |
| 91.83 | 333.5 | 215.22 | 683.7 | 17.82 | 58.71 |
| 96.78 | 351.5 | 219.40 | 693.4 | 19.53 | 66.53 |
| 101.46 | 368.2 | 223.89 | 704.0 | 21.68 | 76.30 |
| 105.93 | 383.6 | 228.69 | 715.1 | 24.58 | 88.26 |
| 110.72 | 400.2 | 233.43 | 726.1 | 28.30 | 103.4 |
| 115.83 | 417.4 | 238.12 | 737.0 | 32.42 | 119.1 |
| 120.75 | 433.1 | 242.77 | 748.3 | 36.77 | 134.8 |
| 125.50 | 447.8 | 247.37 | 759.2 | 41.62 | 151.7 |
| 130.23 | 462.1 | 251.92 | 770.2 | 46.33 | 168.3 |
| 134.96 | 476.2 | 256.43 | 781.3 | 50.56 | 183.4 |
| 139.57 | 489.8 | 260.89 | 792.0 | 54.72 | 198.1 |
| 144.07 | 502.8 | 265.64 | 804.1 | 59.41 | 215.1 |
| 148.47 | 515.2 | 270.66 | 816.1 | 64.39 | 233.1 |
| 152.78 | 527.3 | 275.62 | 828.8 | 69.56 | 251.8 |
| 157.01 | 538.6 | 280.54 | 841.3 | 74.95 | 271.7 |
| 161.17 | 549.5 | 285.65 | 854.2 | 79.83 | 289.5 |
| 165.67 | 561.6 | 290.91 | 867.2 | 84.33 | 306.3 |
| 170.50 | 574.0 | 296.11 | 880.7 | 88.54 | 321.7 |
| 175.26 | 586.1 | 301.61 | 894.3 | 92.52 | 336.1 |
| 179.93 | 598.2 | Серия 2 | 96.78 | 351.3 | |
| 184.54 | 609.9 | 8.18 | 13.27 | 101.26 | 367.1 |
| 189.09 | 621.0 | 8.82 | 16.00 | 105.56 | 382.6 |
| 193.58 | 631.9 | 9.97 | 20.91 | ||
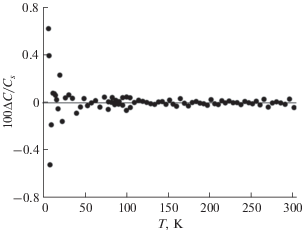
Для вычисления термодинамических функций (энтропии, энтальпии и приведенной энергии Гиббса) было проведено сглаживание экспериментальной теплоемкости с помощью метода Румшиского [20, 21]. В этом методе используется аппроксимация кривой сплайн-функциями. Каждая сплайн-функция третьего, четвертого или более высокого порядка аппроксимирует заранее выбранное количество точек k (k = 5, 6, 7 или более) в зависимости от степени кривизны сглаживаемой функции. При этом могут использоваться сплайн-функции с согласованием в точке сшивки первых производных для i- и (i + 1)-ой сплайн-функций. Графическое сглаживание использовалось на концах температурных диапазонов. Отклонение экспериментальных значений от сглаженной кривой Cs(T) показано на рис. 2. Среднеквадратичные отклонения экспериментальных точек Cp, m(T) от полученной сглаженной кривой Cs(T) составляют: 0.33% (8.18–20 K), 0.09% (20–80 K), 0.023% (80–301.61 K).
Рис. 2.
Относительное отклонение (ΔС = Cp, m(T) – ‒ Cs(T)) экспериментальных значений теплоемкости Cp, m(T) от сглаженной кривой Cs(T) для Co(C11H19O2)3.
Значения энтропии $\Delta _{0}^{T}S_{m}^{^\circ },$ энтальпии $\Delta _{0}^{T}H_{m}^{^\circ }$ и приведенной энергии Гиббса $\Phi _{m}^{^\circ }$ во всем рассматриваемом интервале температур получены численным интегрированием сглаженной зависимости теплоемкости Cs(T) от температуры. При расчетах предполагалось, что ниже 8.18 K, где экспериментальные данные отсутствуют, теплоемкость образца не содержит аномальных вкладов и подчиняется предельному закону Дебая (С ~ Т3, рис. 3). Значения термодинамических функций в интервале от 0 до 300 K представлены в табл. 3.
Рис. 3.
Теплоемкость в координатах Cp, m(T)/T от T 2 для Co(C11H19O2)3 в диапазоне температур 0–30 K. Черные кружки – экспериментальные данные, пунктирная линия соответствует закону Дебая, сплошная линия – сглаженные значения теплоемкости.
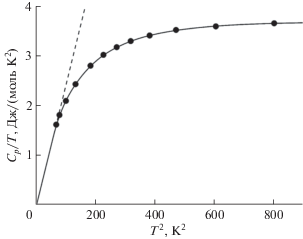
Таблица 3.
Молярные термодинамические функции (теплоемкость $C_{{p,m}}^{^\circ },$ энтропия $\Delta _{0}^{T}S_{m}^{^\circ },$ энтальпия $\Delta _{0}^{T}H_{m}^{^\circ },$ приведенная энергия Гиббса $\Phi _{m}^{^\circ }$ = $\Delta _{0}^{T}S_{m}^{^\circ }$ – $\Delta _{0}^{T}H_{m}^{^\circ }/T$) для Co(C11H19O2)3 при давлении р = 0.1 МПа; М = 608.72 г/моль
| T, K | $C_{{p,m}}^{^\circ },$ Дж/(моль K) | $\Delta _{0}^{T}S_{m}^{^\circ },$ Дж/(моль K) | $\Delta _{0}^{T}H_{m}^{^\circ },$ Дж/моль | $\Phi _{m}^{^\circ },$ Дж/(моль K) |
|---|---|---|---|---|
| 0 | 0 | 0 | 0 | 0 |
| 5 | 3.030 | 1.022 | 3.916 | 0.2392 |
| 10 | 21.16 | 7.853 | 58.69 | 1.984 |
| 15 | 45.20 | 20.88 | 223.6 | 5.977 |
| 20 | 68.71 | 37.15 | 509.1 | 11.69 |
| 30 | 109.9 | 73.01 | 1408 | 26.09 |
| 40 | 146.2 | 109.7 | 2690 | 42.41 |
| 50 | 181.3 | 146.1 | 4328 | 59.50 |
| 60 | 217.2 | 182.3 | 6320 | 76.95 |
| 70 | 253.5 | 218.5 | 8673 | 94.58 |
| 80 | 290.1 | 254.7 | 11 390 | 112.3 |
| 90 | 326.9 | 291.0 | 14 480 | 130.2 |
| 100 | 362.9 | 327.3 | 17 930 | 148.1 |
| 110 | 397.8 | 363.5 | 21 730 | 166.0 |
| 120 | 430.7 | 399.6 | 25 870 | 184.0 |
| 130 | 461.4 | 435.3 | 30 340 | 201.9 |
| 140 | 491.0 | 470.6 | 35 100 | 219.9 |
| 150 | 519.5 | 505.4 | 40 150 | 237.7 |
| 160 | 546.6 | 539.8 | 45 480 | 255.6 |
| 170 | 572.7 | 573.7 | 51 080 | 273.3 |
| 180 | 598.4 | 607.2 | 56 940 | 290.9 |
| 190 | 623.2 | 640.2 | 63 050 | 308.4 |
| 200 | 647.2 | 672.8 | 69 400 | 325.8 |
| 210 | 671.1 | 705.0 | 75 990 | 343.1 |
| 220 | 694.9 | 736.7 | 82 820 | 360.3 |
| 230 | 718.1 | 768.1 | 89 890 | 377.3 |
| 240 | 741.5 | 799.2 | 97 180 | 394.3 |
| 250 | 765.6 | 830.0 | 104 720 | 411.1 |
| 260 | 789.9 | 860.5 | 112 500 | 427.8 |
| 270 | 814.7 | 890.7 | 120 520 | 444.4 |
| 280 | 839.9 | 920.8 | 128 790 | 460.8 |
| 290 | 865.1 | 950.7 | 137 320 | 477.2 |
| 298.15 | 885.7 | 975.0 | 144 450 | 490.5 |
| 300 | 890.5 | 980.5 | 146 090 | 493.5 |
Энтропия образования Co(C11H19O2)3 была рассчитана с использованием значений абсолютной энтропии трис-дипивалоилметаната кобальта (данные этой работы), кобальта [22], углерода [23], водорода [24] и кислорода [24]. Значение энтропии образования Δf S(298.15, Co(C11H19O2)3) = = –(3584 ± 4) Дж/(моль K).
Список литературы
Pollard M.J., Weinstock B.A., Bitterwolf T.E. et al. // J. Catal. 2008. V. 254. P. 218. https://doi.org/10.1016/j.jcat.2008.01.001
Ikedo Y., Sugiyama J., Nozaki H. et al. // Phys. Rev. B: Condens. Matter 2007. V. 75. P. 054424. https://doi.org/10.1103/physrevb.75.054424
Kadam L.D., Patil P.S. // Sol. Energy Mater. Sol. Cells. 2001. V. 70. P. 15. https://doi.org/10.1016/S0927-0248(00)00404-9
Moon J., Kim T.K., VanSaders B. et al. // Sol. Energy Mater. Sol. Cells 2015. V. 134. P. 417.
Nam H.-J., Sasaki T., Koshizaki N. // J. Phys. Chem. B. 2006. V. 110. P. 23081. https://doi.org/10.1021/jp063484f
Vladimirova S., Krivetskiy V., Rumyantseva M. et al. // Sensors. 2017. V. 17. P. 2216. https://doi.org/10.3390/S17102216
Patil A., Patil V., Shin D.W. et al. // Mater. Res. Bull. 2008. V. 43. P. 1913. https://doi.org/10.1016/J.materresbull.2007.08.031
Alemaa F., Osinskya A., Mukhopadhyay P. et al. // J. Cryst. Growth. 2019. V. 525. P. 125207. https://doi.org/10.1016/j.jcrysgro.2019.125207
Fahlman B.D., Barron A.R. // Adv. Mater. Opt. Electron. 2000. V. 10. P. 223. https://doi.org/10.1002/1099-0712(200005/10)10:3/5% 3c223::aid-amo411%3e3.0.co;2-m
Ahmed M.A.K., Fjellva H., Kjekshus A. et al. // Z. Anorg. Allg. Chem. 2008. V. 634. P. 247. https://doi.org/10.1002/zaac.200700462
Bissengaliyeva M.R., Gogol D.B., Bekturganov N.S. et al. // J. Chem. Eng. Data. 2011. V. 56. № 5. P. 1941.
Tyurin A.V., Khoroshilov A.V., Guskov V.N. et al. // Russ. J. Inorg. Chem. 2018. V. 63. № 12. P. 1599. https://doi.org/10.1134/S0036023618120215
Guskov V.N., Sazonov E.G., Tyurin A.V. et al. // Russ. J. Inorg. Chem. 2019. V. 64. № 8. P. 1041. https://doi.org/10.1134/S0036023619080059
Musikhin A.E., Naumov V.N., Bespyatov M.A. et al. // Thermochim. Acta. 2018. V. 670. P. 107.
Bryant B.E., Fernelius W.C. // Inorg. Synth. 1957. V. 5. P. 188.
Lee H., Lee C.H., Oh I.S. et al. // Bull. Korean Chem. Soc. 2010. V. 31. № 4. P. 891.
Drebushchak V.A., Naumov V.N., Nogteva V.V. et al. // Thermochim. Acta. 2000. V. 348. P. 33.
Bespyatov M.A., Kuzin T.M., Naumov V.N. et al. // J. Therm. Anal. Calorim. 2016. V. 123. P. 899.
Rybkin N.P., Orlova M.P., Baranyuk A.K. et al. // Meas. Tech. 1974. V. 17. P. 1021.
Румшиский Л.З. Математическая обработка результатов эксперимента. Справочное руководство. М.: Наука, 1971.
Bespyatov M.A., Musikhin A.E., Naumov V.N. et al. // J. Chem. Thermodyn. 2018. V. 118. P. 21.
Chase M.W.Jr. // J. Phys. Chem. Ref. Data 1998. Monograph. 9. V. 1. P. 1951.
DeSorbo W., Tyler W.W. // J. Chem. Phys. 1953. V. 21. P. 1660.
Cox J.D., Wagman D.D., Medvedev V.A. CODATA Key Values for Thermodynamics. N.Y.: Hemisphere Publishing Corp., 1984.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии