Журнал неорганической химии, 2020, T. 65, № 5, стр. 581-585
Синтез, структура и теплофизические свойства германата NdGaGe2O7
Л. Т. Денисова a, *, Ю. Ф. Каргин b, Л. А. Иртюго a, В. В. Белецкий a, Н. В. Белоусова a, В. М. Денисов a
a Сибирский федеральный университет, Институт цветных металлов и материаловедения
660041 Красноярск, Свободный пр-т, 79, Россия
b Институт металлургии и материаловедения им. А.А. Байкова РАН
119991 Москва, Ленинский пр-т, 49, Россия
* E-mail: antluba@mail.ru
Поступила в редакцию 15.10.2019
После доработки 24.10.2019
Принята к публикации 25.12.2019
Аннотация
Методом твердофазных реакций при последовательном ступенчатом обжиге на воздухе стехиометрической смеси исходных оксидов Nd2O3, Ga2O3 и GeO2 в интервале температур 1273–1473 K синтезированы поликристаллические образцы германата галлия-неодима NdGaGe2O7. При помощи дифференциальной сканирующей калориметрии исследована температурная зависимость теплоемкости полученных образцов в области 350–1000 K. По экспериментальным значениям Cp = f(T) рассчитаны термодинамические функции (изменения энтальпии, энтропии и приведенной энергии Гиббса) сложного оксидного соединения NdGaGe2O7.
ВВЕДЕНИЕ
Интересные физические свойства и возможность практического применения германатов состава RMGe2O7 (R = РЗЭ; M = Al, Ga, In, Fe) в течение длительного времени привлекают к себе внимание исследователей и практиков [1–12]. Они могут использоваться в качестве лазеров [4, 5], люминофоров [4], новых магнитных материалов [2, 3, 13]. Для соединения NdGaGe2O7 в литературе имеются только данные о кристаллической структуре [1, 14] и оптических свойствах [14, 15], сведения о теплофизических свойствах отсутствуют. Диаграмма состояния системы Nd2O3–Ga2O3–GeO2 не построена. Для термодинамического моделирования фазовых равновесий в этой системе требуются данные по термодинамическим свойствам образующихся соединений, которых к настоящему времени нет.
Цель настоящей работы – исследование высокотемпературной теплоемкости NdGaGe2O7 и определение его термодинамических свойств.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
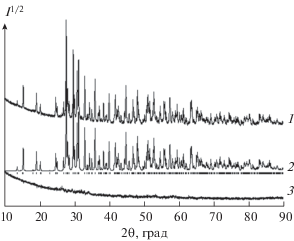
Для синтеза соединения NdGaGe2O7 в качестве исходных компонентов использовали предварительно прокаленные на воздухе при T = 1173 K оксиды Nd2O3, Ga2O3 (ос. ч.) и GeO2 (99.996%). Поликристаллические образцы германата галлия-неодима состава NdGaGe2O7 получали методом твердофазных реакций. Для этого стехиометрическую смесь исходных компонентов тщательно смешивали в агатовой ступке и прессовали без добавления связующего в таблетки. Обжиг приготовленных таблеток проводили в муфельной печи на воздухе при последовательном ступенчатом повышении температуры: 1273 (40 ч), 1373 (100 ч) и 1473 K (60 ч). С целью достижения полноты протекания твердофазной реакции спеченные таблетки через каждые 20 ч измельчали и снова прессовали. Поскольку относительно высокие температуры твердофазного синтеза могут приводить к испарению GeO2 и отклонению состава от стехиометрии [16], для обжига образцов использовали тигли с крышками. Время синтеза и дополнительное количество GeO2 подбирали экспериментально. Фазовый состав полученных образцов контролировали с помощью рентгенофазового анализа (дифрактометр X´Pert Pro MPD PANalytical, Нидерланды, CuKα-излучение). Дифрактограмма подтвердила однофазность синтезированного образца NdGaGe2O7 (рис. 1). Параметры элементарной ячейки полученного германата галлия-неодима определены согласно [17].
Рис. 1.
Рентгенограмма NdGaGe2O7 при комнатной температуре: 1 – экспериментальный, 2 – расчетный, 3 – разностный профили рентгенограмм; штрихи указывают расчетные положение рефлексов.
Измерение теплоемкости NdGaGe2O7 проводили при помощи термоанализатора STA 449 C Jupiter (Netzsch, Германия), подробное описание методики экспериментов приведено в [18]. Ошибка экспериментов не превышала 2%.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Параметры кристаллической решетки синтезированного германата NdGaGe2O7 (пр. гр. P21/c, Z = 4) приведены в табл. 1. Видно, что полученные нами значения a = 7.2240(1), b = 6.5913(1), c = = 12.8507(2) Å удовлетворительно согласуются с данными других авторов. На рис. 2 показана связь между значениями ионного радиуса редкоземельных ионов ${{r}_{{{{{\text{R}}}^{{3 + }}}}}}$ и параметрами элементарной ячейки германатов RGaGe2O7. Видно, что с ростом ${{r}_{{{{{\text{R}}}^{{3 + }}}}}}$ значения a, b и c линейно увеличиваются и могут быть описаны линейными уравнениями:
(1)
$a = \left( {{\text{5}}.{\text{74}} \pm 0.0{\text{6}}} \right) + \left( {{\text{1}}.{\text{26}} \pm 0.0{\text{5}}} \right){{r}_{{{{{\text{R}}}^{{3 + }}}}}},$(2)
$b = \left( {{\text{5}}.{\text{74}} \pm 0.0{\text{4}}} \right) + \left( {0.{\text{723}} \pm 0.0{\text{4}}} \right){{r}_{{{{{\text{R}}}^{{3 + }}}}}},$(3)
$c = \left( {{\text{1}}0.{\text{94}} \pm 0.{\text{14}}} \right) + \left( {{\text{1}}.{\text{631}} \pm 0.{\text{13}}} \right){{r}_{{{{{\text{R}}}^{{3 + }}}}}}.$Рис. 2.
Корреляция между значениями ионных радиусов редкоземельных ионов ${{r}_{{{{{\text{R}}}^{{3 + }}}}}}$ и параметрами элементарной ячейки германатов RGaGe2O7: a (1), b (2), c (3), d (4).
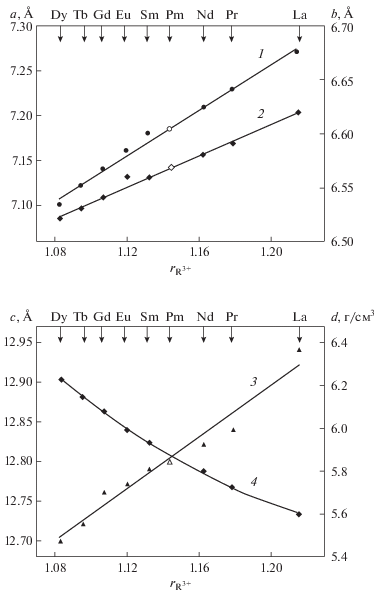
Коэффициенты корреляции для уравнений (1)–(3) равны соответственно 0.9948, 0.9920 и 0.9827. В то же время плотность этих соединений с ростом значений ${{r}_{{{{{\text{R}}}^{{3 + }}}}}}$ закономерно уменьшается не по линейному закону и может быть описана соотношением:
(4)
$\begin{gathered} d = \left( {{\text{31}}.{\text{91}} \pm {\text{3}}.{\text{14}}} \right)--\left( {{\text{4}}0.{\text{64}} \pm {\text{5}}.{\text{48}}} \right){{r}_{{{{{\text{R}}}^{{3 + }}}}}} + \\ + \,\,\left( {{\text{15}}.{\text{64}} \pm {\text{2}}.{\text{38}}} \right)r_{{{{{\text{R}}}^{{3 + }}}}}^{2}. \\ \end{gathered} $Значения параметров элементарной ячейки RGaGe2O7 взяты из работы [14], а ${{r}_{{{{{\text{R}}}^{{3 + }}}}}}$ (для координационного числа ионов РЗЭ, равного 9) – из [19]. Подобная корреляция между значениями ${{r}_{{{{{\text{R}}}^{{3 + }}}}}}$ и параметрами элементарной ячейки была получена ранее для соединений R2Ge2O7 [17].
Наличие зависимостей, описываемых уравнениями (1)–(3), позволяет оценить параметры элементарной ячейки соединения PmGaGe2O7, которое к настоящему времени еще не получено: a = 7.18, b = 6.57, c = 12.80 Å.
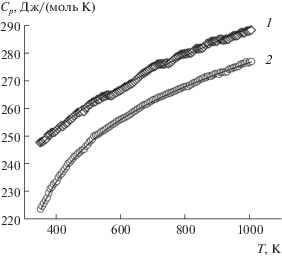
На рис. 3 приведена зависимость теплоемкости полученных поликристаллических образцов NdGaGe2O7 от температуры. Значения молярной теплоемкости Cp закономерно увеличиваются по мере роста температуры, а на графике зависимости Cp = f(T) не наблюдается каких-либо заметных отклонений (аномалий или экстремумов) от плавной кривой. Характер полученной кривой теплоемкости свидетельствует о том, что в области температур 350–1000 K соединение NdGaGe2O7 не испытывает полиморфных превращений. Таким образом, полученные результаты могут быть описаны классическим уравнением Майера–Келли [20]:
Рис. 3.
Температурная зависимость молярной теплоемкости Nd2Ge2O7 (1) и NdGaGe2O7 (2), точки – экспериментальные данные, линия – расчет по уравнению (6).
которое для NdGaGe2O7 имеет следующий вид:
(6)
$\begin{gathered} {{С}_{p}} = \left( {250.8 \pm 0.29} \right) + \left( {37.48 \pm 0.30} \right) \times {{10}^{{--3}}}T - \\ - \,\,\left( {47.39 \pm 0.33} \right) \times {{10}^{5}}{{T}^{{--2}}}. \\ \end{gathered} $Отсутствие в литературе сведений о теплоемкости NdGaGe2O7 не позволяет сравнить полученные нами результаты с данными других авторов. Тем не менее можно оценить величину теплоемкости этого соединения, используя различные модельные представления. Установлено, что лучшее согласие с экспериментом наблюдается для значений Cp, рассчитанных методами Неймана–Коппа [21–23], Кумока [24] и Келлога [25]. Значения Cp при 298 K в этом случае равны соответственно 206.5, 212.8 и 214.3 Дж/(моль K), что отличается от экспериментальных на 0.02, 3.0 и 3.8% (полученное для NdGaGe2O7 экстраполяцией экспериментальных данных по уравнению (6) расчетное значение Cp298 = 206.55 Дж/(моль K)).
На рис. 3 для сравнения приведены данные по теплоемкости Nd2Ge2O7 (Cp298 = 243.1 Дж/(моль K)), полученные нами ранее [17]. Видно, что замещение части неодима на галлий приводит к уменьшению молярной теплоемкости, что, возможно, связано с меньшей атомной массой галлия и структурными изменениями. Кроме того, для соединений неодима (как и для других парамагнитных соединений РЗЭ) следует также учитывать появление избыточной теплоемкости в широком температурном диапазоне (или аномального вклада Шоттки). Следует также отметить, что при 350 K значение Cp для NdGaGe2O7 сопоставимо с величинами теплоемкости сложных индийсодержащих германатов DyInGe2O7, HoInGe2O7 [26] и Y2Ge2O7 [27].
По известным термодинамическим соотношениям с использованием уравнения (6) рассчитаны термодинамические функции (изменения энтальпии, энтропии и приведенной энергии Гиббса) оксидного соединения NdGaGe2O7, результаты приведены в табл. 2.
Таблица 2.
Термодинамические свойства NdGaGe2O7
| T, K | Cp, Дж/(моль K) | H°(T) – H°(350 K), кДж/моль | S°(T) – S°(350 K), Дж/(моль K) | Ф°(Т) – Ф°(350 K), Дж/(моль K) |
|---|---|---|---|---|
| 350 | 222.8 | – | – | – |
| 400 | 233.4 | 11.42 | 30.48 | 1.93 |
| 450 | 241.1 | 23.29 | 58.44 | 6.68 |
| 500 | 247.1 | 35.51 | 84.17 | 13.16 |
| 550 | 251.9 | 47.99 | 107.9 | 20.71 |
| 600 | 256.0 | 60.69 | 130.1 | 28.91 |
| 650 | 259.4 | 73.57 | 150.7 | 37.50 |
| 700 | 262.5 | 86.62 | 170.0 | 46.28 |
| 750 | 265.3 | 99.82 | 188.2 | 55.14 |
| 800 | 267.8 | 113.1 | 205.4 | 64.00 |
| 850 | 270.2 | 126.6 | 221.7 | 72.81 |
| 900 | 272.4 | 140.2 | 237.2 | 81.51 |
| 950 | 274.5 | 153.8 | 252.0 | 90.10 |
| 1000 | 276.6 | 167.6 | 266.2 | 98.56 |
ЗАКЛЮЧЕНИЕ
Выполнен синтез поликристаллических образцов германата галлия-неодима состава NdGaGe2O7 ступенчатым обжигом на воздухе при 1273–1473 K стехиометрической смеси Nd2O3, Ga2O3 и GeO2. Определены параметры кристаллической решетки синтезированного NdGaGe2O7 (пр. гр. P21/c, Z = 4): a = 7.2240(1), b = 6.5913(1), c = 12.8507(2) Å. Методом дифференциальной сканирующей калориметрии измерена высокотемпературная теплоемкость полученных образцов. Показано, что в области 350–1000 K температурная зависимость Cp описывается уравнением Майера–Келли с отклонением экспериментальных точек от сглаживающей кривой, не превышающим 0.29%. На основании экспериментальных данных рассчитаны термодинамические свойства (изменения энтальпии, энтропии и приведенной энергии Гиббса) сложного оксида NdGaGe2O7.
Список литературы
Jarchow O., Klaska K.-H., Schenk-Strauß H. // Z. Kristallogr. V. 172. P. 159.
Милль Б.В., Казей З.А., Рейман С.И. и др. // Вестн. Моск. ун-та. Сер. 3. Физ., астрономия. 1987. Т. 28. № 4. С. 95.
Bucio L., Cascales C., Alonso J.A. et al. // J. Phys.: Condens. Matter. 1996. V. 8. P. 2641.
Juarez-Arellano E.A., Campa-Molina J., Ulloa-Godinez S. et al. // Mater. Res. Soc. Symp. Proc. 2005. V. 848. P. FF6.15.1.
Kaminskii A.A., Rhee H., Lux O. et al. // Laser. Phys. Lett. 2013. V. 19. P. 075803-1. https://doi.org/10.1088/1612-2011/10/7/0755803
Denisova L. T., Kargin Yu. F., Irtyugo L. A. et al. // Inorg. Mater. 2018. V. 54. № 12. P. 1245. [Денисова Л.Т., Каргин Ю.Ф., Иртюго Л.А. и др. // Неорган. материалы. 2018. Т. 54. № 12. С. 1315.] https://doi.org/10.1134/S0020168518120026
Juarez-Arellano E.-A., Rosales I., Bucio L. et al. // Acta Crystallogr. 2002. V. C58. P. i135. https://doi.org/10.1107/S010827010201/3343
Juarez-Arellano E.A., Rosales I., Oliver A. et al. // Acta Crystallogr. 2004. V. C60. P. i14. https://doi.org/10.1107/S0108270/03029056
Bucio L., Cascales C., Alonso J.A. et al. // Mater. Sci. Forum Vols. 1996. P. 735. https://doi.org/10.4028/www.Scientific.net/MSF.228-231.735
Cascales C., Gutierrez Puebla, Klimin S. et al. // Chem. Mater. 1999. V. 11. № 9. P. 2520.
Baran E.J., Cascales C., Mercader R.C. // Spectrochim. Acta. 2000. V. A56. P. 1277.
Juárez-Arellano E.A., Bucio L., Ruvalcaba J.L. et al. // Z. Kristallogr. 2002. V. 217. P. 201.
Cascales C., Fernandez-Diaz M.T., Monge M.A. et al. // Chem. Mater. 2002. V. 14. P. 1995.
Kaminskii A.A., Mill B.V., Butashin A.V. et al. // Phys. Status Solidi A. 1987. V. 103. P. 575.
Lozano G., Cascales C., Zaldo C., Porcher P. // J. Alloys Compd. 2000. V. 303–304. P. 349.
Becker U.W., Felsche J. // J. Less-Common. Met. 1987. V. 128. P. 269.
Denisova L.T., Irtyugo L.A., Beletskii V.V. et al. // Phys. Solid State. 2018. V. 60. № 3. P. 626. [Денисова Л.Т., Иртюго Л.А., Белецкий В.В. и др. // ФТТ. 2018. Т. 60. № 3. С. 618.] https://doi.org/10.1134/S1063783418030071
Denisova L.T., Irtyugo L.A., Kargin Yu.F. // Inorg. Mater. 2017. V. 53. № 1. P. 93. [Денисова Л.Т., Иртюго Л.А., Каргин Ю.Ф. и др. // Неорган. материалы. 2017. Т. 53. № 1. С. 71.] https://doi.org/10.1134/S0020168517010046
Shannon R.D. // Acta Crystallogr. Sect. A. 1976. V. 32. P. 751.
Maier C.G., Kelley K.K. // J. Am. Chem. Soc. 1932. V. 54. № 8. P. 3234.
Leitner J., Chuchvalec P., Sedmidubský D. et al. // Thermochim. Acta. 2003. V. 395. P. 27.
Моисеев Г.К., Ватолин Н.А., Маршук Л.А., Ильиных Н.И. Температурные зависимости приведенной энергии Гиббса некоторых неорганических веществ (альтернативный банк данных АСТРА. OWN). Екатеринбург; УрО РАН, 1997. 230 с.
Морачевский А.Г., Сладков И.Б., Фирсова Е.Г. Термодинамические расчеты в химии и металлургии. СПб.: Лань, 2018. 208 с.
Кумок В.Н. // Прямые и обратные задачи химической термодинамики. Новосибирск: Наука, 1987. С. 108.
Кубашевский О., Олкокк С.Б. Металлургическая термохимия. М.: Металлургия, 1982. 392 с.
Denisova L.T., Irtyugo L.A., Kargin Yu.F. et al. // Russ. J. Inorg. Chem. 2019. V. 64. № 9. P. 1161. [Денисова Л.Т., Иртюго Л.А., Каргин Ю.Ф. и др. // Журн. неорган. химии. 2019. Т. 64. № 9. С. 980.] https://doi.org/10.1134/S0036023619090079
Denisova L.T., Irtyugo L.A., Kargin Yu.F. et al. // Russ. J. Inorg. Chem. 2018. V. 63. № 3. P. 361. [Денисова Л.Т., Иртюго Л.А., Каргин Ю.Ф. и др. // Журн. неорган. химии. 2018. Т. 63. № 3. С. 338.]https://doi.org/10.1134/S003602361803004X
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии


