Журнал неорганической химии, 2020, T. 65, № 5, стр. 660-668
Строение и термодинамические свойства фосфатов Pb0.5 + xMgxZr2 – x(PO4)3 (x = 0, 0.5)
П. А. Майоров a, Е. А. Асабина a, В. И. Петьков a, А. В. Маркин a, *, Н. Н. Смирнова a, А. М. Ковальский b
a Национальный исследовательский Нижегородский государственный университет им. Н.И. Лобачевского
603950 Нижний Новгород, пр-т Гагарина, 23, Россия
b Национальный исследовательский технологический университет “Московский институт стали и сплавов”
119049 Москва, Ленинский пр-т, 4, Россия
* E-mail: markin@calorimetry-center.ru
Поступила в редакцию 22.10.2019
После доработки 06.11.2019
Принята к публикации 27.12.2019
Аннотация
xMgxZr2 –x(PO4)3 (x = 0, 0.5) структурного типа NaZr2(PO4)3 (NZP). Методами адиабатической вакуумной и дифференциальной сканирующей калориметрии измерена теплоемкость Pb0.5Zr2(PO4)3 в интервале температур 8–660 K. Установлено, что изученный фосфат претерпевает обратимый фазовый переход в интервале 256–426 K. Согласно результатам структурного исследования методом Ритвельда, этот переход обусловлен ростом позиционной разупорядоченности катионов свинца в полостях NZP-структуры. Измерения теплоемкости PbMg0.5Zr1.5(PO4)3 в области температур 195–660 K показали, что для него наблюдается аналогичный фазовый переход при 255–315 K. По полученным экспериментальным данным рассчитаны значения термодинамических функций Pb0.5Zr2(PO4)3: $C_{p}^{0}(T),$ [H0(T) – H0(0)], S0(T) и [G0(T) – H0(0)] в интервале температур 0–660 K. Определена стандартная энтропия образования Pb0.5Zr2(PO4)3 при 298.15 K.
ВВЕДЕНИЕ
Фосфаты со смешанными октаэдротетраэдрическими каркасами {[L2(РO4)3]p–}3∞ (NaZr2(PO4)3 (NZP, NASICON, коснарит), Sc2(WO4)3 (SW), K2Mg2(SO4)3 (лангбейнит) и др.) интенсивно изучаются в связи с их химической, термо- и радиационной стойкостью и регулируемым (в том числе ультрамалым) тепловым расширением [1–3]. Такие соединения представляют интерес как матричные материалы для иммобилизации токсичных элементов, в частности тяжелых металлов (Pb, Cd, Sr и др.), из промышленных, в том числе радиоактивных, отходов [4, 5]. В работе [6] нами изучены возможности вхождения элементов в степени окисления +2 в структуру каркасных фосфатов и показано, что ряды, включающие крупные катионы М2+ (начиная с кадмия), кристаллизуются в NZP-типе структуры. В настоящей работе в качестве объектов исследования выбраны два свинецсодержащих NZP-фосфата Pb0.5 +xMgxZr2 –x(PO4)3 с x = 0 и 0.5.
Кристаллохимическая формула NZP-фосфатов имеет вид (M1)0 → 1(M2)0 → 3{[L2(PO4)3]p–}3∞, где L – октаэдрически координированные катионные позиции каркасообразующих катионов, а сам каркас образован полиэдрами LO6 и PO4. (M1)0 → 1 и (M2)0 → 3 – типы катионных позиций в полостях каркаса с обозначением числа занимаемых мест в каждом типе (M1 – внутри колонок полиэдров, М2 – между ними).
В зависимости от особенностей распределения катионов в полостях и незначительных смещений ионов, образующих каркас, может наблюдаться небольшое искажение ячейки и изменение симметрии. Наивысшая симметрия, возможная для NZP-структуры, наблюдается для родоначальника семейства NaZr2(PO4)3, кристаллизующегося в пр. гр. $R\bar {3}c$ (Z = 6). Однако упорядочение катионов щелочноземельных металлов M2+ в М1-полостях некоторых соединений состава M0.5Zr2(PO4)3 [7] приводит к расщеплению каждой внекаркасной М1-позиции на две и к чередованию занятых и вакантных позиций внутри колонок. Для этих фосфатов характерна пр. гр. $R\bar {3}.$
На основании литературных данных можно утверждать, что в структуре Pb0.5Zr2(PO4)3 (x = 0) каркас образован октаэдрами ZrO6 и тетраэдрами PO4, а катионы Pb2+ занимают половину имеющихся М1-позиций в полостях. Частичное замещение циркония ионами магния в каркасе структуры PbMg0.5Zr1.5(PO4)3 (x = 0.5) приводит к полному заселению М1-полостей ионами Pb2+.
Для фосфатов Pb0.5 +xMgxZr2 –x(PO4)3 изучены условия синтеза и фазообразования, выявлены области протяженности твердых растворов [6]. Тепловое расширение PbMg0.5Zr1.5(PO4)3 в интервале температур 293–1073 K позволило охарактеризовать его как малорасширяющийся материал, устойчивый к тепловым ударам. Однако для полной характеристики термического поведения свинецсодержащих керамик необходимы сведения об их фундаментальных свойствах – теплоемкости, термодинамических функциях и термодинамических характеристиках фазовых переходов.
В настоящей работе исследовано строение, температурная зависимость теплоемкости $C_{p}^{0}$ = = f(T) и определены термодинамические функции кристаллических NZP-фосфатов Pb0.5 + xMgxZr2 –x(PO4)3 (x = 0, 0.5) в области 8–660 K.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Фосфаты Pb0.5Zr2(PO4)3 (x = 0) и PbMg0.5Zr1.5(PO4)3 (x = 0.5) получены золь-гель методом с последующей термообработкой. Использовали следующие исходные реагенты особой степени чистоты: Pb(NO3)2, MgO, ZrOCl2 ∙ ∙ 8H2O, NH4H2PO4. Перед проведением синтеза оксид магния растворяли в рассчитанном количестве азотной кислоты, остальные реактивы – в дистиллированной воде.
При синтезе фосфатов стехиометрические количества водных растворов солей металлов сливали при постоянном перемешивании при комнатной температуре, затем при перемешивании добавляли раствор дигидрофосфата аммония, взятый также в соответствии со стехиометрией фосфатов. Реакционные смеси высушивали при 363 K, диспергировали и подвергали термообработке в условиях свободного доступа воздуха при 873 (100 ч) и 1073 K (50 ч). Для идентификации образцов, определения полноты взаимодействия реагентов и отсутствия в образцах посторонних фаз фосфаты изучали методами рентгенографии, электронной микроскопии и микрозондового анализа.
Рентгенограммы образцов Pb0.5Zr2(PO4)3 и PbMg0.5Zr1.5(PO4)3 записывали на дифрактометре Shimadzu XRD-6000 (CuKα-излучение, λ = = 1.54178 Å) в интервале углов 2θ = 10°–80° (шаг сканирования 0.02°) с экспозицией в точке 6 с. Рентгенограммы Pb0.5Zr2(PO4)3 для структурных исследований снимали при 173 и 473 K, рентгенограмму PbMg0.5Zr1.5(PO4)3 для расчета кристаллографических характеристик – при 298.15 K. Обработку рентгенограмм и уточнение структуры проводили методом Ритвельда [8] с помощью программы RIETAN-97 [9]. Для аппроксимирования профилей пиков использовали модифицированную функцию псевдо-Войта (Mod-TCH pV). Условия съемки и обработки рентгенограмм позволяли обнаружить в образце кристаллические фазы при их содержании не менее 1%.
Контроль химического состава и однородности синтезированных образцов Pb0.5 + xMgxZr2 –x(PO4)3 (x = 0, 0.5) проводили на сканирующем электронном микроскопе JEOL JSM-7600F с термополевой электронной пушкой (катод Шоттки). Микроскоп оснащен системой микроанализа – энергодисперсионным спектрометром OXFORD X-Max 80 (Premium) с полупроводниковым кремний-дрейфовым детектором. Точность определения элементного состава образцов составляла 0.5–2.5 мол. %.
Теплоемкость Pb0.5Zr2(PO4)3 в области температур 8–300 K измеряли с помощью полностью автоматизированного адиабатического вакуумного калориметра БКТ-3.07 (АОЗТ “Термис”) [10] по методике, опубликованной в работе [11]. В качестве хладагентов применяли жидкий гелий и азот. Ампулу с веществом наполняли до давления 40 кПа при комнатной температуре сухим гелием в качестве теплообменного газа. Поверку надежности работы калориметра осуществляли посредством измерения $C_{p}^{0}$ эталонного образца меди особой чистоты, синтетического корунда и бензойной кислоты марки K-3. Аппаратура и методика измерений позволяли получать значения теплоемкости веществ с погрешностью ±2% при температурах до 15 K, ±0.5% в интервале 15−40 K и ±0.2% в области 40−300 K; измерять температуры фазовых превращений с точностью ±0.01 K и энтальпий превращений с погрешностью ±0.2%. В калориметрическую ампулу адиабатического калориметра помещали 1.47266 г исследуемого вещества. Теплоемкость измеренного образца составляла 40–50% от суммарной теплоемкости калориметрической ампулы с веществом.
Для измерения теплоемкости фосфатов в области 195–660 K использовали дифференциальный сканирующий калориметр DSC204F1 Phoenix (Netzsch Gerätebau). Конструкция калориметра DSC204F1 и методика работы описаны в работах [12, 13]. Поверку надежности работы калориметра осуществляли посредством стандартных калибровочных экспериментов по измерению термодинамических характеристик плавления н-гептана, ртути, индия, олова, свинца, висмута и цинка. Аппаратура и методика измерений позволяли измерять температуры фазовых превращений с погрешностью ±0.5 K, энтальпий переходов – ±1%. Теплоемкость изученных фосфатов определяли методом отношений (“Ratio method” [13]). В качестве стандартного образца сравнения использовали корунд. Измерения проводили при средней скорости нагрева ампулы с веществом 5 град/мин в атмосфере аргона. Погрешность определения $C_{p}^{0}$ указанным методом не превышала ±2%.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Характеристика образцов. Полученные образцы Pb0.5 +xMgxZr2 –x(PO4)3 (x = 0, 0.5) представляют собой бесцветные поликристаллические порошки. Согласно данным порошковой рентгенографии, синтезированные фосфаты однофазны, кристаллизуются в структурном типе NZP и идентичны описанным в [6]. Их рентгенограммы проиндицированы в рамках пр. гр. $R\bar {3}$ (рис. 1, табл. 1, 2). Содержание примесей в изученных образцах не превышает предела обнаружения при данных условиях съемки рентгенограмм и их обработки методом Ритвельда (1%). Однородность образцов фосфатов Pb0.5 +xMgxZr2 –x(PO4)3 (x = 0, 0.5) подтверждена данными электронной микроскопии (рис. 2). Их химический состав, по данным микрозондового анализа, соответствует теоретическим значениям в пределах погрешности метода (табл. 3, 4).
Рис. 1.
Экспериментальные (1), вычисленные (2), разностные (3) и штрихрентгенограммы (4) фосфата Pb0.5Zr2(PO4)3 при температурах 173 (а), 473 K (б).
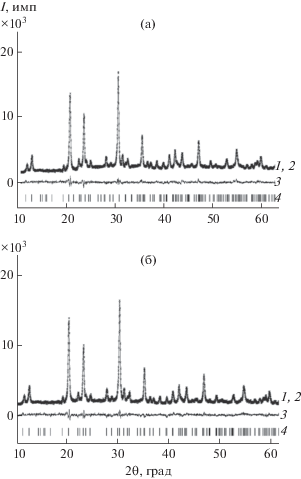
Таблица 1.
Условия съемки и результаты уточнения кристаллической структуры Pb0.5Zr2(PO4)3
| T, K | 173 | 473 |
|---|---|---|
| Пр. гр. | R$\bar {3}$ (№ 148) | |
| Z | 6 | |
| Интервал углов 2θ, град | 10−80 | |
| Параметры ячейки: | ||
| a, Å c, Å V, Å3 |
8.7009(4) 23.4822(11) 1539.57(13) |
8.6996(16) 23.479(3) 1538.9(4) |
| Число отражений | 295 | 301 |
| Число уточняемых параметров* | 23 + 28 | 23 + 28 |
| Факторы достоверности, %: | ||
| Rwp; Rp S |
3.47; 2.75 1.41 |
3.48; 2.75 1.39 |
Таблица 2.
Кристаллографические характеристики PbMg0.5Zr1.5(PO4)3 при 298.15 K
| a, Å | c, Å | V, Å3 |
|---|---|---|
| 8.6997(4) | 23.4591(8) | 1537.63(15) |
Таблица 3.
Результаты микрозондового анализа образца Pb0.5Zr2P3O12
| № точки | O | P | Zr | Pb |
|---|---|---|---|---|
| 1 | 12 | 3.02 | 2.06 | 0.52 |
| 2 | 12 | 2.94 | 2.05 | 0.48 |
| 3 | 12 | 2.97 | 1.95 | 0.54 |
| 4 | 12 | 2.96 | 2.06 | 0.53 |
| 5 | 12 | 2.99 | 2.08 | 0.5 |
| 6 | 12 | 3.04 | 2.03 | 0.54 |
| 7 | 12 | 3.03 | 1.98 | 0.52 |
| Средний состав | 12 | 3.03(4) | 2.03(4) | 0.52(2) |
Таблица 4.
Результаты микрозондового анализа образца PbMg0.5Zr1.5P3O12
| № точки | O | P | Mg | Zr | Pb |
|---|---|---|---|---|---|
| 1 | 12 | 3.06 | 0.48 | 1.54 | 0.97 |
| 2 | 12 | 2.95 | 0.49 | 1.53 | 1.03 |
| 3 | 12 | 3.03 | 0.47 | 1.49 | 1.03 |
| 4 | 12 | 2.98 | 0.53 | 1.53 | 0.97 |
| 5 | 12 | 3.05 | 0.5 | 1.48 | 1.01 |
| 6 | 12 | 3.04 | 0.47 | 1.54 | 0.97 |
| 7 | 12 | 2.99 | 0.51 | 1.51 | 0.98 |
| Средний состав | 12 | 3.02(4) | 0.49(2) | 1.52(2) | 0.99(3) |
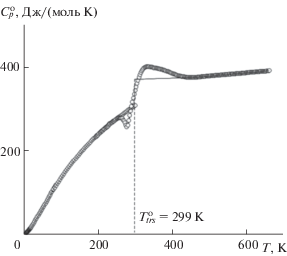
Температурная зависимость теплоемкости и полиморфные переходы. Теплоемкость фосфата Pb0.5Zr2(PO4)3 изучена с помощью адиабатической вакуумной (8–300 K, получено 110 экспериментальных значений $C_{p}^{0}$) и дифференциальной сканирующей калориметрии (195–660 K) (рис. 3). Экспериментальные значения $C_{p}^{0}$ сглаживали с помощью степенных и полулогарифмических полиномов так, чтобы среднеквадратичное отклонение экспериментальных точек от сглаженной кривой $C_{p}^{0}$ = f(T) не превышало погрешности измерений теплоемкости. Например, теплоемкость Pb0.5Zr2(PO4)3 можно описать зависимостями ($C_{p}^{0}$, Дж/(моль K)):
в интервале температур 8–20 K
в области 20–50 K
при 50–80 K
в интервале 80–150 K
и при 150–300 K
Все экспериментальные точки $C_{p}^{0}$ и сглаженная кривая для Pb0.5Zr2(PO4)3 приведены на рис. 3. Согласно данным ДСК, изученный фосфат претерпевает обратимый фазовый переход в интервале 256–426 K. По термодинамической классификации фазовых переходов Мак-Каллафа, его можно отнести к переходам G-типа. Отметим, что при измерениях теплоемкости этого же образца Pb0.5Zr2(PO4)3 в адиабатическом калориметре переход не проявляется вплоть до 300 K, что, вероятно, связано с его неравновесным характером (он не проявляется в условиях съемки, близких к равновесным).
Для изучения природы рассмотренного фазового превращения проведено структурное исследование Pb0.5Zr2(PO4)3 при температурах 173 и 473 K с помощью метода Ритвельда по данным порошковой рентгенографии (рис. 1, табл. 2). В качестве исходных данных для уточнения структуры при указанных температурах использовали координаты атомов в структуре фосфата Cu0.5Mn0.25Zr2(PO4)3 (NZP, пр. гр. R$\bar {3}$ [14]). Координаты атомов в уточненных моделях приведены в табл. 5.
Таблица 5.
Координаты атомов в структуре Pb0.5Zr2(PO4)3
| Атом/позиция | x | y | z | |||
|---|---|---|---|---|---|---|
| 173 K | 473 K | 173 K | 473 K | 173 K | 473 K | |
| Pb*/18f | 0.02(6) | –0.033 (26) | 0.00(12) | –0.034 (22) | 0.0044(11) | 0.0035(13) |
| Zr(1)/6с | 0 | 0 | 0 | 0 | 0.15061(18) | 0.15073(20) |
| Zr(2)/6с | 0 | 0 | 0 | 0 | 0.64726(17) | 0.64701(19) |
| P/18e | 0.2939(13) | 0.2996(13) | 0.0201(16) | 1.0237(15) | 0.2524(6) | 0.2455(6) |
| O(1)/18f | 0.1701(21) | 0.1655(23) | 0.9654(22) | 0.9585(26) | 0.1901(11) | 0.1927(10) |
| O(2)/18f | 0.073(3) | 0.1513(25) | 0.859(3) | 0.9306(23) | 0.7036(7) | 0.7024(8) |
| O(3)/18f | 0.193(3) | 0.2022(25) | 0.178(2) | 0.1516(22) | 0.0840(9) | 0.0980(8) |
| O(4)/18f | 0.8293(28) | 0.7999(26) | 0.7724(23) | 0.7733(27) | 0.6114(8) | 0.5936(8) |
Обе полиморфные модификации Pb0.5Zr2(PO4)3 относятся к NZP-типу структуры, и в обоих случаях уточнение проведено в рамках пр. гр. R$\bar {3},$ которая характеризуется расщеплением кристаллографических М1-позиций (6a) в полостях внутри колонок полиэдров на два типа неэквивалентных позиций (3a и 3b).
В структурах большинства NZP-соединений состава M0.5Zr2(PO4)3 [7] позиции одного типа (3a или 3b) заняты катионами М2+, а другой тип остается вакантным. При этом катионы М2+ характеризуются октаэдрическим окружением с шестью связями металл–кислород одинаковой длины. Однако в случае Pb0.5Zr2(PO4)3 катионы Pb2+, занимающие полости структуры, обладают стереоактивной 6s2-электронной парой, как правило, приводящей к искажению свинец-кислородных полиэдров [15, 16]. Степень их искажения в известных свинецсодержащих соединениях зависит от температуры и структурных особенностей веществ. Вследствие этого ионы Pb2+ смещены из центров октаэдрически координированных полостей (разупорядочены) и симметрия их позиций понижается до 18f.
Фрагмент кристаллической структуры Pb0.5Zr2(PO4)3 при 173 K представлен на рис. 4а. NZP-каркас этого соединения образован октаэдрами ZrO6 и тетраэдрами РО4. Фрагменты из двух октаэдров и трех тетраэдров формируют колонки вдоль кристаллографической оси с. Половина полостей внутри этих колонок занята ионами Pb2+, смещенными из центра полостей вследствие небольшого разупорядочения. Значения межатомных расстояний (табл. 6) в координационных полиэдрах, формирующих кристаллическую структуру изученного соединения при обеих температурах, согласуются с литературными данными для других фосфатов NZP-строения [6, 14].
Рис. 4.
Структура Pb0.5Zr2(PO4)3: фрагмент кристаллической структуры при 173 K (а) и искажение октаэдров PbO6 при 173 и 473 K (б).
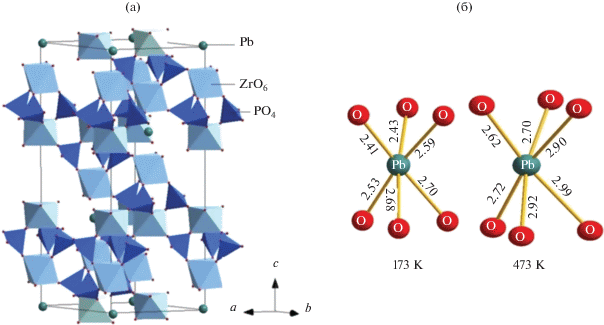
Таблица 6.
Основные межатомные расстояния в полиэдрах, образующих структуру Pb0.5Zr2(PO4)3
| Т = 173 K | Т = 473 K | ||
|---|---|---|---|
| связь | d, Å | связь | d, Å |
| Pb–O(3) | 2.41(3) | Pb–O(3) | 2.62(2) |
| Pb–O(3') | 2.43 (6) | Pb–O(3') | 2.70(5) |
| Pb–O(3'') | 2.53(4) | Pb–O(3'') | 2.72(8) |
| Pb–O(3''') | 2.59 (5) | Pb–O(3''') | 2.90(7) |
| Pb–O(3'''') | 2.68(6) | Pb–O(3'''') | 2.92(5) |
| Pb–O(3''''') | 2.70(3) | Pb–O(3''''') | 2.99(6) |
| Zr(1)–O(1) (×3) | 1.894(21) | Zr(1)–O(1) (×3) | 1.922(23) |
| Zr(1)–O(3) (×3) | 2.250 (19) | Zr(1)–O(3) (×3) | 2.012(17) |
| Zr(1)–O(4) (×3) | 1.974 (23) | Zr(1)–O(4) (×3) | 2.141(19) |
| Zr(1)–O(2) (×3) | 2.107 (27) | Zr(1)–O(2) (×3) | 2.252(19) |
| P–O(3) | 1.413(21) | P–O(3) | 1.426(17) |
| P–O(2) | 1.443(29) | P–O(2) | 1.436(12) |
| P–O(4) | 1.535 (26) | P–O(4) | 1.599(25) |
| P–O(1) | 1.636(27) | P–O(1) | 1.699(27) |
Результаты уточнения структуры Pb0.5Zr2(PO4)3 при 173 и 473 K показали, что с повышением температуры наблюдается увеличение степени разупорядочения катионов свинца, которое сопровождается бóльшим искажением октаэдров PbO6 (рис. 4б, табл. 6). Таким образом, полиморфные переходы на кривых теплоемкости изученных фосфатов обусловлены ростом позиционной разупорядоченности катионов свинца в полостях NZP-структуры.
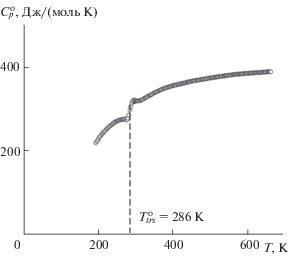
Температурная зависимость теплоемкости PbMg0.5Zr1.5(PO4)3 в области 195–660 K (рис. 5) имеет схожий характер с рассмотренной выше для Pb0.5Zr2(PO4)3. Для этого соединения также наблюдается полиморфный фазовый переход, однако он имеет место при более низких температурах (255–315 K), а скачок теплоемкости в этом интервале менее выражен. Такое термическое поведение PbMg0.5Zr1.5(PO4)3 можно объяснить тем, что в его структуре катионы Pb2+ полностью заселяют М1-полости внутри колонок каркасообразующих полиэдров, следовательно, возможности структурных деформаций за счет смещения этих ионов более ограничены.
Теплоемкость и термодинамические функции. За исключением областей переходов, теплоемкость фосфатов не имеет особенностей и плавно возрастает во всем изученном интервале температур. Для расчета термодинамических функций фосфата Pb0.5Zr2(PO4)3 температурную зависимость его теплоемкости экстраполировали к 0 K по функции Дебая: $C_{p}^{0}$ = nD(θD/T), где D – символ функции Дебая, n = 3, θD = 88.4 K – подобранные параметры. С указанными параметрами это уравнение описывает экспериментальные значения $C_{p}^{0}$ в области 8–12 K с погрешностью 2.4%. Полагали, что уравнение (2) воспроизводит значения $C_{p}^{0}$ при Т < 8 K с той же погрешностью.
Данные низкотемпературной (30–50 K) теплоемкости обработаны с учетом мультифрактальности колебательных состояний атомов [17, 18]. Значение фрактальной размерности D [19, 20] в мультифрактальной модели служит опосредованной характеристикой топологии строения твердых тел и позволяет судить о геометрическом характере структуры: в случае тел цепной структуры D = 1, слоистой – 2, пространственной – 3. Допуская без заметной погрешности, что при T < 50 K величина $C_{p}^{0}$ = $C_{V}^{0},$ и используя экспериментальные данные о теплоемкости, для изученного фосфата Pb0.5Zr2(PO4)3 получили значение D = 3 с погрешностью 1.0%, что соответствует пространственной (каркасной) структуре этого соединения.
Значения энтальпий [H 0(T) – H 0(0)] и энтропий S 0(T) для Pb0.5Zr2(PO4)3 рассчитывали численным интегрированием соответствующих зависимостей $C_{p}^{0}$ = f(T) и $C_{p}^{0}$ = f(ln T), функции Гиббса [G 0(T) – H0(0)] по энтальпиям и энтропиям соединений при соответствующих температурах. Сглаженные значения теплоемкости Pb0.5Zr2(PO4)3 вместе с его термодинамическими функциями приведены в табл. 7. Сглаженные с помощью полиномов значения теплоемкости PbMg0.5Zr1.5(PO4)3 даны в табл. 8.
Таблица 7.
Стандартные термодинамические функции кристаллического Pb0.5Zr2(PO4)3 (М = 570.957 г/моль, p0 = 0.1 МПа)
| Т, K | $C_{p}^{0}$, Дж/(моль K) | $\left[ {{{H}^{0}}\left( T \right) - {{H}^{0}}\left( 0 \right)} \right]$, кДж/моль | S0(T), Дж/(моль K) | $ - \left[ {{{G}^{0}}\left( T \right) - {{H}^{0}}\left( 0 \right)} \right]$, кДж/моль |
|---|---|---|---|---|
| Кристалл I | ||||
| 0 | 0 | 0 | 0 | 0 |
| 5 | 0.352 | 0.000400 | 0.117 | 0.000146 |
| 10 | 2.60 | 0.00680 | 0.910 | 0.00232 |
| 20 | 12.87 | 0.08060 | 5.611 | 0.03165 |
| 30 | 26.42 | 0.2743 | 13.28 | 0.1239 |
| 40 | 41.83 | 0.6154 | 22.99 | 0.3041 |
| 60 | 71.15 | 1.747 | 45.53 | 0.9847 |
| 80 | 103.5 | 3.492 | 70.41 | 2.140 |
| 100 | 129.5 | 5.822 | 96.29 | 3.807 |
| 120 | 154.7 | 8.668 | 122.2 | 5.992 |
| 140 | 177.4 | 11.99 | 147.7 | 8.692 |
| 160 | 198.2 | 15.75 | 172.8 | 11.90 |
| 180 | 217.2 | 19.91 | 197.3 | 15.60 |
| 200 | 234.7 | 24.43 | 221.1 | 19.78 |
| 220 | 250.8 | 29.29 | 244.2 | 24.44 |
| 240 | 265.9 | 34.46 | 266.7 | 29.55 |
| 260 | 278.3 | 39.89 | 288.4 | 35.10 |
| 280 | 291.4 | 45.59 | 309.5 | 41.08 |
| 298.15 | 303.4 | 50.99 | 328.2 | 46.87 |
| 299 | 303.9 | 51.24 | 329.1 | 47.15 |
| Кристалл II | ||||
| 299 | 367.7 | 51.24 | 329.1 | 47.15 |
| 300 | 368 | 51.6 | 330 | 47.5 |
| 320 | 368 | 59.0 | 354 | 54.3 |
| 340 | 369 | 66.3 | 376 | 61.6 |
| 360 | 369 | 73.7 | 397 | 69.4 |
| 380 | 370 | 81.1 | 417 | 77.5 |
| 400 | 370 | 88.5 | 436 | 86.1 |
| 420 | 371 | 95.9 | 455 | 95.0 |
| 440 | 372 | 103 | 472 | 104 |
| 460 | 372 | 111 | 488 | 114 |
| 480 | 374 | 118 | 504 | 124 |
| 500 | 375 | 126 | 520 | 134 |
| 520 | 377 | 133 | 534 | 145 |
| 540 | 379 | 141 | 549 | 155 |
| 560 | 380 | 148 | 562 | 166 |
| 580 | 382 | 156 | 576 | 178 |
| 600 | 383 | 164 | 589 | 190 |
| 620 | 385 | 171 | 601 | 201 |
| 640 | 386 | 179 | 613 | 214 |
| 660 | 388 | 187 | 625 | 226 |
Таблица 8.
Сглаженные с помощью полиномов значения теплоемкости кристаллического PbMg0.5Zr1.5(PO4)3 (М = = 641.098 г/моль, p0 = 0.1 МПа)
| Т, K | $C_{p}^{0}$, Дж/(моль K) | Т, K | $C_{p}^{0}$, Дж/(моль K) |
|---|---|---|---|
| Кристалл I | 380 | 347 | |
| 195 | 214 | 400 | 353 |
| 200 | 222 | 420 | 357 |
| 220 | 245 | 440 | 361 |
| 240 | 261 | 460 | 365 |
| 260 | 272 | 480 | 369 |
| 280 | 280 | 500 | 371 |
| 286 | 282 | 520 | 374 |
| Кристалл II | 540 | 377 | |
| 286 | 307 | 560 | 379 |
| 298.15 | 312 | 580 | 381 |
| 300 | 312 | 600 | 383 |
| 320 | 321 | 620 | 384 |
| 340 | 330 | 640 | 385 |
| 360 | 340 | 660 | 386 |
Теплоемкость изученных фосфатов при высоких температурах приближается к значениям, оцененным по правилу Дюлонга и Пти: $C_{p}^{0}$ = = 3RN, где R – универсальная газовая постоянная, N – число атомов в формульной единице. Рассчитанные и экспериментальные (при 660 K) значения теплоемкости составили 436.5 и 387.8 Дж/(моль K) для Pb0.5Zr2(PO4)3, 449.0 и 416 Дж/(моль K) для PbMg0.5Zr1.5(PO4)3.
По величинам абсолютных энтропий кристаллического фосфата S0(Pb0.5Zr2(PO4)3, к, 298.15 К) = = 328.2 ± 1.0 Дж/(моль K) (табл. 7) и соответствующих простых веществ [21, 22]: S0(Pb, к, 298.15 К) = = 64.80 ± 0.30 Дж/(моль K), S0(Zr, к, 298.15 К) = = 38.994 ± 0.167 Дж/(моль K), S0(P, к, 298.15 К) = = 41.09 ± 0.25 Дж/(моль K), S0(O2, г, 298.15 К) = = 205.152 ± 0.005 Дж/(моль K) рассчитали стандартную энтропию образования изученного соединения Δf S0(Pb0.5Zr2(PO4)3, к, 298.15 К) = –1136.4 ± ± 1.3 Дж/(моль K). Полученная величина соответствует процессу:
0.5Pb(к) + 2Zr(к) + 3P(к, белый) + 6О2(г) = = Pb0.5Zr2(PO4)3 (к).
ЗАКЛЮЧЕНИЕ
Золь-гель методом синтезированы кристаллические фосфаты Pb0.5Zr2(PO4)3 и PbMg0.5Zr1.5(PO4)3 структурного типа NZP. Впервые изучена изобарная теплоемкость Pb0.5Zr2(PO4)3 в температурном интервале 8−660 K и PbMg0.5Zr1.5(PO4)3 в области 195−660 K. На кривых температурной зависимости теплоемкости обоих фосфатов обнаружены фазовые переходы G-типа. По результатам структурного исследования Pb0.5Zr2(PO4)3 при 173 и 473 K установлено, что эти полиморфные переходы обусловлены ростом позиционной разупорядоченности катионов свинца в полостях NZP-структуры. Рассчитаны термодинамические функции Pb0.5Zr2(PO4)3 в диапазоне от Т → 0 до 660 K, определена стандартная энтропия его образования из простых веществ при 298.15 K. По низкотемпературной теплоемкости рассчитана фрактальная размерность Pb0.5Zr2(PO4)3 и сделано заключение о применимости этой модели для каркасных NZP-соединений.
Список литературы
Kimpa M.I., Mayzan M.Z.H., Yabagi J.A. et al. // IOP Conf. Series: Earth and Environmental Science. 2018. V. 140. P. 012156. https://doi.org/10.1088/1755-1315/140/1/012156
Small L., Wheeler J., Ihlefeld J. et al. // J. Mater. Chem. A. 2018. V. 6. P. 9691. https://doi.org/10.1039/C7TA09924J
Pet’kov V.I. // Russ. Chem. Rev. 2012. V. 81. P. 606. [Петьков В.И. // Успехи химии. 2012. Т. 81. С. 606.]https://doi.org/10.1070/RC2012v081n07ABEH004243
Scheetz B.E., Agrawal D.K., Breval E., Roy R. // Waste Management. 1994. V. 14. P. 489.
Pet’kov V., Asabina E., Loshkarev V., Sukhanov M. // J. Nucl. Mater. 2016. V. 471. P. 122. https://doi.org/10.1016/j.jnucmat.2016.01.016
Asabina E., Pet’kov V., Mayorov P. et al. // Pure Appl. Chem. 2017. V. 89. P. 523. https://doi.org/10.1515/pac-2016-1005
Pet’kov V.I., Kurazhkovskaya V.S., Orlova A.I., Spiridonova M.L. // Crystallogr. Rep. 2002. V. 47. P. 736. [Петьков В.И., Куражковская В.С., Орлова А.И., Спиридонова М.Л. // Кристаллография. 2002. Т. 47. С. 802.]https://doi.org/10.1134/1.1509386
Rietveld H.M. // Acta Crystallogr. 1967. V. 22. P. 151.
Kim Y.I., Izumi F. // J. Ceram. Soc. Jpn. 1994. V. 102. P. 401.
Малышев В.М., Мильнер Г.А., Сорокин Е.Л. и др. // Приборы и техника эксперимента. 1985. Т. 6. С. 195.
Varushchenko R.M., Druzhinina A.I., Sorkin E.L. // J. Chem. Thermodyn. 1997. V. 29. P. 623.
Hohne G.W.H., Hemminger W.F., Flammersheim H.F. Differential scanning calorimetry. Springer-Verlag Berlin Heidelberg, 2003. 299 p.
Drebushchak V.A. // J. Therm. Anal. Cal. 2005. V. 79. № 1. P. 213.
Mouline A., Alami M., Brochu R. et al. // J. Solid State Chem. 2000. V. 152. P. 453. https://doi.org/10.1006/jssc.2000.8711
Larregola S.A., Alonso J.A., Pedregosa J.C. et al. // Dalton Trans. 2009. Iss. 28. P. 5453. https://doi.org/10.1039/B821688F
Larregola S.A., Alonso J.A., Alguero M. et al. // Dalton Trans. 2010. V. 39. Iss. 21. P. 5159. https://doi.org/10.1039/C0DT00079E
Якубов Т.С. // Докл. АН СССР. 1990. Т. 310. С. 145.
Изотов А.Д., Шебершнева О.В., Гавричев К.С. // Тр. Всерос. конф. по термическому анализу и калориметрии. Казань, 1996. С. 200.
Тарасов В.В. // Журн. физ. химии. 1950. Т. 24. № 1. С. 111.
Тарасов В.В., Юницкий Г.А. // Журн. физ. химии. 1965. Т. 39. № 8. С. 2077.
CODATA key values for thermodynamics / Eds. Cox J.D., Wagman D.D., Medvedev V.A.. N.Y., 1984.
Термические константы веществ / Под ред. Глушко В.П. М.: Наука, 1965–1981.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии