Журнал неорганической химии, 2020, T. 65, № 5, стр. 711-716
Термодинамические свойства фаз и фазовые равновесия в системе H2O–HNO3–UO2(NO3)2–Th(NO3)4
А. С. Малютин a, *, Н. А. Коваленко a, И. А. Успенская a
a Московский государственный университет им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
* E-mail: maliutin@td.chem.msu.ru
Поступила в редакцию 18.11.2019
После доработки 18.12.2019
Принята к публикации 24.12.2019
Аннотация
Получен набор параметров модели Питцера, адекватно описывающий термодинамические свойства раствора в системе H2O–UO2(NO3)2–Th(NO3)4–HNO3 при 25°С и воспроизводящий термодинамические свойства жидкой фазы в подсистеме H2O–Th(NO3)4–HNO3 в температурном интервале 25–50°С. Рассчитаны параметры стабильности кристаллогидратов Th(NO3)4 · 6H2O и UO2(NO3)2 · 3H2O, позволяющие предсказывать растворимость этих соединений в указанных растворах в широком диапазоне концентраций.
ВВЕДЕНИЕ
Система H2O–UO2(NO3)2–Th(NO3)4–HNO3 представляет интерес во многих аспектах, в частности, сведения о термодинамических свойствах составляющих ее фаз необходимы для разработки новых и оптимизации существующих процессов выделения соединений урана и тория из различных смесей, в которых присутствие указанных радиоактивных элементов нежелательно. Примером может служить фосфогипс, радиоактивность которого обусловлена наличием в составе соединений урана и тория, что препятствует его широкому применению в аграрном секторе и производстве строительных материалов [1].
При разработке способов выделения и разделения составляющих многокомпонентных систем удобным инструментом решения задачи является термодинамическое моделирование. Полноценных термодинамических моделей фаз системы H2O–UO2(NO3)2–Th(NO3)4–HNO3 в литературе найти не удалось. В связи с этим целью настоящей работы стало получение набора параметров модели Питцера, позволяющих рассчитать термодинамические свойства фаз и фазовые равновесия в указанной системе при 25°С и атмосферном давлении. Этапом параметризации четырехкомпонентной системы H2O–UO2(NO3)2–Th(NO3)4–HNO3 является построение моделей трехкомпонентных систем: представленное в данной работе описание подсистемы H2O–Th(NO3)4–HNO3 в температурном интервале 25–50°С при атмосферном давлении и полученное нами ранее описание подсистемы H2O–UO2(NO3)2–HNO3 [2].
РАСЧЕТНАЯ ЧАСТЬ
Описание свойств жидкой фазы. Для описания термодинамических свойств растворов нитратов урана и тория использовали модель Питцера. Вид избыточной энергии Гиббса раствора, выражения для коэффициентов активности составляющих, а также возможности и ограничения этой модели подробно рассмотрены в работах [3, 4].
Описание свойств твердых фаз. Термодинамические свойства твердых фаз (в исследуемых системах таковыми являются кристаллогидраты нитратов тория и уранила) представлены в виде параметров стабильности – величин, характеризующих изменение термодинамических свойств веществ при переходе из кристаллической фазы в раствор. Для этого были рассмотрены реакции вида:
(1)
${{{\text{M}}}_{m}}{{{\text{X}}}_{n}} \cdot k{{{\text{H}}}_{2}}{{{\text{O}}}_{{\left( s \right)}}} \Leftrightarrow m{\text{M}}_{{\left( {aq} \right)}}^{{n + }} + n{\text{X}}_{{\left( {aq} \right)}}^{{m - }} + k{{{\text{H}}}_{2}}{{{\text{O}}}_{{\left( {aq} \right)}}}.$Соответствующие им константы равновесия
(2)
${{K}_{r}} = {{\left( {{{m}_{{\text{M}}}}} \right)}^{m}}{{\left( {{{m}_{{\text{X}}}}} \right)}^{n}}{{\left( {{{\gamma }_{{ \pm ,{{{\text{M}}}_{m}}{{{\text{X}}}_{n}}}}}} \right)}^{{m + n}}}a_{{{{{\text{H}}}_{2}}{\text{O}}}}^{k}$Построение модели многокомпонентной системы. Согласно “принципу пирамиды CALPHAD” [5], для построения термодинамической модели многокомпонентной системы необходимо сначала построить термодинамические модели ее подсистем, начиная с бинарных. Таким образом, для получения модели жидкой фазы системы H2O–Th(NO3)4–HNO3 следует иметь модели растворов H2O–HNO3 и H2O–Th(NO3)4, а для построения модели жидкости в системе H2O‒HNO3–UO2(NO3)2–Th(NO3)4 следует располагать термодинамическими моделями фаз систем H2O–Th(NO3)4–HNO3 и H2O–UO2(NO3)2–HNO3. Данный подход был реализован в настоящей работе, однако бинарная система H2O–Th(NO3)4 описывалась не отдельно, а в составе трехкомпонентной системы H2O–Th(NO3)4–HNO3 вследствие ограниченного количества литературных данных. Системы H2O–HNO3 и H2O–UO2(NO3)2–HNO3 были описаны ранее в работе [2].
Процедура параметризации модели заключается в подборе таких значений ее параметров, при которых рассчитанные значения термодинамических свойств системы отличаются от экспериментальных в пределах погрешностей их измерения. В настоящей работе для определения параметров использовали метод наименьших квадратов: оптимальными значениями параметров считались те, при которых целевая функция OF вида:
(4)
$OF = \sum\limits_Y {\sum\limits_i {{{w}_{i}}{{{\left( {Y_{i}^{{{\text{exp}}}} - Y_{i}^{{calc}}\left( {{{Q}_{1}}, \ldots ,{{Q}_{k}}} \right)} \right)}}^{2}}} } $Оптимизируемыми параметрами Q являлись параметры модели Питцера ${{P}_{{sol}}}$ и константы ${{K}_{r}}.$ В общем случае эти величины зависят от температуры, поэтому параметры модели Питцера представляли в виде линейной функции от абсолютной температуры T, а логарифмы константы ${{K}_{r}}$ – от обратной температуры 1/T:
где a, b, c, d – коэффициенты температурной зависимости.Литературными данными, на основе которых проводили параметризацию модели, служили осмотические коэффициенты при различных температурах, а также давление насыщенного пара воды над растворами разного состава при различных температурах и растворимость солей.
Более подробно литературные данные рассмотрены в разделе “Результаты и обсуждение”.
Параметризацию модели проводили в среде программирования MATLAB. При этом использовали имплементацию модели Питцера, разработанную сотрудником лаборатории химической термодинамики А.Л. Восковым.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Обзор экспериментальных данных
Система H2O–Th(NO3)4. Авторы [6] приводят значения осмотических коэффициентов водного раствора нитрата тория, полученные изопиестическим методом, в диапазоне концентраций 0–5.2 моль/кг (25°C). В работах [7, 8] авторы использовали метод осмометрии и метод давления насыщенного пара. Измерения проводили в более узком интервале концентраций (<2 моль/кг в работе [8] и <0.25 моль/кг в работе [7]) и при различных температурах: 25, 35, 37, 45 и 50°С.
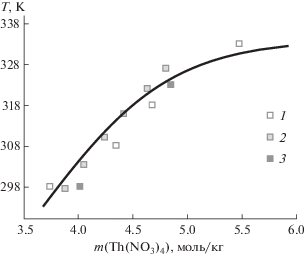
Сведения о растворимости нитрата тория в воде представлены в работах [9, 10]. Авторы [9] приводят диаграмму состояния системы H2O–Th(NO3)4 в температурном интервале 20–200°С, в [10] дана эмпирическая зависимость растворимости гексагидрата нитрата тория от температуры в диапазоне 20–60°С. Можно сказать, что данные этих статей дополняют друг друга. Несмотря на то, что они слабо согласуются между собой, их совокупность образует некоторый коридор значений, в который попадают значения растворимости гексагидрата нитрата тория, полученные другими авторами при исследовании системы H2O–Th(NO3)4–HNO3. В работе [9] в качестве стабильной твердой фазы при температуре 111–150°С указан тетрагидрат нитрата тория. Авторы [10] приводят температуры замерзания разбавленных растворов нитрата тория и значения pH растворов до концентрации 1 М при температурах 25, 35, 45 и 60°С.
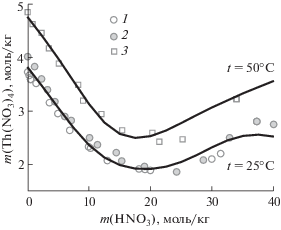
Система H2O–Th(NO3)4–HNO3. Термодинамические свойства растворов системы H2O‒Th(NO3)4–HNO3 изучены в [11, 12]. Работы выполнены одним и тем же коллективом авторов и идентичны по методологии исследования, однако полученные данные относятся к разным температурам: 25 [11] и 50°С [12]. В этих работах авторы определяли парциальные давления паров воды и азотной кислоты над растворами системы H2O–Th(NO3)4–HNO3 методом переноса, причем диапазон концентраций нитрата тория составлял 0–2.5 моль/кг, а азотной кислоты – 0–25 моль/кг. Дополнительно в работе [12] представлены данные по давлению насыщенного пара воды в бинарной системе H2O–Th(NO3)4.
Данные о равновесиях кристаллическая фаза–раствор в тройной системе H2O–Th(NO3)4–HNO3 представлены в работах [13, 14]. В указанных работах приведены почти полные изотермические сечения фазовой диаграммы исследуемой системы при 25°С (в работе [14] также при 50°С). Разночтения связаны с составом твердой фазы, сосуществующей с раствором. Авторы [14] сами указали на эти разночтения и привели разумные аргументы, подтверждающие надежность полученных ими данных. Согласно [14], в диапазоне концентраций 0–4 моль/кг Th(NO3)4 и 0–50 моль/кг HNO3 стабильными твердыми фазами должны быть гекса- и тетрагидрат нитрата тория.
В работе [15] представлены теплоты разбавления растворов нитрата тория. В ходе эксперимента к исследуемым растворам добавляли небольшое количество азотной кислоты для подавления гидролиза иона Th4+, поэтому, строго говоря, полученные данные следует относить к тройной системе H2O–Th(NO3)4–HNO3. Верхняя граница диапазона исследованных концентраций нитрата тория составила ∼0.01 моль/кг, температура – 25°С. В статье [16] приведены теплоты разбавления раствора нитрата тория при 30°С.
Система H2O–UO2(NO3)2–Th(NO3)4–HNO3. Набор кривых растворимости для системы H2O‒UO2(NO3)2–Th(NO3)4–HNO3 при 25°С получен в работе [17]. Согласно [17], в указанной системе при комнатной температуре есть область сосуществования раствора и твердого тригидрата нитрата уранила, которая не наблюдалась в тройной системе H2O–UO2(NO3)2–HNO3. Этот факт косвенно свидетельствует о сильном взаимном влиянии ионов ${\text{UO}}_{{\text{2}}}^{{{\text{2}} + }}$ и Th4+. Также в работе приведены составы газовой фазы, находящейся в равновесии с жидким раствором при температуре его кипения.
Данные, не использованные при параметризации. При параметризации модели в рамках настоящей работы использовали все указанные выше данные, за исключением температуры замерзания разбавленных водных растворов нитрата тория [10]; значений pH водных растворов нитрата тория [10]; теплот разбавления азотнокислых растворов нитрата тория [15, 16]; данных о составе газовой фазы в системе H2O–UO2(NO3)2–Th(NO3)4–HNO3 [17].
Отказ от включения в параметризацию данных о температуре замерзания растворов нитрата тория объясняется тем, что взятая за основу модель системы H2O–HNO3 в настоящей работе параметризована для температур выше 15°С. Модель Питцера является полиномиальной, поэтому нельзя гарантировать ее корректное поведение за пределами области определения параметров. Кроме того, в настоящей работе изначально не ставилась задача описать поведение систем при низких температурах.
Данные о pH были исключены из рассмотрения по причинам, аналогичным описанным в работе [2]; введение гидролитических равновесий сильно осложняет модель, но не приводит к выигрышу в точности предсказания термодинамических свойств.
Учесть теплоты разбавления, представленные в работе [15], в рамках настоящего исследования невозможно, так как отсутствуют сведения о плотности жидкой фазы. Без этого нельзя корректно перейти от шкалы молярных концентраций к шкале моляльностей, используемой в модели Питцера. Отсутствие полной информации об условиях проведения эксперимента стало причиной исключения данных о составе газовой фазы в системе H2O–UO2(NO3)2–Th(NO3)4–HNO3 [17]. В этой работе приведены составы газовой смеси, образующейся при кипении раствора при атмосферном давлении, но при этом температуры кипения не указаны.
Параметры модели Питцера для растворов нитратов урана и тория. Как отмечалось ранее, в литературе отсутствуют полноценные модели системы H2O–UO2(NO3)2–Th(NO3)4–HNO3, однако в литературе можно найти три набора параметров модели Питцера для пары ионов Th4+/N${\text{O}}_{3}^{ - }$ при комнатной температуре. Все они определены в рамках исследования применимости модели Питцера при решении различных практических задач. Первый набор параметров получен научной группой самого Питцера [18], второй – Кимом с соавторами [19], третий – авторами [20]. Все три набора параметров определены с использованием данных [6], поэтому их можно применять только для предсказания термодинамических свойств водных растворов нитрата тория при комнатной температуре при концентрациях раствора, не превышающих 5.2 моль/кг.
Для систем H2O–Th(NO3)4–HNO3 и H2O‒UO2(NO3)2–Th(NO3)4–HNO3 в работах [14, 17] предложены эмпирические уравнения, связывающие концентрации компонентов жидкого раствора вдоль поверхностей растворимости той или иной твердой фазы. Эти уравнения не являются термодинамическими моделями, они представляют собой формально-математическое описание равновесий раствор–осадок в указанных системах.
Результаты параметризации. При описании раствора в системе H2O–UO2(NO3)2–Th(NO3)4–HNO3 и ее подсистемах в качестве составляющих выбраны частицы H2O, H+, ${\text{UO}}_{{\text{2}}}^{{{\text{2}} + }},$ Th4+, ${\text{NO}}_{{\text{3}}}^{--},$ HNO3. Такой набор означает, что модель учитывает неполноту диссоциации азотной кислоты, но не учитывает гидратацию ионов Th4+ и ${\text{UO}}_{{\text{2}}}^{{{\text{2}} + }}.$ Параметры взаимодействия Питцера для подсистем H2O–HNO3 и H2O–UO2(NO3)2–HNO3 взяты непосредственно из работы [2]. Параметры модели, полученные в рамках настоящей работы, представлены в табл. 1.
Таблица 1.
Параметры модели Питцера и параметры ln Kr, определенные в ходе настоящей работы
| Параметр ${{P}_{{sol}}}$ | a | b |
|---|---|---|
| Система H2O–Th(NO3)4–HNO3 | ||
| ${\beta }_{{{\text{T}}{{{\text{h}}}^{{4 + }}}/{\text{NO}}_{3}^{ - }}}^{{\left( 0 \right)}}$ | –4.9514 × 100 | 1.4405 × 10–2 |
| ${\beta }_{{{\text{T}}{{{\text{h}}}^{{4 + }}}/{\text{NO}}_{3}^{ - }}}^{{\left( 1 \right)}}$ | –1.3074 × 102 | 4.3318 × 10–1 |
| ${\beta }_{{{\text{T}}{{{\text{h}}}^{{4 + }}}/{\text{NO}}_{3}^{ - }}}^{{\left( 2 \right)}}$ | 1.0959 × 101 | –2.9596 × 10–2 |
| ${\text{C}}_{{{\text{T}}{{{\text{h}}}^{{4 + }}}/{\text{NO}}_{3}^{ - }}}^{{\left( 0 \right)}}$ | 6.3624 × 10–2 | –1.9096 × 10–4 |
| ${{{\varphi }}_{{{\text{T}}{{{\text{h}}}^{{4 + }}}/{{{\text{H}}}^{ + }}}}}$ | 4.6062 × 100 | –1.3548 × 10–2 |
| ${{\psi }_{{{\text{T}}{{{\text{h}}}^{{4 + }}}/{{{\text{H}}}^{ + }}/{\text{NO}}_{3}^{ - }}}}$ | –6.7207 × 10–1 | 2.0716 × 10–3 |
| ${{{\lambda }}_{{{\text{T}}{{{\text{h}}}^{{4 + }}}/{\text{HN}}{{{\text{O}}}_{3}}}}}$ | 1.6560 × 100 | –6.6172 × 10–4 |
| α1 | 1.3 | 0 |
| α2 | 0.17 | 0 |
| Система H2O–UO2(NO3)2–Th(NO3)4–HNO3 | ||
| ${{{\varphi }}_{{{\text{T}}{{{\text{h}}}^{{4 + }}}/{\text{UO}}_{2}^{{2 + }}}}}$ | 3.2643 × 10–1 | 0 |
| ${{\psi }_{{{\text{T}}{{{\text{h}}}^{{4 + }}}/{\text{UO}}_{2}^{{2 + }}/{\text{NO}}_{3}^{ - }}}}$ | 1.3715 × 10–1 | 0 |
| Параметр $\ln {{K}_{r}}$ | ||
| Твердая фаза | c | d |
| Th(NO3)4 · 6H2O | 7.78452 × 101 | –2.34241 × 104 |
| UO2(NO3)2 · 3H2O | 8.61067 × 101 (для t = 25°C) | |
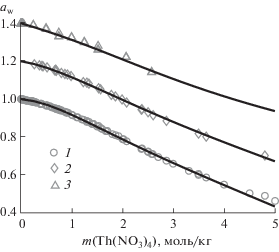
Полученное нами термодинамическое описание системы H2O–Th(NO3)4–HNO3 показывает хорошее согласие с литературными данными в температурном интервале 25–50°С и диапазоне концентраций 0–5 моль/кг Th(NO3)4 и 0–40 моль/кг HNO3 (рис. 1–3). На рис. 1 сопоставлены экспериментальные и рассчитанные активности воды в системе H2O–Th(NO3)4 при 25, 35 и 50°С; на рис. 2 сравниваются литературные данные и рассчитанная растворимость гексагидрата нитрата тория в воде при различных температурах; на рис. 3 показаны фрагменты изотермических сечений фазовой диаграммы системы H2O–Th(NO3)4–HNO3. Активность воды в азотнокислых растворах нитрата тория также воспроизводится достаточно хорошо. При 25°С среднее отклонение рассчитанных значений a(H2O) от приведенных в работе [11] составило 0.0106, максимальное – 0.0364 (86 точек). При температуре 50°С эти величины равны 0.0085 и 0.0261 (48 точек, источник данных – работа [12]).
Рис. 1.
Зависимость активности воды в водном растворе нитрата тория от концентрации при различных температурах. Символы – литературные данные (1 – 25 [6, 8], 2 – 35 [8], 3 – 50°С [7, 8, 12]), сплошная линия – расчет. Для наглядности каждый следующий график (t ≥ 35°C) поднят относительно предыдущего на 0.2 единицы.
Согласно литературным данным, в тройной системе H2O–Th(NO3)4–HNO3 при температуре 25–50°С в диапазоне концентраций 0–5 моль/кг Th(NO3)4 и 0–40 моль/кг HNO3 с раствором может стабильно сосуществовать только одна твердая фаза – Th(NO3)4 · 6H2O. Появление других гидратов нитрата тория в данном температурном интервале следует ожидать в областях с более высокой концентрацией азотной кислоты – за пределами границ применимости параметров Питцера для бинарной системы H2O–HNO3. В связи с этим для тройной системы H2O–Th(NO3)4–HNO3 был определен только один параметр стабильности, соответствующий гексагидрату нитрата тория.
Четырехкомпонентная система H2O–UO2(NO3)2–Th(NO3)4–HNO3 исследована только при комнатной температуре, поэтому ее описание также получено для одной температуры (25°C). Первоначальная попытка описать систему с помощью наборов параметров только тройных подсистем H2O–Th(NO3)4–HNO3 и H2O–UO2(NO3)2–HNO3 оказалась неудачной, поэтому потребовалось ввести дополнительные параметры взаимодействия: ${{{\varphi }}_{{{{{\text{T}}{{{\text{h}}}^{{4 + }}}} \mathord{\left/ {\vphantom {{{\text{T}}{{{\text{h}}}^{{4 + }}}} {{\text{UO}}_{2}^{{2 + }}}}} \right. \kern-0em} {{\text{UO}}_{2}^{{2 + }}}}}}}$ и ${{\psi }_{{{{{{{\text{T}}{{{\text{h}}}^{{4 + }}}} \mathord{\left/ {\vphantom {{{\text{T}}{{{\text{h}}}^{{4 + }}}} {{\text{UO}}_{2}^{{2 + }}}}} \right. \kern-0em} {{\text{UO}}_{2}^{{2 + }}}}} \mathord{\left/ {\vphantom {{{{{\text{T}}{{{\text{h}}}^{{4 + }}}} \mathord{\left/ {\vphantom {{{\text{T}}{{{\text{h}}}^{{4 + }}}} {{\text{UO}}_{2}^{{2 + }}}}} \right. \kern-0em} {{\text{UO}}_{2}^{{2 + }}}}} {{\text{NO}}_{3}^{ - }}}} \right. \kern-0em} {{\text{NO}}_{3}^{ - }}}}}}.$ Насколько улучшилось описание системы после их введения, можно увидеть из данных табл. 2. Полученный результат можно рассматривать как одно из подтверждений высказанной ранее гипотезы о сильном взаимном влиянии ионов ${\text{UO}}_{{\text{2}}}^{{{\text{2}} + }}$ и Th4+.
Таблица 2.
Общие характеристики результатов расчета равновесий кристаллическая фаза–раствор в системе H2O–UO2(NO3)2–Th(NO3)4–HNO3 при 25°С
| Поверхность кристаллизации фазы A · nH2O | Отклонение экспериментально измеренной растворимости кристаллогидрата от расчетного значения | |||
|---|---|---|---|---|
| вариантa | вариантb | |||
| cреднее значение δc, моль/кг | наибольшее значение δ, моль/кг | среднее значение δ, моль/кг | наибольшее значение δ, моль/кг | |
| UO2(NO3)2 · 6H2Od | 1.54 | 6.09 | 0.24 | 0.66 |
| UO2(NO3)2 · 3H2Od | 6.79 | 8.68 | 0.35 | 0.75 |
| Th(NO3)4 · 6H2Oe | 0.56 | 1.31 | 0.18 | 0.53 |
a Для расчета фазовых равновесий использовали только параметры модели, полученные при обработке экспериментальных данных систем с меньшим числом компонентов, параметры ${{\varphi }_{{{{{\text{T}}{{{\text{h}}}^{{4 + }}}} \mathord{\left/ {\vphantom {{{\text{T}}{{{\text{h}}}^{{4 + }}}} {{\text{UO}}_{2}^{{2 + }}}}} \right. \kern-0em} {{\text{UO}}_{2}^{{2 + }}}}}}}$ и ${{\psi }_{{{{{{{\text{T}}{{{\text{h}}}^{{4 + }}}} \mathord{\left/ {\vphantom {{{\text{T}}{{{\text{h}}}^{{4 + }}}} {{\text{UO}}_{2}^{{2 + }}}}} \right. \kern-0em} {{\text{UO}}_{2}^{{2 + }}}}} \mathord{\left/ {\vphantom {{{{{\text{T}}{{{\text{h}}}^{{4 + }}}} \mathord{\left/ {\vphantom {{{\text{T}}{{{\text{h}}}^{{4 + }}}} {{\text{UO}}_{2}^{{2 + }}}}} \right. \kern-0em} {{\text{UO}}_{2}^{{2 + }}}}} {{\text{NO}}_{3}^{ - }}}} \right. \kern-0em} {{\text{NO}}_{3}^{ - }}}}}}$ не использовали. bДля расчета фазовых равновесий использованы также параметры ${{\varphi }_{{{{{\text{T}}{{{\text{h}}}^{{4 + }}}} \mathord{\left/ {\vphantom {{{\text{T}}{{{\text{h}}}^{{4 + }}}} {{\text{UO}}_{2}^{{2 + }}}}} \right. \kern-0em} {{\text{UO}}_{2}^{{2 + }}}}}}}$ и ${{\psi }_{{{{{{{\text{T}}{{{\text{h}}}^{{4 + }}}} \mathord{\left/ {\vphantom {{{\text{T}}{{{\text{h}}}^{{4 + }}}} {{\text{UO}}_{2}^{{2 + }}}}} \right. \kern-0em} {{\text{UO}}_{2}^{{2 + }}}}} \mathord{\left/ {\vphantom {{{{{\text{T}}{{{\text{h}}}^{{4 + }}}} \mathord{\left/ {\vphantom {{{\text{T}}{{{\text{h}}}^{{4 + }}}} {{\text{UO}}_{2}^{{2 + }}}}} \right. \kern-0em} {{\text{UO}}_{2}^{{2 + }}}}} {{\text{NO}}_{3}^{ - }}}} \right. \kern-0em} {{\text{NO}}_{3}^{ - }}}}}}.$ сδ – абсолютные отклонения экспериментальных и расчетных значений растворимости. При расчете растворимости находили равновесную концентрацию одного из компонентов при фиксированных значениях двух других. В случае d варьировали концентрацию нитрата тория, в случае e – нитрата уранила.
Выше отмечалось, что при увеличении концентрации азотной кислоты в системе H2O–UO2(NO3)2–Th(NO3)4–HNO3 появляется область устойчивости тригидрата нитрата уранила UO2(NO3)2 · 3H2O, поэтому при построении модели четырехкомпонентной системы потребовалось оптимизировать соответствующий параметр стабильности. Указанная твердая фаза присутствует также в трехкомпонентной системе H2O–UO2(NO3)2–HNO3. В связи с этим для определения значения lnKr были использованы параметры модели Питцера из работы [2]. При последующей оптимизации параметров ${{\varphi }_{{{{{\text{T}}{{{\text{h}}}^{{4 + }}}} \mathord{\left/ {\vphantom {{{\text{T}}{{{\text{h}}}^{{4 + }}}} {{\text{UO}}_{2}^{{2 + }}}}} \right. \kern-0em} {{\text{UO}}_{2}^{{2 + }}}}}}}$ и ${{\psi }_{{{{{{{\text{T}}{{{\text{h}}}^{{4 + }}}} \mathord{\left/ {\vphantom {{{\text{T}}{{{\text{h}}}^{{4 + }}}} {{\text{UO}}_{2}^{{2 + }}}}} \right. \kern-0em} {{\text{UO}}_{2}^{{2 + }}}}} \mathord{\left/ {\vphantom {{{{{\text{T}}{{{\text{h}}}^{{4 + }}}} \mathord{\left/ {\vphantom {{{\text{T}}{{{\text{h}}}^{{4 + }}}} {{\text{UO}}_{2}^{{2 + }}}}} \right. \kern-0em} {{\text{UO}}_{2}^{{2 + }}}}} {{\text{NO}}_{3}^{ - }}}} \right. \kern-0em} {{\text{NO}}_{3}^{ - }}}}}}$ значение lnKr для реакции (1) с участием UO2(NO3)2 · 3H2O было зафиксировано.
ЗАКЛЮЧЕНИЕ
В результате настоящей работы обобщены литературные данные по термодинамическим свойствам и фазовым равновесиям в системах H2O–Th(NO3)4–HNO3 и H2O–UO2(NO3)2–Th(NO3)4–HNO3. Впервые получены термодинамические модели жидкой и твердых фаз, адекватно описывающие имеющиеся данные. Полученные термодинамические модели могут быть использованы при разработке различных процессов выделения и очистки смесей природного или техногенного происхождения с участием азотнокислых растворов урана и тория.
Список литературы
Nascimento R., Moreira J., Cardoso L. // Rev. Caatinga. 2017. V. 30. № 1. P. 213. https://doi.org/10.1590/1983-21252017v30n123rc
Малютин А.С., Коваленко Н.А., Успенская И.А. // Вестник МГУ. Сер. 2, химия. 2020. Т. 61. № 2. С. 83.
Pitzer K.S. // J. Phys. Chem. 1973. V. 77. № 2. P. 268. https://doi.org/10.1021/j100621a026
Pitzer K.S., Wang P., Rard J. // J. Solution Chem. 1999. V. 28. № 4. P. 265. https://doi.org/10.1023/A:1022695525943
Voskov A.L., Kovalenko N.A., Kutsenok I.B. // Russ. J. Phys. Chem. A. 2019. V. 93. № 10. P. 1849. [Восков А.Л., Коваленко Н.А., Куценок И.Б. // Журн. физ. химии. 2019. Т. 93. № 10. С. 1445.]https://doi.org/10.1134/S0036024419100327
Robinson R.A., Levien B.J. // Trans. Proc. R. Soc. New Zeal. 1946. V. 76. P. 295.
Lemire R.J., Sagert N.H., Lau D.W.P. // J. Chem. Eng. Data. 1984. V. 29. № 3. P. 329. https://doi.org/10.1021/je00037a031
Apelblat A., Azoulay D., Sahar A. // J. Chem. Soc., Faraday Trans. 1. Phys. Chem. Condens. Phases. 1973. V. 69. P. 1624. https://doi.org/10.1039/f19736901624
Marshall W.L., Gill J.S., Secoy C.H. // J. Am. Chem. Soc. 1951. V. 73. № 10. P. 4991. https://doi.org/10.1021/ja01154a531
Apelblat A., Azoulay D., Sahar A. // J. Chem. Soc., Faraday Trans. 1. Phys. Chem. Condens. Phases. 1973. V. 69. P. 1618. https://doi.org/10.1039/f19736901618
Lemire R.J., Brown C.P. // J. Solution Chem. 1982. V. 11. № 3. P. 203. https://doi.org/10.1007/BF00667602
Lemire R.J., Brown C.P., Campbell A.B. // J. Chem. Eng. Data. 1985. V. 30. № 4. P. 421. https://doi.org/10.1021/je00042a015
Ferraro J.R., Katzin L.I., Gibson G. // J. Am. Chem. Soc. 1954. V. 76. № 3. P. 909. https://doi.org/10.1021/ja01632a083
Volk V.I., Vakhrushin A.Yu., Mamaev S.L. // Radiochemistry. 1999. V. 41. № 3. P. 222. [Волк В.И., Вахрушин А.Ю., Мамаев С.Л. // Радиохимия. 1999. Т. 41. № 3. С. 212.]
Lange E., Miederer W. // Ber. Bunsenges. Phys. Chem. 1957. V. 61. № 3. P. 407. https://doi.org/10.1002/bbpc.19570610317
Apelblat A., Sahar A. // J. Chem. Soc., Faraday Trans. 1. Phys. Chem. Condens. Phases. 1975. V. 71. P. 1667. https://doi.org/10.1039/f19757101667
Volk V.I., Vakhrushin A.Yu., Mamaev S.L. // J. Radioanal. Nucl. Chem. 2000. V. 243. № 3. P. 703. [Волк В.И., Вахрушин А.Ю., Мамаев С.Л. // Радиохимия. 1999. Т. 41. № 3. С. 215.]https://doi.org/10.1023/A:1006764417407
Pitzer K.S., Mayorga G. // J. Phys. Chem. 1973. V. 77. № 19. P. 2300. https://doi.org/10.1021/j100638a009
Kim H.T., Frederick W.J. // J. Chem. Eng. Data. 1988. V. 33. № 2. P. 177. https://doi.org/10.1021/je00052a035
Simoes M., Hughes K., Ingham D. // J. Chem. Eng. Data. 2016. V. 61. № 7. P. 2536. https://doi.org/10.1021/acs.jced.6b00236
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии