Журнал неорганической химии, 2020, T. 65, № 5, стр. 619-625
Кинетические и методические проблемы прямого синтеза “АЛОНа” (9Al2O3 · 5AlN)
К. Г. Сморчков a, Н. А. Грибченкова a, А. С. Алиханян a, *
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
* E-mail: alikhan@igic.ras.ru
Поступила в редакцию 08.11.2019
После доработки 12.12.2019
Принята к публикации 27.12.2019
Аннотация
Исследована кинетика прямого взаимодействия оксида и нитрида алюминия при температурах 1700, 1780°С в условиях низкого давления (р ≤ 1 Па). Показано, что в процессе реакции без потери массы образуется двухфазный неравновесный продукт [АЛОН + AlN] с составом “АЛОНа” (AlON), обогащенным оксидом алюминия. Реакция, протекающая в восстановительных условиях, сопровождается потерей массы и образованием равновесного двухфазного продукта [АЛОН + AlN], в котором оксонитридная шпинель обогащена нитридом алюминия. Установлены основные методические требования для прямого синтеза “АЛОНа” с высокими оптическими и механическими характеристиками.
ВВЕДЕНИЕ
Прошло ровно 60 лет, как было показано [1, 2], что гексагональный оксид алюминия может быть допирован азотом с образованием кубической фазы шпинели при температурах выше 1600°С. В последующие годы появилось большое количество работ, связанных с исследованием фазовой диаграммы Al2O3–AlN [3–20]. По данным этих работ, квазибинарная система в интервале температур 1650–2600°C содержит не менее 14 фаз, четыре из которых на основе шпинели: Al23O27N5, Al19.7O29.5N2.5, Al22O30N2, Al19O27N. В работе [3] установлено, что ниже 1600°C взаимодействие между компонентами смеси [Al2O3 + AlN] не происходит, а выше этой температуры образуется кубическая фаза Al23O27N5 (9Al2O3 · 5AlN) со структурой дефектной шпинели, характеризующаяся широкой областью гомогенности. Авторы [4] показали, что при температуре 2000°С область гомогенности шпинели лежит в интервале 60–73 мол. % Al2O3. В литературе эта фаза получила название γ‑AlON. Большинство физических и химических свойств АЛОНа сопоставимы со свойствами глинозема, но благодаря кубической структуре его механические и оптические свойства изотропны, он легко обрабатывается и может использоваться в различных областях техники, но наибольший интерес представляет как “прозрачная броня” и головные обтекатели ракет.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Наиболее качественную оксонитридную керамику (с точки зрения механических и оптических свойств) получают по методике, которая включает в себя два этапа: синтез АЛОНа в виде белого непрозрачного продукта и длительный высокотемпературный отжиг спрессованного синтезированного соединения до получения прозрачного материала. Из многочисленных методов синтеза АЛОНа [2, 3, 8, 20–30] чаще всего используют два: прямое взаимодействие компонентов при t > 1650°C:
(1)
${\text{A}}{{{\text{l}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}\left( {{\text{тв}}} \right) + {\text{AlN}}\left( {{\text{тв}}} \right) \to {\text{АЛОН}}\left( {{\text{тв}}} \right),$(2)
$9{\text{A}}{{{\text{l}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}\left( {{\text{тв}}} \right) + {\text{5AlN}}\left( {{\text{тв}}} \right) = {\text{A}}{{{\text{l}}}_{{{\text{23}}}}}{{{\text{O}}}_{{{\text{27}}}}}{{{\text{N}}}_{{\text{5}}}}\left( {{\text{тв}}} \right){\text{,}}$(3)
$\begin{gathered} {\text{A}}{{{\text{l}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}\left( {{\text{тв}}} \right) + {\text{С}}\left( {{\text{тв}}} \right) + {{{\text{N}}}_{{\text{2}}}}\left( {\text{г}} \right) \to \\ \to {\text{АЛОН}}\left( {{\text{тв}}} \right) + {\text{СО}}\left( {\text{г}} \right){\text{,}} \\ \end{gathered} $(4)
${\text{A}}{{{\text{l}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}\left( {{\text{тв}}} \right) + {\text{Al}}\left( {{\text{тв}}} \right) + {{{\text{N}}}_{{\text{2}}}}\left( {\text{г}} \right) \to {\text{АЛОН}}\left( {{\text{тв}}} \right).$Основные требования при проведении реакции – это чистота исходных препаратов (не менее 99.9 мас. %) и высокая гомогенность реакционной смеси с размером частиц реагентов ∼1 мкм. Предварительно компоненты смеси должны быть спрессованы до 50–60% от теоретической плотности конечного продукта. Время проведения реакции образования АЛОНа на начальном этапе при температуре 1700–1800°С, согласно литературным данным, не превышает 15–30 мин. Для исключения реакций окисления синтез, как правило, ведут в инертной атмосфере. В качестве примеси АЛОН практически всегда содержит 5–10 мас. % нитрида алюминия. Объясняется это высокой скоростью образования АЛОНа с повышенным содержанием оксида алюминия и низкой скоростью диффузии нитрида алюминия в образовавшемся продукте [31, 32]:
(5)
$\begin{gathered} 9{\text{A}}{{{\text{l}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}\left( {{\text{тв}}} \right) + 5{\text{AlN}}\left( {{\text{тв}}} \right) = \\ = {\text{A}}{{{\text{l}}}_{{23--х}}}{{{\text{O}}}_{{27}}}{{{\text{N}}}_{{5--х}}}\left( {{\text{тв}}} \right) + х{\text{AlN}}\left( {{\text{тв}}} \right). \\ \end{gathered} $Следует отметить, что эта реакция является наглядным примером высокотемпературного образования (с точки зрения фазовых диаграмм) неравновесной системы. Поэтому для получения однофазного образца приходится значительно увеличивать время синтеза (отжига). Однако присутствие нитрида алюминия может быть связано и с реакциями восстановления оксида алюминия или АЛОНа в процессе высокотемпературного синтеза, если используются, например, углеродные и вольфрамовые нагреватели, избыток углерода и алюминия в методиках карботермического и алюмотермического азотирования. Но в этом случае состав синтезируемого АЛОНа будет обеднен оксидом алюминия, и не исключено, что в результате образуется равновесная двухфазная область [(9 – х)Al2O3 ∙ (5 + y)AlN + AlN]. На втором этапе полученный белый непрозрачный продукт диспергируется с добавлением незначительных количеств оксидов (не более 1 мас. %) иттрия, лантана, магния или кальция. Эти оксиды образуют низкоплавкие эвтектики на границах зерен АЛОНа и способствуют их спеканию при t > 1650°C до окончательного получения плотной прозрачной керамики. Далее в зависимости от требуемого размера и формы прозрачного изделия используют различные методики отжига (спекания) [33]. Спекание без давления PL (pressureless) [34] предварительно спрессованного при давлении 10–100 МПа образца. Этот метод экспериментально прост, но требует высоких температур (t > 1850°C) и длительного времени отжига (τ > 20 ч). Качество керамики получается удовлетворительное, его можно улучшить, изменив некоторые параметры эксперимента. Хорошие оптические и плотностные характеристики получаются при использовании методики горячего одноосного прессования НР (hot pressing) [35], но производство АЛОНа при этом дорогое и можно изготавливать только небольшие изделия простой формы. Метод горячего изостатического прессования HIP (hot isostatic pressing) [36, 37] дает возможность синтезировать керамику с высокими оптическими и механическими характеристиками, причем изделия могут быть получены любой сложности, но только одно в данном технологическом цикле. Несмотря на высокое качество получаемой продукции, перспективы широкого использования данной методики проблематичны из-за чрезмерно высокой стоимости производства. Относительно недавно появилось несколько работ, связанных с использованием метода искровой плазмы SPS (spark plasma sintering) [38, 39] при спекании АЛОНа. Эта методика позволяет получать плотную прозрачную керамику относительно быстро и при более низких температурах. К недостаткам данного метода можно отнести ограничения по форме изготовления керамических образцов и высокой стоимости оборудования и его эксплуатации.
Таким образом, несмотря на большое количество работ, посвященных разработке методик получения АЛОНа с высокими оптическими, механическими и ударостойкими характеристиками, и определенные успехи, все еще остается актуальной проблема разработки дешевой методики и методики получения больших и сложных изделий из АЛОНа.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Настоящая работа посвящена исследованию кинетики прямого взаимодействия компонентов Al2O3, AlN в условиях низкого давления (р ≤ 1 Па) в интервале температур 1660–1800°С и в условиях высокого вакуума (р ≤ 1 × 10–4 Па) в интервале температур 1650–1700°С. В качестве исходных реагентов использовали нитрид алюминия марки Aldrich (чистота ≥98 мас. %) с размером частиц 10 мкм и оксид алюминия, синтезированный в ИМЕТ РАН им. Байкова (чистота 99.9 мас. %), с удельной поверхностью 50 м2/г. Исследование синтеза АЛОНа в условиях низкого давления осуществляли в кварцевом реакторе, изображенном на рис. 1. Реакционную смесь [Al2O3 + AlN] массой 3 г с содержанием Al2O3 64.3 мол. % помещали в сапфировую ступку и растирали в абсолютированном спирте в течение 5 ч. Далее эту гомогенную смесь высушивали в течение 2 ч в сушильном шкафу при t = 80–190°С. Из полученного порошка готовили таблетки диаметром 14 мм и массой 0.2–0.3 г одноосным прессованием при давлении 150 МПа. Для проведения высокотемпературного твердофазного синтеза таблетку в графитовом тигле помещали в реактор, при этом образец изолировали от стенок и дна тигля порошком и пластинами из нитрида бора. Графитовый тигель вместе с образцом экранировали от кварцевых стенок реактора углеродной тканью (Урал ТМ-4-22 и Урал ТМ-22Р). Затем реактор вакуумировали до давления р ≤ 1 Па. Нагрев углеродного тигля осуществляли с помощью высокочастотного индукционного нагревателя ВЧ‑25АВ “Проминдуктор”, температуру измеряли вольфрам-рениевой термопарой (ВР5/ВР20). Подобная конструкция и постановка эксперимента позволяла нагревать тигель с образцом до температуры 1800–1850оС и держать ее в течение 60 мин без заметного изменения прочности кварцевого реактора. В табл. 1, 2 и на рис. 2, 3 приведены результаты нескольких экспериментов.
Рис. 1.
Схема кварцевого реактора для высокотемпературного синтеза АЛОНа: 1 – индуктор; 2 – кварцевая трубка; 3 – крышка реактора; 4 – трубка с трехходовым краном для откачки и напуска газа; 5 – трубка с двухходовым краном для напуска атмосферы; 6 – тепловые экраны из углеродного материла Урал ТМ-4-22; 7 – алундовый держатель тигля; 8 – термопара вольфрам-рениевая (ВР5/ВР20); 9 – образец [Al2O3 + + AlN]; 10 – экраны из нитрида бора; 11 – порошок нитрида бора; 12 – углеродный тигель.
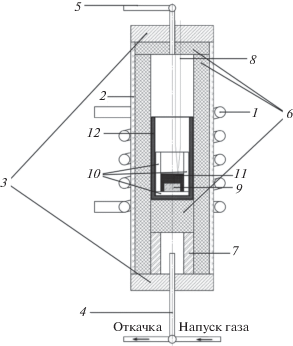
Таблица 1.
Результаты отжига образцов состава [9Al2O3 + 5AlN] при t = 1700°С
| № опыта | Масса образца, г | Время отжига, с | Фазовый состав продукта синтеза | Потеря массы образца, % |
|---|---|---|---|---|
| 1 | 0.23 | 10 | Al2O3, AlN | 0 |
| 2 | 0.25 | 20 | Al2O3, AlN, АЛОН | 0 |
| 3 | 0.23 | 60 | Al2O3, AlN, АЛОН | 0 |
| 4 | 0.28 | 120 | AlN, АЛОН | <5 |
Таблица 2.
Результаты отжига образцов состава [9Al2O3 + 5AlN] при t = 1780°С
| № опыта | Масса образца, г | Время отжига, мин | Фазовый состав продукта синтеза | Потеря массы образца, % |
|---|---|---|---|---|
| 1 | 1.72 | 0 | Al2O3, AlN, АЛОН | 0 |
| 2 | 1.72 | 1 | AlN, АЛОН | 0 |
| 3 | 1.72 | 3 | AlN, АЛОН | 9.3 |
| 4 | 1.72 | 10 | AlN, АЛОН | 16.7 |
| 5 | 1.56 | 13 | AlN, АЛОН | 20.5 |
Рис. 2.
Фазовый состав образца системы A2O3–AlN с начальным содержанием AlN 35.7 мол. %, отожженного при температуре 1700°C и давлении р ≤ 1 Па в течение 10 (а), 20 (б), 60 (в), 120 с (г).
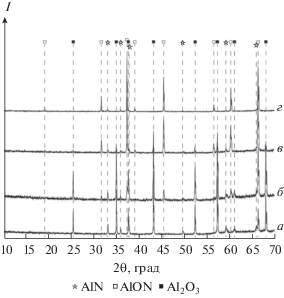
Рис. 3.
Фазовый состав образца системы A2O3–AlN с начальным содержанием AlN 35.7 мол. %, отожженного при температуре 1780°C и давлении р ≤ 1 Па в течение >0.1 (а), 1 (б), 3 (в), 10 (г), 13 мин (д).
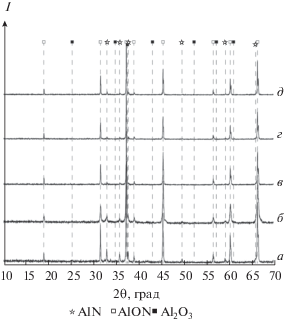
Отжиг системы при t = 1700°С в течение 10 с не сопровождается образованием заметных количеств АЛОНа. Как видно из рентгенограммы (рис. 2, кривая а), исследуемая система состоит из двух исходных фаз, но по истечении 20 с в конденсированной фазе появляется третья фаза – АЛОН. Дальнейшее продолжение высокотемпературного синтеза в течение 120 с приводит к увеличению количества АЛОНа и исчезновению фазы оксида алюминия (рис. 2, кривая г). Похожие результаты были получены при исследовании кинетики взаимодействия оксида и нитрида алюминия при температуре 1780°С (табл. 2). Однако в данном случае скорость реакции настолько высока, что АЛОН образуется уже за время подъема температуры углеродного тигля от 1660 до 1780°С и снижения ее до первоначального значения без дополнительного отжига. Суммарное время цикла составляет не более 5–10 с. По данным рентгенофазового анализа, образец (табл. 2, опыт 1), полученный таким образом, состоит из трех фаз – [Al2O3 + AlN + АЛОН]. Все остальные образцы, подвергнутые отжигу (опыты 2–5), представляли собой смесь только двух фаз – [AlN + АЛОН]. Как отмечалось выше, в литературе подобный состав продуктов твердофазной реакции (1) объясняется высокой скоростью образования АЛОНа с завышенным содержанием оксида алюминия 9Al2O3 ⋅ (5 – x)AlN по сравнению со стехиометрическим составом 9Al2O3 ⋅ 5AlN и чрезвычайно низкой скоростью диффузии нитрида алюминия в фазе образовавшегося продукта:
(6)
$\begin{gathered} 9{\text{A}}{{{\text{l}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}\left( {{\text{тв}}} \right) + 5{\text{AlN}}\left( {{\text{тв}}} \right) = \\ = {\text{A}}{{{\text{l}}}_{{{\text{23--}}x}}}{{{\text{O}}}_{{{\text{27}}}}}{{{\text{N}}}_{{{\text{5--}}x}}}\left( {{\text{тв}}} \right) + х{\text{AlN}}\left( {{\text{тв}}} \right). \\ \end{gathered} $Подобное объяснение вполне справедливо, если в результате синтеза и недлительного отжига нет потери массы. Например, результаты, представленные в табл. 1, вполне можно объяснить этим механизмом синтеза. Синтез оксонитридной керамики, сопровождающийся потерей массы (табл. 2), естественно, должен быть описан иными реакциями. В нашем эксперименте синтез АЛОНа протекал в условиях динамического вакуума при остаточном атмосферном давлении р ≤ 1 Па. При такой постановке эксперимента вследствие относительной негерметичности установки в зону реакции постоянно в незначительном количестве натекает атмосфера и молекулы кислорода взаимодействуют с избытком углерода (тигель, теплоизолирующая ткань), образуя СО, который восстанавливает оксид алюминия до металла. Алюминий как легколетучий компонент может удаляться из реакционной смеси или, если скорость образования нитрида алюминия выше скорости испарения алюминия, взаимодействовать с азотом и образовывать дополнительное сверхстехиометрическое количество нитрида алюминия. Таким образом, рассматриваемый процесс образования системы [АЛОН + AlN] может быть представлен следующими гетерофазными реакциями:
(9)
${\text{Al}}\left( {{\text{тв, г}}} \right) + 0.5{{{\text{N}}}_{2}} = {\text{AlN}}\left( {{\text{тв}}} \right){\text{,}}$(10)
$\begin{gathered} 9{\text{A}}{{{\text{l}}}_{{\text{2}}}}{{{\text{O}}}_{3}} \cdot 5{\text{AlN}}\left( {{\text{тв}}} \right) + 6х{\text{CO}} + x{{{\text{N}}}_{2}} = \\ = (9 - x){\text{A}}{{{\text{l}}}_{{\text{2}}}}{{{\text{O}}}_{3}} \cdot 5{\text{AlN}}\left( {{\text{тв}}} \right) + 2x{\text{AlN}}\left( {{\text{тв}}} \right) + 6х{\text{С}}{{{\text{О}}}_{{\text{2}}}}. \\ \end{gathered} $Эти реакции сопровождаются уменьшением массы исходной навески [Al2O3 + AlN] и образованием двухфазной системы [AlN + АЛОН] с АЛОНом, обогащенным нитридом алюминия.
Совершенно иная картина наблюдается при синтезе АЛОНа в условиях высокого вакуума. Образец системы [9Al2O3 + 5AlN] в виде таблетки диаметром 10 мм и массой 0.5 г, приготовленный одноосным прессованием (р = 150 МПа), помещали в вольфрамовую эффузионную камеру масс-спектрометра МС-1301, внутренняя поверхность которой была покрыта нитридом бора, и отжигали при температурах 1660–1700°С и остаточном давлении (1–5) × 10–4 Па в течение 30 мин. Вольфрамовую эффузионную камеру нагревали электронной бомбардировкой, температуру измеряли оптическим пирометром ЭОП-66 с точностью ±5°С. Процесс отжига, по данным масс-спектрального анализа, сопровождается интенсивным газовыделением, связанным с сублимацией нитрида алюминия в виде молекул азота и атомов алюминия (табл. 3).
Таблица 3.
Величины парциальных давлений (Па) газовой фазы при изотермическом отжиге образца [Al2O3 + AlN], t = 1670°С
| Состав конденсированной фазы | p(Al) | p(N2) |
|---|---|---|
| [Al2O3 + AlN] неравновесный состав | 56.0 | 28.0 |
| [Аl23–xO27N5–x + AlN] | 56.0 | 28.0 |
| [Al23O27N5] | 45.2 | 22.6 |
| [Аl23–xO27N5–x + Al2O3] | >42.6 | >21.3 |
Рентгенофазовый анализ показал, что в результате длительного отжига смеси [Al2O3 + AlN] в масс-спектральном эксперименте образуется равновесная двухфазная система [АЛОН + Аl2O3]. Таким образом, с учетом фазовой диаграммы [4, 5] процесс отжига образца может быть описан следующими реакциями:
(11)
$9{\text{A}}{{{\text{l}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}\left( {{\text{тв}}} \right) + 5{\text{AlN}}\left( {{\text{тв}}} \right) = {\text{A}}{{{\text{l}}}_{{{\text{23}}}}}{{{\text{O}}}_{{{\text{27}}}}}{{{\text{N}}}_{{\text{5}}}}\left( {{\text{тв}}} \right),$(12)
$\begin{gathered} {\text{A}}{{{\text{l}}}_{{{\text{23}}}}}{{{\text{O}}}_{{{\text{27}}}}}{{{\text{N}}}_{{\text{5}}}}\left( {{\text{тв}}} \right) = {\text{А}}{{{\text{l}}}_{{{\text{23}} - x}}}{{{\text{O}}}_{{{\text{27}}}}}{{{\text{N}}}_{{{\text{5}} - x}}}\left( {{\text{тв}}} \right) + \\ + \,\,x{\text{Al}}\left( {\text{г}} \right) + 0.5х{{{\text{N}}}_{2}}. \\ \end{gathered} $Предварительная калибровка масс-спектрометра и конгруэнтный характер парообразования нитрида алюминия [40] дали возможность рассчитать величины парциальных давлений атомов алюминия и молекул азота в течение всего периода отжига образца.
Эти последние исследования высокотемпературного отжига системы [Al2O3 + AlN] в условиях высокого вакуума показали, что образование АЛОНа, обогащенного оксидом алюминия, так же как и в предыдущих случаях, происходит достаточно быстро, но дальнейший отжиг сопровождается парообразованием нитрида алюминия и последовательным образованием двухфазной системы [Аl23–xO27N5–x + Al2O3] и чистого [Al2O3].
ЗАКЛЮЧЕНИЕ
Выполненный цикл высокотемпературных исследований и краткий анализ известных литературных данных по методам синтеза АЛОНа позволили заключить, что наиболее перспективным с точки зрения простоты, цены аппаратурного оформления и качества получаемой керамики является метод простого спекания смеси оксида и нитрида алюминия начального состава 64.3 мол. % Al2O3. Причем метод должен основываться на двух этапах отжига. На первом (достаточно быстром) этапе при отжиге исходной гомогенизированной смеси [Al2O3 + AlN], спрессованной при давлении 40–50 мПа, в интервале температур 1750–1800°С образуется непрозрачный АЛОН. Второй этап заключается в механическом диспергировании синтезированного АЛОНа, последующем его прессовании при давлении 150–200 МПа и длительном спекании при температуре 1800–1950°С до получения прозрачной керамики плотностью ~3.7 г/см3. Для улучшения оптических и механических свойств к синтезированному на первом этапе АЛОНу следует добавлять, как и в других методиках, один из оксидов иттрия, лантана, магния, кальция в количестве ≤1 мас. %.
Обязательным требованием при проведении высокотемпературного синтеза АЛОНа на всех этапах должно быть полное отсутствие восстановительных условий во избежание образования двухфазного продукта. Процессы отжига и спекания необходимо проводить исключительно в атмосфере азота, давление которого должно быть равно величине парциального давления азота над АЛОНом состава Al23O27N5 [41].
Список литературы
Yamaguchi G., Yanagida H. // J. Chem. Soc. Jpn. 1959. V. 32. P. 1264. https://doi.org/10.1246/bcsj.32.1264
Long G., Foster L.M. // J. Am. Ceram. Soc. 1961. V. 44. № 6. P. 255. https://doi.org/10.1111/j.1151-2916.1961.tb15373.x
Lejus A.M. // Rev. Int. Hautes Tempér et Réfract. 1964. V. 1. № 1. P. 53.
McCauley J.W., Corbin N.D. // J. Am. Ceram. Soc. 1979. V. 62. № 9–10. P. 476. https://doi.org/10.1111/j.1151-2916.1979.tb19109.x
McCauley J.W., Corbin N.D. // Progress in Nitrogen Ceramics / Ed. Riley F.L. V. 65. Springer, 1983. P. 111. https://doi.org/10.1007/978-94-009-6851-6_8
Sakai T. // J. Ceram. Assoc. Jpn. / Ed. Yogyo Kyokai-shi. 1978. V. 86. № 991. P. 125. https://doi.org/10.2109/jcersj1950.86.991_125
Sakai T. // J. Am. Ceram. Soc. 1981. V. 64. № 3. P. 135. https://doi.org/10.1111/j.1151-2916.1981.tb10243.x
Willems H.X., Hendrix M.M.R.M., Metselaar R. et al. // J. Eur. Ceram. Soc. 1992. V. 10. № 4. P. 327. https://doi.org/10.1016/0955-2219(92)90088-U
Tabary P., Servant C. // Calphad. 1998. V. 22. № 2. P. 179. https://doi.org/10.1016/S0364-5916(98)00023-6
Tabary P., Servant C. // J. Appl. Crystallogr. 1999. V. 32. № 2. P. 241. https://doi.org/10.1107/S0021889898012497
Wang X., Li W., Seetharaman S. // Scandinavian J. Metallurgy. 2002. V. 31. № 1. P. 1. https://doi.org/10.1034/j.1600-0692.2002.310101.x
Nakao W., Fukuyama H., Nagata K. // J. Electrochem. Soc. 2003. V. 150. № 2. P. J1. https://doi.org/10.1149/1.1537757
McCauley J.W., Parimal P., Chen M. et al. // J. Eur. Ceram. Soc. 2009. V. 29. № 2. P. 223. https://doi.org/10.1016/j.jeurceramsoc.2008.03.046
Ado G., Billy M., Guillo P., Lefort P. // Industrie Ceramique (Paris). 1985. V. 792. P.173.
McCauley J.W. // J. Am. Ceram. Soc. 1978. V. 61. № 7–8. P. 372. https://doi.org/10.1111/j.1151-2916.1978.tb09336.x
Raytheon patents: #4,481,300 (1984); #4,520,116 (1985); #4,686,070 (1987) #4,720,362 (1988).
McCauley J.W., Krishnan K.M., Rai R.S. et al. // Ceramic Microstructures’86 / Ed. Pask J., Evans A. Plenum Publishing Corp., Springer US, 1988. P. 577. https://doi.org/10.1007/978-1-4613-1933-7_59
Corbin N.D. // J. Eur. Ceram. Soc. 1989. V. 5. № 3. P. 143. https://doi.org/10.1016/0955-2219(89)90030-7
McCauley J.W. // Aluminum Nitride and AlON Ceramics, Structure and Properties Elsevier’s Encyclopedia of Materials: Science and Technology. Elsevier Science Ltd. 2001. P. 1272. https://doi.org/10.1016/b0-08-043152-6/00028-0
Sullivan R.M. // A historical view of ALO№ In Proceedings of SPIE, Window and Dome Technologies and Materials IX, V. 5786 / Ed. Tustison R.W. 2005. P. 23–32. https://doi.org/10.1117/12.598031
Takebe H., Kameda T., Komatsu M. et al. // J. Ceram. Soc. Jpn. Inter. Edn. 1989. V. 97. № 2. P.166. https://doi.org/10.2109/jcersj.97.166
Collongues R., Gilles J.C., Lejus A. et al. // Mater. Res. Bull. 1967. V. 2. № 9. P. 837. https://doi.org/10.1016/0025-5408(67)90092-X
Chen C.F., Savrun E., Ramirez A.F. // Ceramics Today – Tomorrow’s Ceramics. Proc. 7th Int. Meeting on Modern Ceramics Technologies / Ed. Vincenzini P. Elsevier, 1991. P. 1295–1309.
Corbin N.D., McCauley J.W. // Proc. SPIE 1981, San Diego, United States. 1982. V. 0297. P. 19. https://doi.org/10.1117/12.932479
Rafaniello W., Cutler I.B. // Comm. Am. Ceram. Soc. 1981. V. 64. № 10. P. 128. https://doi.org/10.1111/j.1151-2916.1981.tb10232.x
Ish-Shalom M. // J. Mater. Sci. Lett. 1982. V.1. № 4. P. 147. https://doi.org/10.1007/BF00730944
Zheng J., Forslund B. // J. Eur. Ceram. Soc. 1995. V. 15. № 11. P. 1087. https://doi.org/10.1016/0955-2219(95)00078-9
Li Y., Li N., Yuan R. // J. Mater. Sci. 1997. V. 32. № 4. P. 979. https://doi.org/10.1023/A:1018518103842
Li Y., Li N., Yuan R. // J. Mater. Sci. Lett. 1997. V. 16. № 3. P. 185. https://doi.org/10.1023/A:1018574917741
Li Y., Li N., Yuan R. // J. Mater. Sci. 1999. V. 34. № 11. P. 2547. https://doi.org/10.1023/A:1004636312836
Bandyopadhyay S., Rixecker G., Aldinger F. et al. // J. Am. Ceram. Soc. 2002. V. 85. № 4. P. 1010. https://doi.org/10.1111/j.1151-2916.2002.tb00212.x
Gorter H., Dortmans L.J.M.G., Bos B. // 27th International Cocoa Beach Conference on Advanced Ceramics and Composites: A: Ceramic Engineering and Science Proceedings. John Wiley & Sons, Inc. 2008. V. 24. № 3. P. 433. https://doi.org/10.1002/9780470294802.ch62
Balázsi C., Furkó M., Szira F. et al. // Acta Materialia Transylvanica. 2019. V. 2. № 1. P. 7. https://doi.org/10.33923/amt-2019-01-02
Shan Y., Zhang Z., Sun X. et al. // J. Eur. Ceram. Soc. 2016. V. 36. № 3. P. 671. https://doi.org/10.1016/j.jeurcer-amsoc.2015.10.026
Zhang N., Liang B., Wang X.Y. // Sci. Engineer. A. 2011. V. 528. № 19-20. P. 6259. https://doi.org/10.1016/j.msea.2011.04.072
Jiang N., Liu Q., Xie T. et al. // J. Eur. Ceram. Soc. 2017. V. 37. № 13. P. 4213. https://doi.org/10.1016/j.jeurceramsoc.2017.04.028
Chen F., Zhang F., Wang J. et al. // J. Alloys Compd. 2015. V. 659. P. 757. https://doi.org/10.1016/j.jallcom.2015.08.028
Sahin F.C., Kanbur H.E., Apak B. // J. Eur. Ceram. Soc. 2012. V. 32. № 4. P. 925. https://doi.org/10.1016/j.jeurceramsoc.2011.10.043
Li X., Huang J., Luo J. // Trans. Ind. Ceram. Soc. 2017. V. 76. № 1. P. 14. https://doi.org/10.1080/0371750X.2016.1257956
Hildenbrand D.L., Hall W.F. // J. Phys. Chem. 1963. V. 67. № 4. P. 888. https://doi.org/10.1021/j100798a041
Gribchenkova N.A., Beresnev E.N., Smorchkov K.G. et al. // Russ. J. Inorg. Chem. 2015. V. 60. № 9. P. 1137. [Грибченкова Н.А., Береснев Э.Н., Сморчков К.Г. и др. // Журн. неорган. химии. 2015. Т. 60. № 9. С. 1247.]https://doi.org/10.1134/S0036023615090089
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии


