Журнал неорганической химии, 2020, T. 65, № 5, стр. 673-678
Исследование термодинамических свойств β-дикетонатного комплекса рутения Ru(thd)3 – прекурсора для получения покрытий химическим осаждением из газовой фазы
С. В. Сысоев a, Т. М. Кузин a, *, Л. Н. Зеленина a, К. В. Жерикова a, Н. В. Гельфонд a
a Институт неорганической химии им. А.В. Николаева СО РАН
630090 Новосибирск, Россия
* E-mail: kuzin@niic.nsc.ru
Поступила в редакцию 15.11.2019
После доработки 25.11.2019
Принята к публикации 24.12.2019
Аннотация
Изучены термодинамические свойства комплексного соединения рутения Ru(thd)3 (thd = трис(2,2,6,6-тетраметил-3,5-гептадионат-анион), Ru(C11H19O2)3). Методом дифференциальной сканирующей калориметрии определены температуры (434.8 ± 2.0, 452.2 ±1.0, 461.1 ± 1.0, 487.8 ± 1 K) и термодинамические параметры (изменение энтальпии ΔH = 13.3 ± 2.0, 2.1 ± 0.5, 6.0 ± 2.0, 3.8 ± 1 кДж/моль) трех обратимых твердофазных переходов и процесса плавления. Методом потока установлена зависимость давления насыщенного пара от температуры в интервале 392–488 K. Рассчитаны термодинамические параметры процесса сублимации (изменения энтальпии ΔH = 121 ± 1, 103 ± 3, 101 ± 5, 86 ± 2 кДж/моль и энтропии ΔS° = 219 ± 3, 176 ± 7, 173 ± 10, 141 ± 4 Дж/(моль K)) для всех четырех кристаллических фаз. Методом термодинамического моделирования рассчитаны CVD-диаграммы, позволяющие определить равновесный фазовый состав системы. Полученные результаты позволяют дать рекомендации по нахождению оптимальных условий проведения процесса CVD и выбору прекурсора.
ВВЕДЕНИЕ
Тонкие покрытия из рутения и оксида рутения в последние годы приобретают все большее значение в различных областях электроники, радиотехники и электротехники, химической промышленности. Известно использование β-дикетонатов рутения, в том числе Ru(thd)3 (thd = = трис(2,2,6,6-тетраметил-3,5-гептадионат-анион), Ru(C11H19O2)3) в качестве прекурсоров для получения покрытий из рутения и его оксидов на различных поверхностях [1–4]. Одним из наиболее эффективных методов получения покрытий на основе металлов платиновой группы является метод MO CVD (Metalorganic chemical vapour deposition). Это обусловлено совокупностью таких термических свойств прекурсора, как летучесть при относительно невысоких температурах, термическая устойчивость в процессе парообразования, способность паров соединений разлагаться на нагретых поверхностях и в реакционной атмосфере с выделением в твердой фазе материала покрытия. Главная роль при изучении этих процессов отводится экспериментальным методам (калориметрии, рентгеновской дифракции, ИК-спектроскопии и другим физико-химическим методам анализа [5–9]).
Высокая проводимость рутенийсодержащих пленок получила свое применение при изготовлении тонкопленочных резисторов [10]. Тонкие пленки из металлического рутения используются для производства электродов, а также для антикоррозионных диффузионных барьерных слоев при производстве динамической памяти с произвольным доступом [11–13]. Следует отметить такое важное свойство пленок оксида рутения RuO2, как их оптическая прозрачность в видимом и ультрафиолетовом диапазонах [14].
Рутений широко применяется в гетерогенном и гомогенном катализе [15, 16], а также в реакциях гидрирования [17, 18]. Большое значение приобрели рутениевые катализаторы для получения различного класса органических соединений и полимеров [19, 20]. Наиболее эффективные катализаторы получаются при нанесении рутения на различные носители с сильно развитой поверхностью [21, 22].
Потенциальное расширение области применения летучих комплексных соединений обусловливает необходимость их всестороннего изучения. Прежде всего необходимы количественные данные по давлению насыщенного пара, характеристикам фазовых превращений, термической устойчивости соединений. Данные о термических свойствах Ru(thd)3, Pd(thd)2 и Pt(thd)2, а также ацетилацетоната Ru(acac)3 (acac = ацетилацетонат-анион), полученные методами комплексного термического анализа (ТГ, ДТА, ДСК), приведены в [23]. Для Ru(thd)3 обнаружены три фазовых перехода в кристаллической фазе при температурах 440, 454 и 464 K, а также установлена температура плавления, равная 489 K [23].
Процессы термического разложения паров ß-дикетонатов Ru(acac)3 и Ru(tfac)3 (tfac = трифторацетилацетонат-анион) в вакууме, водороде и кислороде были исследованы с использованием масс-спектрометрии [24]. Определена структура и параметры кристаллической решетки низкотемпературной фазы Ru(thd)3 [25].
В работе [26] проведено термодинамическое моделирование процессов MOCVD и получены металлические и оксидные тонкие пленки с использованием в качестве прекурсора [Ru(EtCp)2] (бис(этил)-π-циклопентадиенил Ru).
Настоящая работа посвящена изучению свойств β-дикетонатного комплекса рутения Ru(thd)3 для использования его в качестве прекурсора при получении функциональных металлических и оксидных покрытий методами MOCVD, включая определение термодинамических данных процессов парообразования, фазовых превращений и термодинамическое моделирование процессов осаждения.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез и идентификация вещества. Синтез Ru(thd)3 осуществляли по оригинальной методике, разработанной для получения β-дикетонатных производных рутения(III) и подробно описанной в [27], с использованием гексафторокомплексов рутения в качестве исходных соединений. Для дальнейших термодинамических исследований продукт синтеза был тщательно очищен двукратной сублимацией в вакуумной градиентной печи при p = 7 Па и T = 403–408 K. Выход составил 65%. Проведен C,H,N-элементный анализ (Euro EA 3000 анализатор, погрешность 0.5%):
Экспериментальные методы исследования. Калориметрические измерения образцов Ru(thd)3 массой 18–32 мг проводили на сканирующем калориметре DSC 111 Setaram со скоростью нагрева 1–3 град/мин в вакуумированных стеклянных ампулах. Экспериментальная процедура для аналогичных веществ описана в [28]. В исследуемом диапазоне температур (273–490 K) обнаружены три обратимых фазовых перехода вещества в кристаллическом состоянии и эффект плавления.
Температурная зависимость давления насыщенного пара над кристаллическим Ru(thd)3 определена с использованием метода потока (переноса) в атмосфере сухого инертного газа-носителя (гелия) [29, 30]. Количество вещества, сублимированного и сконденсированного в холодной зоне, определяли взвешиванием с погрешностью ±5 × 10–4 г. Погрешность метода не превышала ±5% при точности измерения температуры ±0.5 K и ошибке в измерении расхода газа-носителя ±2%. Измерения проводили в квазиравновесных условиях. Экспериментально было показано, что определяемое давление пара не зависит от скорости потока гелия (в диапазоне 0.5–2.0 л/ч). Давление насыщенного пара рассчитывается по формуле:
где pобщ – общее давление в системе, n – количество молей перешедшего в газовую фазу или сконденсированного в холодной зоне вещества, N – количество молей газа-носителя (гелия). Расчет основан на предположении, что вещество переходит в газовую фазу в мономолекулярной форме. Совпадение результатов, полученных из данных по количеству сублимированного вещества и вещества, осажденного в холодной зоне, указывает на то, что исследуемый комплекс обладает хорошей термической стабильностью в исследованном диапазоне температур.Термодинамическое моделирование MOCVD-процессов. Для выбора условий проведения CVD-процессов и прекурсора использовали метод термодинамического моделирования, позволяющий определить равновесный состав осаждаемых фазовых комплексов и парциальные давления газообразных компонентов системы при варьировании в широких пределах условий проведения технологического процесса (температуры, давления), состава исходного реагента и соотношений входных газовых потоков.
Расчеты проводили с использованием базы данных и прикладной программы расчета равновесий банка данных по свойствам материалов электронной техники (БнД СМЭТ, ИНХ СО РАН) [31, 32]. При выборе необходимых для вычислений значений термодинамических характеристик за основу взяты величины, рекомендованные справочным изданием [33]. Расчет детального равновесного состава физико-химической системы при заданных термодинамических условиях был основан на принципе минимизации значения функции свободной энергии Гиббса G при ограничениях, задаваемых условиями сохранения материального баланса системы. Вычисления проводили для температур Т = 300–1400 K, общего давления p = 13.3–1333 Па и входных соотношений реакционного газа и прекурсора n(H2, O2)/n(B) = 0–100. В расчетах учитывали до 100 находящихся в термодинамическом равновесии веществ газовой фазы и соответствующих конденсированных фаз. Oсновные допущения, принятые при моделировании: процесс CVD протекает в квазиравновесных условиях; химический состав системы в зоне осаждения идентичен составу вводной газовой смеси; газовая фаза в зоне осаждения находится в термодинамическом равновесии с образующимися в зоне осаждения конденсированными фазами, которые имеют постоянный состав; подложка инертна. Термодинамическое моделирование для подобных систем описано, например, в работах [34, 35].
АНАЛИЗ ПОЛУЧЕННЫХ РЕЗУЛЬТАТОВ
Экспериментальные данные
Результаты исследования образцов Ru(thd)3 методом дифференциальной сканирующей калориметрии (ДСК), позволившие определить температуры и термодинамические характеристики фазовых превращений комплекса, представлены в табл. 1. Обнаружено четыре эндотермических фазовых перехода. Визуальный контроль позволил определить, что только последний из них обусловлен плавлением вещества, вплоть до которого комплекс термически стабилен. Первые же три пика относятся к твердофазным переходам. Значения температур всех фазовых переходов находятся в хорошем согласии с данными, полученными ранее методом комплексного термического анализа [23]. В данной работе впервые количественно охарактеризованы параметры фазовых переходов, наблюдаемых в Ru(thd)3. Наличие твердофазных превращений для соединений β-дикетонатов металлов с трет-бутильными заместителями неоднократно наблюдали как авторы данной статьи [36], так и другие исследователи [37, 38]. На примере разнолигандного комплекса магния с дипивалоилметаном и thd-лигандом с привлечением ренгенофазового анализа нами было показано, что подобные переходы зачастую являются обратимыми и связаны со структурной перестройкой вещества [28]. В данном случае эндотермические фазовые переходы являются обратимыми, что подтверждает (как и термическую стабильность комплекса) совпадение результатов при неоднократном проведении экспериментов с одним и тем же образцом.
Таблица 1.
Термодинамические параметры (изменение энтальпии, энтропии) и температуры фазовых переходов для комплекса Ru(thd)3, полученные методом ДСК
| Вещество | Процесс | ΔН(T), кДж/моль | ΔS°(T), Дж/(моль K) | T, K | Количество экспериментов |
|---|---|---|---|---|---|
| α-Ru(thd)3 | α → β | 13.3 ± 2.0 | 30.6 ± 4 | 434.8 ± 2.0 | 15 |
| β-Ru(thd)3 | β → γ | 2.1 ± 0.5 | 4.6 ± 1.0 | 452.2 ±1.0 | 16 |
| γ-Ru(thd)3 | γ → δ | 6.0 ± 2.0 | 13 ± 2 | 461.1 ± 1.0 | 16 |
| δ-Ru(thd)3 | Плавление | 3.8 ± 1.0 | 7.8 ± 1.0 | 487.8 ± 1.0 | 3 |
Графическая зависимость давления насыщенного пара Ru(thd)3 от температуры, полученная тензиометрическим методом, а также температуры фазовых превращений, измеренные методом ДСК, представлены на рис. 1. Наблюдаемые изменения угла наклона логарифма давления от обратной температуры вследствие фазовых превращений хорошо согласуются с данными табл. 1. По результатам двух методов, кристаллическое соединение в относительно узком температурном интервале 392–488 K вблизи температуры плавления претерпевает три обратимых фазовых перехода. Для каждой фазы были рассчитаны термодинамические характеристики процессов парообразования, полученные значения приведены в табл. 2.
Рис. 1.
Температурные зависимости давления насыщенного пара над твердым Ru(thd)3, рассчитанные из экспериментальных данных по количеству сублимированного вещества при температуре Т (светлые символы) и из массы транспортированного вещества, сконденсированного в холодной зоне (темные символы). Приведены температуры фaзовых превращений, измеренные методом ДСК.
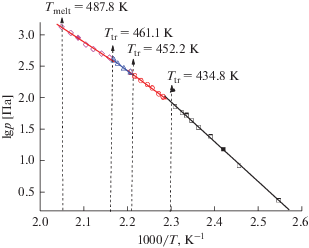
Таблица 2.
Температурные зависимости давления насыщенного пара и термодинамические характеристики процессов сублимации Ru(thd)3
| Фаза вещества | ln p [Пa] = (A – B)/T | ΔН(T*), кДж/моль | ΔS°(T*), Дж/(моль K) | Интервал температур, K | N | |
|---|---|---|---|---|---|---|
| A | B | |||||
| α-Ru(thd)3 | 37.85 | 14 522 | 121 ± 1 | 219 ± 3 | 392–433 | 21 |
| β-Ru(thd)3 | 32.75 | 12 332 | 103 ± 3 | 176 ± 7 | 438–453 | 22 |
| γ-Ru(thd)3 | 32.34 | 12 150 | 101 ± 5 | 173 ± 10 | 453–461 | 12 |
| δ-Ru(thd)3 | 28.46 | 10 383 | 86 ± 2 | 141 ± 4 | 463–488 | 13 |
Результаты расчетов CVD-диаграмм
Для оценки возможности использования тех или иных исходных веществ с целью получения фаз требуемого состава и оптимизации условий CVD-процессов целесообразно применять метод термодинамического моделирования. Наиболее наглядно результаты расчетов могут быть представлены в виде CVD-диаграмм, показывающих состав находящихся в равновесии с газом конденсированных фаз в зависимости от условий проведения процесса.
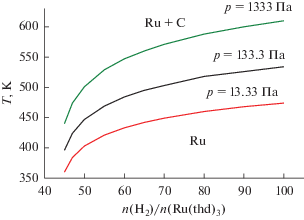
По результатам термодинамического моделирования, осаждение металлического рутения возможно как в среде водорода, так и в кислородной атмосфере. На рис. 2 приведена CVD-диаграмма для системы Ru(thd)3 + H2, из которой следует, что осаждение Ru без примеси углерода возможно при относительно невысоких температурах. При повышении общего давления в системе температура фазовой границы повышается.
Рис. 2.
CVD-диаграмма системы Ru(thd)3 + H, показывающая температуры фазовых границ в зависимости от количества водорода и общего давления.
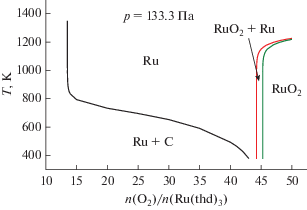
На рис. 3 приведена CVD-диаграмма для системы Ru(thd)3 + O2, которая представляет температуры фазовых границ в зависимости от молярного отношения кислорода и исследуемого прекурсора. Осаждение Ru без примеси углерода прогнозируется при повышенных температурах вплоть до образования фазы, содержащей оксид рутения RuO2 (n(O2)/n(Ru(thd)3) > 45). С ростом общего давления температуры фазовых границ также повышаются.
Рис. 3.
Равновесная CVD-диаграмма системы Ru(thd)3 + О2, показывающая температуры границ между фазовыми комплексами в зависимости от количества кислорода.
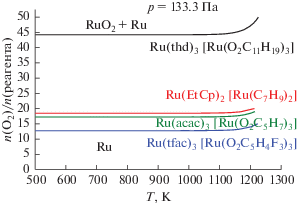
Интересно сравнить условия получения металлических и оксидных покрытий осаждением из газовой фазы Ru(thd)3 с использованием других металлоорганических соединений рутения. На рис. 4 приведены результаты термодинамического моделирования CVD-процесса в атмосфере кислорода при использовании в качестве прекурсоров трифторацетонатного Ru(tfac)3, ацетилацетонатного Ru(acac)3 β-дикетонатных летучих комплексов рутения и [Ru(EtCp)2] в сравнении с Ru(thd)3. Молярное отношение кислорода к прекурсору на границе образования оксида RuO2 существенно зависит от состава исходного соединения и связано в основном с содержанием углерода и фтора в молекуле вещества. В связи с этим для получения оксидных покрытий предпочтительно использовать Ru(tfac)3 (меньший расход кислорода), а для металлических покрытий – Ru(thd)3 (более широкая область условий).
ЗАКЛЮЧЕНИЕ
Проведено комплексное термодинамическое исследование Ru(thd)3 с целью использования его в качестве предшественника для получения металлических и оксидных покрытий методом CVD.
При изучении соединения методами дифференциальной сканирующей калориметрии и тензометрии определены термодинамические параметры трех твердофазных переходов и процесса плавления. Наличие таких превращений в кристаллическом состоянии характерно и для других комплексных соединений с thd-лигандами. Полученные экспериментальные данные по зависимости давления насыщенного пара от температуры и термодинамические характеристики процессов парообразования позволяют прецизионно контролировать процесс парообразования исходного вещества в испарителе CVD-реактора и его доставку в реакционную зону в ходе CVD-процесса.
Термодинамическое моделирование системы Ru–O–C–H–(F) в различных условиях демонстрирует принципиальную возможность CVD-процессов получения металлических и оксидных покрытий. Полученные результаты позволяют дать рекомендации по нахождению оптимальных условий проведения процесса и выбору прекурсора.
Список литературы
Lai Y.H., Chen Y.L., Chi Y. et al. // J. Mater. Chem. 2003. V. 13. P. 1999.
Premkumar P.A., Prakash N.S., Gaillard F. et al. // Mater. Chem. Phys. 2011. V. 125. P. 757. https://doi.org/10.1016/j.matchemphys.2010.09.062
Morozova N.B., Gelfond N.V., Semyannikov P.P. et al. // J. Struct. Chem. 2012. V. 53. P. 725. https://doi.org/10.1134/S0022476612040154
Wang F.Z., Xu Q., Tan Z.A. et al. // J. Mater. Chem. 2014. V. A2. P. 1318.
Bilyalova A.A., Tatarin S.V., Kalle P. et al. // Russ. J. Inorg. Chem. 2019. V. 64. P. 207. [Билялова А.А., Татарин С.В., Калле П. и др. // Журн. неорган. химии. 2019. Т. 64. № 2. С. 172.]https://doi.org/10.1134/S0036023619020037
Morozova E.A., Malkerova I.P., Kiskin M.A., Alikhanyan A.S. // Russ. J. Inorg. Chem. 2018. V. 63. P. 1436. [Морозова Е.А., Малкерова И.П., Кискин М.А., Алиханян А.С. // Журн. неорган. химии. 2018. Т. 63. № 11. С. 1414.]https://doi.org/10.1134/S0036023618110128
Levchenko M., Matskevich N.I., Kerzhentseva V.E. et al. // Russ. J. Inorg. Chem. 2018. V. 63. P. 923. [Левченко Л.М., Мацкевич Н.И., Керженцева В.Е. и др. // Журн. неорган. химии. 2018. Т. 63. С. 880.]https://doi.org/10.1134/S0036023618070136
Aliev I.I., Magammedragimova R.S., Aliev O.M. et al. // Russ. J. Inorg. Chem. 2019. V. 64. P. 527. [Алиев И.И., Магаммедрагимова Р.С., Алиев О.М., Бабанлы К.Н. // Журн. неорган. химии. 2019. Т. 64. С. 421.]https://doi.org/10.1134/s003602361904003x
Demina L.I., Kostikova G.V., Zhilov V.I. // Russ. J. Inorg. Chem. 2019. V. 64. P. 323. https://doi.org/10.1134/S0036023619030082
Berkin S., Hrovat M., Kolar D. // J. Mater. Sci. Lett. 1990. V. 10. P. 69.
Lai Y.-H., Chou T.-Y., Song Y.-H. et al. // Chem Mater. 2003. V. 15. P. 2454.
Shibutami T., Kawano K., Oshima N. et al. // Electrochem. Solid-State Lett. 2003. V. 6. P. 117. https://doi.org/10.1149/1.1592374
Johnston S., Feller D., Dubin V., Moon P. // Conference Proceedings AMC XIX. 2004. P. 335.
Park H.L., Chung C.H., Kim C.H., Kim S.H. // J. Mater. Sci. Lett. 1987. V. 6. P. 1093. https://doi.org/10.1007/BF01729143
Barreca D., Buchberger A., Daolio S. et al. // Langmuir. 1999. V. 15. P. 4537.
Bond G.C., Slaa J.C. // J. Mol. Catal. A. 1995. V. 101. P. 243.
Uner D.O., Pruski M., King T.S. // J. Catal. 1995. V. 156. P. 60.
Sierra M.C.S., Ruiz J.G., Proietti M.G., Blasco J. // J. Mol. Catal. A. 1995. V. 96. P. 65. https://doi.org/10.1016/1381-1169(94)00022-0
Patil Y.P., Tambade P.J., Nandurkar N.S., Bhanage B.M. // Catal. Commun. 2010. V. 9. P. 2068.
Kolesnik V.D., Ashirov R.V., Sheglova N.M. // R.F. Patent. 2011. № 2. P. 409.
Lashdaf M., Krause A.O.I., Lindblad M. et al. // Appl. Catal., A. 2003. V. 241. P. 65. https://doi.org/10.1016/S0926-860X(02)00423-4
Duman S., Ozkar S. // Int. J. Hydrogen Energy. 2013. V. 38. P. 180.
Lashdaf M., Hatanpää T., Tiitta M. // J. Therm. Anal. Calorim. 2001. V. 64. P. 1171. https://doi.org/10.1023/A:1011549130134
Bykov A.F., Morozova N.B., Igumenov I.K., Sysoev S.V. // J. Therm. Anal. 1996. V. 46. P. 1551. https://doi.org/10.1007/BF01980761
Sysoev S.V., Naumov D.Yu., Kuratieva N.V. et al. // J. Struct. Chem. 2016. V. 57. P. 826. [Сысоев С.В., Наумов Д.Ю., Куратьева Н.В. и др. // Журн. структур. химии. 2016. Т. 57. № 4. С. 865.]https://doi.org/10.1134/S0022476616040314
Sang Y.K., Kook H.C., Seok K.L. et al. // J. Electrochem. Soc. 2000. V. 147. P. 1161.
Morozova N.B., Mit’kin V.N., Igumenov I.K. et al. // Russ. J. Coord. Chem. 1989. V. 15. P. 110.
Vikulova E.S., Zherikova K.V., Korolkov I.V. et al. // J. Therm. Anal. Calorim. 2014. V. 118. P. 849. https://doi.org/10.1007/s10973-014-3997-7
Суворов А.В. Термодинамическая химия парообразного состояния. Л.: Химия, 1970. С. 2055.
Vikulova E.S., Cherkasov S.A., Nikolaeva N.S. et al. // J. Therm. Anal. Calorim. 2019. V. 135. P. 2573. https://doi.org/10.1007/s10973-018-7371-z
Kuznetsov F.A., Titov V.A., Borisov S.V., Vertoprakhov V. // CODATA Bulletin Abstracts from the 11th International CODATA Conference. 1988. № 68. P. 9.
Фундаментальные основы процессов химического осаждения пленок и структур для наноэлектроники / Под ред. Смирновой Т.П. Новосибирск: Изд-во СО РАН, 2013. 176 с.
Термодинамические свойства индивидуальных веществ: Справочное издание / Под ред. Гурвича Л.В. и др. М.: Наука, 1979.
Shestakov V.A., Ermakova E.N., Sysoev S.V. // Russ. Chem. Bull. 2018. V. 67. P. 980. [Шестаков В.А., Ермакова Е.Н., Сысоев С.В. и др. // Изв. АН. Сер. хим. 2018. № 6. С. 980.]https://doi.org/10.1007/s11172-018-2167-7
Vikulova E.S., Zherikova K.V., Sysoev S.V. et al. // J. Therm. Anal. Calorim. 2019. V. 137. P. 923. https://doi.org/10.1007/s10973-018-07991-y
Zherikova K.V., Morozova N.B., Zelenina L.N. et al. // J. Therm. Anal. Calorim. 2008. V. 92. № 3. P. 729.
Mishin V.Y., Solovev S.M., Chinenov P.P. // Soviet Radiochem. 1985. V. 27. P. 333. [Мишин В.Я., Соловьев С.М., Чиненов П.П. и др. // Радиохимия. 1985. № 3. С. 354.]
Ahmed M.A.K., Fjellvåg H., Kjekshus A. et al. // Z. Anorg. Allg. Chem. 2008. V. 634. P. 247. https://doi.org/10.1002/ZAAC.200700462
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии