Журнал неорганической химии, 2020, T. 65, № 6, стр. 809-816
Синтез, строение и электромагнитные характеристики стеарата гадолиния
С. Н. Иванин a, *, В. Ю. Бузько a, А. И. Горячко a, В. Т. Панюшкин a
a Кубанский государственный университет
350040 Краснодар, ул. Ставропольская, 149, Россия
* E-mail: Ivanin18071993@mail.ru
Поступила в редакцию 14.09.2019
После доработки 03.12.2019
Принята к публикации 27.01.2020
Аннотация
Синтезирован порошок стеарата гадолиния и методом растровой электронной микроскопии исследована его микроструктура. С помощью ИК-спектроскопии, рентгенофазового и элементного анализа установлен его состав и предполагаемое строение. Методом молекулярной механики выполнено молекулярное моделирование пространственной цепной структуры стеарата гадолиния для девятикоординированного состояния центрального иона Gd(III). С помощью векторного анализатора цепей исследованы магнитные и диэлектрические свойства стеарата гадолиния в зависимости от частоты приложенного электромагнитного излучения.
ВВЕДЕНИЕ
В последнее время большое внимание уделяется исследованиям пленок Ленгмюр–Блоджетт на основе стеарата гадолиния [1–5]. Особый интерес вызывают зависящие от температуры и числа слоев магнитные свойства пленок стеарата гадолиния. Ранее магнитные свойства пленок стеарата гадолиния уже исследовали методами вибрационной [6] и силовой магнитометрии Фарадея при низких температурах [7], ЭПР-спектроскопии [8], а также магнитно-индуцированной оптической генерацией второй гармоники [9]. В указанных выше работах [1–7, 9] для получения ультратонких пленок стеарата гадолиния к водному раствору хлорида или ацетата гадолиния добавляли хлороформный раствор стеариновой кислоты, в процессе испарения хлороформа на поверхности воды образовывался монослой стеарата гадолиния, который в последующем переносили на подложку для образования пленки Ленгмюра–Блоджетт.
Данных по исследованию электромагнитных свойств порошков индивидуального стеарата гадолиния в литературе не обнаружено. Однако знание электромагнитных свойств стеарата гадолиния в виде порошка могло бы отразить важность эффекта упорядочивания пространственной сетки стеарата гадолиния на его магнитные свойства.
В настоящей работе растворным методом нами синтезирован порошок стеарата гадолиния и с помощью векторного анализатора цепей исследованы его электродинамические параметры (частотные зависимости магнитной и диэлектрической проницаемости).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез порошка стеарата гадолиния проводили по методу, описанному в работе [10]. К эквивалентной смеси водных растворов хлорида гадолиния (GdCl3) квалификации “х. ч.” и стеариновой кислоты (C17H35COOH) квалификации “ч.” по каплям добавляли 25%-ный водный раствор гидроксида аммония квалификации “ос. ч.” для поддержания pH в ходе синтеза на уровне 7 ± 0.1. Процесс синтеза стеарата гадолиния, проходивший в течение 1 ч при постоянной температуре растворной смеси (76°C), можно описать уравнением реакции:
(1)
$\begin{gathered} {\text{GdC}}{{{\text{l}}}_{3}} + 3{{{\text{C}}}_{{{\text{17}}}}}{{{\text{H}}}_{{{\text{35}}}}}{\text{COOH}} \to \\ \to {\text{Gd}}{{\left( {{{{\text{C}}}_{{{\text{17}}}}}{{{\text{H}}}_{{{\text{35}}}}}{\text{COO}}} \right)}_{3}} + 3{\text{HCl}}. \\ \end{gathered} $После завершения реакции образовывался восковидный порошок стеарата гадолиния, который отделяли от маточного раствора центрифугированием, трижды промывали смесью деионизированной воды с 94%-ным этанолом (1 : 1 по объему) и высушивали в течение 24 ч в сушильном шкафу при 75°C.
ИК-спектр синтезированного порошка стеарата гадолиния исследовали методом ИК-спектроскопии с использованием Bruker VERTEX 70. Для определения структуры порошка стеарата гадолиния применяли метод порошкового рентгенофазового анализа (рентгеновский дифрактометр Shimadzu XRD-7000 X-RAY Diffractometer). Образец исследовали в диапазоне углов 2θ от 3° до 70° с шагом сканирования 0.02°, время съемки в точке шага сканирования 1.2 с, использовали CuKα‑излучение (λ = 1.5406 Å) при токе 30 мА и ускоряющем напряжении 40 кВ. Измерения кривых зависимости интенсивности дифракционной картины от угла отражения 2θ проводили при комнатной температуре. Элементный состав порошка стеарата гадолиния был подтвержден методом C,H,N-анализа с использованием элементного анализатора vario MICRO cube. Микроструктуру порошка GdSt3 исследовали методом растровой электронной микроскопии на микроскопе сверхвысокого разрешения JEOL JSM-7500F.
Молекулярное моделирование возможных модельных структур стеарата Gd(III) осуществляли методом молекулярной механики с силовым полем ММ+ в программе HyperChem 8.06. Проводили полную оптимизацию геометрии металлокомплексов без каких-либо ограничений по симметрии по достижении оптимизационного предела 0.01 ккал/моль методом сопряженных градиентов Поллака–Рибера.
Для определения магнитных и диэлектрических свойств порошка GdSt3 были измерены параметры рассеяния (S-параметры) для порошка в коаксиальной ячейке. Применяли режим линии передачи между первым и вторым портами с использованием векторного анализатора цепей Deepace KC901V в диапазоне 0.03–7 ГГц. Образцы исследуемого вещества были изготовлены в форме тороида с внутренним диаметром 3.05 мм, внешним диаметром 7 мм и толщиной 3 мм. Значения диэлектрической и магнитной проницаемости рассчитывали из измеренных значений S11 и S21 по алгоритму Николсона–Росса–Вейра [11–14].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
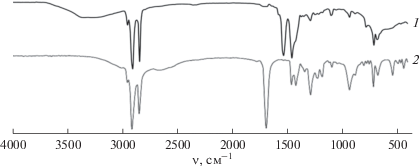
В ИК-спектре синтезированного порошка стеарата гадолиния содержатся интенсивные полосы поглощения в областях 2920–2850 и 1550–1420 см–1 и полосы слабой и средней интенсивности в области 1300–690 см–1 (рис. 1). Для сравнения на графике представлен ИК-спектр чистой стеариновой кислоты, которую использовали при синтезе стеарата гадолиния.
Максимумы поглощения в ИК-спектре при 2640, 1700, 1450, 950, 690 и 550 см–1, характерные для жирных кислот, указывают на наличие в исследуемом соединении карбоксильной группы в виде димерной структуры и подтверждают существование межмолекулярной водородной связи между двумя молекулами стеариновой кислоты согласно данным [15–19]. Полосы поглощения при 2910 и 2850 см–1 отвечают соответственно асимметричным и симметричным валентным колебаниям метиленовых группировок (–CH2–), а полоса при 1466 см–1 – их деформационным колебаниям. Как видно из рис. 1, для стеариновой кислоты наблюдаются четко выраженный пик поглощения при 1700 см–1 из-за растягивающих колебаний C=O в группе карбоновой кислоты (–COOH) и полоса поглощения при 1300 см–1, соответствующая колебательному растяжению и деформации группировки (C–H–O). Пик поглощения при 1429 см–1 соответствует деформационному колебанию (HO–C) в ОН-плоскости. При 950 см–1 наблюдается внеплоскостное деформационное, при 690 см–1 – деформационное сгибательное и при 550 см–1 – вилятельное колебания группировки HO–C–O. Обработанные нами данные ИК-спектра стеариновой кислоты коррелируют с таковыми для стеариновой кислоты в работах [20–22].
Полоса поглощения в ИК-спектре при 1700 см–1 имеет интенсивный пик для стеариновой кислоты, однако для стеарата гадолиния она размывается и появляются два интенсивных пика, которым соответствуют асимметричные (1541 см–1) и симметричные (1426 см–1) растягивающие колебания карбоксилат-иона, что коррелирует с данными [23–26]. Исчезновение карбоксильного пика поглощения при 1700 см–1 в ИК-спектре подтверждает образование стеарата гадолиния и указывает на ионный характер связи этого соединения. Согласно [27], по величине ∆ν, равной разности пиков асимметричного и симметричного растягивающих колебаний карбоксилат-иона, можно предположительно сказать о типе координации карбоксилатной группировки по отношению к иону лантаноида (Δν = 100 см–1 соответствует хелатирующая бидентатная координация карбоксилат-аниона, Δν = 150–170 см–1 – бидентатная мостиковая, а Δν = 138 см–1 – ионная тридентатная координация карбоксилат-аниона). Для исследуемого стеарата гадолиния величина ∆ν = 115, следовательно, можно сделать вывод, что карбоксилатная группа в стеарате гадолиния преимущественно имеет бидентатную хелатную координацию. Широкая полоса валентных (–ОН) колебаний при 3300 см–1 указывает на присутствие молекул воды в синтезированном порошке стеарата гадолиния.
Согласно данным [28], для упаковки триклинных или гексагональных цепей жирных кислот ожидается одна полоса для метиленовых группировок (–CH2) около 720 см–1, однако расщепление этой полосы свидетельствует об орторомбической или моноклинной упаковке, что наблюдается как для чистой стеариновой кислоты, так и для синтезированного нами стеарата гадолиния.
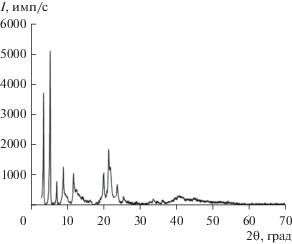
Рентгенограмма синтезированного стеарата гадолиния показана на рис. 2. Согласно данным [29–33], для соединений стеариновой кислоты с металлами характерно наличие на порошковой рентгенограмме двух областей с ярко выраженными рефлексами: первой области соответствуют рефлексы при углах 2θ = 0°–15°, второй – рефлексы при углах дифракции 2θ = 20°–30°. Так, в работе [29] исследованы порошки стеарата магния (MgSt2) как порошкового лубриканта для фармацевтических таблеток. РФА показал наличие пяти рефлексов в интервале углов 2θ = 5°–13° и четырех рефлексов в интервале 2θ = 20°–25° у моногидрата стеарата магния и наличие двух рефлексов в интервале 2θ = 5°–10° и четырех рефлексов в интервале 2θ = 21°–26° у дигидрата стеарата магния. Согласно [30], тригидрат стеарата магния характеризуется наличием слабовыраженных рефлексов при углах 2θ = 2.5°, 4.5° и 14° и двух ярко выраженных рефлексов при 2θ = 19° и 23°. В работах [31, 32] изучали стеарат кальция (CaSt2). Результаты его рентгенофазового анализа также показали наличие трех ярко выраженных рефлексов в интервале 2θ = 5°–15° и пяти рефлексов в интервале 2θ = 20°–27°. Похожие рентгенограммы имеют и стеараты цинка (ZnSt2), меди (CuSt2) и свинца (PbSt2) в работе [33]. Интенсивность и полуширина (т.е. угловая ширина пика на половине его максимальной интенсивности) рефлексов являются мерой степени кристалличности образца. Результаты проведенного литературного анализа и полученные нами данные рентгенофазового и элементного анализа (С – 61.52%, H – 10.5%) подтверждают, что синтезированное нами вещество является хорошо кристаллизованным порошком кристаллогидрата стеарата гадолиния и имеет состав Gd(C18H35O2)3 · 2.42H2O.
Межплоскостное расстояние между слоями, соответствующее расстоянию между двумя последовательными слоями ионов гадолиния(III), рассчитывали по рефлексам рентгенограммы, используя уравнение Вульфа–Брегга (nλ = 2d sin θ); полученные данные приведены в табл. 1.
Таблица 1.
Данные рентгенофазового анализа и рассчитанное межплоскостное расстояние для исследуемого порошка стеарата гадолиния
| № пика | 2θ | λ/2 sin θ | d, Å | n |
|---|---|---|---|---|
| 1 | 3.61 | 24.49 | 48.99 | 2 |
| 2 | 5.41 | 16.31 | 48.93 | 3 |
| 3 | 7.23 | 12.21 | 48.84 | 4 |
| 4 | 9.04 | 9.77 | 48.85 | 5 |
| 5 | 11.01 | 8.02 | 48.15 | 6 |
| 6 | 12.62 | 7.00 | 48.98 | 7 |
| 7 | 14.29 | 6.18 | 49.43 | 8 |
| 8 | 16.48 | 5.36 | 48.23 | 9 |
| 9 | 20.11 | 4.39 | 48.31 | 11 |
| 10 | 21.46 | 4.12 | 49.38 | 12 |
| 11 | 23.81 | 3.71 | 48.23 | 13 |
| 12 | 25.52 | 3.46 | 48.45 | 14 |
| 13 | 33.01 | 2.68 | 48.15 | 18 |
| 14 | 36.23 | 2.44 | 48.75 | 20 |
Таким образом, для исследованного порошка синтезированного стеарата гадолиния рассчитанное среднее значение межплоскостного расстояния dср = 48.69 Å.
Дифракционные пики на рентгенограмме исследованного порошка стеарата гадолиния соответствуют последовательным отражениям и указывают на наличие в нем пластинчатой структуры. Эти плоскости отделены друг от друга бислоем полностью вытянутых радикалов жирных кислот. Межплоскостное расстояние между слоями соответствует расстоянию между двумя последовательными слоями ионов гадолиния(III). Таким образом, можно сделать вывод, что исследованный образец стеарата гадолиния представляет собой двухслойную структуру. Этот вывод подтверждается хорошим согласием экспериментального (dср = 48.69 Å) и расчетного (dмакс = 49.99 Å) максимальных средних межплоскостных расстояний. Максимальное среднее межплоскостное расстояние между двухслойной структурой было рассчитано для радикалов жирных кислот, перпендикулярных плоскостям ионов гадолиния(III), по формуле из работы [27]:
где n – общее количество атомов углерода, dC–H = = 1.09 Å, dC–C = 1.54 Å и dC–O = 1.36 Å. Ионный радиус гадолиния(III) для КЧ = 9 был взят из работы Шеннона [34]. Двухслойная структура соединений металлов с жирными кислотами также предложена авторами работы [35].
Исследование синтезированного порошка стеарата гадолиния методом растровой электронной микроскопии при увеличении в 1000 раз показало, что синтезированный материал представляет собой пластинчатые микрочастицы со средним размером ∼6 мкм и высокой степенью однородности поверхности (рис. 3а). Однако дальнейший анализ микроструктуры порошка стеарата гадолиния при увеличении в 5000 раз (рис. 3б) показал, что пластинчатые микрочастицы имеет выраженную слоистую структуру.
Рис. 3.
Изображения синтезированного стеарата гадолиния, полученные на растровом электронном микроскопе при увеличении в 1000 (а) и 5000 раз (б).

Молекулярное моделирование стеаратного аквакомплекса иона Gd(III) в девяти- и восьмикоординированном состоянии с тремя стеарат-анионами и тремя/двумя молекулами воды на одну формульную единицу стеарата гадолиния показало, что наиболее энергетически устойчивыми являются координационные узлы с КЧ = 9. На основании проведенного нами молекулярного моделирования можно сделать вывод, что структура карбоксилатов редкоземельных элементов может быть как моноядерной, так и биядерной, как это экспериментально наблюдалось для пивалатных комплексов лантаноидов в работе [36]. Молекулярное моделирование моноядерного стеаратного аквакомплекса иона Gd(III) в девятикоординированном состоянии с тремя стеарат-анионами и тремя молекулами воды показало, что точечная группа симметрии координационного узла [Gd(St)3(H2O)3] близка к C3 (рис. 4а). Проведено также молекулярное моделирование биядерного стеаратного аквакомплекса иона Gd(III) в девятикоординированном состоянии с шестью стеарат-анионами и шестью молекулами воды [Gd2(St)6(H2O)6] (рис. 4б). Смоделированы декамерный цепочечный фрагмент ([Gd(St)3(H2O)3])10 (рис. 4в) и пентамерный биядерного типа цепочечный фрагмент ([Gd2(St)6(H2O)6])5 (рис. 4г) с мостиковыми молекулами воды, связывающими мономерные фрагменты стерата гадолиния в полимерные цепи. Поскольку одна молекула воды является мостиковой, соединяющей атомы иона гадолиния мономерных фрагментов, координационное число принимает значение 8.5.
Рис. 4.
Модельные структуры моноядерного стеаратного аквакомплекса иона Gd(III) (а), биядерного стеаратного аквакомплекса иона Gd(III) (б), декамерного цепочечного фрагмента ([Gd(St)3(H2O)3])10 (в) и пентамерного биядерного типа цепочечного фрагмента ([Gd2(St)6(H2O)6])5 (г).
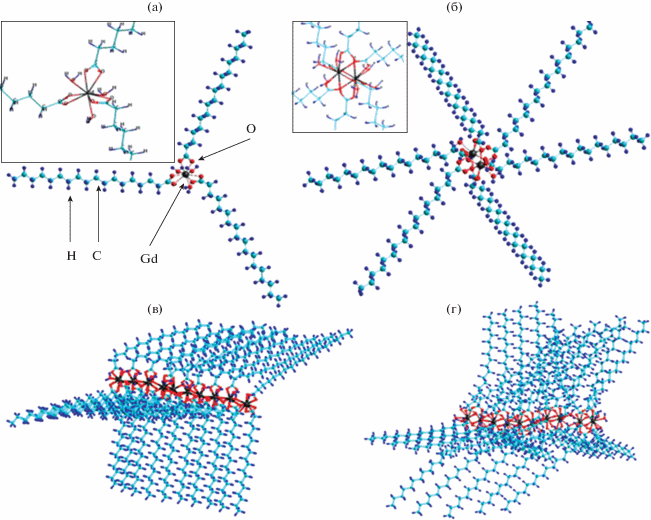
Рассчитанная энергия образования полимерной металлокомплексной цепи, состоящей из пяти димерных мономеров аквакомплекса стеарата гадолиния с эффективным координационным числом, равным 8.5, составляет 1268.07 ккал/моль, а энергия образования димера стеаратного аквакоплекса гадолиния – 220.52 ккал/моль; соответственно рассчитанный энергетический эффект образования цепной полимерной биядерной структуры равен 33.09 ккал/моль на димерный фрагмент [Gd2(St)6(H2O)6], что говорит о затратах энергии на образование таких полимерных биядерных структур.
Рассчитанная энергия образования полимерной металлокомплексной цепи, состоящей из десяти одноядерных мономеров аквакомплекса стеарата гадолиния с эффективным координационным числом, также равным 8.5, составляет 770.95 ккал/моль, а энергия образования одноядерного мономера аквакомплекса девятикоординированного стеарата гадолиния – 89.91 ккал/моль. В этом случае рассчитанный энергетический эффект образования такой цепочечной полимерной моноядерной структуры равен 12.82 ккал/моль на фрагмент.
На основании проведенных расчетов можно сделать вывод, что полимерная цепочка, состоящая из одноядерных аквакомплексов стеарата гадолиния, более вероятна в условиях комнатных температур. Этот факт подтверждается также, если учитывать значение параметра ∆ν, который для нашего образца имеет значение 115 см–1. Согласно данным [27, 37], для образцов карбоксилатов лантаноидов с Δν = 100 см–1 характерна хелатирующая бидентатная координация карбоксилат-аниона, а для образцов карбоксилатов лантаноидов с Δν = = 150–170 см–1 – бидентатная мостиковая координация. Таким образом, полученные нами данные ИК-спектроскопии, предположительно, могут свидетельствовать о сосуществовании двух типов координационных цепных структур как моноядерного, так и биядерного строения при преобладании моноядерного типа структурного мотива. Необходимо также учитывать, что синтез стеарата гадолиния проводили при нагревании до 76°С, так же как и сушку порошка осуществляли при температуре 75 ± 1°С, что может приводить к образованию энергетически затратных димерных структур в порошке стеарата гадолиния.
Рассчитанное методом молекулярной механики среднее расстояние Gd–Gd в цепочечной структуре ([Gd(St)3(H2O)3])10 составляет 4.11 ± 0.05 Å, а в димерной цепочечной структуре ([Gd2(St)6(H2O)6])5 – 3.48 ± 0.15 Å. Согласно [38, 39], среднее расстояние Gd–Gd в биядерных и цепочечных карбоксилатах гадолиния составляет от 3.76 до 4.62 Å. По данным [38], для биядерных и цепочечных карбоксилатов гадолиния с расстояниями Gd–Gd от 4.06 до 4.58 Å характерен ферромагнетизм; по данным [39], этот диапазон составляет от 4.07 до 4.41 Å. Таким образом, на основании проведенных расчетов методом молекулярной механики можно предполагать, что исследуемый порошок стеарата гадолиния должен обладать ферромагнитными свойствами.
На рис. 5 представлены графики зависимости рассчитанной магнитной и диэлектрической проницаемости для спрессованного образца порошка GdSt3 от частоты приложенного электромагнитного поля на основании измерений в коаксиальной линии. Согласно алгоритму Николсона–Росса–Вейра, по измеренным параметрам рассеяния S11 и S21 можно определить магнитную (μ) и диэлектрическую (ε) проницаемость в комплексном виде, однако на графике мы показали только действительную часть электромагнитных составляющих (μ', ε' – безразмерные величины), так как их мнимые части (μ", ε") во всем диапазоне измерений практически близки к нулю. Например, среднее значение тангенса угла диэлектрических потерь (ε"/ε') для исследованного образца стеарата гадолиния в используемом диапазоне частот составляет tgε = 0.0081 по сравнению с tgε = 0.0042 для стеариновой кислоты.
Рис. 5.
Графики зависимости магнитной (а) и диэлектрической проницаемости (б) порошка GdSt3 (1) и стеариновой кислоты (2) от частоты приложенного электромагнитного излучения.
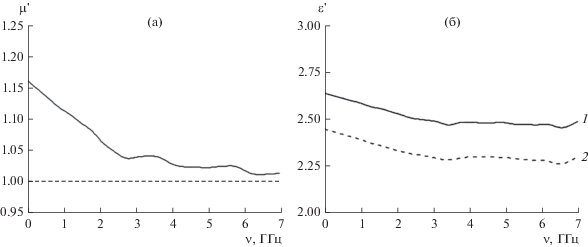
Из полученных данных видно, что при увеличении частоты электромагнитного поля магнитная проницаемость синтезированного порошка GdSt3 постепенно снижается от 1.162 при 30 МГц до 1.017 при 7 ГГц. Этот факт свидетельствует о наличии магнитных свойств (магнитная проницаемость имеет значение >1) у твердого GdSt3, а также отражает ослабление магнитных свойств с уменьшением значения магнитной проницаемости GdSt3 при переходе к СВЧ-частотам >7 ГГц, т.е. предел Сноека для исследованного образца стеарата гадолиния >7 ГГЦ. Диэлектрическая проницаемость порошка GdSt3 имеет слабую зависимость от частоты электромагнитного поля, так как наблюдается небольшое ослабление значения диэлектрической проницаемости от 2.65 до 2.45 в диапазоне частот от 30 МГц до 3.4 ГГц и далее до 7 ГГц наблюдается практически неизменное значение диэлектрической проницаемости GdSt3 на уровне 2.4. Следует отметить, что диэлектрическая проницаемость спрессованного порошка чистой стеариновой кислоты, измеренная в диапазоне частот от 30 МГц до 3.4 ГГц, составляет от 2.44 до 2.31 и до 7 ГГц имеет практически постоянное значение 2.3. Это коррелирует с данными работы [40], в которой диэлектрическая проницаемость стеариновой кислоты равна 2.3 при частоте электромагнитного поля 3.5 ГГц. Заметная разница между наблюдаемой диэлектрической проницаемостью стеариновой кислоты и стеаратом гадолиния может дополнительно свидетельствовать о наличии как минимум одной или нескольких поляризованных молекул воды в координационной сфере иона Gd(III) в синтезированном порошке стеарата гадолиния.
ЗАКЛЮЧЕНИЕ
Синтезированный порошок стеарата гадолиния, по данным элементного анализа, ИК-спектроскопии и электродинамических измерений, состоит из гидратированных Gd(III)-стеаратных структурных единиц и, предположительно, содержит моноядерные цепочечные структуры наряду с биядерными цепочечными фрагментами. Исследование параметров электродинамических характеристик синтезированного порошка стеарата гадолиния показало наличие у него выраженных магнитных свойств при комнатной температуре.
Список литературы
Maiti S., Sanyal M.K., Mukhopadhyay M.K. et al. // Chem. Phys. Lett. 2018. V. 712. P. 177. https://doi.org/10.1016/j.cplett.2018.10.003
Kov’ev E.K., Polyakov S.N., Tishin A.M. et al. // Cryst. Rep. 2002. V. 47. № 3. P. 507. https://doi.org/10.1134/1.1481943
Khomutov G.B., Tishin A.M., Polyakov S.N. et al. // Colloids Surf. A. 2000. V. 166. P. 33. https://doi.org/10.1016/s0927-7757(99)00523-3
Tishin A.M., Koksharov Yu.A., Bohr J. et al. // Phys. Rev. B. 1997. V. 55. № 17. P. 11064. https://doi.org/10.1103/physrevb.55.11064
Tishin A.M., Snigirev O.V., Khomutov G.B. et al. // J. Magn. Magn. Mater. 2001. V. 234. № 3. P. 499. https://doi.org/10.1016/s0304-8853(01)00389-4
Mukhopadhyay M.K., Sanyal M.K., Mukadam M.D. et al. // Phys. Rev. B. 2003. V. 68. № 17. P. 174427. https://doi.org/10.1103/physrevb.68.174427
Mukhopadhyay M.K., Sanyal M.K., Sakakibara T. et al. // Phys. Rev. B. 2006. V. 74. № 1. P. 014402. https://doi.org/10.1103/physrevb.74.014402
Koksharov Yu.A., Bykov I.V., Malakho A.P. et al. // Mater. Sci. Eng. C. 2002. V. 22. № 2. P. 201. https://doi.org/10.1016/s0928-4931(02)00181-9
Aktsipetrov O.A., Didenko N.V., Fedyanin A.A. et al. // Mater. Sci. Eng. C. 1999. V. 8. P. 411. https://doi.org/10.1016/s0928-4931(99)00027-2
Li J., Sun X., Liu S. et al. // Key Eng. Mater. 2013. V. 544. P. 3. https://doi.org/10.4028/www.scientific.net/kem.544.3
Nicolson A.M., Ross G.F. // IEEE Trans. Instrum. Meas. 1970. V. IM-19. № 4. P. 377. https://doi.org/10.1109/tim.1970.4313932
Baker-Jarvis J., Janezic M.D., Riddle B.F. et al. Measuring the permittivity and permeability of lossy materials: Solids, liquids, metals, building materials, and negative-index materials. Washington: U.S. Government Printing Office, 2005. 172 p.
De Paula A.L., Rezende M.C., Barroso J.J. // SBMO/ IEEE MTT-S Inter. Mic. Optoel. Conf. (IMOC 2011). 2011. https://doi.org/10.1109/imoc.2011.6169293
Luukkonen O., Maslovski S.I., Tretyakov S.A. // IEEE Ant. Wir. Prop. Lett. 2011. V. 10. P. 1295. https://doi.org/10.1109/lawp.2011.2175897
Mehrotra K.N., Shukla R.K., Chauhan M. // Bull. Chem. Soc. Jpn. 1995. V. 68. № 7. P. 1825. https://doi.org/10.1246/bcsj.68.1825
Kishore K., Singh M., Singh C. // J. Biol. Chem. Chron. 2017. V. 3. № 2. P. 28.
Gupta A., Upadhyaya S. K., Kishore K. // Int. J. Theor. Appl. Sci. 2012. V. 4. № 1. P. 1.
Singha R., Shuklaa M., Shuklab R.K. // Int. J. Appl. Chem. 2017. V. 13. № 3. P. 585.
Rodric D., Vishwakarma K., Upadhyaya S.K. // Global J. Sci. Front. Res.: B Chem. 2015. V. 15. № 3.
Shukla R.K., Singh T.B. // J. Chem. Chem. Sci. 2016. V. 6. № 11. P. 1037.
Setyawan D., Isadiartuti D., Desti Betari S. et al. // Indonesian J. Pharm. 2016. V. 27. № 1. P. 28. https://doi.org/10.14499/indonesianjpharm27iss1pp28
Lin Y., Peng Q. Stearic acid synthesis, properties and applications: Nova Science Publishers. 2015. 134 p.
Jongen L., Binnemans K., Hinz D. et al. // Liq. Cryst. 2001. V. 28. № 6. P. 819. https://doi.org/10.1080/02678290010025422
Jongen L., Binnemans K., Hinz D. et al. // Liq. Cryst. 2001. V. 28. № 11. P. 1727. https://doi.org/10.1080/02678290110078766
Da Silva Lisboa F., Arízaga G.G.C., Wypych F. // Top. Catal. 2011. V. 54. № 8. P. 474. https://doi.org/10.1007/s11244-011-9610-4
Jongen L., Binnemans K., Hinz D. // Mater. Sci. Eng., C. 2001. V. 18. № 1. P. 199. https://doi.org/10.1016/s0928-4931(01)00357-5
Jongen L. Structure and Thermal Behaviour of Lanthanide (III) Soaps: Thesis, Katholieke Universiteit Leuven. 2002. 203 p.
Nelson P.N., Taylor R.A. // Appl. Petrochem. Res. 2014. V. 4. № 3. P. 253. https://doi.org/10.1007/s13203-014-0044-3
Lugge D. The Story of Magnesium Stearate as a Powder and a Tablet Lubricant // ExcipientFest Americas. 2013.
Delaney S.P., Nethercott M.J., Mays C.J. et al. // J. Pharm. Sci. 2017. V. 106. № 1. P. 338. https://doi.org/10.1016/j.xphs.2016.10.004
Deepika S.K., Hait Y.C. // J. Coat. Technol. Res. 2014. V. 11. № 2. P. 273. https://doi.org/10.1007/s11998-013-9547-6
Gönen M., Öztürk S., Balköse D. et al. // Ind. Eng. Chem. Res. 2010. V. 49. № 4. P. 1732. https://doi.org/10.1021/ie901437d
Corbeil M.-C., Robinet L. // Powder Diffr. 2002. V. 17. № 1. P. 52. https://doi.org/10.1154/1.1431950
Shannon R.D. // Acta Crystallogr., Sect. A. 1976. V. 32. № 5. P. 751. https://doi.org/10.1107/s0567739476001551
Vold R.D., Hattiangdi G.S. // Ind. Eng. Chem. 1949. V. 41. № 10. P. 2311. https://doi.org/10.1021/ie50478a056
Fomina I.G., Dobrokhotova Z.V., Ilyukhin A.B. et al. // Polyhedron. 2013. V. 65. P. 152. https://doi.org/10.1016/j.poly.2013.08.017
Marques E.F., Burrows H.D., da Graca Miguel M. // J. Chem. Soc., Faraday Trans. 1998. V. 94. № 12. P. 1729. https://doi.org/10.1039/a800326b
Cañadillas-Delgado L., Pasán J., Fabelo O. et al. // Polyhedron. 2013. V. 52. P. 321. https://doi.org/10.1016/j.poly.2012.09.016
Koroteev P.S., Efimov N.N., Dobrokhotova Z.V. et al. // Russ. Chem. Bull. 2013. V. 62. № 8. P. 1768. https://doi.org/10.1007/s11172-013-0254-3
Tuhkala M. Dielectric characterization of powdery substances using an indirectly coupled open-ended coaxial cavity resonator: Thesis, University of Oulu. P.: Juvenes print, 2014. 72 p.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии