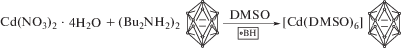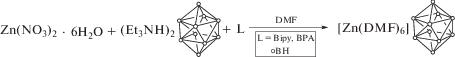Журнал неорганической химии, 2020, T. 65, № 6, стр. 778-786
Синтез, строение и свойства комплексов цинка(II) и кадмия(II) с кластерными анионами бора [M(solv)6][BnHn] (M = Zn(II), Cd(II); solv = DMF, DMSO; n = 10, 12)
С. Е. Короленко a, *, Л. В. Гоева a, А. С. Кубасов a, В. В. Авдеева a, Е. А. Малинина a, Н. Т. Кузнецов a
a Институт общей и неорганической химии им. Н.С. Курнакова
119991 Москва, Ленинский пр-т, 31, Россия
* E-mail: korolencko0110@yandex.ru
Поступила в редакцию 27.11.2019
После доработки 04.12.2019
Принята к публикации 27.01.2020
Аннотация
Синтезированы и изучены методами физико-химического анализа (ИК-, УФ-спектроскопия, рентгенофазовый анализ) комплексные соединения [M(solv)6][BnHn], где M = Zn(II), Cd(II); solv = DMF, DMSO; n = 10, 12. Строение комплексов [Cd(DMF)6][B10H10] и [Zn(DMSO)6][B10H10] установлено методом рентгеноструктурного анализа. На основании полученных данных определены способы синтеза координационных соединений Zn(II) и Cd(II) с азотсодержащими органическими лигандами в присутствии кластерных анионов бора [BnHn]2– (n = 10, 12).
ВВЕДЕНИЕ
Комплексные соединения общей формулы [M(solv)6][BnHn] (M = Zn(II), Cd(II); solv = H2O, DMF, DMSO; n = 10, 12) могут быть использованы в качестве прекурсоров при синтезе координационных соединений металлов с кластерными анионами бора с заданными свойствами как в растворах, так и в твердофазных реакциях [1–7]. Ранее [8] были синтезированы и исследованы косвенными методами анализа комплексные соединения [М(DMF)6][B10H10] (M = Zn(II), Cd(II)). Эти соединения показали свою эффективность в твердофазных реакциях с азагетероциклическими лигандами. Кроме того, в реакциях комплексообразования металлов M(II) (Zn(II), Cd(II), Cu(II) и др.) при недостатке или в отсутствие конкурентоспособных лигандов молекулы растворителя могут участвовать в формировании координационного полиэдра металла-комплексообразователя с образованием смешанолигандных комплексов вплоть до [M(solv)6][BnHn], окружение металла в которых полностью образовано молекулами растворителя. Так, в работе [9] был охарактеризован ряд смешанолигандных моноядерных комплексов Cu(II), координационный полиэдр которых содержит молекулы растворителя: [CuL2(solv)2][B12H12], [CuL(solv)4][B12H12]. Учитывая вышеперечисленное, данные об особенностях образования комплексов и их строении могут быть использованы при объяснении возможных механизмов реакций комплексообразования.
В настоящей работе синтезированы и исследованы физико-химическими методами анализа (ИК-, УФ-спектроскопия, РФА) комплексы общей формулы [M(solv)6][BnHn] (M = Zn(II), Cd(II); solv = DMF, DMSO; n = 10, 12). Методом РСА определено строение комплексов [Cd(DMF)6][B10H10] и [Zn(DMSO)6][B10H10].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Декагидро-клозо-декаборат триэтиламмония (Et3NH)2[B10H10] синтезировали из декаборана-14 через стадию образования 1,6-бис(триэтиламин)декаборана по методике [10].
Додекагидро-клозо-додекаборат триэтиламмония (Et3NH)2[B12H12] получили в результате пиролиза раствора декаборана в триэтиламинборане по методике [11].
Клозо-додекаборат дибутиламмония (Bu2NH)2[B12H12] синтезировали из K2[B12H12] по реакции с Bu2NH2Cl в воде. Клозо-додекаборат калия K2[B12H12] образуется при кипячении (Et3NH)2[B12H12] в водном растворе KOH до полного удаления триэтиламина.
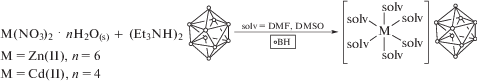
Общая методика синтеза [M(solv)6][B10H10] (M = Zn(II), solv = DMF (1), DMSO (2); M = = Cd(II), solv = DMF (3), DMSO (4)). К раствору, содержащему (Et3NH)2[B10H10] (3 ммоль) в DMF или DMSO (10 мл), при перемешивании добавляли в твердом виде соль соответствующего металла M(NO3)2 (M = = Zn(II), Cd(II)) (3 ммоль). В ходе гетерогенной реакции наблюдалось полное растворение осадка. Изотермическое упаривание реакционных растворов на воздухе при комнатной температуре в течение недели приводит к формированию бесцветных кристаллических осадков, которые отфильтровывали и высушивали. Выход 1–4 ~55–65%.
1 (NaCl, см–1): ν(BH)ап 2558, 2530, 2519, 2504; ν(BH)экв 2433; δ(BBH) 1010; ν(C=O) 1636.
2 (NaCl, см–1): ν(BH)ап 2525; ν(BH)экв 2462, 2425; δ(BBH) 1010; ν(S=O) 1008.
3 (NaCl, см–1): ν(BH)ап 2525, 2515, 2504; ν(BH)экв 2430; δ(BBH) 1010; ν(C=O) 1650.
4 (NaCl, см–1): ν(BH)ап 2514; ν(BH)экв 2455, 2429, 2411; δ(BBH) 1010; ν(S=O) 1010.
| С | Н | N | Zn | Cd | B | |
| Найдено для 1, %: | 34.65; | 8.37; | 13.23; | 10.46; | – | 17.1. |
| Для C18H52N6B10ZnO6 | ||||||
| вычислено, %: | 34.75; | 8.42; | 13.51; | 10.51; | – | 17.4. |
| Найдено для 2, %: | 21.98; | 7.07; | – | 9.98; | – | 16.1. |
| Для C12H46S6B10ZnO6 | ||||||
| вычислено, %: | 22.09; | 7.11; | – | 10.02; | – | 16.6. |
| Найдено для 3, %: | 31.98; | 7.75; | 12.42; | – | 16.73; | 15.8. |
| Для C18H52N6B10CdO6 | ||||||
| вычислено, %: | 32.31; | 7.83; | 12.56; | – | 16.80; | 16.2. |
| Найдено для 4, %: | 20.52; | 6.55; | – | – | 16.02; | 15.2. |
| Для C12H46S6B10CdO6 | ||||||
| вычислено, %: | 20.61; | 6.63; | 16.07; | 15.5. |
Синтез [Zn(DMF)6][B10H10] (1) в присутствии азагетероциклических лигандов. Первоначально смешивали растворы, содержащие (Et3NH)2[B10H10] (0.966 г, 3 ммоль) и Zn(NO3)2 ∙ 6H2O (0.891 г, 3 ммоль) в 10 мл DMF каждый. К полученному реакционному раствору добавляли раствор Bipy (1.404 г, 9 ммоль) или BPA (1.539 г, 9 ммоль) в 10 мл DMF каждый. При этом наблюдали появление ярко-желтой окраски. В результате изотермического упаривания на воздухе из реакционного раствора в качестве основного продукта были выделены бесцветные кристаллы, которые затем отфильтровывали и высушивали. Выход ~80%.
Синтез [Cd(DMSO)6][B12H12] (5). К раствору, содержащему (Bu2NH2)2[B12H12] (3 ммоль) в DMSO (10 мл), добавляли раствор соответствующей соли Cd(NO3)2 (3 ммоль) в том же растворителе. В результате изотермического упаривания реакционных растворов на воздухе при комнатной температуре в течение недели выпадали бесцветные кристаллы, которые отфильтровывали и высушивали на воздухе. Выход ~70%.
ИК-спектр (NaCl, см–1): ν(BH) 2491, 2477, 2459, 2441; δ(BBH) 1007; ν(S=O) 1010.
| С | Н | Cd | B | |
| Найдено для 5, %: | 19.89; | 6.62; | 15.49; | 17.2. |
| Для C12H48S6B12CdO6 | ||||
| вычислено, %: | 19.93; | 6.69; | 15.55; | 17.9. |
Определение содержания бора, кадмия и цинка выполнено методом ICP MS на атомно-эмиссионном спектрометре с индуктивно-связанной плазмой iCAP 6300 Duo.
ИК-спектры соединений записывали на ИК-фурье-спектрометре ИНФРАЛЮМ ФТ-02 (НПФ АП “Люмекс”) в области 4000–600 см–1 с разрешением 1 см–1. Исследовали суспензии твердых образцов в вазелиновом (Aldrich) масле. Для записи спектров использовали пластинки NaCl.
Электронные спектры поглощения (ЭСП) получены на спектрофотометре СФ 103 в УФ- и видимой области 13000–50000 см–1 от образцов, растворенных в CH3CN, и в виде суспензий в глицерине. Результаты исследований приведены в табл. 1.
Таблица 1.
Электронные спектры поглощения комплексов 1–4 (ν, нм)
| Соединение | π → π* | B–H…H–C |
|---|---|---|
| 1, суспензия | 215 | 350 |
| 1, раствор | 215 | 250 |
| 2, суспензия | 210 | 350 |
| 2, раствор | 210 | 260 |
| 3, суспензия | 215 | 350 |
| 3, раствор | 215 | 250 |
| 4, суспензия | 210 | 350 |
| 4, раствор | 210 | 260 |
| DMF | 230 | – |
| DMSO | 225 | – |
Рентгенофазовый анализ проводили на рентгеновском дифрактометре Bruker D8 Advance в Центре коллективного пользования ИОНХ РАН в CuKα-излучении в низкофоновых кюветах с подложкой из ориентированного монокристалла кремния в интервале углов 2θ 5°–80° с шагом 0.01125°. Для получения дифрактограмм образцы тщательно истирали в агатовой ступке.
РСА. Набор дифракционных отражений для кристаллов 2 и 3 получен в ЦКП ИОНХ РАН на автоматическом дифрактометре Bruker SMART APEX2 и Bruker APEX2 CCD (λMoKα, графитовый монохроматор, ω–ϕ-сканирование). Структуры расшифрованы прямым методом с последующим расчетом разностных синтезов Фурье. Все неводородные атомы уточнены в анизотропном приближении. Все атомы водорода уточнены по модели наездника с тепловыми параметрами U(H) = 1.2Uэкв (1.5Uэкв для СН3-групп) соответствующих неводородных атомов. Анализ списка отражений кристалла 3 с наибольшим расхождением между $F_{{\text{o}}}^{2}$ и $F_{{\text{c}}}^{2}$ показывает, что исследованный кристалл содержит двойниковый компонент. Кристаллографически независимая половина аниона [B10H10]2– в структуре 2 разупорядочена с заселенностью 0.5/0.5. Атом S1 разупорядочен по двум позициям с заселенностью 0.12/0.88.
При сборе и обработке массива отражений использовали программы APEX2, SAINT и SADABS [12]. Структура расшифрована и уточнена с помощью комплекса программ OLEX2 [13]. Основные кристаллографические данные, параметры эксперимента и характеристики уточнения структур 2 и 3 приведены в табл. 2. Длины связей и валентные углы – в табл. 3.
Таблица 2.
Основные кристаллографические данные, параметры эксперимента и уточнения структур 2 и 3
| Соединение | 2 | 3 |
|---|---|---|
| Брутто-формула | C12H46B10O6S6Zn | C18H52B10N6O6Cd |
| М | 669.15 | 652.32 |
| T, K | 299 | 296 |
| Сингония | Тетрагональная | Моноклинная |
| Пр. гр. | P4cc | C2/c |
| a, Å | 13.6256(5) | 13.9489(10) |
| b, Å | 13.6256(5) | 13.1227(9) |
| c, Å | 18.3063(10) | 17.6737(12) |
| β, град | 90 | 90.110(2) |
| V, Å3 | 3398.7(3) | 3235.1(4) |
| Z | 4 | 4 |
| ρрасч, г/см3 | 1.308 | 1.339 |
| μ, мм–1 | 0.682 | 1.172 |
| F(000) | 1392.0 | 1368.0 |
| Размеры кристалла, мм | 0.6 × 0.4 × 0.03 | 0.8 × 0.6 × 0.5 |
| Излучение, λ, Å | 0.71073 | 0.71073 |
| Интервал углов 2θ, град | 2.988–61.124 | 4.842–60.494 |
| Число отражений: | ||
| измеренных | 31 589 | 18 484 |
| независимых (N) [Rint] | 5192 [0.0541] | 4804 [0.0383] |
| R1, wR2 по N0 | 0.0404, 0.0995 | 0.0468, 0.1260 |
| R1, wR2 по по всем отражениям | 0.0962, 0.1223 | 0.0693, 0.1411 |
| Δρmax /Δρmin, е/Å3 | 0.95/–0.33 | 0.57/–0.38 |
Таблица 3.
Длины связей и валентные углы для соединений 2 и 3
| Связь | 2 | 3 |
|---|---|---|
| d, Å | ||
| M–O1 | 2.0723(16) | 2.239(4) |
| M–O2 | 2.1094(17) | 2.280(6) |
| M–O3 | 2.1172(16) | 2.246(5) |
| Угол | ω, град | |
| O1MO2 | 89.35(7) | 86.0(3) |
| O1MO3 | 88.62(7) | 92.8(2) |
| O2MO3 | 89.59(7) | 85.9(2) |
Кристаллографические данные депонированы в Кембриджском банке структурных данных (№ 1962992 (3) и 1962993(2)).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В настоящей работе были синтезированы и исследованы, в том числе методом РСА, комплексы [М(DMF)6][B10H10] (1, 3), [М(DMSO)6][B10H10] (2, 4) (M = Zn(II), Cd(II)) и [Cd(DMSO)6][B12H12] (5). Для комплексов [Zn(DMSO)6][B10H10] (2) и [Cd(DMF)6][B10H10] (3), описанных в работе [8], выполнено рентгеноструктурное исследование.
Комплексы [M(solv)6][B10H10] (1–4) образуются при взаимодействии клозо-декабората триэтиламмония с солями цинка(II) или кадмия(II) в DMF или DMSO в результате гетерогенной реакции (схема 1 ):
Схема 1 . Синтез соединений 1–4.
Комплекс кадмия(II) с додекагидро-клозо-додекаборатным анионом во внешней сфере [Cd(DMSO)6][B12H12] (5) был выделен в результате гомогенной реакции додекагидро-клозо-додекабората дибутиламмония с нитратом кадмия в DMSO (схема 2 ):
Схема 2 . Синтез соединения 5.
Селективное выделение комплекса [Zn(DMF)6][B10H10] (1) в качестве основного продукта было обнаружено при проведении реакции комплексообразования цинка(II) в присутствии азагетероциклических лигандов L (L = Bipy, BPA) в DMF (схема 3 ):
Схема 3 . Синтез комплекса 1 в присутствии азагетероциклических лигандов.
Следует отметить существенную растворимость комплексов [М(solv)6][B12H12] по сравнению с аналогичными комплексами [М(solv)6][B10H10]. Так, комплекс [Cd(DMSO)6][B12H12] образуется в реакционном растворе в ходе упаривания в течение недели. В свою очередь, соединения [М(solv)6][B12H12] образуются в виде высокосольватных соединений [М(solv)6][B12H12] ⋅ nsolv. Состав продуктов реакций идентифицировали на основании данных элементного анализа, ИК-, УФ-спектроскопии и РФА.
В ИК-спектрах комплексов [M(solv)6][B10H10] (M = Zn(II), Cd(II); solv = DMF, DMSO) полосы валентных колебаний ν(С=О) и ν(S=O) соответствующих лигандов-растворителей проявляются в более низкочастотном интервале (Δν ~ 30–40 см–1) по сравнению с таковыми в спектрах некоординированных молекул растворителей solv, что указывает на их координацию атомами металлов. Известно, что в области валентных колебаний связей бор–водород свободного аниона [B10H10]2– (например, солей щелочных металлов Na2[B10H10], K2[B10H10]) с учетом его геометрии проявляются две полосы ν(BH)ап апикальных и ν(BH)экв экваториальных BH-связей в интервале 2550–2400 см–1 [14]. Отсутствие полос поглощения в интервале 2400–2100 см–1, характерных для аниона [B10H10]2–, координированного к центральному атому металла-комплексообразователя трехцентровыми двухэлектронными связями, указывает на положение аниона во внешней сфере комплексов [15, 16]. В спектрах исследуемых комплексов в области валентных колебаний связей ВН клозо-декаборатного аниона в интервале 2400–2550 см–1 присутствует интенсивная полоса, характерная для внешнесферного аниона. Следует отметить мультиплетное расщепление указанной полосы. Так, в спектрах комплексов с DMF наблюдается расщепление полосы ν(ВН)ап на несколько компонент (рис. 1); в спектрах комплексов с DMSO – расщепление полосы ν(ВН)экв на несколько компонент, при этом полоса ν(ВН)ап остается синглетной (рис. 2). Такое характерное изменение в области валентных колебаний связей ВН было ранее обнаружено в соответствующих комплексах кобальта(II) и никеля(II) [М(DMF)6][B10H10] [17, 18].
Рис. 1.
Вид ИК-спектров комплексов [Co(DMF)6][B10H10] (1), [Zn(DMF)6[B10H10] (2), [Cd(DMF)6][B10H10] (3) в области валентных колебаний связи BH.
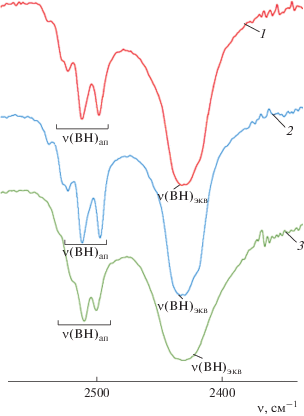
Рис. 2.
Вид ИК-спектров комплексов [Co(DMSO)6][B10H10] (1), [Zn(DMSO)6[B10H10] (2), [Cd(DMSO)6][B10H10] (3) в области валентных колебаний связи BH.

Согласно данным ИК-спектра комплекса [Cd(DMSO)6][B12H12] (5), додекагидро-клозо-додекаборатный анион, находясь в качестве противоиона, участвует в образовании дальних контактов B–H….H–C с метильными группами координированных молекул DMSO. В спектре комплекса присутствует уширенная полоса ν(ВН) колебаний с максимумами при 2491, 2477, 2459 и 2441 см–1 вместо синглетной полосы при 2460 см–1, характерной для спектра соли K2[B12H12] [14], в которой отсутствуют подобные взаимодействия.
Ранее достаточно широко были изучены специфические взаимодействия N–H…H–B в ониевых солях [B10H10]2–, а также в анионных комплексах металлов с алкиламмониевыми катионами [19].
Данные электронных спектров поглощения комплексов [M(solv)6][B10H10] (M = Zn(II), Cd(II)) были получены в УФ- и видимой областях.
В электронных спектрах поглощения образцов в интервале 200–225 нм присутствует интенсивная полоса, отвечающая внутрилигандному переносу заряда в молекулах координированных лигандов DMSO и DMF. Следует отметить, что в спектрах наблюдается небольшой гипсохромный сдвиг указанной полосы – Δν ~ 10 нм (2000 см–1). Анализ электронных спектров поглощения (ЭСП) указывает на полную диссоциацию комплексов на комплексный катион [M(solv)6]2+ и клозо-декаборатный анион. Так, если в спектрах твердых образцов комплексов, записанных в виде суспензии в глицерине, наблюдается только одна вышеуказанная полоса внутрилигандного переноса заряда, то в спектрах растворов в CH3CN появляется дополнительная полоса слабой интенсивности около 255 нм, которую можно отнести к контактам аниона [B10H10]2– с молекулами ацетонитрила В–Н…Н–С. Следует отметить, что в ЭСП комплексов [M(solv)6][B10H10] (M = Zn(II), Cd(II)) в интервале 350–450 нм полоса переноса заряда с внешнесферного клозо-декаборатного аниона на молекулы координированного лиганда (solv) ([B10H10]2– → solv), свойственная подобным комплексам Co(II) [20], слабо выражена, что, вероятно, обусловлено слабыми специфическими взаимодействиями. В УФ-спектрах комплексов 2 и 3 в интервале 350–450 нм наблюдается широкая полоса переноса заряда с внешнесферного клозо-декаборатного аниона на молекулы координированного лиганда ([B10H10]2– → solv), которая исчезает в спектрах растворов данных комплексов в CH3CN, что обусловлено их диссоциацией в указанных растворителях.
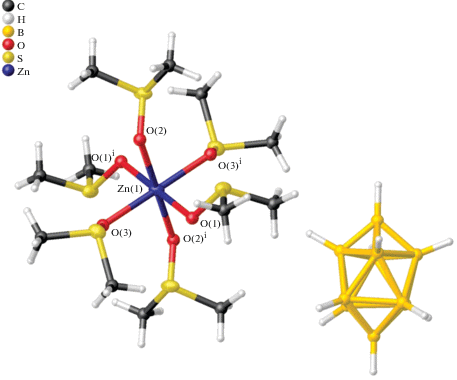
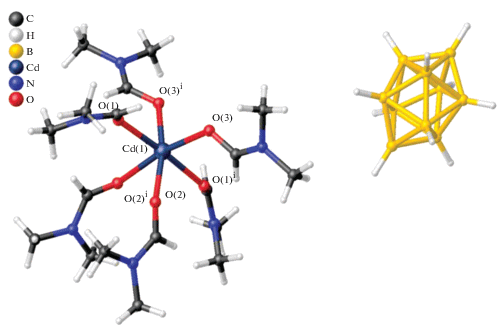
Строение комплексов [Zn(DMSO)6][B10H10] (2) и [Cd(DMF)6][B10H10] (3)
Кристаллы [Zn(DMSO)6][B10H10] (2) (рис. 3) и [Cd(DMF)6][B10H10] (3) (рис. 4) построены из комплексных катионов [M(solv)6]2+ и анионов [В10Н10]2–. Кристаллы подобных соединений [Zn(DMF)6][B10H10] (1) и [Cd(DMSO)6][B10H10] (4) изоструктурны комплексам 3 и 2 соответственно.
В структуре 3 комплексный катион находится на поворотной оси второго порядка, а в 2 расположен в центре симметрии. Координационное окружение атомов М формируют шесть атомов кислорода от соответствующих молекул (solv), образуя октаэдры, последние искажены мало. Длины связей М–O и валентные углы в октаэдрах приведены в табл. 3.
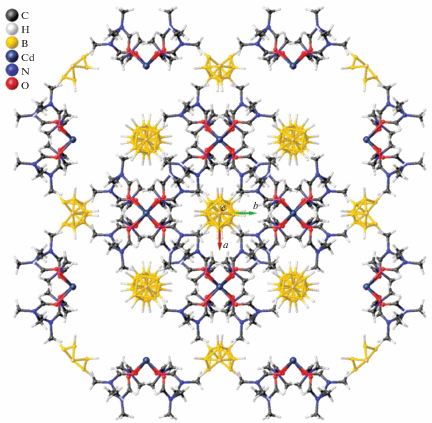
В структуре 3 комплексные катионы [Cd(DMF)6]2+ образуют трехмерные сетки с каналами квадратного сечения, направленными вдоль оси c (рис. 5). Анионы [В10Н10]2– занимают две кристаллографически независимые позиции на поворотных осях четвертого порядка, проходящих вдоль центра каналов. Каждый анион состоит из двух кристаллографически независимых апикальных и экваториальных В–Н-групп. Атомы Н анионов [В10Н10]2– образуют специфические контакты с атомами Н метильных групп молекул DMF. Длины контактов Н…Н с участием апикальных групп составляют 2.51, 2.58 и 2.65 Å, длина самых коротких контактов экваториальных групп находится примерно в том же диапазоне и составляет 2.53, 2.55, 2.56 и 2.70 Å. Следует отметить, что в аналогичном комплексе кобальта [Cо(DMF)6][B10H10] наименьшая длина контактов равна 2.27 Å.
В структуре 2 анион [В10Н10]2– расположен на поворотной оси второго порядка и разупорядочен с заселенностью 0.5 : 0.5. Ось симметрии проходит через середины двух ребер между экваториальными поясами: B5–B5' и B2A–B2A' в первом случае и B5–B5' и B3B–B3B' – во втором. В кристалле 2, как и в 3, комплексные катионы упакованы в трехмерные сетки с каналами вдоль оси с (рис. 5). Наиболее короткие контакты Н…Н, образуемые группами В–Н с метильными группами молекул DMSO составляют 2.23, 2.32, 2.34 и 2.44 Å. В аналогичном комплексе кобальта(II) [Cо(DMSO)6][B10H10] наименьшая длина контактов составляет 2.17 и 2.21 Å.
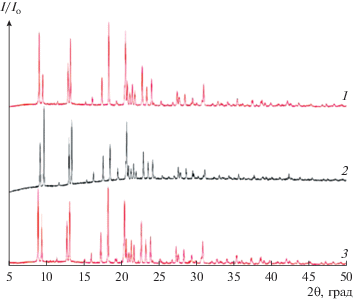
На рис. 6 приведены дифрактограммы комплексов [М(DMF)6][B10H10] (M = Zn(II), Cd(II) и Co(II)). Согласно данным РФА, комплексы изоструктурны.
ЗАКЛЮЧЕНИЕ
Анализируя полученные результаты, следует отметить существенное различие растворимости в однотипных растворителях соединений [M(solv)6][BnHn] в зависимости от природы кластерного аниона бора. Именно этим обстоятельством объясняется факт выделения в качестве основного продукта в реакции комплексообразования Zn(II) с азагетероциклическими лигандами L (L = Bipy, BPA) в DMF комплексного соединения [Zn(DMF)6][B10H10].
Что касается комплексов с додекагидро-клозо-додекаборатным анионом [B12H12]2–, они формируются в виде высокосольватных соединений [M(solv)6][B12H12] ∙ nsolv. В качестве монокристаллов выделено соединение [Cd(DMSO)6][B12H12]. Полученные в работе данные следует учитывать при синтезе координационных соединений Zn(II) и Cd(II) с азотсодержащими органическими лигандами в органических растворителях в присутствии кластерных анионов бора [BnHn]2–.
Список литературы
Avdeeva V.V., Malinina E.A., Kuznetsov N.T. // Russ. J. Inorg. Chem. 2017. V. 62. № 13. P. 1673. https://doi.org/10.1134/S0036023617130022
Malinina E.A., Avdeeva V.V., Goeva L.V. et al. // Russ. J. Inorg. Chem. 2010. V. 55. № 14. P. 2148. https://doi.org/10.1134/S0036023610140032
Nguyen Duc Van New salt-like dodecahydro-closo-dodecaborates and efforts for the partial hydroxylation of [B12H12]2– anions. Stuttgart: Institut fur anorganische Chemie der Universitat, 2009.
Tiritiris I., Schleid Th. // Z. Anorg. Allg. Chem. 2005. V. 631. P. 1593.
Tiritiris I., Schleid Th. // Z. Anorg. Allg. Chem. 2007. V. 634. P. 317.
Malinina E.A., Goeva L.V., Buzanov G.A. et al. // Dokl. Chem. 2019. V. 487. № 1. P. 180. [Малинина Е.А., Гоева Л.В., Бузанов Г.А. и др. // Докл. АН. 2019. Т. 487. № 2. С. 154.]https://doi.org/10.1134/S0012500819070061
Malinina E.A., Goeva L.V., Buzanov G.A. et al. // Russ. J. Inorg. Chem. 2019. V. 64. № 11. P. 1325. [Малинина Е.А., Гоева Л.В., Бузанов Г.А. и др. // Журн. неорган. химии. 2019. Т. 64. № 11. С. 1136.] https://doi.org/10.1134/S0036023619110123
Malinina E.A., Korolenko S.E., Goeva L.V. et al. // Russ. J. Inorg. Chem. 2018. V. 63. № 12. P. 1552. [Малинина Е.А., Короленко С.Е., Гоева Л.В. и др. // Журн. неорган. химии. 2018. Т. 63. № 12. С. 1543.]https://doi.org/10.1134/S0036023618120148
Malinina E.A., Kochneva I.K., Avdeeva V.V. et al. // Russ. J. Inorg. Chem. 2019. V. 64. № 10. P. 1210. [Малинина Е.А., Кочнева И.К., Авдеева В.В. и др. // Журн. неорган. химии. 2019. Т. 64. № 10. С. 1031.]https://doi.org/10.1134/S0036023619100085
Miller H.C., Miller N.E., Muetterties E.L. // J. Am. Chem. Soc. 1963. № 11. P. 338.
Greenwood N.N., Morris J.H. // Proc. Chem. Soc. 1963. № 11. P. 338.
APEX2 (V. 2009, 5-1), SAINT (V7.60A), SADABS (2008/1). Bruker AXS Inc., Madison, Wisconsin, USA, 2008–2009.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Crystallogr. 2009. V. 42. P. 339.
Канаева О.А., Сосновская О.О., Гоева Л.В. и др. // Журн. неорган. химии. 1980. Т. 25. № 9. С. 2380.
Dobrott R.D., Lipscomb W.N. // J. Chem. Phys. 1962. V. 37. № 6. P. 1779.
Polyakova I.N., Malinina E.A., Drozdova V.V. et al. // J. Chem. Crystallogr. 2008. V. 53. № 2. P. 253. [Полякова И.Н., Малинина Е.А., Дроздова В.В. и др. // Кристаллография. 2008. Т. 53. № 2. С. 279.]https://doi.org/10.1134/S1063774508020132
Avdeeva V.V., Polyakova I.N., Goeva L.V. et al. // Inorg. Chim. Acta. 2016. V. 451. P. 129. https://doi.org/10.1016/j.ica.2016.07.016
Avdeeva V.V., Polyakova I.N., Vologzhanina A.V. et al. // Russ. J. Inorg. Chem. 2016. V. 61. № 9. P. 1125. [Авдеева В.В., Полякова И.Н., Вологжанина А.В. и др. // Журн. неорган. химии. 2016. Т. 61. № 9. С. 1182.]https://doi.org/10.1134/S0036023616090023
Malinina E.A., Goeva L.V., Avdeeva V.V. et al. // Russ. J. Inorg. Chem. 2011. V. 56. № 5. P. 687. [Малинина Е.А., Гоева Л.В., Авдеева В.В. и др. // Журн. неорган. химии. 2011. Т. 56. № 5. С. 735.]https://doi.org/10.1134/S0036023611050160
Goeva L.V., Avdeeva V.V., Malinina E.A. et al. // Russ. J. Inorg. Chem. 2018. V. 63. № 8. P. 1050. [Гоева Л.В., Авдеева В.В., Малинина Е.А. и др. // Журн. неорган. химии. 2018. Т. 62. № 8. С. 1015.]https://doi.org/10.1134/S0036023618080089
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии