Журнал неорганической химии, 2020, T. 65, № 6, стр. 748-757
Синтез и сорбционные характеристики магнитных материалов на основе оксидов кобальта и их восстановленных форм
Е. К. Папынов a, *, А. Н. Драньков a, b, И. А. Ткаченко a, И. Ю. Буравлев a, b, В. Ю. Майоров a, Е. Б. Меркулов a, А. Н. Федорец b, А. В. Огнев b, А. С. Самардак b, А. С. Дренин b, И. Г. Тананаев b, c
a Институт химии ДВО РАН
690022 Владивосток, пр-т 100-летия Владивостока, 159, Россия
b Дальневосточный федеральный университет
690090 Владивосток, ул. Суханова, 8, Россия
c Институт физической химии и электрохимии РАН им. А.Н. Фрумкина
119991 Москва, Ленинский пр-т, 31, корп. 4, Россия
* E-mail: papynov@mail.ru
Поступила в редакцию 05.11.2019
После доработки 29.01.2020
Принята к публикации 30.01.2020
Аннотация
Представлены способы прямого осадительного, оригинального темплатного и дополнительного термовосстановительного синтеза материалов на основе оксидов кобальта и их композитных форм, перспективных в качестве магнитных сорбентов для селективного извлечения и концентрирования урана(VI) из водных сред. Методами дифференциального термического и рентгенофазового анализа исследованы процессы термодеструкции промежуточных и фазообразование конечных материалов. Изучена морфология поверхности и структура полученных образцов сорбентов. Проведена оценка сорбционной активности и емкости материалов при извлечении уранил-ионов из водных сред в широком диапазоне pH (2–10) и в присутствии карбонат-ионов (0.001, 0.01, 0.1 и 1 мг/л). Выявлено, что количественную сорбцию урана(VI) в большей степени определяет состав твердой фазы сорбентов, включающий металлический кобальт. Проведен комплекс магнитных исследований и определены магнитные характеристики сорбционных материалов. Установлено, что величина намагниченности насыщения для сорбентов восстановленного типа может достигать 133–237 эме/г, что является дополнительным преимуществом при их извлечении из очищаемых растворов методами магнитной сепарации.
ВВЕДЕНИЕ
Основу сорбционных технологических процессов составляют материалы (адсорбенты), тип и характеристики которых определяют степень очистки водных сред от различных токсичных загрязнителей: углеводородов, тяжелых металлов, канцерогенов, радионуклидов и др. [1]. Повышение эффективности всей адсорбционной технологии может быть обеспечено не только ключевыми характеристиками сорбента (селективность, емкость, устойчивость и др.), но и дополнительными, например магнитными. Наличие магнитного момента повышает эргономику сорбентов за счет возможности введения их в очищаемую среду в виде дисперсной фазы при контролируемой поверхности межфазного контакта и удобного извлечения из среды методом магнитной сепарации [2].
Одним из наиболее промышленно значимых примеров использования магнитных сорбентов является извлечение урана(VI) из природных и сточных вод [3]. Это связано с его токсичностью и естественной радиоактивностью, что является риском загрязнения окружающей среды. Эффективными магнитными сорбентами данного назначения являются оксиды и гидроксиды железа [4, 5], их восстановленные и композитные формы [6, 7], а также их микрофазы в составе минералов слоистой структуры [8] и др. Известный механизм сорбции урана в присутствии сорбентов такого типа основан, во-первых, на активности железа в окислительно-восстановительных реакциях в растворах, где за счет изменения его степени окисления (Fe2+ → Fe3+) происходит восстановление урана (U6+ → U4+), и он адсорбируется совместно с продуктами коррозии железа (процесс “восстановительного осаждения”). При этом высокий сорбционный эффект также определяется количественным содержанием и размерностью фазы металлического железа (Fe0), которое за счет дополнительного окислительного перехода Fe0 → Fe2+ тоже определяет интенсивность адсорбции в широком диапазоне pH [9]. Во-вторых, сорбция может протекать на активных гидроксидных центрах (OH–) – ферригидратных группах гидроксидов железа [4]. Наличие дополнительного магнитного эффекта оксидов железа является важным показателем эргономичности сорбента, что связано с эффективностью его отделения от очищаемого раствора методом магнитной сепарации. Указанные свойства данных систем были изучены в наших ранних исследованиях [10, 11] и выявлен ряд недостатков таких сорбентов, а именно: низкая механическая устойчивость в кислых средах, низкая степень извлечения урана в щелочных и карбонатных растворах, а также недостаточно высокие магнитные характеристики сорбентов (низкие величины намагниченности насыщения и коэрцитивной силы).
В качестве альтернативных и более перспективных сорбционных систем могут выступать материалы на основе оксидов кобальта и их восстановленные формы. Их адсорбционные свойства изучены для различных систем [12–15]. В случае сорбции растворенного урана вероятны оба механизма сорбции с различной степенью активности по отношению к уранил-ионам. Кобальт является переходным металлом и активен в окислительно-восстановительных реакциях в жидкой фазе; его соединения механически и химически устойчивы в агрессивных средах и характеризуются высоким значением магнитного момента и термостабильностью. Получение оксидов кобальта и композитов на его основе эффективно реализуется с помощью различных методов “мокрого синтеза” [16].
Цель настоящего исследования – получение магнитных материалов на основе оксидов кобальта и их восстановленных форм с применением прямого осадительного, оригинального темплатного и дополнительного термовосстановительного способов синтеза, а также оценка их сорбционной активности в условиях извлечения уранил-ионов из водных сред в широком диапазоне pH и в присутствии карбонат-ионов. Отдельной задачей являлось определение магнитных свойств сорбентов и их поведение во внешнем магнитном поле.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реактивы. Синтез структурированных оксидов кобальта проводили золь-гель методом с использованием раствора хлорида кобальта(II) CoCl2 · · 6H2O марки “х. ч.”. В качестве порообразующего темплата использовали промышленную силоксан-акрилатную эмульсию КЭ 13-36 (производитель ООО “Астрохим”, Электросталь) с содержанием твердой фазы 50% и средним размером частиц 160 нм, методика синтеза и свойства которой описаны в [17, 18].
Методика синтеза
Осадительный синтез. К 100 мл дистиллированной воды при перемешивании добавляли 35 мл раствора CoCl2 · 6H2O (c(Со) = 25 мг/мл). Затем к полученному золю по каплям прибавляли 50 мл 1 M раствора NaOH до образования осадка гидратированного оксида металла CoO(OH) (pH раствора 8). Полученный осадок активно перемешивали на магнитной мешалке в течение 60 мин и проводили обработку ультразвуковой кавитацией с целью диспергирования полученных наночастиц. Затем осадок отфильтровывали, промывали дистиллированной водой и сушили при 100°С в течение 4 ч до полного удаления избыточной влаги и образования ксерогеля, который прокаливали во вращающейся трубчатой печи RSR-B 120/500/11 (Nabertherm GmbH, Германия) в атмосфере воздуха с постоянной скоростью нагрева 10 град/мин при температурах 600 и 900°С с выдержкой в течение 1 ч для удаления темплата и формирования неорганической основы материала.
Темплатный синтез. К водному раствору полимерного латекса (силоксан-акрилатная эмульсия, соотношение латекс : вода = 1 : 10) добавляли раствор прекурсора соли металла аналогично описанной выше методике, включая стадию термообработки ксерогеля.
Восстановительный синтез проводили путем термической обработки оксидов кобальта, полученных согласно вышеописанным методикам в трубчатой печи в токе водорода при 700°С (скорость нагрева 10 град/мин, время выдержки 1 ч).
Методы исследования. Идентификацию фаз полученных образцов осуществляли с помощью рентгенофазового анализа (РФА, CuKα-излучение, Ni-фильтр, средняя длина волны λ = 1.5418 Å, диапазон углов съемки 10°–80°, шаг сканирования 0.02°, скорость регистрации спектров 5 град/мин) на рентгеновском дифрактометре D8 Advance Bruker-AXS (Германия). Дифференциальный термический анализ (ДТА) проводили на дериватографе Q-1500 системы F. Paulik, J. Paulik, L. Erdey (Венгрия) на воздухе в платиновом тигле при скорости нагрева до предельной температуры (1000°С) 10 град/мин. Определение удельной поверхности осуществляли на приборе ASAP 2020 MP (Micromeritics GmbH, США) методом физической адсорбции азота при температуре 77 K, данные обсчитывали по методу БЭТ. Анализ фильтрата на содержание кобальта выполняли на атомно-абсорбционном спектрофотометре АА-7000 Shimadzu (Япония). Изображения поверхности образцов были получены с помощью растрового электронного микроскопа (РЭМ) Carl Zeiss Ultra 55 (Германия) с приставкой для энергодисперсионного (ЭДС) микроанализа (Bruker, Германия). Магнитные характеристики исследовали на вибромагнетометре (VSM), входящем в станцию по измерению физических свойств вещества (PPMS) фирмы Quantum Design (США), а также на приборе LakeShore 7401 VSM (США).
Определение сорбционной активности материалов на основе оксидов кобальта и их восстановленных форм проводили в статических условиях. В полипропиленовую пробирку помещали навеску сорбента и приливали раствор нитрата уранила (UO2(NO3)2) требуемой концентрации, соотношение т : ж = 1 : 1000. Величину pH раствора корректировали в пределах 9 с помощью H2SO4 и Na2CO3 марки “ч. д. а.”. Отбор проб для измерения остаточной концентрации уранил-ионов в растворе проводили после 24 ч статической сорбции. Остаточную концентрацию извлекаемого компонента в растворе определяли спектрофотометрически по изменению оптической плотности (до и после сорбции) в присутствии Арсеназо III на приборе UV mini-1240 Shimadzu (Япония) при длине волны 656 нм [19]. Использование Na2CO3 для изменения pH среды обусловлено возможностью более глубокой оценки эффективной сорбции в системе, приближенной к составу природных вод, которые содержат растворенные карбонат- и бикарбонат-ионы.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Полученные в работе материалы на основе оксидов кобальта и их восстановленные формы, а также их характеристики представлены в табл. 1. Характеристики варьировали с помощью различных способов синтеза (осадительный, темплатный, восстановительный) и температурного режима обработки.
Таблица 1.
Перечень и характеристики образцов оксидов кобальта и их восстановленных форм
| Образец | tсинтеза, °С | Газовая среда | РФА | Sуд (БЭТ), м2/г | Ms, эме/г | Hc, Э |
|---|---|---|---|---|---|---|
| Осадительный синтез | ||||||
| Co(ос)-600 | 600 | Воздух | Co3O4 | 12.95 | – | 10 |
| Co(ос)-900 | 900 | Воздух | Co3O4 | 2.22 | – | 10 |
| Темплатный синтез | ||||||
| Co(тс)-600 | 600 | Воздух | Co3O4 | 4.99 | – | 16 |
| Co(тс)-900 | 900 | Воздух | Co3O4/CoO | 0.12 | – | 63 |
| Восстановительный синтез | ||||||
| Co(ос)-600/Восcт | 900 | Водород | Co | 1.68 | 163 | 67 |
| Co(ос)-900/Восcт | 900 | Водород | Co | 1.21 | 237 | 87 |
| Co(тс)-600/Восcт | 900 | Водород | Co | 3.32 | 140 | 110 |
| Co(тс)-900/Восcт | 900 | Водород | Co | 0.15 | 133 | 150 |
Финальной стадией получения образцов является термоокислительная обработка их гидратированных осадков (ксерогелей), а также термовосстановительное прокаливание оксидов кобальта. Выбор температурного режима основан на данных термогравиметрического анализа, который отражает стадии термодеструкции ксерогелей (рис. 1). Прокаливание ксерогеля метагидроксида кобальта CoO(OH), полученного осадительным синтезом, на воздухе сопровождается несколькими эндотермическими эффектами на кривой ДТА (рис. 1а). Первый эффект наблюдается при 90–150°С и связан с потерей адсорбированных молекул воды из межслоевого пространства кристаллической решетки CoO(OH). Второй эндоэффект фиксируется при 250–325°С (максимум перегиба 292°С) и отвечает удалению молекул воды из структуры соединения при его дегидратации и образованию Co3O4:
(1)
$12{\text{CoO(OH)}}\xrightarrow{{150^\circ {\text{C}}}}4{\text{C}}{{{\text{o}}}_{3}}{{{\text{O}}}_{4}} + {{{\text{O}}}_{2}} + 6{{{\text{H}}}_{{\text{2}}}}{\text{O}}{\text{.}}$Рис. 1.
ТГА ксерогелей метагидроксида кобальта, полученных осадительным (а) и темплатным (б) синтезом (анализ на воздухе).
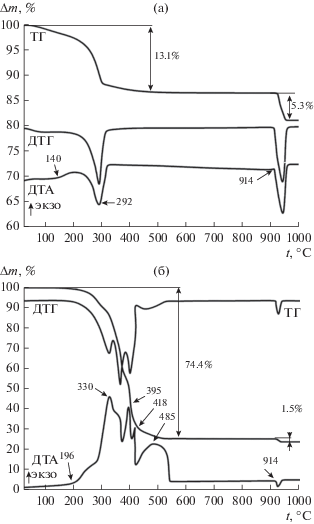
Общая потеря массы на этих этапах составляет 13.1%. Последующее повышение температуры выше 914°С сопровождается потерей кислорода и образованием оксида CoO:
(2)
$2{\text{C}}{{{\text{o}}}_{{\text{3}}}}{{{\text{O}}}_{{\text{4}}}}\xrightarrow{{914^\circ {\text{C}}}}6{\text{CoO}} + {{{\text{O}}}_{2}}.$Потеря массы на данном этапе составляет до 5.3%. Полученные результаты коррелируют с литературными данными, где первому эндоэффекту соответствует температура 92–100°С, второму – 287–326°С, а третьему – выше 905°С [20].
Ксерогель CoO(OH), полученный темплатным синтезом, содержит в своем объеме темплат – полимерный латекс. Основными отличиями результатов ТГА данного ксерогеля от гидратированного осадка, полученного осадительным синтезом, является смещение температуры дегидратации до 196°С. При данной температуре на кривой ДТА отмечено начало экзоэффекта, что свидетельствует не только о разложении CoO(OH), но и о частичном окислении силоксан-акрилатного полимера выделяющимся кислородом (рис. 1б). В температурном интервале 300–425°С происходит интенсивное разложение ксерогеля с окислением силоксан-акрилатного полимера, сопровождаемое значительной потерей массы. При этом наблюдаются экзоэффекты на кривой ДТА с максимумами перегибов при 330, 395 и 418°С. В интервале температур 425–550°С происходит выгорание твердых продуктов разложения в объеме ксерогеля, которое сопровождается широким экзоэфектом с максимумом при 485°С. Общая потеря массы продукта при 600°С составляет 74.4%, что отражено на кривой ТГ. Кроме того, следует учитывать формирование Co3O4 в данной системе при разложении CoO(OH) по реакции (1). Образование CoO при отщеплении кислорода по реакции (2) происходит выше 914°С, потеря массы на этом этапе не превышает 1.5%, что обусловлено меньшим содержанием CoO(OH) в данном образце.
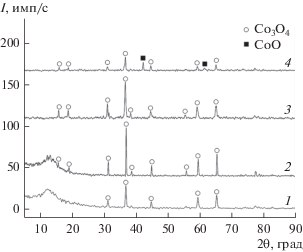
Согласно результатам РФА (рис. 2), при термообработке ксерогеля CoO(OH) при температурах 600 и 900°С на воздухе формируется кристаллическая фаза Co3O4, что согласуется с данными ТГА. Состав образцов, полученных темплатным синтезом и прокаленных при 900°С, включает смесь оксидов Co3O4 и CoO (рис. 2, кривая 4). Частичное восстановление оксида кобальта, как было указано ранее, связано с термической деструкцией органической части полимерного латекса. В результате происходит образование монооксида углерода в газовой фазе и некоторого количества углерода в объеме материала, которые способны проявлять восстановительные свойства. Следует отметить, что степень кристалличности образцов темплатного синтеза ниже, чем осажденных образцов, так как интенсивность их дифракционных максимумов снижена.
Рис. 2.
РФА образцов материалов, синтезированных осадительным и темплатным синтезом: 1 – Co(ос)-600, 2 – Сo(ос)-900, 3 – Co(тс)-600, 4 –Co(тс)-900.
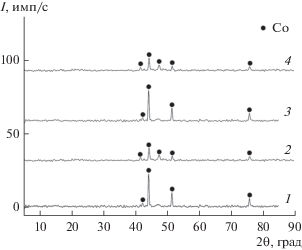
Восстановительное прокаливание полученных оксидов кобальта приводит к формированию материалов гомогенного фазового состава. Вне зависимости от метода синтеза исходных оксидов они восстанавливаются до металлического кобальта (рис. 3).
Рис. 3.
РФА образцов материалов, полученных термовосстановительным прокаливанием оксидов кобальта: 1 – Co(ос)-600/Восcт, 2 – Сo(ос)-900/Восcт, 3 – Co(тс)-600/Воcст, 4 – Co(тс)-900/Восcт.
По результатам исследования методом электронной микроскопии установлено, что морфология полученных образцов зависит от способа их синтеза. Осадительный синтез позволяет получать порошки оксидов кобальта высокой дисперсности. Размер кристаллитов не превышает 500 нм, но при повышении температуры термообработки их размерность изменяется от двумерной (слоистые зерна) до трехмерной (объемные кристаллиты), рис. 4а, 4б. В обоих случаях наблюдается открытая пористость в пределах 300–500 нм. Напротив, микроструктура образцов оксидов темплатного синтеза отличается от вышеописанных образцов более спеченной формой. Оксиды кобальта, полученные при 600°С, имеют мелкозернистую пористую структуру, которая при нагревании до 900°С на воздухе образует монолит (рис. 4в, 4г).
Рис. 4.
РЭМ-изображения образцов оксидов кобальта, полученных осадительным (а, б) и темплатным (в, г) синтезом, при прокаливании на воздухе при температурах 600 и 900°С. Образец: а – Co(ос)-600, б – Co(ос)-900, в – Co(тс)-600, г – Co(тс)-900.

При прокаливании оксидов кобальта, полученных осадительным синтезом, в атмосфере водорода частицы порошков спекаются между собой в бесформенные образования, но пористость сохраняется (рис. 5а, 4б). Восстановительная обработка оксидов, сформированных темплатным синтезом, сопровождается образованием монолитного непористого материала (рис. 5в, 4г).
Рис. 5.
РЭМ-изображения образцов материалов, полученных осадительным (а, б) и темплатным (в, г) синтезом, с последующим восстановительным прокаливанием в среде водорода при температуре 900°С. Образец: а – Co(ос)-600/Воcст, б – Co(ос)-900/Восcт, в – Co(тс)-600/Восcт, г – Co(тс)-900/Восcт.

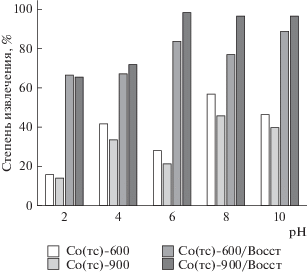
Ключевым параметром, влияющим на эффективность сорбции уранил-ионов, является pH среды вследствие изменения зарядового состояния урана в растворе [21]. Кроме того, на сорбцию оказывают влияние конкурирующие и комплексообразующие ионы. В частности, ион ${\text{CO}}_{3}^{{2--}}$ образует отрицательно заряженные стабильные комплексы с ураном, которые ограниченно сорбируются на поверхности известных магнитных сорбентов и блокируют его активные центры [21, 22]. В связи с этим сорбционную активность полученных материалов оценивали при различном значении pH среды в присутствии карбонат-ионов, а также определяли степень насыщения сорбентов при различных концентрациях извлекаемого компонента в растворе. Исходя из полученных данных (рис. 6 и 7) видно, что независимо от способа синтеза образцы оксидов кобальта обеспечивают максимальное извлечение уранил-ионов (50–60%) при pH 8, а минимальное (до 15%) – при pH 2. Следует отметить, что, в отличие распространенных сорбентов на основе оксидов железа [23, 24], практически все исследуемые оксиды кобальта обеспечивают сорбцию урана в сильнощелочной среде (pH 10) в пределах 35–45%, это является их неоспоримым преимуществом. Особый интерес вызывают образцы восстановленного типа, сорбционная эффективность которых значительно выше по сравнению с оксидами. Степень извлечения уранил-ионов для образцов восстановленных после осаждения оксидов (образцы Co(ос)-600/Воcст и Co(ос)-900/Восcт), составляет от 90 до 100% независимо от pH (рис. 5). Восстановленные формы оксидов кобальта, полученные темплатным синтезом (образцы Co(тс)-600/Восcт и Co(тс)-900/Восcт), менее эффективны в кислой среде (не более 70%) и проявляют максимальную сорбцию в нейтральной и щелочной среде (в пределах 95%) (рис. 6). Повышение сорбционной активности данных образцов можно объяснить их фазовым составом, в частности, наличием металлического кобальта Co0 (рис. 3). В сорбционной системе помимо окислительно-восстановительных переходов Co2+ ↔ Co3+ возникает дополнительное превращение Co0 → Co2+, при этом интенсифицируются процессы восстановления U6+ → U4+ [21], что и определяет сорбционный эффект в системе.
Рис. 6.
Степень извлечения уранил-ионов из водной среды при различных значениях pH в присутствии образцов оксидов кобальта, полученных осадительным синтезом, а также их восстановленных форм.
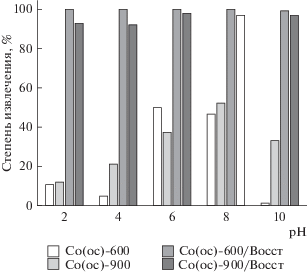
Рис. 7.
Степень извлечения уранил-ионов из водной среды при различных значениях pH в присутствии образцов оксидов кобальта, полученных темплатным синтезом, а также их восстановленных форм.
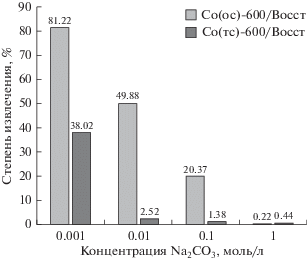
Сорбция уранил-ионов из растворов с различным содержанием карбонат-ионов в присутствии образцов восстановленного типа показана на рис. 8. Из представленных данных видно, что повышенное содержание комплексообразователя увеличивает концентрацию уранил-карбонатных комплексов $({\text{U}}{{{\text{O}}}_{2}}({\text{C}}{{{\text{O}}}_{3}})_{2}^{{2--}},$ ${\text{U}}{{{\text{O}}}_{2}}({\text{C}}{{{\text{O}}}_{3}})_{3}^{{4--}}$ и (UO2)2(CO3)(OH)3), что значительно снижает общую адсорбцию. Однако исследуемые концентрации карбонат-ионов следует считать относительно высокими, а эффективность сорбента Co(ос)-600/Восст вполне приемлемой (до 20% при концентрации 0.1 моль/л Na2CO3) для очистки природных вод. Величину pH очищаемой системы варьировали в пределах 10.5.
Рис. 8.
Степень извлечения уранил-ионов из водного раствора при наличии в нем карбонат-ионов в присутствии образцов, полученных восстановительным прокаливанием оксидов кобальта.
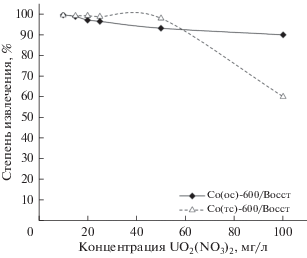
Результаты, представленные на рис. 9, позволяют оценить сорбционную емкость образцов восстановленных форм оксидов кобальта. Максимальное сорбционное насыщение образца Co(тс)-900/Восст сохраняется при концентрации (UO2)2(OH)3– до 50 мг/л, а затем резко снижается. Образец Co(ос)-600/Восст отличается более высокой емкостью, так как степень извлечения сохраняется в пределах 90% при концентрации извлекаемого компонента в растворе 100 мг/л.
Рис. 9.
Зависимость степени извлечения уранил-ионов от их концентрации в водном растворе (pH 6) в присутствии образцов, полученных восстановительным прокаливанием оксидов кобальта.
Дополнительно в исследовании применяли метод атомно-абсорбционной спектрометрии для определения наличия кобальта в очищаемых растворах с целью выявления вероятности его вымывания из-за возможного частичного растворения сорбентов. Аналитические результаты показали, что вымывание кобальта отсутствует.
На основании результатов энергодисперсионного микроанализа установлено, что адсорбированный уран распределяется по всей поверхности отработанного сорбента, но не однородно (рис. 10). Присутствуют области с повышенным и дефицитным содержанием урана, его количество на поверхности варьируется (табл. 2). Вероятно, это обусловлено неоднородной микроструктурой и ограниченностью метода ЭДС – съемкой только с доступной поверхности образца. Кроме того, из-за неоднородного распределения активных центров на поверхности сорбентов локальная концентрация сорбированного урана на ней может сильно различаться.
Рис. 10.
ЭДС-микроанализ распределения элементов (Co и U) по поверхности образца Co(ос)-600/Восcт (увеличение ×1000) после сорбции уранил-ионов из водного раствора при pH 6.

Таблица 2.
Количественные результаты ЭДС-микроанализа с поверхности образца Co(ос)-600/Восcт, содержание элементов в мас. % (область спектров на рис. 10)
| Спектр | Co | O | U |
|---|---|---|---|
| 1 | 80.08 | 12.92 | 7.00 |
| 2 | 84.62 | 11.05 | 4.33 |
| 3 | 91.40 | 5.05 | 3.55 |
Ключевыми магнитными характеристиками неорганических сорбентов, влияющих на “излечимость” отработанного сорбента из раствора, являются намагниченность насыщения (Ms), коэрцитивная сила (Нс) и поле насыщения (Hs) [2]. В настоящей работе магнитные свойства образцов исследовали при комнатной температуре (табл. 1). Установлено, что после осадительного синтеза Co3O4 имеет типичное антиферромагнитное поведение. Намагниченность Ms линейно возрастает с увеличением поля Hs. На рис. 11 представлены петли гистерезиса только для образцов, отожженных при температуре 600°С, так как вид петель для двух серий совпадает. Для образцов, отожженных при 600°С, наблюдается максимум Ms = 1.4 эме/г в поле Нс = 40 кЭ. Величина коэрцитивной силы в этих образцах минимальна и равна Нс = 10 Э (вставки на рис. 11а). Образцы, полученные темплатным синтезом, демонстрируют антиферромагнитное поведение, но с большим гистерезисом.
Рис. 11.
Петли магнитного гистерезиса сорбентов, полученных осадительным и темплатным синтезом при температуре 600°С (а), с последующим восстановительным прокаливанием в среде водорода при 700°С (б).
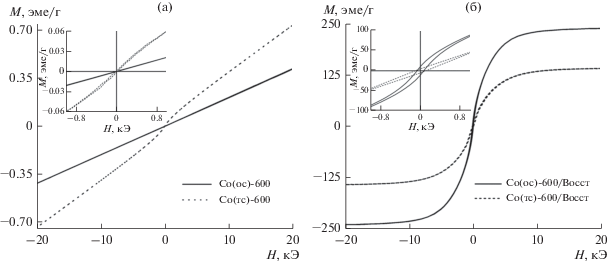
Восстановительное прокаливание оксидов приводит к значительному увеличению намагниченности насыщения Ms до 142–250 эме/г (рис. 11б). Этот факт обусловлен изменением фазового состава материала и образованием металлического кобальта (рис. 3). Отмечено значительное увеличение коэрцитивной силы, но указанные величины являются относительно невысокими (табл. 1). Низкие значения Hc (не более 150 Э) и малая остаточная намагниченность (вставка на рис. 11б) являются преимуществом для магнитных сорбентов, так как их гранулы не будут собираться в агломераты в отсутствие внешнего магнитного поля. Это облегчает их распределение и последующий сбор в очищаемом растворе.
ЗАКЛЮЧЕНИЕ
Получены материалы на основе оксидов кобальта и их восстановленных форм методами прямого осадительного, оригинального темплатного и термовосстановительного синтеза. С помощью ТГ/ДТГ/ДТА и РФА показано, что образование оксидных фаз Co3O4 и CoO и удаление (выгорание) полимерного латекса происходят при термодеструкции ксерогеля CoO(OH) на воздухе независимо от способа его синтеза. Установлено, что термовосстановление полученных оксидов приводит к формированию индивидуальной фазы металлического кобальта в составе материала. Методом РЭМ и физической адсорбцией азота выявлено, что морфология материалов значительно изменяется при повышении температуры и зависит от типа газовой среды: происходит рост зерна, снижается удельная площадь поверхности и образуется монолитная непористая структура. Оценка сорбционных свойств оксидов кобальта показала, что их использование (независимо от способа получения) позволяет извлекать уран в количестве до 15% в кислой среде (pH 2), 50–60% в щелочной (pH 8) и 35–45% в сильнощелочной (pH 10). Установлено, что восстановленные формы оксидов обладают более высокими сорбционными характеристиками (до 90–100% извлечения урана) в диапазоне pH 2–10. Данные сорбенты также эффективны при извлечении урана из карбонатных водных сред (степень извлечения достигает 20% при концентрации 0.1 моль/л Na2CO3). Установлено, что вымывание кобальта при контакте сорбента с очищаемым раствором отсутствует. Наличие магнитного момента у исследованных сорбентов на основе соединений кобальта (до 133–237 эме/г) указывает на перспективность их использования для очистки промышленных стоков сложного состава с применением сепарации магнитным полем. Следует отметить, что для повышения эффективности сепарации сорбентов перспективным является создание композитных соединений кобальта, например, системы шпинелей CoFe2O4 или твердых растворов NdFeCoB в виде наночастиц или объемных материалов. Варьирование соотношения Fe и Со в указанных композитах позволяет регулировать сорбционные и магнитные характеристики в широком диапазоне.
Список литературы
Singh N.B., Nagpal G., Agrawal S. et al. // Environ. Technol. Innov. 2018. V. 11. P. 87. https://doi.org/10.1016/j.eti.2018.05.006
Ambashta R.D., Sillanpää M. // J. Hazard. Mater. 2010. V. 180. P. 38. https://doi.org/10.1016/j.jhazmat.2010.04.105
Bhalara P.D., Punetha D., Balasubramanian K. // J. Environ. Chem. Eng. 2014. V. 2. P. 1621. https://doi.org/10.1016/j.jece.2014.06.007
Missana T., García-Gutiérrez M., Maffiotte C. // J. Colloid Interface Sci. 2003. V. 260. P. 291. https://doi.org/10.1016/S0021-9797(02)00246-1
Shuibo X., Chun Z., Xinghuo Z. et al. // J. Environ. Radioact. 2009. V. 100. P. 162. https://doi.org/10.1016/j.jenvrad.2008.09.008
Jing C., Li Y.L., Landsberger S. // J. Environ. Radioact. 2016. V. 164. P. 65. https://doi.org/10.1016/j.jenvrad.2016.06.027
Zong P., Wang S., Zhao Y. et al. // Chem. Eng. J. 2013. V. 220. P. 45. https://doi.org/10.1016/j.cej.2013.01.038
Palchik N.A., Razvorotneva L.I., Moroz T.N. et al. // Russ. J. Inorg. Chem. 2019. V. 64. P. 308. [Пальчик Н.А., Разворотнева Л.И., Мороз Т.Н. и др. // Журн. неорган. химии. 2019. Т. 64. С. 308.] https://doi.org/10.1134/S003602361903015X
Riba O., Scott T.B., Vala Ragnarsdottir K. et al. // Geochim. Cosmochim. Acta. 2008. V. 72. P. 4047. https://doi.org/10.1016/j.gca.2008.04.041
Papynov E.K., Portnyagin A.S., Cherednichenko A.I. et al. // Dokl. Phys. Chem. 2016. V. 468. P. 67. https://doi.org/10.1134/S001250161605002X
Papynov E.K., Tkachenko I.A., Maiorov V.Y. et al. // Radiochemistry. 2019. V. 61. P. 28. https://doi.org/10.1134/S1066362219010053
Abdolmohammad-Zadeh H., Ayazi Z., Hosseinzadeh S. // Microchem. J. 2019. https://doi.org/10.1016/j.microc.2019.104268
Zolgharnein J., Dalvand K., Rastgordani M. et al. // J. Alloys Compd. 2017. V. 725. P. 1006. https://doi.org/10.1016/j.jallcom.2017.07.228
Bin Chung J., Chung J.S. // Chem. Eng. Sci. 2005. V. 60. P. 1515. https://doi.org/10.1016/j.ces.2004.11.002
Nekouei F., Nekouei S., Tyagi I. et al. // J. Mol. Liq. 2015. V. 201. P. 124. https://doi.org/10.1016/j.molliq.2014.09.027
Haiduk Y.S., Savitsky A.A., Khort A.A. et al. // Russ. J. Inorg. Chem. 2019. V. 64. P. 717. https://doi.org/10.1134/S003602361906007X
Wang H.H., Li X.R., Fei G.Q. et al. // Express Polym. Lett. 2010. V. 4. P. 670. https://doi.org/10.3144/expresspolymlett.2010.82
Papynov E.K., Mayorov V.Y., Palamarchuk M.S. et al. // J. Sol-Gel Sci. Technol. 2013. V. 68. P. 374. https://doi.org/10.1007/s10971-013-3039-0
Бусев А.И., Типцова В.Г., Иванов В.М. // Руководство по аналитической химии редких элементов. М.: Химия, 1978.
Wu R.J., Wu J.G., Tsai T.K. et al. // Sensors Actuators, B Chem. 2006. V. 120. P. 104. https://doi.org/10.1016/j.snb.2006.01.053
Zhao D., Wang X., Yang S. et al. // J. Environ. Radioact. 2012. V. 103. P. 20. https://doi.org/10.1016/j.jenvrad.2011.08.010
Crane R.A., Dickinson M., Popescu I.C. et al. // Water Res. 2011. V. 45. P. 2931. https://doi.org/10.1016/j.watres.2011.03.012
Scott T.B., Allen G.C., Heard P.J. et al. // Proc. R. Soc. A Math. Phys. Eng. Sci. 2005. V. 461. P. 1247. https://doi.org/10.1098/rspa.2004.1441
Crane R.A., Scott T.B. // J. Hazard. Mater. 2012. V. 211–212. P. 112. https://doi.org/10.1016/j.jhazmat.2011.11.073
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии


