Журнал неорганической химии, 2020, T. 65, № 7, стр. 995-999
Исследование равновесий комплексообразования ионов серебра(I) с N-фенилтиомочевиной в водном растворе
А. С. Самадов a, *, И. В. Миронов b, И. Г. Горичев a, А. Ф. Степнова a
a Московский педагогический государственный университет
129164 Москва, ул. Кибальчича, 6, корп. 3, Россия
b Институт неорганической химии им. А.В. Николаева СО РАН
630090 Новосибирск, пр-т Академика Лаврентьева, 3, Россия
* E-mail: s.s.rasul@mail.ru
Поступила в редакцию 21.01.2020
После доработки 25.02.2020
Принята к публикации 27.02.2020
Аннотация
Методом потенциометрического титрования с серебряным электродом изучен процесс комплексообразования ионов серебра(I) с N-фенилтиомочевиной в широкой области концентраций серебра(I) и N-фенилтиомочевины (L) при 25.0°C и ионной силе I = 0.11 М (0.01 M HNO3 + 0.1 M NaNO3). В изученной области концентраций ионов Ag+ (1 × 10–5–1 × 10–3 моль/л) в растворе присутствуют моно- и биядерные комплексы. Доминирующей формой является ${\text{A}}{{{\text{g}}}_{{\text{2}}}}{\text{L}}_{3}^{{2 + }}.$ При CL/CAg > 1 доля моноядерных форм значительно ниже, чем биядерных. Полученные значения полных констант устойчивости комплексов равны: lg β11 = 5.58, lg β12 = 10.75, lg β21 = 10.1, lg β22 = 17.1, lg β23 = 23.2, lg β24 = 25.9, lg β25 = 29.2.
ВВЕДЕНИЕ
Равновесия образования комплексов серебра(I) c тиомочевиной в водном растворе изучены потенциометрически и спектрофотометрически в работах [1–6]. Показано, что серебро(I) с тиомочевиной способно образовывать моноядерные [1, 3, 7] и биядерные комплексы [2, 8]. Исследование моноядерных комплексов с тиомочевиной при малой концентрации ионов серебра(I) ($С_{{{\text{Ag}}}}^{ + }$ ∼ ∼ 10–4 моль/л) было выполнено в работах [6, 9, 10]. Тиомочевина и ее производные имеют высокое сродство к ионам серебра(I) и образуют с ними прочные связи [11], координируясь к атому металла через атом серы. В биядерных комплексах атом серы является мостиковым. Различные комплексы с тиомочевиной обладают высокой термодинамической устойчивостью [12, 13], что позволяет использовать тиомочевину в процессах извлечения серебра из различного сырья наряду с другими благородными металлами [14–16]. Производные тиомочевины, включая фенилтиомочевину, помимо применения в медицине могут использоваться для очистки воды от ионов тяжелых металлов, в первую очередь ртути(II) [17, 18]. Для этого производные тиомочевины обычно вводят в состав какого-либо полимера или многокомпонентных органических композиций, чтобы предотвратить их переход в раствор при сохранении способности к комплексообразованию. Есть данные о разработке высокочувствительных электрохимических датчиков, в частности на серебро(I) [19], в которых фенилтиомочевина и аналогичные соединения входят в состав паст, которые наносят на электрод. По сравнению с тиомочевиной растворимость в воде фенил- и дифенилтиомочевины намного ниже (для дифенилтиомочевины S < 5 × 10–4 M). С другой стороны, в отличие от тиомочевины, они хорошо растворяются в органических растворителях, включая малополярные.
Данных об устойчивости комплексов с производными тиомочевины мало. Так, спектрофотометрически были изучены моноядерные комплексы висмута(III) с N-фенилтиомочевиной и некоторыми N- и N,N-замещенными производными тиомочевины [20, 21]. Сведения о константах устойчивости комплексных соединений серебра(I) с N-фенилтиомочевиной в литературе отсутствуют.
Целью настоящей работы является изучение процесса комплексообразования серебра(I) с N-фенилтиомочевиной в широком диапазоне концентраций в водном растворе при t = 25°C.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали нитрат серебра(I) (х. ч.) и N-фенилтиомочевину (L) (ч.). Исследования проводили потенциометрическим методом. Для этого измеряли ЭДС цепей.
| Ag | ${{C}_{{{\text{AgN}}{{{\text{O}}}_{{\text{3}}}}}}},$ CL | KNO3нас | КClнас | AgCl, Ag |
|---|---|---|---|---|
| 0.1 M NaNO3, 0.01 M HNO3 |
Солевой мост заполняли насыщенным раствором KNO3 во избежание образования осадка AgCl на границе с исследуемым раствором. В качестве электрода сравнения использовали насыщенный хлорсеребряный электрод (НХСЭ), все потенциалы в работе приведены относительно НХСЭ. Индикаторным электродом служила серебряная проволока (99.99%). ЭДС измеряли c помощью прибора Эксперт-001. Для проверки обратимости серебряного электрода проводили измерения ЭДС цепи c CL = 0 и переменной концентрацией CAg (1.0 × 10–5–1.0 × 10–3 моль/л) в той же ионной среде. В этих условиях CAg = [Ag+]. Наклон зависимости E = E∅ + θ lg CAg составил θ = 59 ± 2 мВ, что соответствует теоретическому значению 59.16. Величина E∅ = 591.4 мВ с учетом потенциала НХСЭ (∼200 мВ) соответствует стандартному потенциалу пары Ag+/Ag. Все измерения потенциалов проводили при температуре (25.0 ± 0.1)°С в термостатированной ячейке. Использовали растворы AgNO3 и N-фенилтиомочевины (L) c концентрациями СAg = 1 × 10–5–1 × 10–3 моль/л и СL = 1 × 10–3–1 × 10–2 моль/л. Для поддержания постоянной ионной силы раствора использовали 0.1 М NaNO3 (х. ч.) и 0.01 М HNO3 (фиксанал). В ходе эксперимента раствор с заданной концентрацией $C_{{{\text{Ag}}}}^{0}$ титровали раствором N-фенилтиомочевины с измерением потенциала Ag-электрода. Титрование для каждой серии $\left( {C_{{{\text{Ag}}}}^{0}} \right)$ проводили не менее двух раз, различие показаний для параллельных титрований не превышало 3–4 мВ.
На начальном этапе такое же титрование выполняли для тиомочевины. Предварительная обработка данных показала, что вычисляемые значения логарифмов констант устойчивости отличаются от результатов работы [1] не более чем на 0.2.
Ввиду сложности системы было опробовано два варианта обработки экспериментальных данных. В первом из них величину констант устойчивости моно- и биядерных комплексов ${\text{AgL}}_{i}^{ + }$ и ${\text{A}}{{{\text{g}}}_{{\text{2}}}}{\text{L}}_{i}^{{2 + }}$ (i = 1–6) рассчитывали итерационно при помощи модифицированных функций Ледена [22] с использованием программ Mathcad-15 и Еxcel. Для области низких концентраций серебра(I) (CAg = (1–5) × 10–5 моль/л), где предполагались в основном моноядерные комплексы, используемая функция Ледена имела вид:
(1)
$F([{\text{L}}]) = \sum {{{\beta }_{{1i}}}} {{\left[ {\text{L}} \right]}^{{i - 1}}} = \frac{{{{C}_{{{\text{A}}{{{\text{g}}}^{ + }}}}} - [{\text{A}}{{{\text{g}}}^{{\text{ + }}}}]}}{{[{\text{A}}{{{\text{g}}}^{{\text{ + }}}}][{\text{L}}]}},$(2)
$F([{\text{L]}}) = \sum {{{\beta }_{{2i}}}} {{\left[ {\text{L}} \right]}^{i}} = \frac{{{{C}_{{{\text{A}}{{{\text{g}}}^{ + }}}}} - [{\text{A}}{{{\text{g}}}^{ + }}]}}{{{{{[{\text{A}}{{{\text{g}}}^{ + }}]}}^{2}}}}.$Величины [Ag+] в ходе титрования рассчитывали из значений потенциалов при помощи уравнения Нернста: 59.16 lg([Ag+]/$C_{{{\text{Ag}}}}^{0}$) = ΔE = E – E 0, где E 0 – потенциал электрода в исходном растворе с концентрацией $C_{{{\text{Ag}}}}^{0}$ в отсутствие лиганда.
Другой способ обработки данных состоял в том, что в каждой экспериментальной точке, исключая данные на скачках потенциалов, проводили расчет равновесных концентраций всех форм из заданного набора на основе известных общих концентраций ($C_{{{\text{Ag}}}}^{ + }$ и CL) и констант равновесий первого приближения. Из рассчитанных ([Ag+]расч) и экспериментальных ([Ag+]эксп) величин и находили значение целевой функции S2 = = Σ(lg[Ag+]расч – lg[Ag+]эксп)2. Далее, варьируя значения констант и каждый раз заново рассчитывая равновесный состав, добивались снижения S2 до минимального значения. Поскольку экспериментальная погрешность измерения потенциалов мало изменяется в ходе титрования и от серии к серии, то веса не вводили. Такую обработку проводили как для отдельных серий, так и для всего набора данных. Этот способ полностью аналогичен нелинейному методу наименьших квадратов с единственным отличием, состоящим в том, что расчет равновесного состава по заданному общему составу и константам проводится численно в отдельном блоке [23].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Для изучения равновесий комплексообразования серебра(I) с N-фенилтиомочевиной в водном растворе было выполнено потенциометрическое титрование в широкой области концентраций ионов Ag+ и лиганда. Как и в случае с тиомочевиной [1], в данной системе возможно образование моно- и биядерных комплексов:
(3)
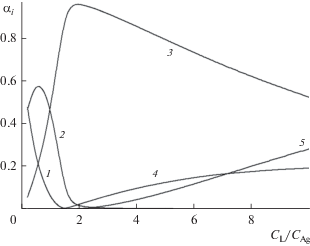
$\begin{gathered} {\text{A}}{{{\text{g}}}^{ + }} + i{\text{L}} = {\text{AgL}}_{i}^{ + },\,\,{{{\beta }}_{{1i}}}, \\ 2{\text{A}}{{{\text{g}}}^{ + }} + i{\text{L}} = {\text{A}}{{{\text{g}}}_{2}}{{{\text{L}}}_{i}},\,\,{{{\beta }}_{{2i}}}. \\ \end{gathered} $Предполагалось, что при низких концентрациях ($С_{{{\text{Ag}}}}^{ + }$ < 5 × 10–5 моль/л) образуются преимущественно моноядерные, а при высоких (5 × 10–5 < < $С_{{{\text{Ag}}}}^{ + }$ ≤ 1 × 10–3 моль/л) – биядерные комплексы. На наличие обоих видов комплексов в системе указывает, в частности, пересечение обычных функций Ледена F = CAg/[Ag+] в зависимости от CL для разных CAg. Зависимости E от отношения CL/CAg для разных концентраций CAg приведены на рис. 1.
Рис. 1.
Зависимости потенциала серебряного электрода (E) от соотношения CL/CAg для $С_{{{\text{Ag}}}}^{ + }{\text{:}}$ 1 – 1 × 10–5; 2 – 5 × 10–5; 3 – 1 × 10–4; 4 – 5 × 10–4; 5 – 1 × 10–3 моль/л.
Предварительное рассмотрение экспериментальных данных показало следующее. Во всех случаях для CAg ≥ 5 × 10–5 моль/л наблюдается скачок при соотношении CL /CAg ∼ 1.5, т.е., как и для тиомочевины [2], в данной системе присутствует устойчивый комплекс ${\text{A}}{{{\text{g}}}_{{\text{2}}}}{\text{L}}_{3}^{{2 + }}.$ Более того, зависимости с CAg ≤ 5 × 10–4 моль/л пересекаются вблизи скачка в узком диапазоне E, что свидетельствует о близких значениях [Ag+] независимо от CAg. Такое возможно, если помимо ${\text{A}}{{{\text{g}}}_{{\text{2}}}}{\text{L}}_{3}^{{2 + }}$ основными формами в этой области являются ${\text{A}}{{{\text{g}}}_{{\text{2}}}}{\text{L}}_{2}^{{2 + }}$ и ${\text{AgL}}_{2}^{ + },$ причем для равновесия ${\text{AgL}}_{{\text{2}}}^{{\text{ + }}}$ + Ag+ = ${\text{A}}{{{\text{g}}}_{{\text{2}}}}{\text{L}}_{2}^{{2 + }}$ величина константы равна lgK ∼ –lg [Ag+] – lg 2 ∼ 6. Таким образом, биядерные формы присутствуют в системе уже при низких значениях CAg. Расчеты по экспериментальным данным в области CL$ \gg $ CAg (в 10–50 раз), где можно принять [L] ∼ CL, не показали значимых превышений производных d lg F/d lg CL по сравнению с 2, что свидетельствует о малом вкладе в материальный баланс системы форм с соотношением L/Ag+ > 2. Вероятно, для получения формы ${\text{AuL}}_{3}^{ + }$ или ${\text{A}}{{{\text{u}}}_{{\text{2}}}}{\text{L}}_{6}^{{2 + }}$ требуется более высокая концентрация лиганда. Таким образом, основными формами системы являются AgLi (i = 0–2) и Ag2Li (i = 1–4). Результаты расчетов констант по описанной выше процедуре для всех экспериментальных точек приведены в табл. 1. В ходе обработки производили включение или, наоборот, исключение новых форм в модель системы для улучшения сходимости. В частности, проверяли влияние комплексов с большей степенью полимеризации, таких как ${\text{A}}{{{\text{g}}}_{{\text{3}}}}{\text{L}}_{3}^{{3 + }}$ и др. Заметного улучшения описания данных это не дало.
Таблица 1.
Логарифмы констант устойчивости моно- и биядерных комплексов серебра(I) с N-фенилтиомочевиной при 25.0°C и I = 0.11 M (0.1 M NaNO3 + 0.01 M HNO3)
| lg β11 | lg β12 | lg β21 | lg β22 | lg β23 | lg β24 | lg β25* |
|---|---|---|---|---|---|---|
| 5.58 | 10.75 | 10.1 | 17.1 | 23.2 | 25.9 | (29.2) |
Из данных табл. 1 видно, что присоединение второго иона Ag+ к AgL+ (AgL+ + Ag+ = Ag2L2+) с образованием мостиковой связи через атом серы лиганда имеет заметно меньшую константу (lg K = 4.5) по сравнению с образованием AgL+ (5.6). Присоединение третьего лиганда (${\text{AgL}}_{3}^{ + },$ ${\text{A}}{{{\text{g}}}_{{\text{2}}}}{\text{L}}_{4}^{{2 + }},$ ${\text{A}}{{{\text{g}}}_{{\text{2}}}}{\text{L}}_{5}^{{2 + }}$), избыточного по отношению к характерному для Ag+ КЧ = 2, характеризуется намного меньшей константой, чем в случае присоединения первого и второго лигандов. Кроме того, сравнение данных табл. 1 с аналогичными данными для тиомочевины [1] показывает, что соответствующие константы соизмеримы. Моноядерные комплексы с тиомочевиной более устойчивы, а устойчивость биядерных, наоборот, на 1–1.5 лог. ед. ниже.
На рис. 2 показано изменение общей доли подсистемы моноядерных комплексов (Ag+, AgL+, ${\text{AgL}}_{2}^{ + }$) в общей концентрации серебра(I) для различных CAg.
Рис. 2.
Зависимость доли моноядерных комплексов от соотношения ${{{{С}_{{\text{L}}}}} \mathord{\left/ {\vphantom {{{{С}_{{\text{L}}}}} {C_{{{\text{Ag}}}}^{ + }}}} \right. \kern-0em} {C_{{{\text{Ag}}}}^{ + }}}$ для $С_{{{\text{Ag}}}}^{ + }{\text{:}}$ 1 – 1 × 10–5; 2 – 5 × × 10–5; 3 – 1 × 10–4; 4 – 5 × 10–4; 5 – 1 × 10–3 моль/л.
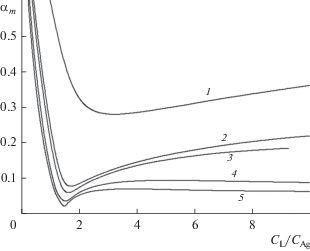
Наблюдаемый минимум зависимостей (рис. 2) расположен близко к ${{{{С}_{{\text{L}}}}} \mathord{\left/ {\vphantom {{{{С}_{{\text{L}}}}} {C_{{{\text{Ag}}}}^{ + }}}} \right. \kern-0em} {C_{{{\text{Ag}}}}^{ + }}}$ = 1.5 и обусловлен доминированием формы ${\text{A}}{{{\text{g}}}_{{\text{2}}}}{\text{L}}_{3}^{{2 + }}$ в подсистеме биядерных комплексов. Резкий рост αm при ${{{{С}_{{\text{L}}}}} \mathord{\left/ {\vphantom {{{{С}_{{\text{L}}}}} {C_{{{\text{Ag}}}}^{ + }}}} \right. \kern-0em} {C_{{{\text{Ag}}}}^{ + }}}$ < < 1.5 связан с нехваткой лиганда и присутствием в системе свободных ионов Ag+. При ${{{{С}_{{\text{L}}}}} \mathord{\left/ {\vphantom {{{{С}_{{\text{L}}}}} {C_{{{\text{Ag}}}}^{ + }}}} \right. \kern-0em} {C_{{{\text{Ag}}}}^{ + }}}$ > 1.5 вклад моноядерных комплексов небольшой (для $C_{{{\text{Ag}}}}^{ + }$ = 1.0 × 10–3 моль/л несколько процентов), хотя при неограниченном росте CL он, вероятно, будет возрастать вследствие появления формы ${\text{AgL}}_{3}^{ + }.$ Однако увеличение CL ограничено невысокой растворимостью N-фенилтиомочевины (∼2 × 10–2 моль/л).
На рис. 3 приведено долевое распределение по формам в подсистеме биядерных комплексов. Доминирующей формой является ${\text{A}}{{{\text{u}}}_{{\text{2}}}}{\text{L}}_{3}^{{2 + }}.$ Вклад остальных форм намного меньше.
ЗАКЛЮЧЕНИЕ
Система комплексов серебра(I) с N-фенилтиомочевиной аналогична системе комплексов с тиомочевиной, в первую очередь в отношении вида форм. Константы соответствующих равновесий несколько различаются: для тиомочевины моноядерные комплексы устойчивее, а биядерные, наоборот, менее устойчивы. В обоих случаях наиболее устойчивой формой является ${\text{A}}{{{\text{g}}}_{{\text{2}}}}{\text{L}}_{3}^{{2 + }},$ и при ${{{{С}_{{\text{L}}}}} \mathord{\left/ {\vphantom {{{{С}_{{\text{L}}}}} {C_{{{\text{Ag}}}}^{ + }}}} \right. \kern-0em} {C_{{{\text{Ag}}}}^{ + }}}$ > 1 общая доля биядерных комплексов в несколько раз превышает долю моноядерных.
Список литературы
Миронов И.В., Цвелодуб Л.Д. // Журн. неорган. химии. 1996. Т. 41. № 2. С. 240.
Миронов И.В. // Журн. неорган. химии. 1989. Т. 34. С. 1769.
Krzewska S., Podsiadly H. // Polyhedron. 1986. V. 5. P. 937.
Ahmad S. // Trans. Met. Chem. 2002. V. 27. P. 782.
Isab A.A., Ahmad S.M. // Polyhedron. 2002. V. 21. P. 1267.
Domenico De Marco // ISRN Inorg. Chem. 2013. V. 2013. P. 1.
Самадов А.С., Изотов А.Д., Горичев И.Г. // VIII Междунар. конф. “Деформация и разрушение материалов и наноматериалов”. Москва 19–22 ноября 2019 г. Сб. материалов. М.: ИМЕТ РАН, 2019. 860 с.
Lukinskas P., Savickaja I., Sˇukiene V. et al. // J. Coord. Chem. 2008. V. 61. № 16. P. 2528.
Содатдинова А.С., Сафармамадов С.М., Аминджанов А.А. и др. // Изв. Вузов. Химия и хим. технология. 2014. Т. 57. № 7. С. 62.
Содатдинова А.С., Сафармамадов С.М., Мабаткадамова К.С. и др. // Вестник Пермского ун-та. Сер. Химия. 2016. № 1(21). С. 69.
Pearson R.G. // J. Am. Chem. Soc. 1963. V. 85. № 22. P. 3533.
Domenico De M., Marchese A., Linert W. // Thermochim. Acta. 1990. V. 167. № 1. P. 1.
Domtyico De M., Giannetto A., Barone F. et al. // Thermochim. Acta. 1994. V. 246. № 1. P. 229.
Ji-In Y., Saurabha B., Yeoung-Sang Y. et al. // J. Hazardous Mater. 2018. V. 344. P. 398. https://doi.org/10.1016/j.jhazmat.2017.10.050
Calla-Choque D., Lapidus G.T. // Hydrometallurgy. 2020. V. 192. Paper 105289. https://doi.org/10.1016/j.hydromet.2020.105289
Fupeng L., Jinliang W., Chao P. et al. // Hydrometallurgy. 2019. V. 185. P. 38. https://doi.org/10.1016/j.hydromet.2019.01.017
Okuniewski A., Rosiak D., Chojnacki J. et al. // Polyhedron. 2015. V. 90. P. 47. https://doi.org/10.1016/j.poly.2015.01.035
Shaker M.A. // Mater. Chem. Phys. 2015. V. 162. P. 580. https://doi.org/10.1016/j.matchemphys.2015.06.032
El-Mai H., Espada-Bellido E., Stitou M. et al. // Talanta. 2016. V. 151. P. 14. https://doi.org/10.1016/j.talanta.2016.01.008
Головнев Н.Н., Новикова Г.В., Лешок А.А. // Журн. неорган. химии. 2009. Т. 54. № 2. С. 374.
Головнев Н.Н., Петров А.И., Лыхин А.О. и др. // Журн. неорган. химии. 2012. Т. 57. № 4. С. 661.
Хартли Ф., Бергес К., Олкок Р. Равновесия в растворах. М.: Мир, 1983. 365 с.
Mironov I.V., Kal’nyi D.B., Kokovkin V.V. // J. Solution Chem. 2017. V. 46. P. 989. https://doi.org/10.1007/s10953-017-0616-9
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии