Журнал неорганической химии, 2020, T. 65, № 8, стр. 1011-1018
Синтез, структура и свойства La1 – 2xSrxBixMn1 – yNiyO3 + δ (x = 0.15, 0.25, y = 0.0–0.4)
О. С. Каймиева a, *, А. В. Ким a, Е. С. Буянова a, С. А. Петрова b
a Уральский федеральный университет имени первого Президента России Б.Н. Ельцина,
Институт естественных наук и математики
620000 Екатеринбург, пр-т Ленина, 51, Россия
b Институт металлургии УрО РАН
620016 Екатеринбург, ул. Амундсена, 101, Россия
* E-mail: kaimi-olga@mail.ru
Поступила в редакцию 17.01.2020
После доработки 03.03.2020
Принята к публикации 27.03.2020
Аннотация
Изучена возможность формирования твердого раствора состава La1 – 2xBixSrxMn1 –yNiyO3 + δ (x = = 0.15, 0.25, y = 0.0–0.4) и влияние метода получения на его характеристики. Однофазные соединения с ромбоэдрической структурой получены при y ≤ 0.2. Дальнейшее увеличение содержания Ni2+ приводит к образованию дополнительных фаз – NiO, Bi7.72Mn0.28O12.14 или Bi1.72Sr0.53O3. Коэффициент термического расширения составов La0.7Bi0.15Sr0.15MnO3.22 и La0.7Bi0.15Sr0.15Mn0.9Ni0.1O3.17 совпадает и равен 12 × 10–6 K–1. Значения электропроводности образцов, полученных цитратно-нитратным методом и соосаждением, на порядок больше, чем при твердофазном синтезе, благодаря меньшему размеру частиц (1–5 мкм). Наличие примесей способствует резкому падению электропроводности при температурах ниже 773 K. Изменение pO2 в области 10–7–0.21 атм не влияет на величину общей электропроводности образцов.
ВВЕДЕНИЕ
Манганиты лантана-стронция с перовскитоподобной структурой ABO3 являются востребованными катодными материалами для топливных элементов, катализаторов дожигания выхлопных газов, кислородных мембран и т.п. [1]. Они имеют достаточно высокие значения электронной проводимости p- и n-типа, обеспечиваемые благодаря переносу электронов между электронными уровнями марганца [2–4], и коэффициента термического расширения (КТР) (∼10.75 × 10–6 K–1 [5]), которые близки к таковым для материалов электролитов (9–11 × 10–6 K–1) [6]. В последние десятилетия эти материалы рассматривают как перспективные для применения в области магнитного охлаждения, магнитных датчиков, фотонных устройств и инфракрасных детекторов [7]. Все манганиты лантана содержат марганец в различных степенях окисления и в зависимости от соотношения Mn3+ и Mn4+ могут кристаллизоваться в кубической (Mn4+ > 33%), ромбоэдрической (24 < < Mn4+ < 33%), орторомбической (0 < Mn4+ < 24%) и моноклинной (Mn4+ = 0%) модификациях [8]. Для оптимизации свойств материалов проводят замещение катионов по A- или B-подрешетке примесями донорного или акцепторного типа, что позволяет изменять величину электропроводности, коэффициента термического расширения и увеличивать механическую совместимость с материалом электролита [1]. При замещении марганца на никель в [9] получены однофазные образцы LaMn1 –xNixO3 с орторомбической структурой (x < 0.3), которая при дальнейшем увеличении содержания ионов никеля переходит в ромбоэдрическую структуру (0.3 < x < 0.7). При комнатной температуре отмечен резкий (в 3 раза) рост электропроводности для состава LaMn0.9Ni0.1O3 по сравнению с матричным соединением. Продолжение исследований выявило, что введение стронция в структуру никельзамещенного манганита лантана на примере La0.6Sr0.4Mn1 –xNixO3 приводит к стабилизации ромбоэдрической структуры при 0 < x < 0.5, при этом электропроводность, согласно [10], растет только до x = 0.1 (табл. 1). Чаще всего введение 3d-переходного металла уменьшает проводимость замещенных манганитов лантана, однако при этом величина КТР становится ближе к таковой для материала электролита [11, 12]. Замещение позиции лантана в LaBO3 висмутом, например с образованием твердого раствора La1 –xBixMnO3 (х = 0.06), приводит к ферромагнитному упорядочению в структуре [13] и может влиять на электропроводящие свойства образцов [14, 15]. Для никелата лантана, замещенного висмутом (La1.65Bi0.1Sr0.25NiO4 + δ), как катодного материала для YSZ (оксид циркония, стабилизированный иттрием) величина поляризационного сопротивления равна 0.61 Ом см2 при 973 K [16], что в разы меньше, чем для аналогов, не содержащих висмут в своем составе. Одним из способов значительного снижения поляризационного сопротивления катодного материала на основе манганита лантана является создание композитных материалов, что самым благоприятным образом влияет на его рабочие характеристики [17–19]. В данном случае в качестве второго компонента композита часто также выступают соединения висмута. Например, композит состава (La0.74Bi0.10Sr0.16)MnO3 – δ–(Bi2O3)0.7(Er2O3)0.3 имеет значение поляризационного сопротивления 0.11 Ом см2 при 1023 K, в то время как для LSM (La1 –xSrxMnO3)–GDC (оксид гадолиния, допированный церием) и LSM–YSZ данная величина составляет 0.49 и 1.31 Ом см2 соответственно [17]. Одновременное замещение A- и B-подрешеток также часто используется для модификации свойств, например в [12, 20]. Однако работ, посвященных созданию и изучению характеристик манганитов лантана как катодных материалов, замещенных в обеих подрешетках несколькими допантами, одним из которых выступает висмут, крайне мало.
Существенное влияние на характеристики конечного продукта оказывает и структура соединений, которая во многом определяется условиями синтеза сложных оксидов. Известна зависимость свойств материала и от размера зерен, и от микроструктуры конечного продукта [21]. В этом случае есть необходимость подбора оптимального метода синтеза сложнооксидных соединений для получения материала с лучшими характеристиками.
Цель настоящей работы – получение новых составов на основе манганита лантана, замещенного висмутом, стронцием и никелем, с общей формулой La1 – 2xBixSrxMn1 –yNiyO3 + δ (x = 0.15, 0.25, y = 0.0–0.4) с использованием различных методов синтеза (твердофазный метод, цитратно-нитратный и соосаждение) и последующим исследованием структурных особенностей и физико-химических свойств материалов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Образцы сложных оксидов с общей формулой La1 – 2xBixSrxMn1 –yNiyO3 + δ (x = 0.15, 0.25, y = 0.0–0.4) получали тремя различными способами: твердофазным (тв), цитратно-нитратным методом (цн) и с помощью соосаждения (ос). Условия проведения твердофазного синтеза описаны в [22], цитратно-нитратного – в [23]. Для соосаждения брали оксиды соответствующих металлов и растворяли их согласно [23]. Далее полученные растворы смешивали и осаждали с помощью раствора гидроксида натрия при pH 10. Полученный осадок многократно промывали деионизованной водой до полного удаления ионов натрия, затем высушивали и отжигали в муфельной печи. Конечная температура синтеза в случае твердофазного метода составляла 1473 K, для других методов – 1373 K. Время отжига на каждой стадии синтеза составляло 8 ч.
Фазовый состав полученных образцов определяли методом рентгенофазового анализа (дифрактометр ДРОН-3, CuKα-излучение, монохроматор из пирографита на отраженном пучке, Россия) с помощью баз данных PDF2 ICDD [24] и Match-DEMO. Для расчета параметров элементарных ячеек использовали программу “Celref” [25]. Кислородную нестехиометрию манганитов лантана определяли с помощью окислительно-восстановительного титрования (автоматический потенциометрический титратор АТП-2 “Аквилон”, Россия) по методике [23]. Размер частиц порошкообразных образцов определяли методом лазерной дифракции на лазерном анализаторе SALD-7101 (Shimadzu, Япония). Для изучения характеристик керамических образцов порошки сложных оксидов предварительно прессовали в форме прямоугольных или цилиндрических брикетов, а затем спекали при 1273 K в течение 8 ч. Морфологию поверхности и локальный химический состав порошкообразных и спеченных образцов изучали при помощи сканирующей электронной микроскопии (СЭМ) (сканирующий электронный микроскоп Jeol JSM6390 LA, оснащенный рентгеновским энергодисперсионным детектором (Япония), и сканирующий электронный микроскоп Evo LS 10 (Carl Zeiss NTS, Германия) с энергодисперсионным анализатором Inca X-Max 150 (Oxford Instruments, Великобритания)). КТР рассчитывали по результатам дилатометрических измерений (дилатометр DIL 402 C, Netzsch, Германия) в интервале температур 298–1273 K. Пористость спеченной керамики определяли методом гидростатического взвешивания.
Электропроводность сложных оксидов рассчитывали по результатам измерений сопротивления на постоянном токе в режиме охлаждения (1133–473 K) с использованием двухконтактной ячейки с платиновыми электродами и мультиметра Agilent 34401A (Agilent Technologies, США). Для определения значений электропроводности при заданном давлении кислорода (10–7–0.21 атм) и температуре 1173 K использовали модуль для установки давления и температуры Zirconia M [26].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
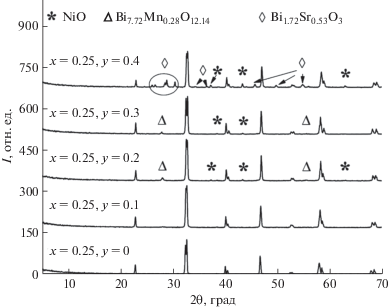
Серия твердых растворов с общей формулой La1 – 2xBixSrxMn1 –yNiyO3 + δ (x = 0.15, 0.25, y = 0.0–0.4) синтезирована твердофазным методом. Фазообразование при выбранных условиях завершается при 1473 K. Однофазные составы формируются при х = 0.15, y = 0.0–0.2 и x = 0.25, y = 0.0–0.1. При повышении содержания никеля за пределами области гомогенности в образцах с x = 0.15, y = 0.3 и x = 0.25, y = 0.2–0.3 зафиксированы фазы на основе NiO и Bi7.72Mn0.28O12.14, а при y = 0.4 помимо NiO наблюдается формирование Bi1.72Sr0.53O3. Дифрактограммы образцов с указанием примесных фаз представлены на рис. 1. Ранее нами показано [22], что в серии La0.9Sr0.05Bi0.05Mn1 –yNiyO3 + δ при x = 0.05 и у = 0.0–1.0 существует только один однофазный состав La0.9Sr0.05Bi0.05MnO3 + δ с ромбоэдрической (пр. гр. R$\bar {3}$c) структурой, параметры ячейки которой равны: a = 5.5243, c = 13.3433 Å, Z = 6, V = 352.65 Å3. Образцы с у = 0.1–0.3 являются смесью орторомбической и ромбоэдрической модификаций. Следовательно, увеличение содержания ионов висмута и стронция в манганите лантана приводит, с одной стороны, к стабилизации ромбоэдрической структуры при малом содержании допанта в B-позициях (при y ≤ 0.2 для х = 0.15), а с другой – к образованию примесей на основе оксидов висмута и стронция уже при y = 0.2 для x = 0.25.
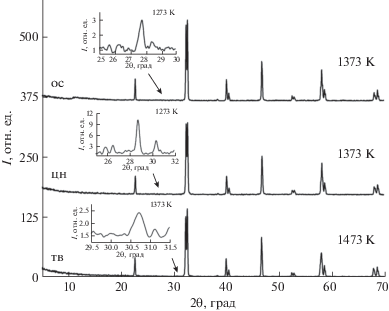
Для сравнения результатов синтеза образцов твердофазным и цитратно-нитратным способами и методом соосаждения выбран состав La0.7Bi0.15Sr0.15Mn0.9Ni0.1O3+δ, содержащий все ионы-заместители (Sr2+, Bi3+, Ni2+) и полученный однофазным по керамической технологии. Результаты показали (рис. 2), что во всех случаях основная фаза формируется на основе манганита лантана La0.93MnO3 с ромбоэдрической структурой (пр. гр. R$\bar {3}$c). При этом однофазные образцы при использовании растворных способов получены уже при 1373 K, что на 100 K меньше, чем в случае твердофазного метода.
Рис. 2.
Дифрактограммы образца La0.7Bi0.15Sr0.15Mn0.9Ni0.1O3.17 (твердофазный, цитратно-нитратный метод и соосаждение) после конечной стадии синтеза. На вставках изображены рефлексы примесных фаз, присутствующих на промежуточных стадиях синтеза.
По полученным рентгенографическим данным рассчитаны параметры элементарных ячеек однофазных составов серии La1 – 2xBixSrxMn1 –yNiyO3 + δ (x = 0.15, 0.25, y = 0.0–0.4), которые представлены в табл. 2. При увеличении содержания Ni2+ в образцах наблюдается уменьшение параметров элементарной ячейки, это связано с меньшим радиусом ионов никеля (r(Ni2+) = 0.55 Å) по сравнению с радиусом замещаемых им ионов марганца (r(Mn3+) = 0.58 Å) [27].
Таблица 2.
Параметры элементарной ячейки однофазных образцов La1 – 2xBixSrxMn1 –yNiyO3 + δ
| Состав образца | δ | a ± 0.002, Å | c ± 0.003, Å | V ± 0.12, Å3 |
|---|---|---|---|---|
| La0.7Bi0.15Sr0.15MnO3 + δ | 0.22 | 5.525 | 13.373 | 353.48 |
| La0.7Bi0.15Sr0.15Mn0.9Ni0.1O3 + δ | 0.17 | 5.524 | 13.350 | 352.73 |
| La0.7Bi0.15Sr0.15Mn0.8Ni0.2O3 + δ | 0.15 | 5.516 | 13.323 | 351.10 |
| La0.5Bi0.25Sr0.25MnO3 + δ | 0.25 | 5.513 | 13.386 | 352.36 |
| La0.5Bi0.25Sr0.25Mn0.9Ni0.1O3 + δ | 0.16 | 5.511 | 13.360 | 351.34 |
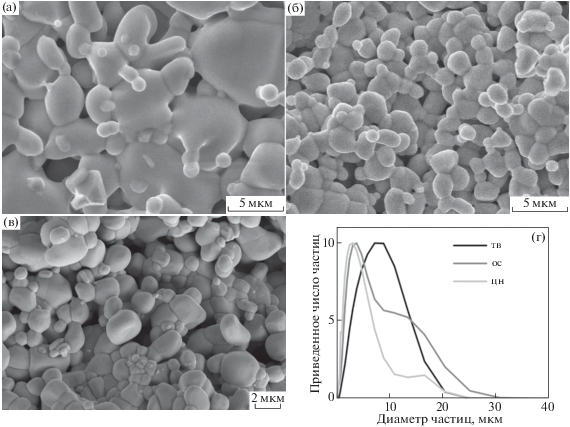
В ходе окислительно-восстановительного титрования образцов сложных оксидов при комнатной температуре установлено, что однофазные составы имеют избыточную кислородную нестехиометрию (δ) (табл. 2), что характерно для манганита лантана с ромбоэдрической структурой [28]. При этом элементный состав образцов, полученных различными методами синтеза, близок к стехиометрическому в пределах погрешности определения (2%). Данные были получены с помощью рентгеновского энергодисперсионного анализа (EDX), результаты которого представлены в табл. 3. Размер зерен образцов, полученных с помощью соосаждения и цитратно-нитратным методом, составляет ∼1–5 мкм, что несколько меньше, чем при использовании твердофазного метода, в результате которого размер частиц может достигать 10–15 мкм (рис. 3). При определении размера частиц порошков методом лазерной дифракции происходит агломерация мелких зерен. Как показали результаты гидростатического взвешивания образцов в виде спеченных брикетов, различный размер зерен не оказывает существенного влияния на степень спекания керамики. Пористость полученных при 1273 K брикетов составляет в среднем 15%.
Таблица 3.
Содержание элементов в La0.7Bi0.15Sr0.15Mn0.9Ni0.1O3 + δ по данным EDX анализа
| Метод синтеза | Соотношение La : Bi : Sr : Mn : Ni | |
|---|---|---|
| теоретическое | экспериментальное | |
| Твердофазный | 0.7 : 0.15 : 0.15 : 0.9 : 0.1 | 0.73 : 0.11 : 0.14 : 0.92 : 0.11 |
| Цитратно-нитратный | 0.75 : 0.12 : 0.15 : 0.88 : 0.11 | |
| Соосаждение | 0.69 : 0.12 : 0.16 : 0.86 : 0.10 | |
Рис. 3.
СЭМ-изображения скола образца La0.7Bi0.15Sr0.15Mn0.9Ni0.1O3.17 (твердофазный метод (а), цитратно-нитратный метод (б), соосаждение (в)) и результаты, полученные методом лазерной дифракции для соответствующих порошков (г).
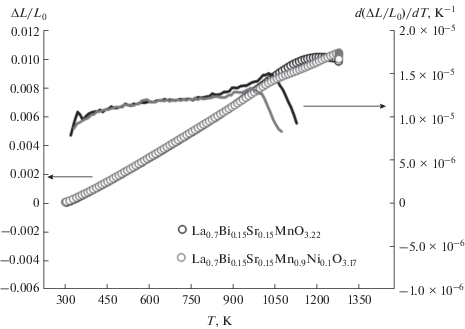
Изменение линейного размера и величина КТР на примере составов La0.7Bi0.15Sr0.15MnO3.22 и La0.7Bi0.15Sr0.15Mn0.9Ni0.1O3.17 определены методом дилатометрического анализа. Результаты, представленные на рис. 4, указывают на отсутствие фазовых переходов во всем исследуемом интервале температур. Значения КТР образцов близки и составляют 12 × 10–6 K–1, что совпадает с ранее изученными висмутсодержащими составами La0.8Bi0.2MnO3 + δ и La0.9Bi0.1Mn0.7Ni0.3O3 + δ [29].
Рис. 4.
Линейное изменение размеров с температурой и КТР образцов La0.7Bi0.15Sr0.15MnO3.22 и La0.7Bi0.15Sr0.15Mn0.9Ni0.1O3.17.
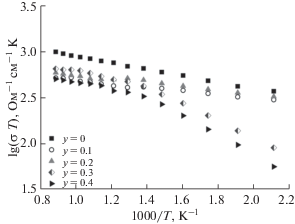
Поскольку манганиты лантана являются перспективными катодными материалами для электрохимических устройств, проведены измерения общей электропроводности сложных оксидов La1 – 2xBixSrxMn1 –yNiyO3 + δ (x = 0.15, 0.25, y = 0.0–0.4) с использованием двухконтактной ячейки, которые позволяют дать качественную оценку степени влияния содержания ионов Bi3+ и Ni2+ на данную характеристику. По полученным в результате исследования данным построены температурные зависимости электропроводности образцов (рис. 5, 6). Для замещенных манганитов лантана наблюдается снижение значений электропроводности по сравнению с матричным соединением. Причем падение происходит как при росте значения x, так и при росте y. Как предположили авторы [14, 15], введение висмута в А-подрешетку может влиять на транспорт электронов в замещенном манганите лантана. Неподеленная пара 6s2-электронов Bi3+ не только образует связь с 2pσ-электронами кислорода, но и может конкурировать с t2g-электронами марганца за связь с 2pπ-орбиталью кислорода. Гибридизация между неподеленной электронной парой Bi3+ и 2pπ-электронами кислорода блокирует движение электронов через связи Mn3+–O–Mn4+.
Рис. 6.
Температурные зависимости электропроводности образцов La0.7Bi0.15Sr0.15Mn0.9Ni0.1O3.17 (твердофазный, цитратно-нитратный метод и соосаждение).
При заменах в В-подрешетке происходит процесс перераспределения заряда между 3d-металлами. Согласно [30], падение электропроводности манганита лантана при замещении ионов марганца на никель объясняется различной электроотрицательностью (ЭО) этих элементов (ЭО (Mn) = 1.55, ЭО (Ni) = 1.91 (по шкале Полинга)) и, следовательно, изменением распределения электронов в цепях –O–Mn–O–Mn–O–, содержащих и не содержащих никель, за счет перетягивания электронной плотности кислорода к ионам никеля. Иначе говоря, ионы никеля играют роль акцепторной примеси и являются ловушками электронов согласно следующему процессу: ${\text{Mn}}_{{{\text{Mn}}}}^{'}$ + ${\text{Ni}}_{{{\text{Mn}}}}^{ \times }$ = ${\text{Mn}}_{{{\text{Mn}}}}^{ \times }$ + ${\text{Ni}}_{{{\text{Mn}}}}^{'}.$
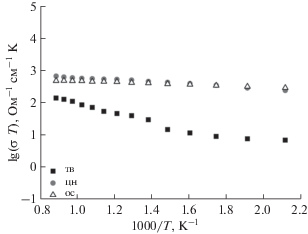
Наличие примесей в образцах оказывает существенное влияние на электропроводность при температурах <773 K. В свою очередь, сложные оксиды, полученные с помощью цитратно-нитратного метода и путем соосаждения, показали лучшие результаты (рис. 6), чем в случае твердофазного синтеза (σ800(тв) = 0.13 Ом–1 см–1, σ800(цн) = = 0.62 Ом–1 см–1, σ800(ос) = 0.48 Ом–1 см–1 для образца состава La0.7Bi0.15Sr0.15Mn0.9Ni0.1O3.17). Это, вероятнее всего, обусловлено меньшим размером зерен спеченной керамики [31]. Такая ситуация в целом характерна для оксидных соединений, в частности для La0.7Sr0.3MnO3 [32, 33]. Для всех однофазных образцов рассчитана энергия активации (Ea) электропроводности, по значениям которой косвенно можно судить о механизме переноса заряда в сложных оксидах. Известно, что для веществ с малополяронным характером переноса заряда температурные зависимости электронной проводимости описываются соотношением $\sigma = \frac{A}{T}\exp \left( { - \frac{{{{E}_{a}}}}{{kT}}} \right),$ где Ea – энергия активации малополяронной проводимости [34, 35]. Для всех исследованных составов значения Ea не превышают 0.5 эВ. Эти значения являются типичными для прыжкового характера переноса заряда поляронами малого радиуса [11].
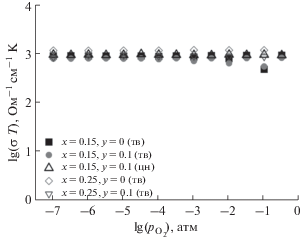
Барическая зависимость электропроводности (рис. 7) при 1173 K является прямолинейной (lg(σT) = const) во всем исследованном диапазоне парциальных давлений кислорода (10–7–0.21 атм), что является типичной картиной для манганита лантана-стронция в данном интервале ${{p}_{{{{{\text{O}}}_{2}}}}}$ [36, 37]. Независимость электропроводности от парциального давления кислорода для исследованных составов, как и для самого LSM, определяется доминирующей ролью процесса образования электронов и дырок за счет реакции диспропорционирования ионов марганца ${\text{2Mn}}_{{{\text{Mn}}}}^{ \times }$ = ${\text{Mn}}_{{{\text{Mn}}}}^{ \cdot }$ + ${\text{Mn}}_{{{\text{Mn}}}}^{'}.$ Ионы висмута не влияют на этот процесс, роль ионов никеля описана выше.
ЗАКЛЮЧЕНИЕ
В работе показана возможность образования твердых растворов сложного состава La1 ‒ 2xSrxBixMn1 –yNiyO3 + δ (x = 0.15, 0.25; y = 0.0–0.4) с ромбоэдрической структурой в узком концентрационном интервале (y ≤ 0.2). Отмечено влияние размера частиц порошков на величину общей электропроводности образцов одного и того же состава. Образцы, полученные цитратно-нитратным методом и соосаждением, с размером зерен 1–5 мкм имеют значения электропроводности на порядок больше, чем при твердофазном синтезе, когда средний размер частиц составляет 10–15 мкм. Появление примесных фаз NiO, Bi7.72Mn0.28O12.14 и Bi1.72Sr0.53O3 приводит к резкому падению электропроводности при температурах ниже 773 K. Изменение парциального давления кислорода в интервале от 0.21 до 10–7 атм не влияет на величину общей электропроводности, что типично для манганита лантана-стронция. Роста электропроводности замещенных составов по сравнению с матричным соединением не наблюдается.
Список литературы
Silva F.S., Souza T.M. // Int. J. Hydrogen Energy. 2017. V. 42. P. 26020. https://doi.org/10.1016/j.ijhydene.2017.08.105
Shirai Y., Hashimoto Sh., Sato K. et al. // Solid State Ionics. 2014. V. 256. P. 83. https://doi.org/10.1016/j.ssi.2013.12.042
Malzbender J., Batfalsky P., Vaben R. et al. // J. Power Sources. 2012. V. 201. P. 196. https://doi.org/10.1016/j.jpowsour.2011.10.117
Tsipis E.V., Kharton V.V. // J. Solid State Electrochem. 2008. V. 12. P. 1039. https://doi.org/10.1007/s10008-007-0468-0
Истомин С.Я., Антипов Е.В. // Успехи химии. 2013. Т. 82. № 7. С. 686. [Istomin S.Ya., Antipov E.V. // Russ. Chem. Rev. 2013. V. 82. № 7. P. 686. https://doi.org/10.1070/RC2013v082n07ABEH004390]
Hammouche A., Siebert E., Hammou A. // Mater. Res. Bull. 1989. V. 24. P. 367. https://doi.org/10.1016/0025-5408(89)90223-7
Li Y., Zhang H., Liu X. et al. // Ceram. Int. 2019. V. 45. P. 16323. https://doi.org/10.1016/j.ceramint.2019.05.159
Bogush A.K., Pavlov V.I., Balyko L.V. // Cryst. Res. Technol. 1983. V. 18. № 5. P. 589. https://doi.org/10.1002/crat.2170180504
Любкина И.Я., Кононюк И.Ф. // Изв. АН СССР. Неорган. материалы. 1986. Т. 22. № 6. С. 979.
Gaiduk Y.S., Kharton V.V., Naumovich E.N. et al. // Inorg. Mater. 1994. V. 30. № 6. P. 759.
Аксенова Т.В., Гаврилова Л.Я., Черепанов В.А. // Журн. физ. химии. 2012. Т. 86. № 12. С. 2000. [Aksenova T.V., Gavrilova L.Ya., Cherepanov V.A. // Russ. J. Phys. Chem. A. 2012. V. 86. № 12. P. 1862. https://doi.org/10.1134/S0036024412120023]
Gupta R.K., Choi I.-J., Cho Y.-S. et al. // J. Power Sources. 2009. V. 187. P. 371. https://doi.org/10.1016/j.jpowsour.2008.10.136
Izgi T., Kolat V.S., Bayri N. et al. // J. Magn. Magn. Mater. 2014. V. 372. P. 112. https://doi.org/10.1016/j.jmmm.2014.07.037
Li R., Qu Z., Fang J. // Phisica B. 2011. V. 406. P. 1312. https://doi.org/10.1016/j.physb.2011.01.023
Chen W.-T., Sher F., Mathur N.D. et al. // Chem. Mater. 2012. V. 24. P. 199. https://doi.org/10.1021/cm202900v
Li J., Wang Sh., Wang Z. et al. // J. Power Sources. 2008. V. 179. P. 474. https://doi.org/10.1016/j.jpowsour.2008.01.017
Jiang Zh., Zhang L., Cai L. et al. // Electrochem. Acta. 2009. V. 54. P. 3059. https://doi.org/10.1016/j.electacta.2008.11.067
Jung W.C., Chang Y.-J., Fung K.-Z. et al. // J. Korean Ceram. Soc. 2014. V. 51. № 4. P. 278. https://doi.org/10.4191/kcers.2014.51.4.278
Wu L., Jiang Zh., Wang Sh. et al. // Int. J. Hydrogen Energy. 2013. V. 38. P. 2398. https://doi.org/10.1016/j.ijhydene.2012.11.111
Ullmann H., Trofimenko N., Tietz F. et al. // Solid State Ionics. 2000. V. 138. P. 79. https://doi.org/10.1016/S0167-2738(00)00770-0
Wincewicz K.C., Cooper J.S. // J. Power Sources. 2005. V. 140. P. 280. https://doi.org/10.1016/j.jpowsour.2004.08.032
Каймиева О.С., Кружков Д.А., Буянова Е.С. и др. // Журн. неорган. химии. 2019. Т. 64. № 2. С. 125. [Kaimieva O.S., Kruzhkov D.A., Buyanova E.S. et al. // Russ. J. Inorg. Chem. V. 64. № 2. P. 158.]https://doi.org/10.1134/S0044457X19020107
Kaymieva O.S., Morozova M.V., Buyanova E.S. et al. // ECS Transactions. 2015. V. 68. P. 977. https://doi.org/10.1149/06801.0977ecst
Powder Diffraction File PDF2 ICDD Release 2013.
Laugier J., Bochu B. LMGP-Suite of Programs for the interpretation of X-ray Experiments/ENSP. Grenoble: Lab. Materiaux Genie Phys, 2003.
Удилов А.Е., Вылков А.И. Пат. России № 2 395 832. // Бюл. изобр. 2010. № 21.
Shannon R.D. // Acta Crystallogr. 1976. V. A32. P. 751.
Hervieu M., Mahesh R., Rangavittal N. et al. // Eur. J. Solid State Inorg. Chem. 1995. V. 32. P. 79.
Каймиева О.С., Данилова В.В., Морозова М.В. и др. // Химия в интересах устойчивого развития. 2016. Т. 24. С. 135. [Kaymieva O.S., Danilova V.V., Morozova M.V. et al. // Chem. Sustainable Development. 2016. V. 24. P. 135.]https://doi.org/10.15372/KhUR20160203
Vashook V., Franke D., Zosel J. et al. // Solid State Ionics. 2008. V. 179. P. 135. https://doi.org/10.1016/j.ssi.2007.12.061
Wandekar R.V., Wani B.N., Bharadwaj S.R. // J. Alloys Compd. 2007. V. 433. P. 84. https://doi.org/10.1016/j.jallcom.2006.06.063
da Conceição L., Silva C.R.B., Ribeiro N.F.P. et al. // Mater. Charact. 2009. V. 60. P. 1417. https://doi.org/10.1016/j.matchar.2009.06.017
Shao Z., Zhou W., Zhu Zh. // Prog. Mater Sci. 2012. V. 57. P. 804. https://doi.org/10.1016/j.pmatsci.2011.08.002
Чеботин В.Н. Физическая химия твердого тела. М.: Химия, 1982. 320 с.
Мотт Н., Дэвис Э. Электронные процессы в некристаллических веществах / Пер. с англ. под ред. Коломийца Б.Т. М.: Мир, 1982. Т. 1. 368 с.
Kuo J.H., Anderson H.U., Sparlin D.M. // J. Solid State Chem. 1990. V. 87. P. 55. https://doi.org/10.1016/0022-4596(90)90064-5
Mizusaki J., Yonemura Y., Kamata H. et al. // Solid State Ionics. 2000. V. 132. P. 167. https://doi.org/10.1016/S0167-2738(00)00662-7
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии