Журнал неорганической химии, 2020, T. 65, № 9, стр. 1155-1160
Особенности синтеза и магнитные характеристики ортоферрита иттрия, полученного методом сжигания геля
В. А. Кецко a, *, М. Н. Смирнова a, М. А. Копьева a, Г. Е. Никифорова a, А. А. Гераськин b, К. И. Янушкевич c
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
b Российский технологический университет
119454 Москва, пр-т Вернадского, 78, Россия
c Научно-практический центр НАН Беларуси по материаловедению
220072 Минск, ул. П. Бровки, 19, Беларусь
* E-mail: ketsko@igic.ras.ru
Поступила в редакцию 09.04.2020
После доработки 17.04.2020
Принята к публикации 27.04.2020
Аннотация
Изучено влияние органического топлива на режим, особенности горения и фазовый состав конечного продукта синтеза ортоферрита иттрия. Показано, что для получения YFeO3 необходимо использовать топливо, которое способствует формированию единого полимерного металлосодержащего комплекса, определяющего структуру геля, и обеспечивает протекание стадии горения в интенсивном самоподдерживающем режиме. Ортоферрит иттрия синтезирован методом сжигания геля с использованием в качестве топлива смеси лимонной кислоты с нитратом аммония. Определены параметры элементарной ячейки орторомбического (пр. гр. Pnma) ортоферрита иттрия: a = = 5.594(2), b = 7.604(3), c = 5.282(1) Å, V = 224.7(3) Å3. Изучена температурная зависимость удельной намагниченности YFeO3 в интервале 80–800 K. Установлено, что температура магнитного фазового превращения магнитный порядок–магнитный беспорядок составляет ТС ≈ 620 K.
ВВЕДЕНИЕ
Ортоферриты – класс химических соединений с общей формулой RFeO3 (R – редкоземельный элемент), востребованный для практического применения в различных областях науки и техники [1–6]. Большинство ортоферритов редкоземельных элементов имеет перовскитоподобную кристаллическую структуру, которая определяет особенности их физико-химических свойств [5, 6]. Из-за присутствия ромбических искажений в кристаллической структуре ортоферриты характеризуются высокой подвижностью (~1 м2/(с А)) и скоростью движения доменных границ ~20 км/с [7, 8]. При этом намагниченность насыщения ортоферритов в ∼20 раз ниже, чем у ферритов-гранатов [9].
Для ортоферрита YFeO3 характерно многообразие важных практических свойств. В зависимости от особенностей кристаллического упорядочения он может быть мультиферроиком, полупроводником, фотокатализатором в видимой области света [6, 9]. Ортоферрит YFeO3, кристаллизуясь в структуре искаженного перовскита, имеет ромбическую кристаллическую ячейку, в которой ионы железа окружены шестью атомами кислорода, образуя октаэдры. В зависимости от степени искажения октаэдров FeO6 ортоферрит иттрия обладает антиферромагнитным упорядочением магнитных моментов либо проявляет свойства слабого ферромагнетика [9].
Известно, что ортоферрит иттрия можно получить с помощью твердофазного синтеза [3, 5, 6], гидротермальным способом [2, 10–12], золь-гель методом [13].
Получение наноразмерного ортоферрита иттрия классическим методом твердофазных реакций связано с необходимостью применения высокой температуры (1000–1200°С) и длительного отжига (более 12 ч). При этом образование конечного заданного продукта может сопровождаться появлением примесных фаз и неконтролируемым ростом кристаллитов до микронных размеров [6, 13]. Эти недостатки исключают возможность практического использования материала, так как фазовая и морфологическая гомогенность, наноразмерность частиц порошкообразного объекта являются одними из ключевых характеристик, необходимых при формировании пленочных функциональных гетероструктур либо плотной керамики различного назначения. Подобных недостатков синтеза можно избежать, применяя методы “мягкой” химии, среди которых наиболее эффективным является метод сжигания геля [1, 4, 14–16]. В основе этого метода лежит окислительно-восстановительная реакция нитратов металлов (окислитель) и органического топлива (восстановитель). При этом фазовая и морфологическая гомогенность конечного продукта во многом зависят от выбора топлива [14–18].
Цель настоящей работы – изучение особенностей синтеза ортоферрита иттрия методом сжигания геля, обоснование выбора оптимальных условий получения однофазного продукта, изучение кристаллической структуры синтезированного YFeO3 и измерение величин фундаментальных магнитных характеристик в интервале температур ~80–800 K.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для синтеза YFeO3 рассчитанные количества карбонильного железа (ос. ч.) и карбоната иттрия (х. ч.) растворяли в разбавленной (1 : 3) азотной кислоте (ос. ч.). Полученный раствор многократно упаривали для удаления избытка HNO3 и затем добавляли восстановитель (топливо). Провели три серии опытов с разным топливом. В качестве топлива использовали: 1 – глицин (х. ч.), 2 – лимонную кислоту (х. ч.), 3 – смесь лимонной кислоты c нитратом аммония (х. ч.).
Расчет необходимого количества восстановителя проводили методом кислородного баланса [14–16] по соответствующим реакциям:
(1)
$\begin{gathered} {\text{Y}}{{\left( {{\text{N}}{{{\text{O}}}_{{\text{3}}}}} \right)}_{3}} + {\text{Fe}}{{\left( {{\text{N}}{{{\text{O}}}_{{\text{3}}}}} \right)}_{{\text{3}}}} + 3.33{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{5}}}}{\text{N}}{{{\text{O}}}_{2}} \to \\ \to \,\,{\text{YFe}}{{{\text{O}}}_{3}} + 4.66{{{\text{N}}}_{2}} + 6.66{\text{C}}{{{\text{O}}}_{2}} + 8.325{{{\text{H}}}_{{\text{2}}}}{\text{O}}, \\ \end{gathered} $(2)
$\begin{gathered} {\text{Y}}{{\left( {{\text{N}}{{{\text{O}}}_{{\text{3}}}}} \right)}_{3}} + {\text{Fe}}{{\left( {{\text{N}}{{{\text{O}}}_{{\text{3}}}}} \right)}_{3}} + 1.66{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{8}}}}{{{\text{O}}}_{7}} \to \\ \to \,\,{\text{YFe}}{{{\text{O}}}_{3}} + 3{{{\text{N}}}_{2}} + 9.96{\text{C}}{{{\text{O}}}_{2}} + 6.64{{{\text{H}}}_{{\text{2}}}}{\text{O}}, \\ \end{gathered} $(3)
$\begin{gathered} {\text{Y}}{{\left( {{\text{N}}{{{\text{O}}}_{{\text{3}}}}} \right)}_{3}} + {\text{Fe}}{{\left( {{\text{N}}{{{\text{O}}}_{{\text{3}}}}} \right)}_{{\text{3}}}} + 3{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{8}}}}{{{\text{O}}}_{7}} + 12{\text{N}}{{{\text{H}}}_{{\text{4}}}}{\text{N}}{{{\text{O}}}_{3}} \to \\ \to {\text{YFe}}{{{\text{O}}}_{3}} + 15{{{\text{N}}}_{{\text{2}}}} + 18{\text{C}}{{{\text{O}}}_{{\text{2}}}} + 36{{{\text{H}}}_{{\text{2}}}}{\text{O}}. \\ \end{gathered} $Полученные растворы переносили в фарфоровые чаши и упаривали при температуре ~100°С при постоянном перемешивании до образования геля. Время упаривания составляло ~60 мин.
После полного испарения воды начиналась реакция горения геля, которая протекала с разной интенсивностью в течение ~2–30 с в зависимости от топлива. В результате синтеза образовывался мелкодисперсный порошок коричневого цвета.
Для удаления углеродсодержащих примесей и кристаллизации ортоферрита иттрия полученные порошки отжигали при температуре 800°С в течение 4 ч.
Рентгенофазовый анализ (РФА) полученных образцов осуществляли на дифрактометре Bruker Advance D8 (CuKα-излучение) в интервале 2θ = = 10°–70° с шагом сканирования 0.0133°.
Морфологию порошка YFeO3 изучали с помощью растровой электронной микроскопии (РЭМ) на микроскопе MIRA3 (Tescan, Чехия).
Температурные зависимости удельной намагниченности получены на поликристаллических образцах пондеромоторным методом в магнитном поле с индукцией В = 0.86 Тл в интервале температур 80–800 K с шагом 5 K по методике, описанной в работе [19]. Погрешность измерения удельной намагниченности составляла ±0.005 А м2/кг.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
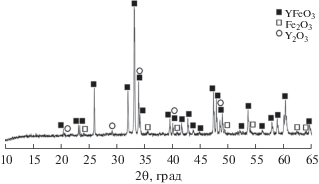
Фазовый состав конечного продукта и особенности протекания реакций (1)–(3) представлены в табл. 1. В результате сжигании геля с использованием глицина (C2H5NO2) кроме фазы орторомбического YFeO3 в прокаленном образце присутствовали фазы оксидов металлов – Y2O3 и Fe2O3 (рис. 1). Вероятно, это связано с особенностями горения металлоорганического геля. Относительно быстрое (5–10 с) горение средней степени интенсивности способствовало кристаллизации образца, однако времени протекания реакции было недостаточно для завершения фазообразования перовскита. Следует отметить, что в процессе синтеза ферритов глицин-нитратным методом формирование структуры геля происходит главным образом за счет комплексообразования [14, 15]. Формирующиеся глицинаты иттрия и железа достаточно устойчивы. В процессе горения геля указанные комплексы разрушаются не единовременно. Это приводит к появлению оксидных примесей в образце даже после последующего отжига при температуре 800°С. В данном случае для получения однофазного продукта необходимо использовать более высокие температуры термической обработки, переходя, по сути, к твердофазному взаимодействию между образовавшимися простыми оксидами Y2O3 и Fe2O3.
Таблица 1.
Особенности процесса горения и фазовый состав конечного продукта в зависимости от типа топлива
| № реакции | Тип топлива | Интенсивность, длительность горения | Фазовый состав конечного продукта |
|---|---|---|---|
| 1 | Глицин 3.33C2H5NO2 | Объемное горение (средняя интенсивность горения), 5–10 с | YFeO3, Y2O3, Fe2O3 |
| 2 | Лимонная кислота 1.66 C6H8O7 | Тление (слабовыраженное “внутреннее” горение), 10–30 с | YFeO3, Y3Fe5O12, Y2O3 |
| 3 | Лимонная кислота и нитрат аммония 3C6H8O7 + 12NH4NO3 | Режим СВС (интенсивное горение в самоподдерживающем режиме), 2–5 с | YFeO3 |
Рис. 1.
Дифрактограмма образца, полученного методом сжигания геля с использованием глицина (реакция (1)) и отожженного при 800°С.
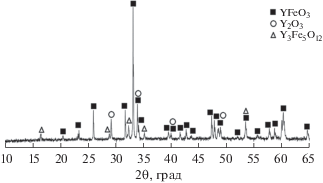
При использовании в качестве восстановителя лимонной кислоты (C6H8O7) в образце после отжига практически отсутствуют примеси отдельных оксидов металлов (рис. 2). Вероятно, это связано с образованием в гелеобразном прекурсоре единого полимерного цитратного комплекса, “связывающего” катионы металлов, что препятствует кристаллизации индивидуальных оксидов Y2O3 и Fe2O3. Однако помимо заданной фазы перовскита YFeO3 в конечном продукте присутствует примесь железоиттриевого граната Y3Fe5O12, что является следствием плавного режима горения (“тления”). Ранее замечено [20], что в данной системе термодинамически более выгодной является фаза феррита-граната. В данном случае невысокая скорость процесса горения при относительно низкой температуре (до 1000°С) способствует протеканию конкурирующих реакций образования YFeO3 и Y3Fe5O12.
Рис. 2.
Дифрактограмма образца, полученного методом сжигания геля с использованием лимонной кислоты (реакция (2)) и отожженного при 800°С.
Таким образом, для предотвращения формирования примесных фаз при использовании в качестве основного восстановителя лимонной кислоты необходимо повысить температуру горения. С этой целью нами был использован нитрат аммония (NH4NO3), который является дополнительным источником кислорода и способствует протеканию реакции в режиме самораспространяющегося высокотемпературного синтеза (СВС).
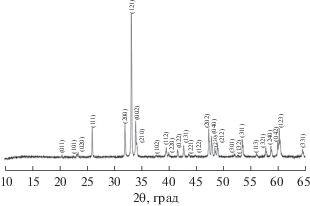
В результате синтеза по реакции (3), где в качестве восстановителя используется смесь C6H8O7 с NH4NO3, и последующего отжига продукта при 800°С образуется мелкодисперсный порошкообразный образец, дифрактограмма которого представлена на рис. 3. Все наблюдаемые дифракционные рефлексы относятся к фазе орторомбического перовскита YFeO3.
Рис. 3.
Дифрактограмма образца YFeO3, полученного методом сжигания геля с использованием смеси лимонной кислоты с нитратом аммониям (реакция (3)) и отожженного при 800°С.
Кристаллическая структура синтезированного ортоферрита иттрия была уточнена с помощью полнопрофильного анализа данных рентгеновской дифракции в предположении пр. гр. Pnma. Рассчитанные параметры элементарной ячейки ортоферрита иттрия (a = 5.594(2), b = 7.604(3), c = = 5.282(1) Å, V = 224.7(3) Å3) находятся в хорошем согласии с данными литературных источников (ICCD PDF2 № 01-086-0171, № 01-073-1345).
Полученный YFeO3, согласно данным РЭМ, представляет собой однородный слабоагрегированный мелкодисперсный порошок с унимодальным распределением частиц по размерам (рис. 4).
Рис. 4.
Морфология YFeO3, полученного методом сжигания геля с использованием смеси лимонной кислоты с нитратом аммония и отожженного при 800°С.

Известно, что отжиг образца в магнитном поле способствует интенсификации диффузионных процессов за счет увеличения тепловых колебаний кристаллической решетки, “выравниванию” различного рода энергетических неоднородностей и напряжений в веществе, приводя тем самым к усилению дальнего кристаллического и магнитного упорядочения [21]. Это убедительно проявилось при измерении величин удельной намагниченности исследуемого ортоферрита иттрия в режиме нагрев–охлаждение в интервале температур ~80–800 K во внешнем магнитном поле с индукцией В = 0.86 Тл (рис. 5). При первичном нагреве образца в магнитном поле наблюдалось резкое увеличение удельной намагниченности в области 550–600 K, вызванное усилением диффузионных процессов. После прогрева образца до 800 K, при охлаждении ниже 600 K величины удельной намагниченности не возвратились к первоначальным значениям, а вид температурной зависимости удельной намагниченности σ = f(T) приблизился к бриллюэновскому. При температуре 80 K произошло увеличение удельной намагниченности (σ) от 0.4 до 1.28 А м2/кг, что свидетельствует об упорядочении магнитных моментов в кристаллической структуре YFeO3. При повторном нагреве величины удельной намагниченности совпали с зависимостью σ = f(T), полученной при охлаждении, что может свидетельствовать о завершении стабилизации кристаллического и магнитного упорядочения образца YFeO3 после прогрева до 800 K в магнитном поле.
Рис. 5.
Температурная зависимость удельной намагниченности состава YFeO3, исследованная в режиме нагрев–охлаждение–нагрев. На вставке приведена температурная зависимость квадрата намагниченности.
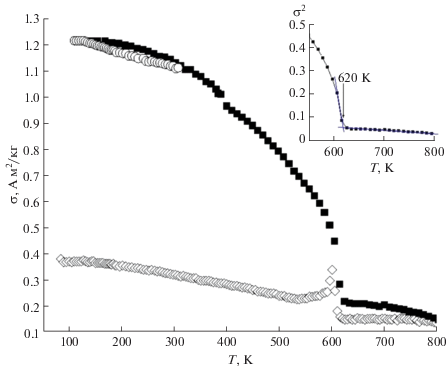
Для определения температуры перехода в парамагнитное состояние (ТС) была построена температурная зависимость квадрата намагниченности, измеренной в режиме охлаждения (вставка к рис. 5). Анализируя особенности поведения зависимостей σ = f(T) и σ2 = f(T), можно сделать вывод, что температура фазового превращения магнитный порядок–магнитный беспорядок для ортоферрита иттрия в пределах точности определения составляет ТС = 620 K.
ЗАКЛЮЧЕНИЕ
Выявлен характер влияния топлива на формирование фазы YFeO3 при синтезе методом сжигания геля. Показано, что применение глицина в качестве восстановителя приводит к формированию геля за счет образования глицинатов металлов, различная термическая устойчивость которых способствует появлению оксидных примесей в конечном продукте.
Использование в качестве топлива лимонной кислоты приводит к образованию единого металлосодержащего полимерного цитратного комплекса, что препятствует появлению примесных индивидуальных оксидов в конечном продукте. Однако относительно низкотемпературный режим горения определяет наличие в образце фазы феррита-граната. Показано, что для получения однофазного ортоферрита иттрия необходимо использовать топливо, способствующее консолидации металлов, с одной стороны, и инициирующее интенсивное высокотемпературное горение – с другой.
В результате ортоферрит иттрия YFeO3 синтезирован методом сжигания геля с использованием в качестве восстановителя смеси лимонной кислоты и нитрата аммония с последующим отжигом при 800°С. Полученный образец, охарактеризованный методами РФА и РЭМ, представляет собой однородный наноразмерный порошок с орторомбической структурой перовскита. Согласно результатам измерения удельной намагниченности ортоферрита иттрия YFeO3, данный состав обладает ферримагнитными свойствами и имеет температуру фазового превращения магнитный порядок–магнитный беспорядок ТС = 620 K.
Список литературы
Coutinho P.V., Cunha F., Barrozo P. // Solid State Commun. 2017. V. 252. P. 59. https://doi.org/10.1016/j.ssc.2017.01.019
Mansournia M., Orae M. // J. Rare Earths. 2018. V. 36. P. 1292. https://doi.org/10.1016/j.jre.2018.05.011
Suthar L., Jha V.K., Bhadala F. et al. // Appl. Phys. A. 2017. V. 123. P. 668. https://doi.org/10.1007/s00339-017-1272-z
Nagrare B.S., Kekade S.S., Thombare B. et al. // Solid State Commun. 2018. V. 280. P. 32. https://doi.org/10.1016/j.ssc.2018.06.004
Rosales-Gonzalez O., Sanchez F., Cortes-Escobedo C.A. et al. // Ceram. Int. 2018. V. 44. P. 15298. https://doi.org/10.1016/j.ceramint.2018.05.175
Wang M.T., Wang S., Songa H. et al. // Ceram. Int. 2017. V. 43. P. 10270. https://doi.org/10.1016/j.ceramint.2017.05.056
Chetkin M.V., Kurbatova Y.N., Shapaeva T.B. et al. // Phys. Lett. A. 2005. V. 337. P. 235. https://doi.org/10.1016/j.physleta.2004.11.064
Didosyan Y.S., Hauser H., Nicolics J. et al. // J. Appl. Phys. 2000. V. 87. P. 7079. https://doi.org/10.1063/1.372937
Рандошкин В.В., Червоненкис А.Я. Прикладная магнитооптика. М.: Энергоатомиздат, 1990.
Popkov V.I., Almjasheva O.V., Semenova A.S. et al. // J. Mater. Sci.: Mater. Electron. 2017. V. 28. P. 7163. https://doi.org/10.1007/s10854-017-6676-1
Shang M., Zhang C., Zhang T. et al. // Appl. Phys. Lett. 2013. V. 102. P. 062903. https://doi.org/10.1063/1.4791697
Tang P., Sun H., Chen H. et al. // Curr. Nanosci. 2012. V. 8. P. 64. https://doi.org/10.2174/1573413711208010064
Mathur S., Veith M., Rapalaviciute R. et al. // Chem. Mater. 2004. V. 16. P. 1906. https://doi.org/10.1021/cm0311729
Smirnova M.N., Goeva L.V., Simonenko N.P. et al. // Russ. J. Inorg. Chem. 2016. V. 61. P. 1301. [Смирнова М.Н., Гоева Л.В., Симоненко Н.П. и др. // Журн. неорган. химии. 2016. Т. 61. С. 1354.]https://doi.org/10.1134/S0036023616100193
Smirnova M.N., Kop’eva M.A., Beresnev E.N. et al. // Russ. J. Inorg. Chem. 2018. V. 63. P. 439. [Смирнова М.Н., Копьева М.А., Береснев Э.Н. и др. // Журн. неорган. химии. 2018. Т. 63. С. 411.]https://doi.org/10.1134/S0036023618040198
Smirnova M.N., Nikiforova G.E., Goeva L.V. et al. // Ceram. Int. 2019. V. 45. P. 4509. https://doi.org/10.1016/j.ceramint.2018.11.133
Chen W., Li F., Yu J. et al. // Mater. Res. Bull. 2006. V. 41. P. 2318. https://doi.org/10.1016/j.materresbull.2006.04.024
Гусева А.Н. Методы получения наноразмерных материалов. Екатеринбург: УрГУ, 2007.
Янушкевич К.И. Система обеспечения единства измерений Республики Беларусь. Минск, 2009.
Lisnevskaya I.V., Bobrova I.A., Lupeiko T.G. // Russ. J. Inorg. Chem. 2015. V. 60. P. 437. [Лисневская И.В., Боброва И.А., Лупейко Т.Г. // Журн. неорган. химии. 2015. Т. 60. С. 496.]https://doi.org/10.1134/S0036023615040130
Мазанко В.Ф., Покоев А.В., Миронов В.М. и др. Диффузионные процессы в металлах и сплавах под действием магнитных полей и импульсных деформаций. М.: Машиностроение-1, 2006. Т. 1.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии


