Журнал неорганической химии, 2020, T. 65, № 9, стр. 1183-1191
Синтез и свойства нанопорошков ZnS и гетеронаноструктур ZnS/Ag2S
С. И. Садовников a, *, А. В. Ищенко b, И. А. Вайнштейн b
a Институт химии твердого тела УрО РАН
620990 Екатеринбург, ул. Первомайская, 91, Россия
b Уральский федеральный университет им. Первого президента России Б.Н. Ельцина
620002 Екатеринбург, ул. Мира, 19, Россия
* E-mail: sadovnikov@ihim.uran.ru
Поступила в редакцию 19.02.2020
После доработки 23.03.2020
Принята к публикации 27.04.2020
Аннотация
Химическим осаждением из водных растворов нитрата цинка и сульфида натрия в присутствии цитрата натрия или Трилона Б синтезированы нанопорошки сульфида цинка ZnS. Гетеронаноструктуры ZnS/Ag2S получены двухстадийным химическим соосаждением сульфидов цинка и серебра. Изменение соотношения между концентрациями реагентов в реакционных смесях позволило получить нанопорошки ZnS со средним размером частиц от 2 до 10 нм. Размер наночастиц в полученных гетеронаноструктурах составляет 8–10 нм. Измерены спектры диффузного отражения наноструктурированного ZnS и гетеронаноструктур ZnS/Ag2S. На основе анализа полученных спектров оптического поглощения выполнена оценка ширины запрещенной зоны Eg в изученных сульфидных наноструктурах. При уменьшении размера наночастиц от 10 до 2 нм величина Eg в нанопорошках ZnS увеличивается в диапазоне 3.59–3.72 эВ. Рост содержания Ag2S в гетеронаноструктурах ZnS/Ag2S приводит к уменьшению ширины запрещенной зоны. Зарегистрированы спектры импульсной катодолюминесценции. Характеристики свечения ZnS и ZnS/Ag2S зависят от способа синтеза и морфологических особенностей наночастиц.
ВВЕДЕНИЕ
Сульфиды цинка ZnS и серебра Ag2S – широко востребованные полупроводниковые соединения [1–8]. Они используются в усилителях и детекторах ультразвука, инфракрасных датчиках, лазерах, люминофорах, солнечных элементах, светодиодах, фотохимических ячейках, инфракрасных детекторах, катализаторах, переключателях сопротивления и энергонезависимых устройствах памяти [9–13].
Низкотемпературная кубическая (пр. гр. $F\bar {4}3m$) модификация α-ZnS имеет кубическую структуру цинковой обманки или сфалерита ZnS (тип В3) и стабильна при температуре ниже 1290 K. При температуре 1293 K низкотемпературный кубический сульфид цинка переходит в высокотемпературную гексагональную (пр. гр. P63mc) модификацию β-ZnS со структурой вюрцита. В нормальных условиях крупнокристаллический (bulk) сульфид цинка является широкозонным полупроводником. Ширина запрещенной зоны Eg кубического α-ZnS составляет 3.50–3.76 эВ, гексагонального вюрцита β-ZnS – 3.74–3.91 эВ [7]. Диаметр экситона в крупнокристаллическом (bulk) сульфиде цинка равен 4.8–5.2 нм [7].
Сульфид серебра Ag2S имеет три полиморфные модификации. Низкотемпературная полупроводниковая фаза – акантит α-Ag2S с моноклинной (пр. гр. P21/c) структурой – существует при температуре ниже 450 K, объемноцентрированный кубический (пр. гр. $I{\text{ }}m\bar {3}m$) суперионный аргентит β-Ag2S – в температурном интервале 452–859 K, высокотемпературный гранецентрированный кубический (пр. гр. $Fm\bar {3}m$) сульфид γ-Ag2S стабилен в интервале от 860 K до температуры плавления. Ширина запрещенной зоны сульфида серебра со структурой акантита (α-Ag2S) равна 0.9–1.1 эВ, диаметр экситона – 2.8 нм [4–6].
Известно, что увеличение ширины запрещенной зоны наноструктурированных сульфидов наблюдается при уменьшении размеров R наночастиц в соответствии с Eg = Eb + π2ħ2/(2μexR2), где Eb – оптическая ширина запрещенной зоны крупнокристаллического полупроводника, μex – масса экситона, ħ – постоянная Планка [1, 6], а также при создании сульфидных нанокомпозитов (гетеронаноструктур) двух разных металлов [1, 7]. Уменьшение размера наночастиц меньше размера экситона позволяет регулировать ширину запрещенной зоны. Диаметр экситона для ZnS и Ag2S мал (~5.0 и ~2.8 нм соответственно), и получать стабильные наночастицы такого размера сложно. Более простым способом является получение полупроводниковых нанокомпозитов, состоящих из наночастиц сульфидов цинка и серебра. В идеальном случае ширина запрещенной зоны гетеронаноструктуры на основе ZnS и Ag2S может меняться от 1.0 до 4.0 эВ, что позволяет варьировать положение края оптического поглощения от инфракрасного до ближнего ультрафиолетового диапазона. Разработка таких гетеронаноструктур позволит расширить спектральную чувствительность сульфидных полупроводников в видимой области спектра, получить новые наноматериалы для твердотельных УФ-лазеров, быстродействующих переключателей сопротивления [1, 2]. В реальной гетеронаноструктуре ZnS/Ag2S можно ожидать независимого поглощения двух сульфидов или наблюдения двух краев собственного поглощения. При малом содержании одного из сульфидов будет наблюдаться край поглощения сульфида с бóльшим его содержанием в гетеронаноструктуре.
В настоящее время проблема синтеза гетеронаноструктур на основе наноструктурированных сульфидов цинка и серебра еще не решена полностью. Систематические исследования таких гетеронаноструктур отсутствуют. Имеются частные работы по синтезу кристаллов ZnS, легированных серебром [14], по синтезу нанокомпозитов ZnS/Ag2S методом катионного обмена [15, 16]. Синтез и оптические свойства пустотелых наночастиц ZnS-Ag2S типа ядро-оболочка и нанокомпозитов ZnS/Ag2S и Ag2S/ZnS типа ядро-оболочка описаны в работах [17, 18]. Фотокаталитическая активность тройных наноструктур ZnO–ZnS–Ag2S рассмотрена в работе [19]. Фотолюминесценция родственных гетеронаноструктур ZnS/CdS исследована авторами [20].
В настоящей работе впервые проведено сравнительное изучение химического осаждения, размера наночастиц и оптических свойств наноструктурированного сульфида цинка и гетеронаноструктур ZnS/Ag2S.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Наиболее перспективным методом синтеза гетеронаноструктур на основе наноструктурированных сульфидов цинка и серебра является осаждение и соосаждение из водных растворов.
Водные растворы реагентов для синтеза наноструктурированного сульфида цинка и гетеронаноструктур сульфидов цинка и серебра готовили на высокочистой деионизированной воде.
Наноструктурированный сульфид цинка синтезировали химическим осаждением из водных растворов нитрата цинка Zn(NO3)2 и сульфида натрия Na2S. В качестве комплексообразователя и стабилизатора применяли водные растворы цитрата натрия Na3C6H5O7 ≡ Na3Cit и динатриевой соли этилендиаминтетрауксусной кислоты (ЭДТА-H2Na2 ≡ Трилон Б). Составы реакционных смесей приведены в табл. 1. Осаждение сульфида цинка в присутствии цитрата натрия или Трилона Б происходит по следующей реакционной схеме:
(1)
$\begin{gathered} {\text{Zn}}{{\left( {{\text{N}}{{{\text{O}}}_{3}}} \right)}_{2}} + {\text{N}}{{{\text{a}}}_{2}}{\text{S}}\xrightarrow{{{\text{N}}{{{\text{a}}}_{3}}{{{\text{C}}}_{6}}{{{\text{H}}}_{5}}{{{\text{O}}}_{7}}{\text{\;или\;EDTA - }}{{{\text{H}}}_{2}}{\text{N}}{{{\text{a}}}_{2}}~}} \\ \to \,\,{\text{ZnS}} \downarrow + \,2{\text{NaN}}{{{\text{O}}}_{3}}. \\ \end{gathered} $Таблица 1.
Состав реакционных смесей, период решетки a и средний размер D частиц сульфида цинка в синтезированных нанопорошках ZnS и гетеронаноструктурах ZnS/Ag2S
| № | Концентрация реагентов в реакционных смесях, моль/л | aB3, нм | D ± 0.5, нм | ||||||
|---|---|---|---|---|---|---|---|---|---|
| синтез ZnS | синтез Ag2S | ||||||||
| Zn(NO3)2 | Na2S | Na3Cit | EDTA-H2Na2 | Ag(NO3)2 | Na2S | Na3Cit | |||
| 1 | 50 | 50 | – | – | – | – | – | 0.53576 | 2 |
| 2 | 50 | 100 | – | – | – | – | – | 0.53995 | 9.5 |
| 3 | 50 | 50 | 50 | – | – | – | – | 0.53496 | 4 |
| 4 | 50 | 50 | 25 | – | – | – | – | 0.53626 | 4 |
| 5 | 50 | 50 | 12.5 | – | – | – | – | 0.53436 | 3.5 |
| 6 | 50 | 50 | 6.25 | – | – | – | – | 0.53496 | 3 |
| 7 | 50 | 100 | 6.25 | – | – | – | – | 0.53810 | 3 |
| 8 | 50 | 50 | – | 50 | – | – | – | 0.53753 | 5.5 |
| 9 | 50 | 50 | – | 25 | – | – | – | 0.53764 | 6 |
| 10 | 50 | 50 | – | 12.5 | – | – | – | 0.53754 | 3 |
| 11 | 50 | 50 | – | 6.25 | – | – | – | 0.53875 | 5 |
| 12 | 50 | 50 | – | 3.125 | – | – | – | 0.53706 | 2.5 |
| 13 | 50 | 100 | – | 1 | – | – | – | 0.53981 | 8 |
| 14 | 50 | 100 | – | 5 | – | – | – | 0.53978 | 10 |
| 15 | 50 | 200 | – | 5 | – | – | – | 0.53981 | 10 |
| 16* | 50 | 50 | – | 3.125 | 2.5 | 1.25 | 1 | 0.53755 | 10 |
| 17** | 50 | 50 | 25 | 10 | 5 | 1 | 0.53974 | 9 | |
Концентрация Zn(NO3)2 во всех реакционных смесях составляла 50 ммоль/л, концентрация Na2S в реакционных смесях с цитратом натрия – 50 ммоль/л, а концентрация цитрата натрия Na3Cit изменялась от 6.25 до 50 ммоль/л. Концентрация Na2S в разных реакционных смесях с Трилоном Б варьировалась от 50 до 200 ммоль/л. Концентрация Трилона Б изменялась от 3.125 до 50 ммоль/л.
Синтез проводили в следующей последовательности: к раствору нитрата цинка приливали раствор стабилизирующего или комплексообразующего агента, затем объем смеси доводили до 100 мл и полученный раствор смешивали со 100 мл раствора Na2S. Такой порядок сливания способствует получению наночастиц ZnS меньшего размера. При сливании реагентов цвет реакционной смеси изменялся от мутно-белого до мутно-лимонного. Затем в течение часа оседали наиболее крупные частицы ZnS и раствор становился прозрачным.
Температуру синтеза варьировали от 298 до 323 K, время выдержки наночастиц в реакционной смеси составляло до 100 ч. При промывке наночастиц для уменьшения их агломерации, разрушения крупных агломератов и равномерного распределения водные растворы в течение 30 мин подвергали воздействию ультразвука в ванне Reltec ultrasonic bath USB-1/100-TH.
Синтезированные порошки промывали методом декантации. Сушку синтезированных образцов проводили сублимационным методом в лиофильной сушилке Alpha 1–2 LDplus (Martin Christ) при температуре ледового конденсатора ‒55°С (218 K). Синтезированные высушенные порошки наноструктурированных сульфидов цинка и серебра и сульфидных гетеронаноструктур хранили в вакуумном эксикаторе Vacuum Desiccator Sanplatec MB, вакуумированном до остаточного давления 13.3 Па (0.1 мм рт. ст.).
Величины произведения растворимости Ksp сульфидов ZnS (Ksp = 2.5 × 10–22) и Ag2S (Ksp = = 6.3 × 10–50) [21] различаются очень сильно. Поэтому для получения гетеронаноструктур ZnS/Ag2S был использован двухстадийный синтез. Сначала химическим осаждением из водных растворов нитрата серебра AgNO3 и сульфида натрия Na2S в присутствии цитрата натрия синтезировали сульфид серебра. В водных растворах цитрат натрия может восстанавливать ионы Ag+ с образованием наночастиц металлического серебра [4, 5, 22] и образовывать цитратную оболочку на частицах Ag2S [4, 5, 23, 24]. Поэтому для получения коллоидных растворов сульфида серебра без примеси Ag и без цитратной оболочки использовали реакционные смеси с небольшим относительным избытком 0.01 ≥ δ ≥ 0.5 сульфида натрия Na2S (по сравнению с реакцией со стехиометрическими коэффициентами) и минимальной концентрацией Na3Cit [4, 6, 25]. Синтез коллоидного раствора Ag2S проводили в темноте в нейтральной среде при pH 7 по следующей реакционной схеме [4, 25]:
(2)
$\begin{gathered} 2{\text{AgN}}{{{\text{O}}}_{3}} + (1 + \delta ){\text{N}}{{{\text{a}}}_{2}}{\text{S}}\xrightarrow{{{\text{N}}{{{\text{a}}}_{{\text{3}}}}{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{5}}}}{{{\text{O}}}_{{\text{7}}}}{\text{ }}}} \\ \to {\text{A}}{{{\text{g}}}_{2}}{\text{S}}{\kern 1pt} \downarrow + {\text{ }}2{\text{NaN}}{{{\text{O}}}_{3}}. \\ \end{gathered} $Далее к водному раствору нитрата цинка при постоянном перемешивании добавляли Трилон Б, затем полученный раствор одновременно смешивали с раствором сульфида натрия и синтезированным коллоидным раствором сульфида серебра. Использование Трилона Б способствовало появлению наноструктурированного сульфида цинка на поверхности частиц сульфида серебра и образованию на конечном этапе синтеза гетеронаноструктур ZnS/Ag2S типа ядро-оболочка.
Осажденные сульфидные порошки исследовали методом рентгеновской дифракции на дифрактометре Shimadzu XRD-7000 в CuKα1,2-излучении. Рентгеновские измерения проводили в интервале углов 2θ = 20°–95° с шагом Δ(2θ) = 0.02° и временем сканирования 10 с в каждой точке. Фазовый состав полученных образцов оценивали с помощью программного пакета Match! Version 1.10 [26]. Окончательное уточнение структуры синтезированных сульфидных порошков проводили с помощью программного пакета X’Pert HighScore Plus [27].
Микроструктуру, размер частиц и элементный химический состав сульфидных порошков изучали методом сканирующей электронной микроскопии на микроскопе JEOL-JSM LA 6390 с энергодисперсионным рентгеновским анализатором JED 2300 Energy Dispersive X-ray Analyzer и микроскопе FEI Quanta-200. Кроме того, средний размер (D) частиц (более точно – средний размер областей когерентного рассеяния) в синтезированных порошках сульфида цинка и гетеронаноструктурах ZnS/Ag2S определяли рентгенодифракционным методом по уширению дифракционных отражений с использованием зависимости приведенного уширения отражений β*(2θ) = = [β(2θ)cos θ]/λ от вектора рассеяния s = (2sin θ)/λ [28]. В этом случае средний размер D находили экстраполяцией зависимости приведенного уширения β*(2θ) от вектора рассеяния s на значение s = 0, т.е. D = 1/β*(2θ)|s = 0.
Измерения спектров диффузного отражения порошкообразных наноструктурированных образцов проводили в диапазоне 220–850 нм при температуре 300 K на спектрофотометре Shimadzu UV-2450 с интегрирующей сферой ISR-2200.
Измерения импульсной катодолюминесценции проводили при комнатной температуре с использованием импульсного ускорителя электронов Радан-Эксперт (энергия электронов 150 кэВ, длительность импульса 2 нс, плотность тока в импульсе 150 А/см2) и монохроматора Shamrock 303i с CCD-камерой Andor Newton EMCCD 970.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Типичные рентгенограммы синтезированных порошков сульфида цинка ZnS и гетеронаноструктур ZnS/Ag2S показаны на рис. 1. Нанопорошки ZnS получены осаждением из реакционных смесей 1, 5, 9 и 14, а гетеронаноструктуры – из реакционных смесей 16 и 17 (табл. 1). Дифракционные отражения всех нанопорошков значительно уширены вследствие малого размера частиц ZnS. Размер D частиц нанопорошков ZnS, определенный по уширению дифракционных отражений, составляет от 2 до 10 нм (табл. 1). Проведенный количественный анализ и сравнение с данными [29] показали, что наблюдаемый набор дифракционных отражений соответствует однофазному сульфиду цинка с кубической (пр. гр. $F\bar {4}3m$) структурой типа сфалерита. Период кристаллической решетки aB3 синтезированных нанопорошков ZnS равен 0.5344–0.5398 нм.
Рис. 1.
Рентгенограммы наноструктурированного сульфида цинка ZnS и гетеронаноструктур ZnS/Ag2S с разным размером частиц. Нумерация соответствует табл. 1.
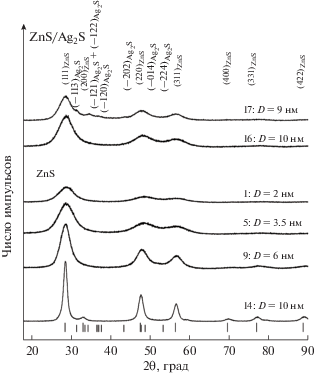
Количественный анализ рентгенограмм гетеронаноструктур показал присутствие дифракционных отражений кубического ZnS и моноклинного Ag2S. Интенсивность дифракционных отражений сульфида серебра значительно меньше интенсивности отражений сульфида цинка вследствие малого относительного содержания Ag2S в гетеронаноструктурах. Дифракционные отражения гетеронаноструктур сильно уширены. Это свидетельствует о малом размере сульфидных частиц, равном примерно 10 и 9 нм для гетеронаноструктур 16 и 17. Проведенный количественный анализ и сравнение с данными [29, 30] показали, что синтезированные гетеронаноструктуры содержат кубический ZnS и моноклинный Ag2S.
Согласно результатам энергодисперсионного рентгеновского анализа, после промывки в дистиллированной воде и вакуумной сушки содержание цинка Zn и серы S в синтезированном высушенном порошке сульфида цинка со средним размером частиц ~10 нм составляет 67.1 ± 0.3 и 32.7 ± 0.2 вес. % соответственно, что отвечает стехиометрическому сульфиду ZnS. Содержание цинка Zn, серебра Ag и серы S в гетеронаноструктуре 16 равно 63.1 ± 0.3, 5.2 ± 0.1 и 31.7 ± 0.2 вес. %, а в гетеронаноструктуре 17 – 53.4 ± 0.3, 17.6 ± 0.2 и 28.7 ± ± 0.2 вес. % соответственно. Поскольку количество ZnS существенно больше содержания сульфида серебра, для указания конкретного состава синтезированных гетеронаноструктур использовано обозначение (ZnS) · (Ag2S)x. С учетом этого и соотношения концентраций реагентов в реакционных смесях 16 и 17 (табл. 1) гетеронаноструктуры 16 и 17 имеют примерный состав ZnAg0.05S1.025 (или ZnS ∙ (Ag2S)0.025) и ZnAg0.20S1.09–1.10 (или ZnS ∙ (Ag2S)0.1).
Ранее на примере сульфида свинца было показано, что выдержка синтезированных наночастиц PbS в течение 3 сут в растворе с исходными концентрациями Pb(AcO)2, Na2S и Na3Cit 5 ммоль/л сопровождается ростом наночастиц от 4–5 до 7–8 нм [31]. В случае сульфида цинка дополнительная выдержка синтезированных наночастиц ZnS в более концентрированных реакционных смесях 9–11 в течение 96–100 ч не привела к изменению их рентгенограмм и росту наночастиц. Наиболее крупные наночастицы ZnS размером 8–10 нм синтезированы из реакционных смесей 2, 13–15 c повышенной концентрацией Na2S и малой концентрацией EDTA-H2Na2. Влияние стабилизатора на структуру и морфологию синтезированных наночастиц с размером от 2 до 10 нм не обнаружено.
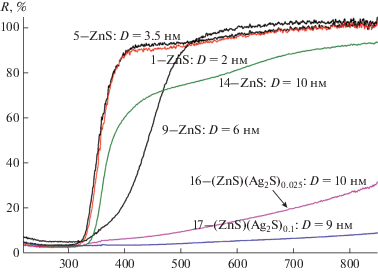
Спектры отражения нанопорошков ZnS с размером частиц от 2 до 10 нм и гетеронаноструктур с размером частиц 9 и 10 нм, измеренные в диапазоне длин волн от 220 до 850 нм, показаны на рис. 2. В области 450–850 нм наибольший коэффициент отражения R имеют нанопорошки сульфида цинка с размером частиц 2, 3 и 6 нм, а наименьший коэффициент отражения – гетеронаноструктуры с размером частиц 9 нм и примерным составом (ZnS) · (Ag2S)0.1. Спектры трех нанопорошков ZnS обладают четко выраженным краем поглощения в области 320–390 нм, для нанопорошка с размером частиц 6 нм край смещен в область 400–480 нм. В спектрах отражения гетеронаноструктур (ZnS) · · (Ag2S)0.025 и (ZnS) · (Ag2S)0.1 оптический край выражен слабо, а коэффициент отражения R уменьшается с ростом содержания Ag2S. Зависимость коэффициента отражения нанопорошков ZnS и гетеронаноструктуры ZnS/Ag2S связана с отличием их цвета. Нанопорошки ZnS имеют белый цвет и обладают большой отражательной способностью. Гетеронаноструктуры ZnS/Ag2S имеют серый цвет, поэтому их отражение заметно слабее. Увеличение содержания Ag2S в гетеронаноструктуре делает ее цвет более темным и снижает коэффициент отражения (рис. 2). Положение края полосы поглощения зависит от того, какой стабилизатор был использован при синтезе. Использование максимальной концентрации Трилона Б при синтезе образца 9 привело к смещению края полосы отражения от 320 до 480 нм по сравнению с образцами 1 и 5, полученными без комплексообразующего агента или с цитратом натрия. Наблюдаемое смещение может произойти также из-за увеличения концентрации вакансий серы в ZnS под влиянием ионов N3+ из Трилона Б. Согласно [32], такие вакансии создают дополнительные полосы вблизи края оптического поглощения.
Рис. 2.
Спектры диффузного отражения наноструктурированного сульфида цинка ZnS и гетеронаноструктур ZnS/Ag2S. Нумерация соответствует табл. 1.
Для оценки оптической ширины запрещенной зоны использовали метод Тауца [33]:
где α – коэффициент поглощения, hν – энергия фотонов, Eg – оптическая ширина щели, A = const – коэффициент пропорциональности, n – показатель, зависящий от типа межзонных переходов. Для ZnS характерны прямые разрешенные переходы, для которых n = 1/2 [34]. Коэффициент поглощения α определялся на основе обработки спектров отражения R (рис. 2) с помощью функции Кубелки–Мунка [35]: α = (1 – R)2/2R.На рис. 3 изображены фрагменты спектров оптического поглощения наноструктурированного сульфида цинка ZnS с размером частиц 2, 3 и 6 нм и гетеронаноструктуры (ZnS) · (Ag2S)0.025 с размером частиц 10 нм, построенные в координатах Тауца. Аппроксимация экспериментальных данных функцией (1) выполнена для линейных участков края оптического поглощения. В результате определена величина Eg для всех исследуемых образцов по точке пересечения линейной зависимости (штриховая линия) с осью абсцисс (hν). Анализ показал, что при уменьшении размера частиц нанопорошков ZnS от 10 до 2 нм оптическая ширина щели Eg увеличивается от 3.59 до 3.72 эВ. Данные значения превышают Eg = 3.50 эВ у крупнокристаллического кубического сульфида цинка α-ZnS [36]. Аналогичное увеличение ширины запрещенной зоны до 3.76 эВ с уменьшением размера наночастиц ZnS наблюдалось в работе [37]. Значение оптической ширины запрещенной зоны у образца 9 (3.52 эВ) может быть искажено из-за наличия дополнительной полосы вблизи края оптического поглощения в районе 380 нм (рис. 2).
Рис. 3.
Край оптического поглощения наноструктурированного сульфида цинка с размером частиц 2, 3, 6 и 10 нм (образцы 1, 5, 9, 14 соответственно) и гетеронаноструктур (ZnS) · (Ag2S)x, где x = 0.025 (образец 16, размер частиц 10 нм) и x = 0.1 (образец 17, размер частиц 9 нм). Номера образцов и оптическая ширина их запрещенной зоны указаны в верхней части рисунка.
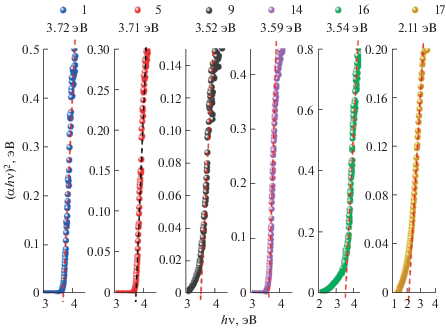
Край оптического поглощения в спектрах гетеронаноструктур (ZnS) · (Ag2S)0.025 и (ZnS) · (Ag2S)0.1 на рис. 2 выражен менее четко, чем в случае нанопорошков ZnS. Данный факт может быть обусловлен наличием в указанных образцах второй фазы – сульфида серебра. Увеличение содержания Ag2S в (ZnS) · (Ag2S)x от x = 0 до x = 0.1 приводит к изменению наклона края оптического поглощения в спектрах отражения (рис. 2, кривые 16 и 17). При этом, согласно оценке по методу Тауца, ширина оптической щели Eg уменьшается от 3.54 до 2.06 эВ.
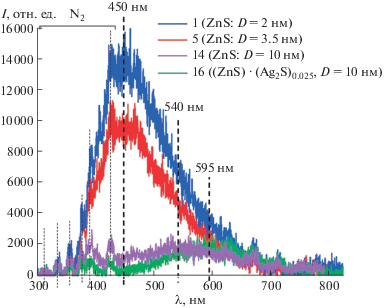
Спектры импульсной катодолюминесценции (ИКЛ) образцов 1, 5 и 14 наноструктурированного ZnS c размером частиц 2, 3 и 10 нм (табл. 1) и гетеронаноструктуры (ZnS) · (Ag2S)0.025 (образец 16) показаны на рис. 4. Свечение образцов 9 и 17 зарегистрировать не удалось. Наиболее интенсивной ИКЛ обладают нанопорошки ZnS с размером частиц 2 и 3 нм. Максимумы спектров ИКЛ сульфида цинка расположены при 450 нм, ширина на половине высоты составляет 150 нм. Аналогичные спектральные параметры характерны для свечения объемных образцов ZnS, что подтверждается литературными данными [38]. Интенсивность ИКЛ в образце ZnS с размером наночастиц 10 нм на порядок ниже, максимум сдвинут в область больших длин волн до 540 нм. Спектр ИКЛ для гетеронаноструктуры (ZnS) · (Ag2S)0.025 также имеет низкую интенсивность, основной максимум расположен при 595 нм. Дополнительно наблюдается серия узких слабых пиков в диапазоне 300–450 нм, не относящихся к свечению исследуемых образцов и принадлежащих свечению молекулярного азота в воздухе под воздействием катодного пучка. Существенное отличие в интенсивности свечения образцов может быть связано с применением разных реагентов при синтезе (табл. 1). Видно, что применение Na3Cit при синтезе (образец 5) незначительно сказывается на люминесцентных свойствах, в то время как использование EDTA-H2Na2 и увеличение его концентрации приводят к заметному снижению интенсивности свечения (образец 14, синтез из реакционной смеси 14 с концентрацией Трилона Б 5 ммоль/л) или к полному отсутствию люминесценции (образец 16, синтез из реакционной смеси с концентрацией Трилона Б 3.125 ммоль/л). Наблюдаемые спектры люминесценции могут быть связаны с электронными переходами в собственных и примесных дефектах, происходящими по донорно-акцепторному механизму. Дефектами, являющимися центрами люминесценции, могут быть разные неконтролируемые примеси, особенно кислород; дефекты в катионной и анионной подрешетках; комплексы внутренних дефектов, включающие примесные атомы и т.д. Центры люминесценции сульфида цинка с дефектной структурой описаны во многих работах, включая [39, 40], а также обзор [7]. Дополнительное уменьшение интенсивности люминесценции гетеронаноструктур происходит из-за наличия узкой запрещенной зоны сульфида серебра, который имеет сильные полосы поглощения в диапазоне люминесценции ZnS.
ЗАКЛЮЧЕНИЕ
Образцы наноструктурированного сульфида цинка ZnS с различным размером наночастиц синтезированы методом гидрохимического осаждения. Синтез гетеронаноструктур ZnS/Ag2S проведен осаждением сульфида цинка на поверхность наночастиц Ag2S, полученных в виде коллоидного раствора.
Исследование оптических свойств наноразмерных образцов ZnS показало, что при уменьшении размера наночастиц от 10 до 2 нм наблюдается синий сдвиг края оптического поглощения за счет увеличения ширины запрещенной зоны Eg от 3.59 до 3.72 эВ. Легирование сульфида цинка сульфидом серебра с образованием гетеронаноструктур ZnS/Ag2S приводит к красному сдвигу края поглощения в оптических спектрах. Увеличение содержания Ag2S в гетеронаноструктурах (ZnS) · (Ag2S)x от 0 до 0.1 сопровождается уменьшением ширины запрещенной зоны Eg от 3.6–3.7 до 2.06 эВ и ростом поглощения в длинноволновой области спектра.
Таким образом, изменение размеров наночастиц ZnS и концентрации Ag2S в гетеронаноструктурах ZnS/Ag2S позволяет регулировать ширину запрещенной зоны и управлять оптическими свойствами в более широком диапазоне, чем в нелегированном наноструктурированном сульфиде цинка. Предложенная процедура синтеза может применяться также для приготовления гетеронаноструктур других сульфидов с разной растворимостью.
Список литературы
Fang X., Zhai T., Gautam U.K. et al. // Prog. Mater. Sci. 2011. V. 56. № 2. P. 175. https://doi.org/10.1016/j.pmatsci.2010.10.001
Wang X., Huang H., Liang B. et al. // Crit. Rev. Solid State Mater. Sci. 2013. V. 38. № 1. P. 57. https://doi.org/10.1080/10408436.2012.736887
Cui C., Li X., Liu J. et al. // Nanoscale Res. Lett. 2015. V. 10. P. 431. https://doi.org/10.1186/s11671-015-1125-7
Sadovnikov S.I., Gusev A.I. // J. Mater. Chem. A. 2017. V. 5. № 34. P. 17676. https://doi.org/10.1039/C7TA04949H
Sadovnikov S.I., Rempel A.A., Gusev A.I. // Russ. Chem. Rev. 2018. V. 87. № 4. P. 303. [Садовников С.И., Ремпель А.А., Гусев А.И. // Успехи химии. 2018. Т. 87. № 4. С. 303.]https://doi.org/10.1070/RCR4803
Sadovnikov S.I., Rempel A.A., Gusev A.I. Nanostructured Lead, Cadmium and Silver Sulfides: Structure, Nonstoichiometry and Properties. Berlin– Heidelberg, Springer, 2018. 331 p. https://doi.org/10.1007/978-3-319-56387-9
Sadovnikov S.I. // Russ. Chem. Rev. 2019. V. 88. № 6. P. 571. [Садовников С.И. // Успехи химии. 2019. Т. 88. № 6. С. 571.]https://doi.org/10.1070/RCR4867
Аветисов И.Х. // Высокочистые вещества / Под ред. Зломанова В.П. М.: Научный мир, 2018. С. 704.
Ma X., Song J., Yu Z. // Thin Solid Films. 2011. V. 519. № 15. P. 5043. https://doi.org/10.1016/j.tsf.2011.01.125
Lim W.P., Zhang Z., Low H.Y., Chin W.S. // Angew. Chem. Int. Ed. 2004. V. 43. № 42. P. 5685. https://doi.org/10.1002/anie.200460566
Kryukov A.I., Stroyuk A.L., Zin’chuk N.N. et al. // J. Mol. Catal. A: Chem. 2004. V. 221. № 1–2. P. 209. https://doi.org/10.1016/j.molcata.2004.07.009
Li H., Xie F., Li Wei et al. // Catal. Surv. Asia. 2018. V. 22. № 3. P. 156. https://doi.org/10.1007/s10563-018-9249-2
Liang C.H., Terabe K., Hasegawa T., Aono M. // Nanotechnology. 2007. V. 18. № 48. P. 485202. https://doi.org/10.1088/0957-4484/18/48/485202
Butkhuzi T.V., Tchelidze T.G., Chikoidze E.G., Kekelidze N.P. // Phys. Status Solidi B. 2002. V. 229. № 1. P. 365. https://doi.org/10.1002/1521-3951(200201)229:1<365::AID-PSSB365>3.0.CO;2-G
Zhang H., Wei B., Zhu L. et al. // Appl. Surf. Sci. 2013. V. 270. P. 133. https://doi.org/10.1016/j.apsusc.2012.12.140
Yang X., Xue H., Xu J. et al. // ACS Appl. Mater. Interfaces. 2014. V. 6. № 12. P. 9078. https://doi.org/10.1021/am5020953
Chaudhuri R.G., Paria S. // J. Phys. Chem. C. 2013. V. 117. № 4. P. 23385. https://doi.org/10.1021/jp408105m
Murugadoss G., Jayavel R., Kumar M.R., Thangamuthu R. // Appl. Nanosci. 2016. V. 6. № 4. P. 503. https://doi.org/10.1007/s13204-015-0448-0
Zamiri R., Ahangar H.A., Tobaldi D.M. et al. // Phys. Chem. Chem. Phys. 2014. V. 16. № 40. P. 22418. https://doi.org/10.1039/C4CP02945C
Isaeva A.A., Smagin V.P. // Russ. J. Inorg. Chem. 2019. V. 64. № 10. P. 1199. [Исаева А.А., Смагин В.П. // Журн. неорган. химии. 2019. Т. 64. № 10. С. 1020.]https://doi.org/10.1134/S0036023619100061
Лурье Ю.Ю. Справочник по аналитической химии. М.: Химия, 1967. С. 101.
Lee P.C., Meisel D. // J. Phys. Chem. 1982. V. 86. № 17. P. 3391. https://doi.org/10.1021/j100214a025
Sadovnikov S.I., Gusev A.I., Gerasimov E.Yu., Rempel A.A. // Chem. Phys. Lett. 2015. V. 642. P. 17. https://doi.org/10.1016/j.cplett.2015.11.004
Sadovnikov S.I., Gusev A.I., Gerasimov E.Yu., Rempel A.A. // Inorg. Mater. 2016. V. 52. № 5. P. 441. [Садовников С.И., Гусев А.И., Герасимов Е.Ю., Ремпель А.А. // Неорган. материалы. 2016. Т. 52. № 5. С. 487.]https://doi.org/10.1134/S0020168516050149
Sadovnikov S.I., Gusev A.I. // Eur. J. Inorg. Chem. 2016. № 31. P. 4944. https://doi.org/10.1002/ejic.201600881
Match! Version 1.10. Phase Identification from Powder Diffraction © 2003–2010 Crystal Impact.
X’Pert HighScore Plus. Version 2.2e (2.2.5). © 2009 PANalytical B. V. Almedo, the Netherlands.
Гусев А.И. Наноматериалы, наноструктуры, нанотехнологии. М.: Физматлит, 2009. 416 с. ISBN 978-5-9221-0582-8
JCPDS card No. 005-0566
Sadovnikov S.I., Gusev A.I., Rempel A.A. // Phys. Chem. Chem. Phys. 2015. V. 17. № 19. P. 12466. https://doi.org/10.1039/C5CP00650C
Sadovnikov S.I., Gusev A.I. // Russ. J. Gen. Chem. 2014. V. 84. № 2. P. 173. [Садовников С.И., Гусев А.И. // Журн. орган. химии. 2014. Т. 84. № 2. С. 177.]https://doi.org/10.1134/S1070363214020017
Peng H., Liu D., Zheng X., Fu X. // Nanomaterials. 2019. V. 9. P. 1657. https://doi.org/10.3390/nano9121657
Tauc J. // Mater. Res. Bull. 1968. V. 3. № 1. P. 37. https://doi.org/10.1016/0025-5408(68)90023-8
Cardona M., Harbeke G. // Phys. Rev. 1965. V. 137. № 5A. P. A1467. https://doi.org/10.1103/PhysRev.137.A1467
Kubelka P., Munk F. // Z. Techn. Phys. 1931. № 11a. P. 593.
Kaur N., Kaur S., Singh J., Rawat M. // J. Bioelectron. Nanotechnol. 2016. V. 1. № 1. P. 1.
Hoa T.T.Q., Vu L.V., Canh L.V., Long N.N. // J. Phys.: Conf. Ser. 2009. V. 187. P. 012081. https://doi.org/10.1088/1742-6596/187/1/012081
Saleh M., Lynn K.G., Jacobsohn L.G., McCloy J.S. // J. Appl. Phys. 2019. V. 125. № 7. P. 075702. https://doi.org/10.1063/1.5084738
Самофалова Т.В., Семенов В.Н., Клюев В.Г. и др. // Журн. прикл. спектроскопии. 2014. Т. 81. № 1. С. 88.
Sahraei R., Mohammadi F., Soheyli E., Roushani M. // J. Lumin. 2017. V. 187. P. 421. https://doi.org/10.1016/j.jlumin.2017.03.020
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии