Журнал неорганической химии, 2021, T. 66, № 10, стр. 1407-1411
Синтез и строение дикарбоксилатов трифенилвисмута Ph3Bi[OC(O)R]2 (R = C6H4OMe-2, C6H3(NO2)2-3,5, C≡CPh)
В. В. Шарутин a, *, О. К. Шарутина a, Л. В. Кощеева a
a Национальный исследовательский Южно-Уральский государственный университет
454080 Челябинск, пр-т Ленина, 76, Россия
* E-mail: sharutin50@mail.ru
Поступила в редакцию 15.03.2021
После доработки 08.04.2021
Принята к публикации 27.04.2021
Аннотация
Из трифенилвисмута, карбоновой кислоты и гидропероксида третичного бутила (1 : 2 : 1 мол.) в эфире синтезированы соединения Ph3Bi[OC(O)R]2 (R = C6H4OMe-2 (I), C6H3(NO2)2-3,5 (II), C≡CPh (III)), особенности строения которых установлены методом рентгеноструктурного анализа. Атомы висмута в I−III имеют искаженную тригонально-бипирамидальную координацию с карбоксилатными лигандами в аксиальных положениях. Углы OBiO равны 172.95(13)°−175.6(2)°, расстояния Bi−C и Bi−O составляют 2.176(6)−2.251(5) и 2.280(4)−2.310(3) Å соответственно. Наличие внутримолекулярных контактов Bi⋅⋅⋅O(=C) (2.759(6)−2.982(7) Å) в молекулах I−III обусловливает увеличение одного валентного угла CBiC (до 154.4(3)°, 140.2(2)°, 145.3(4)° соответственно) за счет уменьшения двух других.
ВВЕДЕНИЕ
Весьма обширным классом органических соединений висмута(V) являются дикарбоксилаты триорганилвисмута, которые способны оказывать антилейшманиозное действие [1−5], обладают высокой фотокаталитической [6] и биологической [7] активностью, поэтому синтез и исследование строения неизвестных ранее дикарбоксилатов триарилвисмута являются актуальной задачей.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Бис(2-метоксибензоато)трифенилвисмут (I) получали по методике [8] из трифенилвисмута, 2-метоксибензойной кислоты и трет-бутилгидропероксида в эфире (20°C, 1 ч, 1 : 2 : 1 мол.). Выделены кристаллы с tпл = 132°С (выход 54%). ИК-спектр (ν, см−1): 3078, 3005, 2935, 1603, 1558, 1470, 1436, 1344, 1250, 1179, 1148, 1094, 1049, 1020, 984, 859, 791, 745, 735, 704, 679, 663, 449, 439.
Соединения II и III также синтезировали по методике [8].
Бис(3,5-динитробензоато)трифенилвисмут (II). К смеси 202 мг (0.50 ммоль) трифенилвисмута и 212 мг (1.00 ммоль) 3,5-динитробензойной кислоты в 20 мл диэтилового эфира добавляли 64 мг 70%-ного водного раствора трет-бутилгидропероксида. Смесь выдерживали в течение 12 ч при комнатной температуре, удаляли растворитель. Остаток перекристаллизовывали из смеси бензол–октан. Получили 390 мг (83%) кристаллов сольвата II ⋅ PhH с tпл = 178°С. ИК-спектр (ν, см−1): 3107, 3095, 2935, 2877, 1632, 1560, 1541, 1469, 1458, 1438, 1386, 1342, 1325, 1286, 1230, 1184, 1183, 1070, 1037, 1010, 985, 321, 910, 810, 802, 786, 742, 731, 723, 686, 650, 638, 534, 451, 443, 418.
Бис(фенилпропиолато)трифенилвисмут (III). К смеси 202 мг (0.50 ммоль) трифенилвисмута и 146 мг (1.00 ммоль) фенилпропиоловой кислоты в 20 мл диэтилового эфира добавляли 64 мг 70%-ного водного раствора трет-бутилгидропероксида. Смесь выдерживали в течение 12 ч при комнатной температуре, удаляли растворитель. Остаток перекристаллизовывали из смеси бензол–октан. Получили 230 мг (63%) кристаллов III с tпл = = 139°С. ИК-спектр (ν, см−1): 3084, 3053, 2268, 2210, 2158, 1963, 1896, 1815, 1589, 1575, 1558, 1541, 1490, 1469, 1436, 1334, 1327, 1220, 1176, 1141, 1097, 1070, 1041, 1010, 985, 937, 918, 837, 808, 771, 758, 732, 678, 648, 623, 611, 532, 503, 447.
ИК-спектры соединений записывали на ИК-Фурье-спектрометре Shimadzu в таблетках KBr. Элементный анализ выполняли на анализаторе Euro EA3028-НТ, РСА – на автоматическом четырехкружном дифрактометре D8 QUEST фирмы Bruker (графитовый монохроматор) при 293 K. Сбор, первичную обработку данных, уточнение параметров элементарной ячейки, учет поглощения, определение и уточнение структур проводили по программам [9–11]. Структуры определены прямым методом и уточнены методом наименьших квадратов в анизотропном приближении для неводородных атомов. Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных; deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk/data_request/cif.
Соединение I (CCDC 2048883): бесцветные кристаллы моноклинные, пр. гр. С2/c, a = = 19.00(3), b = 9.615(14), c = 16.26(2) Å, β = = 92.92(6)°, V = 2966(8) Å3 , Z = 4, ρвыч = 1.663 г/см3; μ = 5.988 мм–1, F(000) = 1456.0. Измерено 3426 независимых отражений (Rint = 0.1140), 188 параметров уточнения: R1 = 0.0606, wR2 = 0.1492.
Соединение II (CCDC 2045887): бесцветные кристаллы триклинные, пр. гр. Р$\bar {1},$ a = 12.456(8), b = 12.713(9), c = 13.357(9) Å, α = 86.23(3)°, β = = 71.82(3)°, γ = 69.78(2)°, V = 1884(2) Å3, Z = 2, ρвыч = 1.659 г/см3; μ = 4.749 мм–1, F(000) = 924.0. Измерено 6845 независимых отражений (Rint = = 0.0620), 496 параметров уточнения: R1 = 0.0368, wR2 = 0.0768.
Соединение III (CCDC 2043997): бесцветные кристаллы моноклинные, пр. гр. С2/с, a = = 13.776(11), b = 20.592(19), c = 12.408(13) Å, β = = 121.73(4)°, V = 2994(5) Å3, Z = 4, ρвыч = 1.621 г/см3; μ = 5.927 мм–1, F(000) = 1424.0. Измерено 3569 независимых отражений (Rint = 0.0501), 187 параметров уточнения: R1 = 0.0433, wR2 = 0.1267.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В основе одного из эффективных способов получения дикарбоксилатов триарилвисмута лежит реакция триарилвисмута с карбоновой кислотой в присутствии окислителя [12–22].
Мы продолжили изучение аналогичных реакций трифенилвисмута с 2-метоксибензойной, 3,5-динитробензойной и фенилпропиоловой кислотами, содержащими в органическом радикале различные по электроотрицательности заместители. Реакции проводили в диэтиловом эфире в присутствии гидропероксида третичного бутила. Несмотря на различную природу заместителей в органическом радикале карбоновой кислоты реакции протекали с образованием дикарбоксилатов трифенилвисмута с выходом до 83%:
Соединения I–III – бесцветные кристаллические вещества, устойчивые к действию влаги и кислорода воздуха, хорошо растворимые в ароматических углеводородах, хлороформе, тетрагидрофуране и нерастворимые в алифатических углеводородах.
В ИК-спектрах соединений I–III наблюдаются интенсивные полосы поглощения в области 450 см–1 (449, 451, 447 см–1 соответственно), которые характеризуют валентные колебания связи Bi–С [23]. Полосы поглощения, соответствующие колебаниям связей С=О (1603, 1632, 1589 см–1 в I−III соответственно), сдвигаются в низкочастотную область спектра по сравнению с этими же полосами поглощения соответствующих карбоновых кислот (1693, 1705, 1670 см–1). В ИК-спектре соединения II наблюдаются полосы поглощения, которые относятся к асимметричным (1541 см–1) и симметричным (1342 см–1) колебаниям NO2-групп. В спектре соединения III присутствует узкая полоса поглощения при 2210 см–1, отвечающая валентным колебаниям связи С≡С.
По данным РСА, в кристаллах I–III атомы висмута имеют искаженную тригонально-бипирамидальную координацию с карбоксилатными лигандами в аксиальных положениях (рис. 1–3). В кристаллах I и III присутствуют элементы симметрии: атомы висмута лежат на оси вращения второго порядка.
Рис. 1.
Общий вид молекулы I (Bi–O(1) 2.283, Bi(1)–C(1) 2.206, Bi(1)–C(7) 2.205 Å; O(1)BiO(11) 174.3°, C(1)BiC(11) 154.4°, C(7)BiC(1) 102.8°).

Рис. 2.
Общий вид молекулы II (молекула сольватного бензола не показана) (Bi–O(2) 2.280, Bi–O(8) 2.310, Bi⋅⋅⋅O(2) 2.901, Bi(1)−C(1) 2.251, Bi(1)−C(11) 2.176, Bi(1)–C(21) 2.204 Å; O(2)BiO(8) 172.9°, C(11)BiC(21) 140.2°, C(11)BiC(1) 108.1°, C(21)BiC(1) 111.7°).
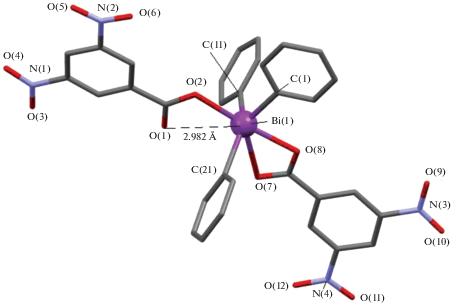
Рис. 3.
Общий вид молекулы III (Bi–O(1) 2.308, Bi(1)–C(1) 2.208, Bi(1)–C(11) 2.196 Å; O(1)BiO(11) 175.6°, C(1)BiC(11) 145.3°, C(11)BiC(1) 107.3°).
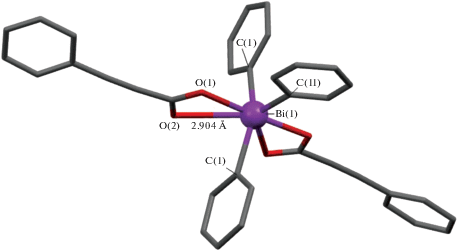
Углы OBiO (172.95(2)°–175.6(2)°) отличаются от 180°, суммы валентных углов CBiC в экваториальной плоскости CCC составляют 360°. Длины связей Bi–C в I–III изменяются в интервале 2.197(3)–2.251(5) Å, расстояния Bi–O (2.280(4)–2.310(3) Å) приближаются по своему значению к сумме ковалентных радиусов атомов висмута и кислорода (2.31 Å [24]). В молекулах I–III наблюдаются внутримолекулярные контакты Bi⋅⋅⋅O(=C), которые изменяются в интервале 2.759(6)–2.982(2) Å, поэтому можно говорить об увеличении координационного числа центрального атома до 7 (5 + 2). Двугранные углы между плоскостями карбоксильных групп в I и II составляют 6.37° и 6.06°. В кристалле III плоскости карбоксильных групп практически параллельны (соответствующий угол равен 0.04°), а валентные углы OBiO (175.6°) и CBiC (145.3°, 107.35°, 107.35°) отличаются от подобных углов, наблюдаемых в изоструктурном аналоге сурьмы (OSbO 177.66° и CSbC 143.23°, 108.38°, 108.38° [25]). Карбоксилатные лиганды в дикарбоксилатах трифенилвисмута I–III имеют цис-ориентацию относительно фрагмента BiC3, что характерно для большинства дикарбоксилатов триорганилвисмута [25], и расположены таким образом, что внутримолекулярные контакты Bi⋅⋅⋅O(=C) формируются внутри одного экваториального угла, значение которого возрастает до 154.4(3)°, 140.2(2)° и 145.3(4)° соответственно, при понижении значений двух других экваториальных углов.
ЗАКЛЮЧЕНИЕ
Наличие различных по природе органических групп в карбоновой кислоте не оказывает влияния на схему протекания реакции окислительного присоединения с участием трифенилвисмута и кислоты. Геометрические характеристики полученных дикарбоксилатов трифенилвисмута (длины связей Bi–C, Bi–О, внутримолекулярные контакты Bi⋅⋅⋅O и величины валентных углов) близки между собой при одинаковом координационном полиэдре атомов висмута.
Список литературы
Duffin R.N., Blair V.L., Kedzierski L., Andrews P.C. // Dalton Trans. 2018. V. 47. P. 971. https://doi.org/10.1039/c7dt04171c
Duffin R.N., Blair V.L., Kedzierski L., Andrews P.C. // J. Inorg. Biochem. 2018. V. 189. P. 151. https://doi.org/10.1016/j.jinorgbio.2018.08.015
Ong Y.C., Blair V.L., Kedzierski L., Andrews P.C. // Dalton Trans. 2014. V. 43. P. 12904. https://doi.org/10.1039/c4dt00957f
Ong Y.C., Blair V.L., Kedzierski L. et al. // Dalton Trans. 2015. V. 44. P. 18215. https://doi.org/10.1039/c5dt03335g
Andleeb S., Imtiaz-ud-Din, Rauf K.M. et al. // Appl. Organomet. Chem. 2019. V. 33. P. e5061. https://doi.org/10.1002/aoc.5061
Zhang X.-Y., Wu R.-X., Bi C.-F. et al. // Inorg. Chim. Acta. 2018. V. 483. P. 129. https://doi.org/10.1016/j.ica.2018.07.02
Oliveira L.G.D., Silva M.M., de Paula F.C.S. et al. // Molecules. 2011. V. 16. P. 10314.
Шарутин В.В., Шарутина О.К., Ефремов А.Н. // Журн. неорган. химии. 2019. Т. 64. № 2. С. 159. [Sharutin V.V., Sharutina O.K., Efremov A.N. // Russ. J. Inorg. Chem. 2019. V. 64. № 2. P. 196.] https://doi.org/10.1134/S0036023619020189
SMART and SAINT-Plus. Version 5.0. Data Collection and Processing Software for the SMART System. Madison. [WI, USA.]: Bruker AXS Inc., 1998.
SHELXTL/PC. Version 5.10. An Integrated System for Solving, Refining and Displaying Crystal Structures from Diffraction Data. Bruker AXS Inc., Madison: WI, USA, 1998.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Crystallogr. 2009. V. 42. P. 339. https://doi.org/10.1107/S0021889808042726
Додонов В.А., Гущин А.В., Брилкина Т.Г. // Журн. общ. химии. 1985. Т. 55. № 1. С. 73.
Шарутин В.В., Егорова И.В., Шарутина О.К., Невмешкина Л.А. // Журн. неорган. химии. 2008. Т. 53. № 11. С. 1853. [Sharutin V.V., Egorova I.V., Sharuti-na O.K., Nevmeshkina L.A. // Russ. J. Inorg. Chem. 2008. V. 53. № 11. P. 1733.] https://doi.org/10.1134/S0036023608110107
Verkhovykh V.A., Kalistratova O.S., Grishina A.I. et al. // Bull. South Ural State University. Ser. Chemistry. 2015. V. 7. № 3. P. 61.
Gushchin F.V., Kalistratova O.S., Maleeva A.I. et al. // Bull. South Ural State University. Ser. Chemistry. 2016. V. 8. № 1. P. 51. https://doi.org/10.14529/chem160108
Гущин А.В., Шашкин Д.В., Прыткова Л.К. и др. // Журн. общей химии. 2011. Т. 81. № 3. С. 397. [Gushchin A.V., Shashkin D.V., Prytkova L.K. et al. // Russ. J. Gen. Chem. 2011. V. 81. № 3. P. 493.] https://doi.org/10.1134/S107036321103008X
Шарутин В.В., Сенчурин В.С., Шарутина О.К. // Журн. неорган. химии. 2011. Т. 56. № 10. С. 1644. [Sharutin V.V., Senchurin V.S., Sharutina O.K. // Russ. J. Inorg. Chem. 2011. V. 56. № 10. Р. 1565.] https://doi.org/10.1134/S0036023611100202
Шарутин В.В., Шарутина О.К., Сенчурин В.С. // Журн. неорган. химии. 2014. Т. 59. № 1. С. 42. https://doi.org/10.7868/S0044457X14010164
Шарутин В.В., Шарутина О.К. // Журн. неорган. химии. 2014. Т. 59. № 6. С. 734. [Sharutin V.V., Sharutina O.K. // Russ. J. Inorg. Chem. 2014. V. 59. № 6. P. 558.] https://doi.org/10.1134/S0036023614060199
Гусаковская А.А., Калистратова О.С., Андреев П.В. и др. // Кристаллография. 2018. Т. 63. № 2. С. 203. https://doi.org/10.7868/S0023476118020066
Шарутин В.В., Мосунова Т.В. // Вестник ЮУрГУ. 2020. Т. 12. № 3. С. 7. https://doi.org/10.14529/chem200301
Сенчурин В.С. // Вестник ЮУрГУ. Сер. Химия. 2020. Т. 12. № 4. С. 72. https://doi.org/10.14529/chem200404
Islam A., Da Silva J.G., Berbet F.M. et al. // Molecules. 2014. V. 19. P. 6009. https://doi.org/10.3390/molecules19056009
Бацанов С.С. // Журн. неорган. химии. 1991. Т. 36. № 12. С. 3015. [Batsanov S.S. // Russ. J. Inorg. Chem. 1991. V. 36. № 12. P. 1694.]
Cambridge Crystallographic Data Center. 2020. deposit@ccdc.cam.ac.uk; http://www.ccdc.cam.ac.uk
Дополнительные материалы
- скачать I.tif
- Рис. I
- скачать I.smf
- I. Ph3Bi[OC(O)C6H4(OMe)-2]2.
- скачать ESM_1.docx
- I checkCIF/PLATON report.
- скачать II.tif
- Рис. II
- скачать II.smf
- II. Ph3Bi[OC(O)C6H3(NO2)2]2.
- скачать ESM_2.docx
- II checkCIF/PLATON report.
- скачать III.tif
- Рис. III
- скачать III.smf
- III. Ph3Bi[OC(O)CCPh]2.
- скачать ESM_3.docx
- III checkCIF/PLATON report.
Инструменты
Журнал неорганической химии


