Журнал неорганической химии, 2021, T. 66, № 11, стр. 1593-1596
Термическое расширение и термодинамические функции гафната европия при 298–1300 K
А. В. Гуськов a, П. Г. Гагарин a, В. Н. Гуськов a, *, А. В. Хорошилов a, К. С. Гавричев a
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
* E-mail: guskov@igic.ras.ru
Поступила в редакцию 27.04.2021
После доработки 18.05.2021
Принята к публикации 20.05.2021
Аннотация
Методами дифференциальной сканирующей калориметрии и высокотемпературной дифрактометрии выполнены измерения молярной теплоемкости и термического расширения кристаллической решетки гафната европия структурного типа пирохлора в интервале температур 298–1300 K. Структурные превращения Eu2Hf2O7 в этой области температур отсутствуют. Оценены коэффициенты термического расширения гафната европия.
ВВЕДЕНИЕ
Гафнат европия Eu2Hf2O7 структурного типа пирохлора (Fd3m) кристаллизуется при соотношении металлов Eu : Zr = 1 : 1 в области непрерывных твердых растворов на основе диоксида гафния (1 – x)EuO1.5 ⋅ xHfO2 (x ≈ 0.45–1.0), имеющих кристаллическую структуру разупорядоченного флюорита Fm3m. Кристаллизация пирохлоров происходит под действием высокой температуры (1600–1900 K), активизирующей диффузионные процессы [1]. Гафнат европия относится к высокотемпературным оксидам и не имеет структурных превращений вплоть до температуры перехода в структуру разупорядоченного флюорита (~2500–2700 K) [2–5]. Это соединение, как и другие цирконаты и гафнаты редкоземельных элементов (РЗЭ), имеет хороший потенциал практического применения в атомной промышленности и энергетике [6–8]. Особый интерес представляет разработка защитных покрытий для высокотемпературных энергетических установок – газовых турбин (thermal barrier coatings, TBC) и двигателей самолетов (thermal/environmentalcoatings, TBC/EBC) [9–11]. Высокая химическая инертность и коррозионная стойкость гафнатов и цирконатов РЗЭ, которая должна обеспечить надежность покрытий, нуждается в подтверждении, особенно при высокотемпературном контакте с оксидами группы CMAS (calcium-magnesium-alumina-silicate). Экспериментальные исследования достаточно затратны и трудоемки, однако эту проблему можно решить методами химической термодинамики – моделированием химических равновесий при высоких температурах [12, 13]. Достоинством такого подхода является элиминирование кинетических факторов, осложняющих экспериментальные измерения. Для проведения модельных расчетов требуются надежные данные по температурным зависимостям термодинамических функций: теплоемкости, энтропии, приращения энтальпии и энергии Гиббса в максимально широком температурном диапазоне. Высокотемпературную теплоемкость Eu2Hf2O7 измеряли методом дифференциальной сканирующей калориметрии (ДСК) в атмосфере гелия в интервале температур 373–1073 K [14], а также рассчитывали из результатов измерений приращения энтальпии в диапазонах 774–1679 [15] и 977–1738 K [16], полученных методом калориметрии сброса (drop-calorimetry). Полученные в работе [14] данные кажутся завышенными, а результаты [15] и [16] не слишком согласуются между собой, особенно в области температур выше 1000 K. Важной характеристикой высокотемпературных керамических материалов являются параметры термического расширения. Цель настоящего исследования – измерение методом ДСК молярной теплоемкости Eu2Hf2O7 в диапазоне температур 298–1300 K, исследование температурной зависимости параметра кристаллической решетки методом рентгеновской дифракции и оценка коэффициентов термического расширения в интервале 298–1300 K.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
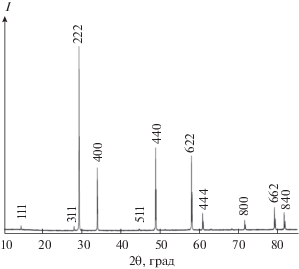
Синтез, методы измерения и обработки результатов подробно описаны в работе [17]. Для синтеза использовали сесквиоксид европия (99.99 мас. %), диоксид гафния (99.99 мас. %) производства “Lanhit” LLC, соляную кислоту (35–38 мас. %, ос. ч. 20-4) и раствор аммиака (25–28 мас. % NH4OH, ос. ч.) производства ООО “Химмед”. По данным рентгенофазового анализа, полученный гафнат европия однофазный с параметром решетки а = 10.541(4) Å (пирохлор) и, согласно результатам сканирующей электронной микроскопии и оценке размеров областей когерентного рассеяния на основании дифрактограммы, не является наноразмерным (рис. 1, 2). Синтезированный образец, по данным химического анализа, имеет состав Eu2Hf1.97O6.94 (величина индекса при кислороде рассчитана исходя из соотношения оксидов металлов). Как было показано ранее [18], такое отклонение от стехиометрического состава не может оказывать существенного влияния на величину молярной теплоемкости. Молярная масса, рассчитанная по рекомендациям [19], составила 772.9038 г/моль. Теплоемкость измеряли методом ДСК (STA 449 F1 Jupiter (Netzsch)), а термическое расширение – высокотемпературной рентгеновской порошковой дифракцией (ShimadzuX-raydiffractometer с высокотемпературной приставкой HA-1001) [20].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
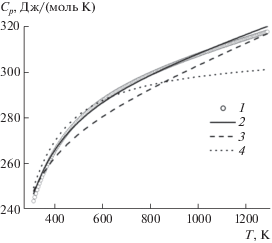
Теплоемкость гафната европия структурного типа пирохлора в интервале температур 298–1300 K, измеренная методом ДСК (рис. 3), хорошо описывается уравнением Майера–Келли [21]:
(1)
$\begin{gathered} C_{{p,m}}^{^\circ }(T,{\text{ Дж/(мол}}{{{\text{ь}}}^{{}}}{\text{K}})) = 284.08 + \\ + \,\,0.02836150T - {{4756428} \mathord{\left/ {\vphantom {{4756428} {{{T}^{2}}}}} \right. \kern-0em} {{{T}^{2}}}},\,\,\,\,{{R}^{2}} = {\text{ }}0.9998. \\ \end{gathered} $На температурной зависимости теплоемкости отсутствуют аномалии, связанные со структурными превращениями. На рис. 3 приведено сопоставление результатов по теплоемкости Eu2Hf2O7 в области 300–1300 K из различных источников: наши измерения (кривая 1), расчет по Нейману–Коппу из теплоемкостей Eu2O3 [22] и HfO2 [23] (кривая 2) и данные из работ [15] (кривая 3), [16] (кривая 4). Из рисунка видно, что кривые 1 и 2 очень близки, хотя оценка теплоемкости по Нейману–Коппу при 298.15 K (242.8 Дж/(моль K)) выше полученного нами экспериментального значения на 4.5 Дж/(моль K). Рассчитанные из данных изменения энтальпии значения теплоемкости (кривая 3) из [15] также близки к полученным нами (кривая 1). Результаты расчета теплоемкости (кривая 4) исходя из уравнения, приведенного в [16]:
(2)
$\begin{gathered} С_{p}^{^\circ }\left( Т \right) = 298.693 + 4.226 \times \\ \times \,\,{{10}^{{--3}}}T - 48.663 \times {{10}^{5}}{{Т}^{{--2}}}, \\ \end{gathered} $Термическое расширение гафната европия изучали методом высокотемпературной рентгеновской дифракции в интервале 298–1300 K путем определения температурной зависимости параметра а кубической решетки пирохлора (рис. 4, табл. 1). Термическое расширение гафната европия, как и ожидалось, носит положительный характер, общий вид которого подтверждает отсутствие структурных превращений в изученном интервале температур. Температурная зависимость параметра а удовлетворительно описывается линейным уравнением:
Рис. 4.
Температурная зависимость параметра а кристаллической решетки гафната европия структурного типа пирохлора (Fd3m): 1 – настоящая работа, 2 – уравнение (3), 3 – [24, 25], 4 – Gd2Hf2O7 [17].
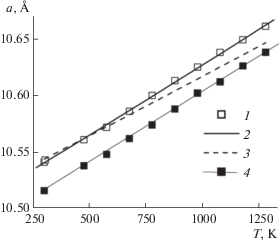
Таблица 1.
Температурные зависимости параметра кристаллической решетки (a), текущего коэффициента термического расширения (αT) и относительного термического расширения (TE) гафната европия структурного типа пирохлора, p = 101.3 кПа
| T, K | a, Å | αT × 10–6, K–1 | TE, % |
|---|---|---|---|
| 298 | 10.541 | 11.79 | 0 |
| 303 | 10.543 | 11.79 | 0.02 |
| 473 | 10.561 | 11.77 | 0.19 |
| 573 | 10.572 | 11.76 | 0.29 |
| 673 | 10.586 | 11.74 | 0.43 |
| 773 | 10.600 | 11.73 | 0.56 |
| 873 | 10.613 | 11.71 | 0.68 |
| 973 | 10.625 | 11.70 | 0.80 |
| 1073 | 10.638 | 11.69 | 0.92 |
| 1173 | 10.649 | 11.67 | 1.03 |
| 1273 | 10.661 | 11.66 | 1.14 |
Относительное линейное термическое расширение (ТЕ) описывается соотношением:
Температурные зависимости параметров кристаллических решеток гафнатов европия и гадолиния [17] (рис. 4, кривые 1 и 4) практически параллельны, что свидетельствует о близких величинах производных da(T)/dT и значениях относительных коэффициентов термического расширения α298 (K–1) = 11.79 × 10–6 и 11.75 × 10–6 соответственно. Температурные зависимости параметра кристаллической решетки, полученные нами и в работе [24] (рис. 4) в пределах 5%-ной погрешности совпадают, но рассчитанное относительное термическое расширение отличается от приведенного в [25] практически в 2 раза.
ЗАКЛЮЧЕНИЕ
Гафнат европия со структурой пирохлора синтезирован обратным осаждением и охарактеризован методами растровой электронной микроскопии, рентгенофазового и химического анализа. Проведены измерения молярной теплоемкости гафната европия методом дифференциальной сканирующей калориметрии (298–1300 K) и показано отсутствие аномалий, связанных со структурными превращениями в этом интервале температур. Методом высокотемпературной рентгеновской дифракции получена температурная зависимость параметра кубической решетки гафната европия (пирохлор) и оценены коэффициенты термического расширения. Показано, что относительные коэффициенты термического расширения гафнатов европия и гадолиния имеют практически одинаковые значения и постоянны в интервале температур 298–1273 K. Полученные результаты могут быть использованы для термодинамического моделирования процессов с участием Eu2Hf2O7, прогнозирования поведения высокотемпературных материалов на основе гафната европия в условиях коррозионно-активных сред и разработки новых технологий его получения.
Список литературы
Popov V.V., Menushenkov A.P., Zubavichus Ya.V. et al.// Russ. J. Inorg. Chem. 2015. V. 60. P. 602. [Попов В.В., Менушенков А.П., Зубавичус Я.В. и др. // Журн. неорган. химии. 2015. Т. 60. С. 672.]https://doi.org/10.1134/S0036023615050162
Andrievskaya E.R. // J. Eur. Ceram. Soc. 2008. V. 28. P. 2363. https://doi.org/10.1016/jeurceramsoc.2008.01.009
Scheidecker R.W., Wilder D.R., Moeller H. // J. Am. Ceram. Soc. 1977. V. 60. P. 501. https://doi.org/10.1111/j.1151-2916.1977.tb14092.x
Stanek C.R., Grimes R.W. // J. Am. Ceram. Soc. 2002. V. 85. P. 2139. https://doi.org/10.1111/j.1151-2916.2002.tb00423.x
Rushton M.J.D., Grimes R.W., Stanek C.R., Owens S. // J. Mater. Res. 2004. V. 19. P. 1603. https://doi.org/10.1557/JMR.2004.0231
Ewing R.C., Weber W.J., Lian J. // J. Appl. Phys. 2004. V. 95. P. 5949. https://doi.org/10.1063/1.1707213
Yamamura H. // Solid State Ionics. 2003. V. 158. P. 359. https://doi.org/10.1016/s0167-2738(02)00874-3
Shlyakhtina A.V., Shcherbakova L.G. // Solid State Ionics. 2011. V. 192. P. 200. https://doi.org/1016/j.ssi.2010.07.013
Cao X.Q., Vassen R., Stoever D. // J. Eur. Ceram. Soc. 2004. V. 24. P. 1. https://doi.org/1016/S0955-2219(03)00129-8
Mehboob G., Liu M.-J., Xu T. et al. // Ceram. Int. 2020. V. 46. P. 8497. https://doi.org/10.1016/j.ceramint.2019.12.200
Padture N.P. // Science. 2002. V. 296. P. 280. https://doi.org/10.1126/science.1068609
Costa G., Harder B.J., Wiesner V.L. et al. // J. Am. Ceram. Soc. 2019. V. 102. P. 2948. https://doi.org/10.1111/jace.16113
Fabrichnaya O., Seifert H.J. // J. Phase Equilibria and Diffusion. 2010. V. 32. P. 2. https://doi.org/10.1007/s11669-010-9815-4
López-Cota F.A., Cepeda-Sánchez N.M., Díaz-Guillén J.A. et al. // J. Am. Ceram. Soc. 2017. V. 100. P. 1994.https://doi.org/10.1111/jace.14712
Kandan R., Reddy B.P., Panneerselvan G., Mudali U.K. // J. Therm. Anal. Calorim. 2018. V. 131. P. 2687. https://doi.org/10.1007/s10973-017-6802-6
Babu R., Nagarajan K. // J. Alloys Compd. 1998. V. 265. P. 137. https://doi.org/10.1016/s0925-8388(97)00430-1
Guskov V.N., Tyurin A.V., Guskov A.V. et al. // Ceram. Int. 2020. V. 46. P. 12822. https://doi.org/10.1016/j.ceramint.2020.02.052
Gagarin P.G., Guskov A.V., Guskov V.N. et al. // Ceram. Int. 2021. V. 47. P. 2892. https://doi.org/10.1016/j.ceramint.2020.09072
Wieser M.E. // Pure Appl. Chem. 2006. V. 78. P. 2051. https://doi.org/10.1351/pac200678112051
Kolomiets T.Yu., Tel’nova G.B., Ashmarin A.A. et al. // Inorg. Mater. 2017. V. 53. P. 874. https://doi.org/10.7868/S0002337X17080152 [Коломиец Т.Ю., Тельнова Г.Б., Ашмарин А.А. и др. // Неорган. материалы. 2017. Т. 53. С. 890.]
Maier C.G., Kelley K.K. // J. Am. Chem. Soc. 1932. V. 54. P. 3243. https://doi.org/10.1021/ja01347a029
Konings R.J.M., Beneš O., Kovács O.A. et al. // J. Phys. Chem. Ref. Data. 2014. V. 43. № 1. P. 013101. https://doi.org/10.1063/1.4825256
Pankratz L.B. // U.S. Bureau of Mines Bulletin. 1982. V. 672. P. 188.
Kutty K.V.G., Rajagopalan S., Mathews C.K. et al. // Mater. Res. Bull. 1994. V. 29. P. 759. https://doi.org/10.1016/0025-5408(94)90201-1
Kutty K.V.G., Rajagolapan S., Asuvathraman R. // Thermochim. Acta. 1990. V. 168. P. 205. https://doi.org/10.1016/0040-6031(90)80639-G
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии