Журнал неорганической химии, 2021, T. 66, № 11, стр. 1561-1567
Синтез и кристаллическая структура трис-фенантролин кобальта(II/III) с различными полииодидными анионами
П. Калле a, b, С. И. Беззубов a, *
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
b Московский государственный университет им. М.В. Ломоносова,
Химический факультет
119991 Москва, Ленинские горы, 1, Россия
* E-mail: bezzubov@igic.ras.ru
Поступила в редакцию 14.04.2021
После доработки 29.05.2021
Принята к публикации 31.05.2021
Аннотация
Синтезирован и структурно охарактеризован перхлорат трис-фенантролин кобальта(II), а также аналогичные соли с полииодидными анионами. В кристаллах комплексные катионы упакованы посредством многочисленных C–H···π- и π···π-контактов, тогда как иодсодержащие анионы изолированы и взаимодействуют с π-системой ароматических лигандов. Спонтанное окисление трис-фенантролин кобальта(II) иодом приводит к кристаллическому продукту, содержащему трехзарядный комплексный катион, трииодид-анионы и молекулярный иод. В кристалле анионы и молекулы иода образуют каркас из атомов иода, выстроенный за счет галоген-галогеновых взаимодействий, тогда как комплексные катионы за счет контактов C–H⋅⋅⋅I и I⋅⋅⋅π удерживаются в этом каркасе и непосредственно друг с другом не взаимодействуют. Исследование проясняет природу взаимодействий, которые могут иметь место при работе сенсибилизированных красителем солнечных элементов, содержащих тандемные иодные и кобальтовые редокс-медиаторы.
ВВЕДЕНИЕ
С момента изобретения сенсибилизированных красителем солнечных элементов (Dye-Sensitized Solar Cells, DSSC) окислительно-восстановительная пара трииодид/иодид была предпочтительным медиатором (переносчиком электронов между фотоанодом и фотокатодом), обеспечивающим медленную рекомбинацию электронов и быструю регенерацию красителя [1]. Тем не менее ряд недостатков электролита на основе иода ограничивают производительность DSSC: коррозия металла фотокатода, сублимация иода, поглощение видимого света полииодидами, неподходящий для некоторых красителей окислительно-восстановительный потенциал пары ${{{\text{I}}_{3}^{ - }} \mathord{\left/ {\vphantom {{{\text{I}}_{3}^{ - }} {{{{\text{I}}}^{--}}}}} \right. \kern-0em} {{{{\text{I}}}^{--}}}}$ [2]. Среди медиаторов, не содержащих иода, наиболее перспективными являются полипиридиновые комплексы кобальта(II/III), редокс-потенциал которых можно тонко подстраивать, варьируя заместители в лигандах [3, 4]. Однако кобальтовые электролиты также не идеальны и их основные проблемы связаны с медленным массопереносом и неэффективным переносом заряда на фотокатоде [5, 6]. Удобный способ сочетать полезные свойства различных медиаторов и минимизировать их негативные эффекты – это стратегия тандемного электролита [7–9]. При конструировании ячеек с тандемным электролитом пару Co3+/Co2+ обычно комбинируют с кинетически быстрым медиатором [10–12], тогда как работу пары ${{{\text{I}}_{3}^{ - }} \mathord{\left/ {\vphantom {{{\text{I}}_{3}^{ - }} {{{{\text{I}}}^{--}}}}} \right. \kern-0em} {{{{\text{I}}}^{--}}}}$ оптимизируют путем добавления окислительно-восстановительной пары с потенциалом, достаточным для подавления образования ${\text{I}}_{3}^{ - },$ что сохраняет электролит бесцветным и увеличивает напряжение, создаваемое такой ячейкой [13, 14].
Удивительно, но лишь в одной работе кобальтовая и иодная редокс-пары были объединены в тандемный электролит [15]. Авторы зафиксировали увеличение эффективности работы ячейки на основе двойного электролита по сравнению с таковой для ячеек с однокомпонентным медиатором. Они предположили, что окислительно-восстановительная пара на основе кобальта действует преимущественно как восстанавливающий краситель агент (на фотоаноде), тогда как трииодид-иодидная пара работает на фотокатоде, причем из такой модели следует, что между электродами могут возникать градиенты концентрации компонентов.
Процессы в этой сложной системе трудно изучать в жидкой среде из-за высокой подвижности частиц. Представляется разумным проводить исследование кристаллических образцов, в которых при сохранении физической сущности процессов, происходящих в жидкости, удастся “заморозить” частицы и изучить межмолекулярные взаимодействия между ними с помощью рентгеноструктурного анализа [16].
В качестве объектов исследования были отобраны катионные трис-комплексы кобальта(II/III) с 1,10-фенантролином, которые кристаллизовали в виде солей из растворов, содержащих различные формы иода, с последующим изучением полученных кристаллов с помощью РСА и выявлением особенностей кристаллической упаковки. Учитывая, что, согласно Кембриджскому банку данных, существует только одна структурно охарактеризованная соль трис-фенантролин кобальта(II) с трииодид-анионом [17], дополнительные структурные данные представляют ценность для понимания природы взаимодействий между противоионами в этой системе.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Описание молекулярных структур комплексных катионов
Структуры перхлората, иодид-трииодида и трииодида трис-фенантролин кобальта(II) [Co(phen)3](ClO4)2, [Co(phen)3]I3I (соединение 1) и [Co(phen)3](I3)2 (соединение 2), а также тетра-иод трииодида трис-фенантролин кобальта(III) [Co(phen)3](I3)3 ⋅ 4I2 (соединение 3) содержат одинаковый по составу катион, в котором атом кобальта находится практически в идеальном октаэдрическом окружении, образованном шестью атомами азота трех молекул о-фенантролина. Межатомные расстояния Co–N приведены в табл. 1.
Таблица 1.
Межатомные расстояния Co–N (Å) в структурах [Co(phen)3](ClO4)2 и соединений 1–3 и их сравнение с данными Кембриджского банка (CSD)
| Структура | Co−N1 | Co−N2 | Co−N3 | Co−N4 | Co−N5 | Co−N6 | Среднее | Ст. откл. |
|---|---|---|---|---|---|---|---|---|
| [Co(phen)3](ClO4)2 | 2.146(4) | 2.122(4) | 2.130(4) | 2.134(4) | 2.143(4) | 2.150(4) | 2.138 | 0.011 |
| 1 | 2.130(3) | 2.140(3) | 2.133(3) | 2.141(3) | 2.138(3) | 2.120(3) | 2.134 | 0.008 |
| 2 | 2.133(2) | 2.127(2) | 2.151(2) | 2.143(2) | 2.124(2) | 2.121(2) | 2.133 | 0.012 |
| 3 | 1.950(5) | 1.948(5) | 1.946(5) | 1.939(5) | 1.950(5) | 1.944(5) | 1.946 | 0.004 |
| Co(+3)–N(phen), CSD | 1.940 | 0.008 | ||||||
| Co(+2)–N(phen), CSD | 2.134 | 0.010 |
Средние значения длин связей Co–N в двухзарядных катионах, входящих в состав структур исходного перхлората и соединений 1 и 2, находятся в хорошем согласии между собой, а также соответствуют значениям из Кембриджского банка для аналогичных комплексов. В структуре 3, содержащей трехзарядный катион, средняя длина связи Co–N также хорошо согласуется с литературными данными и почти на 0.2 Å меньше таковой в двухзарядных катионах, что объясняется уменьшением ионного радиуса кобальта при окислении до степени окисления +3.
Во всех четырех структурах три молекулы 1,10-фенантролина не испытывают стерического напряжения и демонстрируют плоскую геометрию. Меньший радиус Co(+3) по сравнению с Co(+2) приводит к тому, что в двухзарядных комплексных катионах углы NCoN, образованные каждым лигандом по отдельности, составляют не более 78.61(8)°, тогда как в трехзарядном катионе аналогичные углы лежат в диапазоне 84.3(2)°–84.8(2)°, что обеспечивает существование более правильного октаэдра для трехзарядного катиона.
Описание кристаллических упаковок
Перхлорат трис-фенантролин кобальта(II) гидрат. Комплексные катионы выстраиваются в плотные цепи вдоль оси с за счет совместного действия π···π- и C–H···π-взаимодействий (рис. 1). Цепи образуют слои в плоскости 0ac, в которых имеются небольшие карманы, содержащие анионы и молекулы воды, связанные с последними и между собой водородными связями. Оба перхлорат-аниона поворотно неупорядочены по двум позициям вдоль одной из связей Cl–O так, что разупорядоченные части анионов направлены в пространство между слоями, тем самым обеспечивая их более плотное прилегание вдоль оси b. Связь структурных единиц вдоль направлений a и b, по-видимому, достигается в основном за счет электростатического взаимодействия между противоионами.
Рис. 1.
Фрагменты кристаллической упаковки [Co(phen)3](ClO4)2 · 1.25H2O. Межмолекулярные контакты приведены в Å.
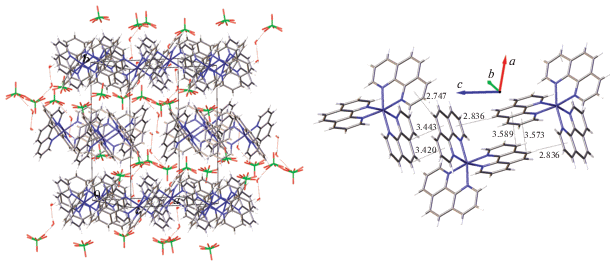
Соединение 1. Упаковка кристалла формируется за счет π···π- и C–H···π-контактов между соседними комплексными катионами, а также за счет многочисленных взаимодействий C–H⋅⋅⋅I и I⋅⋅⋅π (рис. 2). Молекулы ацетонитрила заполняют каналы, проходящие вдоль оси b.
Рис. 2.
Фрагменты кристаллической упаковки соединения 1 (молекулы растворителя не показаны): окружение три-иодид-аниона (слева), окружение иодида (справа). Эллипсоиды тепловых колебаний приведены с 50%-ной вероятностью. Межмолекулярные контакты приведены в Å.
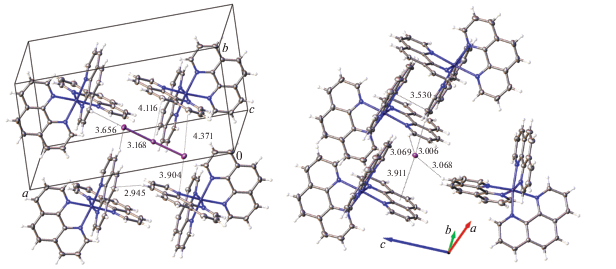
Соединение 2. Комплексные катионы формируют слои вдоль плоскости {011} за счет π···π- и C–H···π-взаимодействий. Анионы и молекулы ацетонитрила занимают межслоевое пространство и участвуют в формировании упаковки посредством C–H⋅⋅⋅I- и I⋅⋅⋅π-контактов (рис. 3).
Рис. 3.
Фрагменты кристаллической упаковки соединения 2 (молекулы растворителя не показаны): эллипсоиды тепловых колебаний приведены с 50%-ной вероятностью. Межмолекулярные контакты приведены в Å.
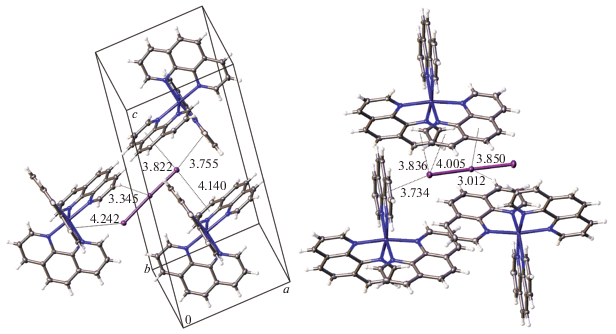
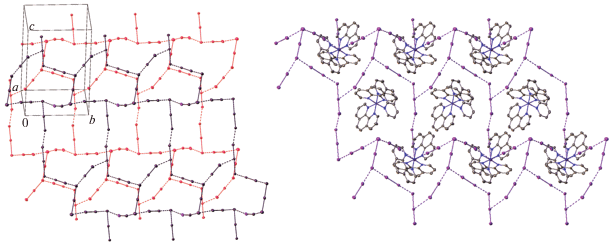
Соединение 3. Упаковка кристалла главным образом сформирована за счет галоген-галогеновых контактов между анионами трииодида, иодида и молекулами иода (dmin(I···I) = 3.179(2) Å). Иодсодержащие частицы объединены в зигзагообразные слои, находящиеся в плоскости 0bc и расположенные друг над другом со смещением (рис. 4). Слои образуют трехмерную иод-полииодидную сетку, в которой имеются ячейки, занятые не связанными друг с другом комплексными катионами, участвующими в многочисленных C–H⋅⋅⋅I- и I⋅⋅⋅π-контактах со структурными единицами иодполииодидной сетки.
Рис. 4.
Два иод-полииодидных слоя в структуре соединения 3 (слева) и расположение комплексных катионов [Co(phen)3]3+ относительно одного слоя (справа), атомы водорода не показаны. Эллипсоиды тепловых колебаний приведены с 50%-ной вероятностью.
Исходный комплекс – перхлорат трис-фенантролин кобальта(II) – синтезирован и охарактеризован с применением 1H ЯМР, РСА, РФА, ЦВА и УФ-спектроскопии (рис. С1–С7 , табл. С1–С3 ). Хотя данное соединение описано ранее [18–21], в настоящей работе выращены кристаллы его новой модификации, для которой установлена кристаллическая структура, сформированная из чередующихся слоев катионов и анионов. Впервые структура данного соединения уточнена с R-фактором ниже 7%. Комплекс демонстрирует обратимое окислительно-восстановительное поведение, отвечающее одноэлектронному процессу Co(phen)3]3+ ⇄ [Co(phen)3]2+ (рис. С6 ). В спектре поглощения комплекса интенсивные полосы в УФ-диапазоне обусловлены внутрилигандными электронными переходами, тогда как широкая полоса, частично регистрируемая в видимом диапазоне, отвечает переходам с переносом заряда; d–d-переходы не зафиксированы (рис. С7 ). В спектре протонного магнитного резонанса полученной соли наблюдаются сигналы в диапазоне от 17 до 109 м.д. (рис. С1), что типично для парамагнитных комплексов кобальта(II) [22, 23]. При окислении этой соли перекисью водорода слабопольные сигналы исчезают и возникают сигналы в районе 7–10 м.д. (рис. С2), характерные для диамагнитных комплексов кобальта(III), что подтверждает полноту окисления.
Взаимодействие перхлората трис-фенантролин кобальта(II) с раствором трииодид-иодидного электролита в ацетонитриле (C(I–)/C(I2) = 10/1) приводит к образованию кристаллической соли [Co(phen)3](I3)I · CH3CN (соединение 1), содержащей небольшую примесь соли [Co(phen)3](I3)2 · · CH3CN (соединение 2). Ожидаемо, что трис-фенантролин кобальта(III), обладающий редокс-потенциалом 0.64 В отн. СВЭ в ацетонитриле, реагирует с аналогичным электролитом (E(${{{\text{I}}_{3}^{ - }} \mathord{\left/ {\vphantom {{{\text{I}}_{3}^{ - }} {{{{\text{I}}}^{--}}}}} \right. \kern-0em} {{{{\text{I}}}^{--}}}}$) = 0.35 В отн. СВЭ), окисляя не связанный в комплекс иодид и давая соединение 1.
В кристалле соединения 1 упаковка сформирована главным образом за счет взаимодействий между комплексными катионами, тогда как изолированные иодсодержащие частицы занимают пустоты и дают контакты с π-системой лигандов. В отличие от этого кристаллическая упаковка соединения 2 (имеющего изоструктурный аналог [Fe(phen)3](I3)2 · H2O [24]) близка к таковой для исходного перхлората и содержит слои из анионов и молекул ацетонитрила, уложенные между слоями из комплексных катионов. Кратчайшее расстояние I···I между соседними трииодидами, составляющее 4.2574(3) Å, не позволяет говорить о наличии каких-либо более крупных полииодидных образований в данной структуре (по данным [25], существенными взаимодействиями между атомами иода являются те, для которых межатомные расстояния не превышают 4.0 Å – удвоенный ван-дер-ваальсов радиус иода).
В ацетонитриле иод может существовать в виде радикалов, причем редокс-потенциал пар ${{{\text{I}}_{2}^{{\centerdot - }}} \mathord{\left/ {\vphantom {{{\text{I}}_{2}^{{\centerdot - }}} {{{{\text{I}}}^{--}}}}} \right. \kern-0em} {{{{\text{I}}}^{--}}}}$ и I•/I− гораздо выше редокс-потенциала пары ([Co(phen)3]3+/[Co(phen)3]2+ [26]. Именно поэтому в соединении 3, полученном при использовании растворов нейтрального иода, кобальт окислен до с.о. +3, что подтверждается не только РСА (табл. 1), но и спектром протонного магнитного резонанса, полностью аналогичным спектру [Co(phen)3](ClO4)3.
Наличие свободного иода оказывает существенное воздействие и на кристаллическую упаковку соединения 3, где за счет галоген-галогеновых контактов формируется трехмерная иод-полииодидная структура, в которой симметричные практически сферические катионы занимают пустоты и непосредственно между собой не взаимодействуют.
Анализ межмолекулярных взаимодействий в кристаллах соединений 1–3 может быть полезным для построения модели, описывающей совместную работу кобальтового и иодного медиаторов в DSSC. При этом ключевую роль играет взаимодействие между компонентами ячейки в приэлектродном пространстве близи фотоанода (мезопористый диоксид титана с нанесенным на него красителем), поскольку именно здесь происходят основные “паразитные” процессы рекомбинации заряда, приводящие к уменьшению эффективности [27, 28].
При использовании тандемного электролита после поглощения света и передачи электрона в зону проводимости полупроводника окисленная молекула красителя (D+) может быть восстановлена как иодидом, так и комплексом кобальта(II) согласно уравнениям реакций в ионной форме:
1) $2{{{\text{D}}}^{ + }} + 2{{{\text{I}}}^{ - }} = 2{{{\text{D}}}^{0}} + {{{\text{I}}}_{2}};{\text{ }}{{{\text{I}}}_{2}} + {{{\text{I}}}^{ - }} = {\text{I}}_{3}^{ - },$
2) ${{{\text{D}}}^{ + }} + {{\left[ {{\text{Co}}{{{\left( {{\text{phen}}} \right)}}_{3}}} \right]}^{{2 + }}} = {{{\text{D}}}^{0}} + {{\left[ {{\text{Co}}{{{\left( {{\text{phen}}} \right)}}_{3}}} \right]}^{{3 + }}}.$
Если опираться на предложенную авторами [15] модель, то в прианодном пространстве преимущественно протекает реакция (2), вследствие чего там накапливается [Co(phen)3]3+, далее восстанавливаемый иодидом, переходящим, в свою очередь, в трииодид, диффундирующий к фотокатоду для восстановления:
3) $2{{\left[ {{\text{Co}}{{{\left( {{\text{phen}}} \right)}}_{{\text{3}}}}} \right]}^{{3 + }}} + 3{{{\text{I}}}^{ - }} = 2{{\left[ {{\text{Co}}{{{\left( {{\text{phen}}} \right)}}_{3}}} \right]}^{{2 + }}} + {\text{I}}_{3}^{ - },$
4) ${\text{I}}_{3}^{ - } + 2{{\bar {e} }} = 3{{{\text{I}}}^{ - }}\left( {{\text{на фотокатоде}}} \right).$
Соединения 1 и 2 отвечают такой модели и демонстрируют “замороженное” состояние, образующееся после реакции (3).
При условии, что концентрации компонентов в тандемном электролите сопоставимы, трудно ожидать, что комплекс кобальта будет концентрироваться в прианодном пространстве, тогда как трииодид – в прикатодном, как предполагают авторы [15]. Во всяком случае, допустима модель с альтернативным распределением компонентов, при котором протекает цепочка превращений:
5) ${{{\text{D}}}^{ + }} + {{{\text{I}}}^{ - }} = {{{\text{D}}}^{0}} + {{{\text{I}}}^{ \bullet }},$
6) ${{{\text{D}}}^{ + }} + 2{{{\text{I}}}^{ - }} = {{{\text{D}}}^{0}} + {\text{I}}_{2}^{{ \bullet - }},$
7) 2I• = I2,
8) ${{{\text{I}}}^{ \bullet }} + {{{\text{I}}}_{2}} + {\text{ }}{{\left[ {{\text{Co}}{{{\left( {{\text{phen}}} \right)}}_{{\text{3}}}}} \right]}^{{2 + }}} = {\text{I}}_{3}^{ - } + {{\left[ {{\text{Co}}{{{\left( {{\text{phen}}} \right)}}_{{\text{3}}}}} \right]}^{{3 + }}},$
9) ${\text{I}}_{2}^{{ \bullet - }} + 2{{{\text{I}}}_{2}} + {{[{\text{Co}}{{\left( {{\text{phen}}} \right)}_{{\text{3}}}}]}^{{2 + }}} = 2{\text{I}}_{3}^{ - } + {{[{\text{Co}}{{\left( {{\text{phen}}} \right)}_{{\text{3}}}}]}^{{3 + }}}.$
В ячейке образование иодсодержащих радикалов вызвано тем, что стандартные красители имеют редокс-потенциал около 1 В отн. СВЭ, и иодид может окисляться до более высокоэнергетических частиц [29]. Учитывая очень высокую площадь поверхности мезопористого диоксида титана и, соответственно, высокую концентрацию красителя на нем [27], можно ожидать, что содержание иода, не связанного в трииодид, в приповерхностном слое может в несколько раз, если не на порядки, превышать таковое в объеме электролита. Поэтому модель, иллюстрируемая реакциями (5)–(9), также представляется состоятельной, тогда как соединение 3 отвечает одному из состояний тандемного электролита, допустимого в рамках этой модели. Кроме того, образование полииодидов большего, чем трииодид, размера и даже протяженных полииодидных цепей в приэлектродном пространстве также возможно (что подчеркивается авторами [30, 31]), причем это объясняло бы механизм переноса заряда в ячейке, особенно учитывая способность полииодидных цепей проводить электрический ток [32–35].
ЗАКЛЮЧЕНИЕ
Получены и структурно охарактеризованы три соли трис-фенантролин кобальта(II) с перхлоратом, иодидом и трииодидом в качестве анионов, а также соль трис-фенантролин кобальта(III), содержащая анионы трииодида и нейтральные молекулы иода. Установлено, что в растворе стандартного иодного электролита для DSSC (доминирующая форма – трииодид) может существовать двухзарядный комплексный катион [Co(phen)3]2+, тогда как присутствие свободного иода в системе приводит к окислению кобальта до степени окисления +3. В кристаллах солей кобальта(II) комплексные катионы взаимодействуют посредством многочисленных C–H···π- и π···π-контактов, тогда как иодсодержащие частицы изолированы и взаимодействуют с π-системой ароматических лигандов. Упаковка соли кобальта(III), напротив, сформирована главным образом за счет галоген-галогеновых контактов между трииодидами и молекулярным иодом, а катионы занимают пустоты в полииодидном каркасе и непосредственно между собой не взаимодействуют. Полученные данные позволяют предполагать значительную роль полииодидных цепей в переносе заряда в DSSC.
Список литературы
Boschloo G., Hagfeldt A. // Acc. Chem. Res. 2009. V. 42. № 11. P. 1819. https://doi.org/10.1021/ar900138m
Wu J., Lan Z., Lin J. et al. // Chem. Rev. 2015. V. 115. № 5. P. 2136. https://doi.org/10.1021/cr400675m
Sapp S.A., Elliott C.M., Contado C. et al. // J. Am. Chem. Soc. 2002. V. 124. № 37. P. 11215. https://doi.org/10.1021/ja027355y
Nusbaumer H., Zakeeruddin S.M., Moser J.E. et al. // Chem. – A Eur. J. 2003. V. 9. № 16. P. 3756. https://doi.org/10.1002/chem.200204577
Moser J., Zakeeruddin S.M., Nazeeruddin M.K. et al. // J. Phys. Chem. B. 2001. V. 105. P. 10461. https://doi.org/10.1021/jp012075a
Klahr B.M., Hamann T.W. // J. Phys. Chem. C 2009. V. 113. № 31. P. 14040. https://doi.org/10.1021/jp903431s
Baillargeon J., Xie Y., Hamann T.W. // ACS Appl. Mater. Interfaces. 2017. V. 9. № 39. P. 33544. https://doi.org/10.1021/acsami.7b01626
Li C.T., Lee C.P., Lee C.T. et al. // ChemSusChem. 2015. V. 8. № 7. P. 1244. https://doi.org/10.1002/cssc.201403204
Cho W., Song D., Lee Y.G. et al. // J. Mater. Chem. A. 2013. V. 1. № 2. P. 233. https://doi.org/10.1039/c2ta00719c
Cazzanti S., Caramori S., Argazzi R. et al. // J. Am. Chem. Soc. 2006. V. 128. № 31. P. 9996. https://doi.org/10.1021/ja062087f
Hao Y., Yang W., Zhang L. et al. // Nat. Commun. 2016. V. 7. № 1. P. 13934. https://doi.org/10.1038/ncomms13934
Caramori S., Husson J., Beley M. et al. // Chem. – A Eur. J. 2010. V. 16. № 8. P. 2611. https://doi.org/10.1002/chem.200902761
Cong J., Yang X., Hao Y. et al. // RSC Adv. 2012. V. 2. № 9. P. 3625. https://doi.org/10.1039/c2ra20310c
Chu T.C., Lin R.Y.Y., Lee C.P. et al. // ChemSusChem. 2014. V. 7. № 1. P. 146. https://doi.org/10.1002/cssc.201301015
Cong J., Hao Y., Sun L. et al. // Adv. Energy Mater. 2014. V. 4. № 8. P. 1. https://doi.org/10.1002/aenm.201301273
Tuikka M., Hirva P., Rissanen K. et al. // Chem. Commun. 2011. V. 47. № 15. P. 4499. https://doi.org/10.1039/c1cc10491h
Tershansy M.A., Goforth A.M., Smith M.D. et al. // Acta Crystallogr., Sect. E: Struct. Reports Online. 2005. V. 61. № 9. P. M1680. https://doi.org/10.1107/S1600536805023883
Boys D., Escobar C., Wittke O. // Acta Crystallogr., Sect. C: Cryst. Struct. Commun. 1984. V. 40. № 8. P. 1359. https://doi.org/10.1107/s0108270184007964
Chen X., Zhang D. // Z. Kristallogr. – New Cryst. Struct. 2014. V. 229. № 3. P. 247. https://doi.org/10.1515/ncrs-2014-0125
England J., Bill E., Weyhermüller T. et al. // Inorg. Chem. 2015. V. 54. № 24. P. 12002. https://doi.org/10.1021/acs.inorgchem.5b02415
Avdeeva V.V., Vologzhanina A.V., Goeva L.V. et al. // Inorg. Chim. Acta. 2015. V. 428. P. 154. https://doi.org/10.1016/j.ica.2014.12.029
Brisig B., Constable E.C., Housecroft C.E. // New J. Chem. 2007. V. 31. № 8. P. 1437. https://doi.org/10.1039/b707601k
Symes M.D., Wilson C. // Supramol. Chem. 2018. V. 30. № 9. P. 742. https://doi.org/10.1080/10610278.2017.1373195
Horn C., Berben L., Chow H. et al. // CrystEngComm. 2002. V. 4. № 2. P. 7. https://doi.org/10.1039/B109311H
Svensson P.H., Kloo L. // Chem. Rev. 2003. V. 103. № 5. P. 1649. https://doi.org/10.1021/cr0204101
Gajardo F., Loeb B. // J. Chil. Chem. Soc. 2011. V. 56. № 2. P. 697. https://doi.org/10.4067/S0717-97072011000200016
Teuscher J., Marchioro A., Andrès J. et al. // J. Phys. Chem. C / 2014. V. 118. № 30. P. 17108. https://doi.org/10.1021/jp501481c
Saygili Y., Stojanovic M., Flores-Díaz N. et al. // Inorganics. 2019. V. 7. № 3. P. 30. https://doi.org/10.3390/inorganics7030030
Hagfeldt A., Boschloo G., Sun L. et al. // Chem. Rev. 2010. V. 110. № 11. P. 6595. https://doi.org/10.1021/cr900356p
Mao Z., Ye Y., Lv H. et al. // Angew. Chem. Int. Ed. 2020. V. 59. № 27. P. 10780. https://doi.org/10.1002/anie.201915824
Wang H., Zhang X., Gong F. et al. // Adv. Mater. 2012. V. 24. № 1. P. 121. https://doi.org/10.1002/adma.201103785
Madhu S., Evans H.A., Doan-Nguyen V.V.T. et al. // Angew. Chem. Int. Ed. 2016. V. 55. № 28. P. 8032. https://doi.org/10.1002/anie.201601585
Starikov E.B. // Int. J. Quantum Chem. 1997. V. 64. № 4. P. 473.
Lamberts K., Handels P., Englert U. et al. // CrystEngComm. 2016. V. 18. № 21. P. 3832. https://doi.org/10.1039/C6CE00396F
Bartashevich E.V., Yushina I.D., Stash A.I. et al. // Cryst. Growth Des. 2014. V. 14. № 11. P. 5674. https://doi.org/10.1021/cg500958q
Дополнительные материалы
- скачать ESM.docx
- Содержание:
1. Экспериментальная часть
2. Спектры 1H ЯМР
3. Рентгеновские данные
4. Данные циклической вольтамперометрии
5. Данные УФ-спектроскопии
Инструменты
Журнал неорганической химии


