Журнал неорганической химии, 2021, T. 66, № 12, стр. 1770-1778
Исследование условий глицин-нитратного синтеза шпинели NiCo2O4
В. Д. Журавлев a, А. В. Дмитриев a, Е. В. Владимирова a, *, И. М. Гиниятуллин a, Д. И. Переверзев a, Е. А. Шерстобитова b
a Институт химии твердого тела УрО РАН
620990 Екатеринбург, ул. Первомайская, 91, Россия
b Институт физики твердого тела УрО РАН
620990 Екатеринбург, ул. С. Ковалевской, 18, Россия
* E-mail: Vladimirova@ihim.uran.ru
Поступила в редакцию 28.04.2021
После доработки 31.05.2021
Принята к публикации 01.06.2021
Аннотация
Исследовано влияние содержания глицина (ϕ) и температуры отжига на фазовый состав и морфологию образцов при получении шпинели NiCo2O4 в реакциях Solution Combustion Synthesis. Основной фазой при малом содержании глицина в прекурсоре является оксид никеля-кобальта, при ϕ ≥ 0.7 в образцах дополнительно образуется металлический никель, и только при ϕ ≥ 1.4 начинается формирование шпинелей NixCo3 –xO4, где x < 1. Состав с максимальным содержанием никеля (Ni0.72Co2.22O4) получен при ϕ = 2.2. Увеличение температуры отжига от 400 до 700°С сопровождается уменьшением доли никеля в кристаллической решетке шпинели NixCo3 –xO4 до x = 0.07–0.13 и увеличением его содержания в образцах двойного оксида.
ВВЕДЕНИЕ
Оксиды d-металлов обладают многоуровневой кристаллической структурой и способностью менять степени окисления, поэтому двойные и тройные оксидные комбинации на основе оксидов кобальта, никеля, марганца, меди, цинка, железа и т.п. широко исследуются для создания суперконденсаторов, анодов литий-ионных аккумуляторов и других электрохимических накопителей энергии [1–6]. Электрохимическое поведение оксидов, псевдоемкостное по своей природе, из-за сильно обратимых поверхностных химических реакций или чрезвычайно быстрого обратимого интеркалирования решетки весьма чувствительно как к сочетанию различных типов катионов, их способности к перемене степени окисления, так и к методу синтеза, определяющему морфологию, размерность, пористость, удельную поверхность данных материалов [7–9].
Среди оксидных материалов никель-кобальтовая шпинель NiCo2O4 наиболее перспективна для применения в качестве суперконденсаторов [5]. Кроме превосходной электропроводности и высокой электрохимической активности это соединение обладает доступностью, низкой стоимостью и экологической безопасностью [10]. Однако формульный состав шпинели изменяется с увеличением температуры отжига (синтеза) от NiCo2O4 в области 400°С (содержание никеля в составе шпинели уменьшается) до формирования твердого раствора в системе NiO–CoO при температурах выше 800°C [11].
Синтез шпинелей ведут различными способами, например золь-гель методом [6], реализуемым либо в коллоидном, либо в полимерном или алкоксидном варианте. Это эффективный метод, дающий гомогенные многокомпонентные металлооксидные материалы. Так, в [9] сообщалось о золь-гель синтезе кубического NiCo2O4 при использовании в качестве хелатирующего лиганда лимонной кислоты, а в качестве растворителя N,N-диметилформамида и воды. Авторами [9] были получены субмикронные и нанопорошки шпинели в виде кораллов.
Гидротермальный метод [12–17] обеспечивает контролируемое выпадение осадка синтезируемого материала за счет взаимодействия с водяным паром. В результате из пересыщенного раствора формируются центры зародышеобразования, на которых происходит агрегирование частиц в качестве наноструктуры будущего соединения. Например, пористые гексагональные нанопластинки NiCo2O4 диаметром 100 нм и толщиной 25 нм были выращены в работе [14] с использованием гексадецилтриметиламмоний бромида. Материал продемонстрировал емкость 294 Ф/г при текущей плотности 1 A/г с циклической стабильностью 89.8% после 2200 циклов. Поверхность BET образцов NiCo2O4 с мезопорами достигала в максимуме 67.08 м2/г.
Химическое осаждение − очень простой, крупномасштабный и недорогой метод приготовления композитов и легированных материалов. Например, в работе [15] пористый NiCo2O4 был получен методом вспомогательного осаждения с этилендиаминтетрауксусной кислотой и полиэтиленимином. Материал с иерархической пористой сетью наночастиц показал емкость 587 Ф/г при 2 A/г и до 518 Ф/г при 16 A/г.
Для получения нанопорошков кубических шпинелей часто используют метод solution combustion synthesis (SCS) [18–28]. Так, авторы [18] получили (Ni0.35Co0.92Mn1.72)O4, нагревая растворы нитратов никеля, кобальта и марганца с лимонной кислотой в мольном соотношении нитратов и лимонной кислоты 1 : 1. После добавления аммиака до рН 6 и нагревания раствор переходит в золь при 80°С, а при 130°С формирует коричневый гель, который после нагревания до 300°С полностью переходит в сухой порошок. Отжиг в интервале 400–900°С показал, что тетрагональная фаза соединения выше 600°С переходит в кубическую шпинель с размером частиц (по Шереру) 20–40 нм.
В настоящей работе исследована возможность получения методом SCS кубической шпинели NiCo2O4 из раствора нитратов никеля и кобальта с глицином, морфология и фазовый состав материалов, получаемых при различном содержании глицина, а также влияние температуры отжига на стабилизацию и распад структуры шпинели.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве исходных реагентов использовали кристаллогидраты нитратов кобальта Co(NO3)2 ⋅ ⋅ 6H2O и никеля Ni(NO3)2 ⋅ 6H2O марки “х. ч.” (Россия, НПФ “Балтийская мануфактура”) и аминоуксусную кислоту C2H5NO2 (глицин) квалификации “х. ч.” (ООО “ВитаХим”). Для экспериментов готовили рабочий раствор исходных солей в дистиллированной воде из расчета на получение 93.2 г шпинели из 1 л раствора. Для проведения эксперимента 50 мл рабочего раствора (получение 4.66 г NiСo2O4) помещали в жаростойкий стеклянный стакан (реактор) объемом 300 мл. В раствор вносили соответствующее количество глицина (табл. 1) в интервале значений ϕ от 0.5 до 2.2. Стакан нагревали на электрической плите с температурой поверхности 400°С. Ниже приведено теоретическое уравнение SCS для ϕ = 1:
(1)
$\begin{gathered} 2{\text{Co}}{{\left( {{\text{N}}{{{\text{O}}}_{{\text{3}}}}} \right)}_{2}} + {\text{Ni}}{{\left( {{\text{N}}{{{\text{O}}}_{{\text{3}}}}} \right)}_{2}} + 3.33{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{5}}}}{\text{N}}{{{\text{O}}}_{2}} + \\ + \,\,0.5{{{\text{O}}}_{2}} = {\text{NiС}}{{{\text{o}}}_{{\text{2}}}}{{{\text{O}}}_{4}} + 6.66{\text{C}}{{{\text{O}}}_{2}} + \\ + \,\,8.332{{{\text{H}}}_{{\text{2}}}}{\text{O}} + 4.665{{{\text{N}}}_{2}}. \\ \end{gathered} $Таблица 1.
Количество прекурсора (mp), полученное в опытах
| Параметр | Номер образца | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | |
| ϕ | 0.5 | 0.6 | 0.7 | 0.8 | 0.9 | 1.0 | 1.2 | 1.4 | 1.6 | 1.8 | 2.0 | 2.2 |
| mp, г | 2.00 | 1.26 | 0.58 | 0.78 | 2.15 | 3.15 | 3.94 | 4.52 | 5.00 | 5.54 | 5.06 | 4.59 |
Полученные прекурсоры перетирали в агатовой ступке и отжигали при 400, 600 и 700°С.
Фазовый состав полученного продукта определяли при комнатной температуре методом рентгеновской дифракции с помощью дифрактометра Shimadzu XRD-7000 (CuKα-излучение, 2θ = = 5°–70°, шаг 0.03°). Для идентификации фаз использовали базу порошковых стандартов PDF2 (ICDD, USA, Release 2016). Параметры кристаллической структуры продуктов определяли методом полнопрофильного анализа Ритвельда с использованием программы Fullprof [29]. Морфологию и микроструктуру полученных порошков исследовали методом сканирующей электронной микроскопии с помощью электронного микроскопа Jeol JSM 6390 LA.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Для глицин-нитратного процесса или в целом для всех процессов SCS авторы [19] сформулировали общие характерные положения. В частности, адиабатические температуры горения достигают максимума в реакционных смесях со стехиометрическим отношением топливо : окислитель (глицин : нитрат), принято обозначение ϕ = 1. Область концентрации топлива c ϕ < 1 – область окислительного горения, а область ϕ >1 – область восстановительного горения. Температуры горения в этих областях снижаются с увеличением отклонения ϕ от 1. Это неоднократно подтверждалось экспериментально. Граница самоподдерживающегося процесса горения зависит от характеристик компонентов реакционного раствора. Обычно экзотермический процесс взаимодействия глицина с нитратными группами начинает доминировать над процессом термолиза нитратов металлов примерно при ϕ = 0.4–0.6. Он протекает в виде волны тления, проходящей по массе высыхающего раствора, а по мере увеличения содержания топлива (глицина) экзотермический процесс переходит в горение по типу самораспространяющегося синтеза. Увеличение содержания топлива в реакционном растворе больше ϕ = 1.1–1.5 затрудняет доступ внешнего кислорода в зону реакции, количества внутреннего окислителя становится недостаточно для полной деструкции и окисления органического компонента. В прекурсорах после горения остаются фрагменты топлива, которые снижают температуру процесса и в дальнейшем требуют отжига при температурах выше 400–500°С для их удаления.
Синтез оксидов d-металлов с глицином из нитратных растворов – процесс, в котором при ϕ = 1 развиваются достаточно высокие температуры. В области окислительного горения (ϕ = = 0.5–0.9) превращение полувысохшего геля начинается без открытого пламени в виде волны перехода в порошок с активным выносом мелких частиц порошка за пределы реактора (рис. 1а), унос возрастает от 57 до 87% от теоретического выхода материала для образцов с ϕ = 0.5–0.9 (табл. 1). Очаги невысокого горения расположены по фронту волны превращения, увеличиваясь при ϕ = 0.8–0.9. Отходящие газы не имеют рыжей окраски, характерной для оксидов азота.
Рис. 1.
SCS NiCo2O4 при ϕ = 0.5 (а); начало реакции при ϕ = 1.2 (б), окончание реакции при ϕ = 1.2−2.2 (в).

Реакции горения при ϕ = 1.0–2.2 протекают более спокойно, температура горения, достигая максимума при ϕ = 1, постепенно снижается с увеличением содержания глицина в исходном растворе. Типичное поведение – гелирование раствора с увеличением объема в 4–5 раз, формирование ксерогеля и возгорание. Превращение в области ϕ = 1.0–2.2 сопровождается ярким оранжевым пламенем (рис. 1б), его высота постепенно уменьшается от 50 до 20 см, переходя в режим каления с увеличением ϕ (рис. 1в).
С увеличением содержания глицина время реакции возрастает от 20 с (ϕ = 1) до 1 мин (ϕ = 2.2). В опытах 9–12 окислительно-восстановительные процессы идут спокойно, без выброса материала из реактора, масса прекурсора превышает теоретическое значение (табл. 1) из-за наличия фрагментов несгоревшего восстановителя. Прекурсоры, полученные с ϕ = 1–2.2, представляют собой порошки серого цвета, взаимодействующие с магнитом, что объясняется присутствием в нем частиц порошка металлического никеля [27].
Наличие неравновесных примесных и аморфных фаз в порошках прекурсоров не позволяет точно определить содержание фаз в образцах после SCS. Формульный состав твердых растворов шпинелей NixCo3 –xO4 и двойных оксидов NiyCo1 –yO оценивали по уравнениям изменения параметров твердых растворов:
(2)
$a({\text{N}}{{{\text{i}}}_{x}}{\text{C}}{{{\text{o}}}_{3}}_{{--x}}{{{\text{O}}}_{4}}) = 0.37231x + 8.0813\,\,({\text{{\AA}}}),$(3)
$a({\text{N}}{{{\text{i}}}_{y}}{\text{C}}{{{\text{o}}}_{1}}_{{--y}}{\text{O}}) = --0.0828y + 4.2581\,\,({\text{{\AA}}}),$Таблица 2.
Фазовый состав прекурсоров после SCS
| Образец №/ϕ |
NixCo3–xO4 | Ni* | NiyCo1–yO | ||
|---|---|---|---|---|---|
| NixCo3–xO4 | a, Å | Ni1–yCoyO | a, Å | ||
| 1/0.5 | – | – | – | Ni0.52Сo0.48O | 4.215(2) |
| 2/0.6 | – | – | – | Ni0.39Co0.61O | 4.226(1) |
| 3/0.7 | – | – | + | Ni0.38Co0.62O | 4.229(1) |
| 4/0.8 | – | – | + | Ni0.38Co0.62O | 4.229(1) |
| 5/0.9 | – | – | + | Ni0.33Co0.67O | 4.231(1) |
| 6/1.0 | – | – | + | Ni0.17Co0.83O | 4.244(1) |
| 7/1.2 | – | – | + | Ni0.48Co0.52O | 4.218(1) |
| 8/1.4 | Ni0.28Co2.72O4 | 8.093(3) | + | Ni0.46Co0.54O | 4.220 (1) |
| 9/1,6 | Co3O4** | 8.072(2) | + | Ni0.47Co0.53O | 4.219(1) |
| 10/1.8 | Ni0.28Co2.72O4 | 8.093(2) | + | Ni0.47Co0.53O | 4.219(1) |
| 11/2.0 | Ni0.30Co2.70O4 | 8.094(1) | + | Ni0.51Co0.49O | 4.217(1) |
| 12/2.2 | Ni0.72Co2.22O4 | 8.112(2) | + | Ni0.46 Co0.54O | 4.220(1) |
Рис. 2.
Дифрактограммы прекурсоров образцов 1 (ϕ = 0.5), 3 (ϕ = 0.7), 6 (ϕ = 1.0), 8 (ϕ = 1.4), 10 (ϕ = 1.8).
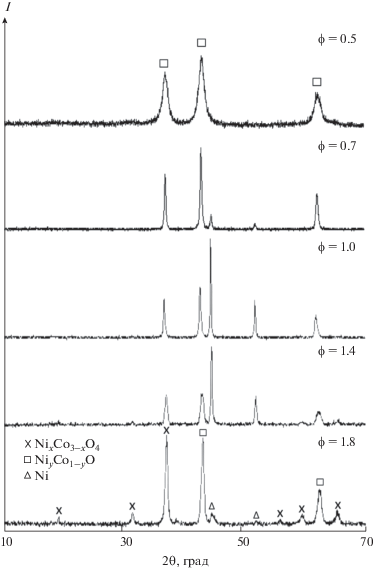
Образцы прекурсоров, полученные в области окислительного (ϕ = 0.5 и 0.7) и объемного горения (ϕ = 1.0) представляют собой дискретные субмикронные порошки практически не соединенных в агрегаты частиц (рис. 3а, 3б, 3в). С увеличением содержания глицина агрегаты укрупняются, частицы материала в них уплотняются, а увеличение содержание металлического никеля в области восстановительного горения способствует формированию агрегатов на базе протяженных сеток из монолитных и крупных (>2–3 мкм) частиц металлического никеля (рис. 3г).
С целью получения монофазных и равновесных образцов был проведен отжиг (6 ч для удаления несгоревших углеродсодержащих фрагментов глицина с последующей перешихтовкой и 2 раза по 10 ч с перешихтовкой для кристаллизации материала) при 400°С образцов 1–5. В табл. 3 представлены параметры кристаллических ячеек, состав и количество (мас. %) фаз, входящих в состав образцов по данным РФА (рис. 4).
Таблица 3.
Параметры кристаллических ячеек, содержание и состав фаз в образцах 1–5 после отжига при 400°С
| Образец №/ϕ | NiхCo3–xO4 | NiyCo1–yO | ||||
|---|---|---|---|---|---|---|
| мас. % | NixCo3–xO4 | a, Å | мас. % | NiyCo1–yO | a, Å | |
| 1/0.5 | 88 | Ni0.28Co2.72O4 | 8.093(1) | 12 | Ni0.87Co0.17O | 4.185(1) |
| 2/0.6 | 85 | Ni0.44Co2.56O4 | 8.099(1) | 15 | Ni0.97Co0.03O | 4.178(1) |
| 3/0.7 | 70 | Ni0.47Co2.53O4 | 8.101(1) | 17 13 |
Ni0.96Co0.04O Х-фаза |
4.173(1) 4.084(1) |
| 4/0.8 | 68 | Ni0.46Co2.54O4 | 8.100(1) | 13 19 |
Ni0.87Co0.17O Х-фаза |
4.173(1) 4.084(1) |
| 5/0.9 | 66 | Ni0.38Co2.62O4 | 8.097(1) | 24 9 |
Ni0.92Co0.08O Х-фаза |
4.182(1) 4.083(1) |
После отжига порошков при 400°С средняя массовая доля шпинельной фазы в образцах достигала 66–88 мас. %, доля никеля в кристаллической решетке шпинелей NixCo3 –xO4 была в пределах x = 0.28–0.47. Второй фазой являлся твердый раствор NiyCo1 –yO с y = 0.04–0.24, поэтому можно предположить, что имеет место диффузия катионов кобальта из аморфного оксида кобальта в кристаллическую решетку шпинели и двойного оксида никеля-кобальта. Кроме того, часть образцов содержала также третью фазу с кубической кристаллической решеткой (а = 4.083–4.084 Å). Возможно, это дефектный оксид никеля, появляющийся в результате незавершенного окисления никеля металлического, присутствующего в прекурсорах, полученных при ϕ = 0.7–0.9.
Морфология и размеры отожженных при 400°С образцов практически не изменяются (рис. 5), что указывает на близость температуры процесса SCS к 400°С.
Металлический никель в образцах 6–12 после отжига в течение 5 ч при 600°С полностью окисляется, и его катионы диффундируют в кристаллические решетки шпинели и двойного оксида. Поскольку выше 400°С NiCo2O4 нестабилен [11], доля никеля уменьшается при повышении температуры отжига (усредненная формула шпинели Ni0.22Co2.78O4), доля шпинели в отожженных образцах не превышает 65–68 мас. %. Вторая фаза в образцах 6–12 после 600°С представлена двойным оксидом никеля и кобальта Ni0.83–0.87Co0.17–0.83O (табл. 4, рис. 6а).
Таблица 4.
Параметры кристаллических ячеек, содержание и состав фаз в образцах после отжига при 600°С
| Образец №/ϕ | NixCo3 –xO4 | NiyCo1 –yO | ||||
|---|---|---|---|---|---|---|
| мас. % | NixCo3 –xO4 | a, Å | мас. % | NiyCo1 –yO | a, Å | |
| 6/1.0 | 68 | Ni0.22Co2.78O4 | 8.090 (1) | 32 | Ni0.84Co0.16O | 4.188 (1) |
| 7/1.2 | 65 | Ni0.13Co2.87O4 | 8.087(1) | 35 | Ni0.83Co0.17O | 4.189(1) |
| 8/1.4 | 66 | Ni0.14Co2.86O4 | 8.087 (1) | 34 | Ni0.85Co0.15O | 4.187(1) |
| 9/1.6 | 68 | Ni0.18Co2.82O4 | 8.089 (1) | 32 | Ni0.87Co0.13O | 4.186 (1) |
| 10/1.8 | 70 | Ni0.22Co2.78O4 | 8.090 (1) | 30 | Ni0.86Co0.14O | 4.187(1) |
| 11/2.0 | 70 | Ni0.23Co2.77O4 | 8.090 (1) | 30 | Ni0.86Co0.14O | 4.187 (1) |
| 12/2.2 | 66 | Ni0.12Co2.88O4 | 8.086 (1) | 34 | Ni0.85Co0.15O | 4.187 (1) |
В составе двойных оксидов NiyCo1 –yO после 10 ч отжига при 600°С содержание никеля составляет у = 0.84 ± 0.02, но массовая доля в составе образцов возрастает от 12–24 до 30–34%.
В процессе 10-часового отжига при 700°С продолжается перекристаллизация и изменение состава шпинели и двойного оксида. Данные РФА указывают на снижение доли шпинели в образцах от 67 до 62 мас. % и увеличение доли двойного оксида никеля кобальта до 36–40 мас. % (табл. 5). В составе последнего уменьшается средняя доля никеля – с y = 0.84 до 0.78. В кристаллической решетке шпинели продолжается снижение содержания никеля до x = 0.07–0.12. Таким образом, при 700°C усредненный состав шпинели можно представить как Ni0.12Co2.88O4.
Таблица 5.
Параметры кристаллических ячеек, содержание и состав фаз в образцах 6–12 после отжига при 700°С
| Образец №/ϕ |
NixCo3 –xO4 | NiyCo1 –yO | ||||
|---|---|---|---|---|---|---|
| мас. % | NixCo3–xO4 | a, Å | мас. % | NiyCo1 –yO | a, Å | |
| 6/1.0 | 62 | Ni0.07Co2.93O4 | 8.084(1) | 38 | Ni0.79Co0.21O | 4.192(1) |
| 7/1.2 | 60 | Ni0.11Co2.89O4 | 8.086(1) | 40 | Ni0.74Co0.26O | 4.197(1) |
| 8/1.4 | 62 | Ni0.07Co2.93O4 | 8.084(1) | 38 | Ni0.78Co0.22O | 4.193(1) |
| 9/1.6 | 64 | Ni0.11Co2.89O4 | 8.086(1) | 36 | Ni0.80Co0.20O | 4.191(1) |
| 10/1.8 | 63 | Ni0.12Co2.88O4 | 8.086(1) | 37 | Ni0.79Co0.21O | 4.192(1) |
| 11/2.0 | 62 | Ni0.12Co2.88O4 | 8.086 (1) | 37 | Ni0.78Co0.22O | 4.193(1) |
| 12/2.2 | 62 | Ni0.13Co2.087O4 | 8.087(1) | 38 | Ni0.77Co0.23O | 4.194(1) |
Полученные результаты по твердым растворам на основе оксида никеля и никель-кобальтовой шпинели несколько отличаются от приведенных в [11] данных о начальных температурах их формирования и содержании катионов. Так, твердый раствор на основе оксида никеля при 600°С содержит ~15 ат. % Co, при 700°C содержание Co в нем возрастает до 22 ат. %, а в образцах твердофазного синтеза [11] найдено 6 и 23 ат. % соответственно. Не исключено, что расхождения с данными [11] являются следствием погрешности расчетов, ±(1–2%) по уравнениям (2) и (3).
ЗАКЛЮЧЕНИЕ
В результате исследования условий SCS шпинели NiCo2O4 из растворов нитратов никеля и кобальта с глицином было установлено, что содержание никеля в образцах шпинели не достигает номинального значения. Шпинель с максимальным содержанием никеля (Ni0.72Co2.22O4) была получена при ϕ = 2.2. Отжиг прекурсоров при 400°С позволяет получить смесь шпинели NixCo3 –xO4 с x = 0.28−0.47 (66–86 мас. %) и двойного оксида NiyCo1 –yO с y = 0.04−0.24 с примесью дефектного оксида никеля.
Отжиг при 600 и 700°С уменьшает содержание никеля в шпинельной фазе и меняет соотношение компонентов двойного оксида, что связано с сужением области гомогенности на основе шпинели NiCo2O4 выше 400°С.
Список литературы
Zhao H., Liu L., Hu Z. et al. // Mater. Res. Bull. 2016. V. 77. P. 265. https://doi.org/10.1016/j.materresbull.2016.01.049
Wei B.T.-Y., Chen C.-H., Chien H.-C. et al. // Adv. Mater. 2010. V. 22. P. 347. https://doi.org/10.1002/adma.200902175
Zhao Q., Yan Z., Chen C. et al. // Chem. Rev. 2017. V. 117. P. 10121. https://doi.org/10.1021/acs.chemrev.7b00051
Ge D., Wu J., Qu G. et al. // Dalton Trans. 2016. V. 45. № 34. P. 13509. https://doi.org/10.1039/C6DT02136K
Dubal D.P., Gomez-Romero P., Sankapal B.R. et al. // Nano Energy. 2015. V. 11. P. 377. https://doi.org/10.1016/j.nanoen.2014.11.013
Lee E., Jang Ji-H., Kwon Y.-U. // J. Power Sources. 2015. V. 273. P. 735. https://doi.org/10.1016/j.jpowsour.2014.09.156
Klyushina A., Pacultová K., Karásková K. et al. // J. Mol. Catal. A: Chem. 2016. V. 425. P. 237. https://doi.org/10.1016/j.molcata.2016.10.014
Masi A., Bellusci M., McPhail S.J. et al. // J. Eur. Ceram. Soc. 2017. V. 37. P. 661. https://doi.org/10.1016/j.jeurceramsoc.2016.09.025
Wu Y.Q., Chen X.Y., Ji P.T. et al. // Electrochim. Acta. 2011. V. 56. P. 7517. https://doi.org/10.1016/j.electacta.2011.06.101
Chang S.-K., Zainal Z., Tan K.-B. et al. // Ceram. Int. 2015. V. 41. P. 1. https://doi.org/10.1016/j.ceramint.2014.07.101
Kuboon S., Hu Y.H. // Ind. Eng. Chem. Res. 2011. V. 50. P. 2015.https://doi.org/10.1021/ie101249r
Yang G., Park S.-J. // Electrochim. Acta. 2018. V. 285. P. 405. https://doi.org/10.1016/j.electacta.2018.08.013
Wang W., Ye W. // J. Supercond. Nov. Magn. 2018. V. 31. P. 3989. https://doi.org/10.1007/s10948-018-4672-1
Pu J., Wang J., Jin X. et al. // Electrochim. Acta. 2013. V. 106. P. 226. https://doi.org/10.1016/j.electacta.2013.05.092
Yuan C., Li J., Hou L. et al. // J. Mater. Chem. A. 2013. V. 1. P. 11145. https://doi.org/10.1039/c3ta11949a
Boopathi R.R., Parthibavarman M. // Chem. Phys. Lett. 2020. V. 755. P. 137809. https://doi.org/10.1016/j.cplett.2020.137809
Nguyen T.V., Son L.T., Thuy V.V. et al. // Dalton Trans. 2020. V. 49. P. 6718. https://doi.org/10.1039/D0DT01177K
Mhin S., Han H., Kim K.M. et al. // Ceram. Int. 2016. V. 42. № 12. P. 13654. https://doi.org/10.1016/j.ceramint.2016.05.161
Mukasyan A.S., Epstein P., Dinka P. // Proceedings of the Combustion Institute. 2007. V. 31. № 2. P. 1789. https://doi.org/10.1016/j.proci.2006.07.052
Ershov D.S., Besprozvannykh N.V., Sinel’shchikova O.Yu. // Glass Phys. Chem. 2020. V. 46. № 4. P. 329. http://dx.doi.org/ [Ершов Д.С., Беспрозванных Н.В., Синельщикова О.Ю. // Физика и химия стекла. 2020. Т. 46. № 4. С. 416.]https://doi.org/0.1134/S1087659620040057
Ketsko V.A., Smirnova M.N., Kop’eva M.A. et al. // Russ. J. Inorg. Chem. 2020. V. 65. № 9. P. 1287. [Кецко В.А., Смирнова М.Н., Копьева М.А. и др. // Журн. неорган. химии. 2020. Т. 65. № 9. С. 1155.]https://doi.org/10.1134/S0036023620090065
Ashok A., Kumar A., Bhosale R.R. et al. // Ceram. Int. 2016. V. 42. № 11. P. 12771. https://doi.org/10.1016/j.ceramint.2016.05.035
Zhuravlev V.D., Ermakova L.V., Sherstobitova E.A. et al. // Dokl. Chem. 2021. V. 496. P. 21. [Журавлев В.Д., Ермакова Л.В., Шерстобитова Е.А. и др. // Доклады АН. Химия, науки о материалах. 2021. V. 496. С. 21.]https://doi.org/10.1134/S0012500821020063
Deganello F., Tyagi A.K. // Prog. Cryst. Growth Charact. Mater. 2018. V. 64. P. 23. https://doi.org/10.1016/j.pcrysgrow.2018.03.001
Carlos E., Martins R., Fortunato E. et al. // Chem. Eur. J. 2020. V. 26. P. 9099. https://doi.org/10.1002/chem.202000678
Thoda O., Xanthopoulou G., Prokof’ev V. et al. // Int. J. Self-Propagating High-Temperature Synthesis. 2018. V. 27. № 4. P. 207. https://doi.org/10.3103/S1061386218040088
Morozov N.A., Sinelshchikova O.Yu., Besprozvannykh N.V. et al. // Russ. J. Inorg. Chem. 2020. V. 65. № 8. P. 1127. [Морозов Н.А., Синельщикова О.Ю., Беспрозванных Н.В. и др. // Журн. неорган. химии. 2020. Т. 65. № 8. С. 1019.]https://doi.org/10.1134/S1063778815120169
Zhuravlev V.D., Bamburov V.G., Ermakova L.V. et al. // Phys. Atom Nucl. Inzh. 2015. V. 5. P. 505. [Журавлев В.Д., Бамбуров В.Г., Ермакова Л.В. и др. // Ядерная физика и инженеринг. 2014. Т. 5. С. 1.]https://doi.org/10.1134/S1063778815120169
Rodríguez-Carvajal J. // Phys. A. 1993. V. 192. P. 55.https://doi.org/10.1016/0921-4526(93)90108-I
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии






