Журнал неорганической химии, 2021, T. 66, № 2, стр. 119-127
Взаимодействие слоистых гидроксидов редкоземельных элементов с формамидом с образованием [Ln(HCOO)3 · 2(HCONH2)]
А. А. Родина a, b, А. Д. Япрынцев a, А. В. Чураков a, А. Е. Баранчиков a, *
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
b Московский государственный университет им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
* E-mail: a.baranchikov@yandex.ru
Поступила в редакцию 03.04.2020
После доработки 08.04.2020
Принята к публикации 20.04.2020
Аннотация
Впервые изучена долговременная (более 30 сут) стабильность дисперсий в формамиде слоистых гидроксидов РЗЭ (Y, Gd и Eu), интеркалированных додецилсульфат-анионом. Показано, что слоистые гидроксиды иттрия, гадолиния и европия, интеркалированные додецилсульфат-анионом, взаимодействуют с формамидом с образованием соединений состава [Ln(HCOO)3 · 2(HCONH2)] (Ln = Y, Gd и Eu). Структура полученных соединений определена методом монокристальной рентгеновской дифракции. Полученные данные свидетельствуют о том, что коллоидные растворы квазидвумерных кристаллов слоистых гидроксидов РЗЭ в формамиде остаются стабильными в течение нескольких суток.
ВВЕДЕНИЕ
Слоистые гидроксосоединения редкоземельных элементов (СГ РЗЭ) представляют собой новый класс неорганических анионообменных соединений [1] и являются структурными аналогами слоистых двойных гидроксидов [2–4]. В общем виде состав слоистых СГ РЗЭ может быть представлен как Ln2(OH)6– x(Am–)x/m · nH2O (A – анион, m – заряд аниона, x = 1–2, n = 0–2, Ln – РЗЭ). Структура этих соединений характеризуется наличием положительно заряженных слоев, между которыми расположены анионы, которые могут быть заменены на кислотные остатки различных органических и неорганических кислот [5, 6]. Значительный интерес к СГ РЗЭ связан с возможностью сочетания уникальных свойств лантанидов (оптических, магнитных, каталитических), обусловленных их электронным строением, и интеркалированных в межслоевое пространство лигандов с целью создания многофункциональных материалов на основе данных соединений [1].
Мерой ионообменной емкости материала служит поверхностная плотность заряда, которую можно рассчитать из кристаллографических данных [1]. СГ РЗЭ обладают рекордными значениями поверхностной плотности заряда (до 0.087 e/Å2) [7] среди слоистых неорганических анионообменных материалов, что позволяет ожидать от них высоких значений ионообменной емкости. Наиболее известными примерами органических анионов, интеркалирующихся в структуру СГ РЗЭ, являются алкилсульфонаты и алкилсульфаты, в том числе додецилсульфат-анион [8, 9]. Интеркалирование таких анионов приводит к значительному увеличению межслоевого пространства в СГ РЗЭ (до 20–35 Å), в результате сила взаимодействия между металл-гидроксидными слоями существенно уменьшается, что дает возможность расщепить полученную структуру до квазидвумерных кристаллов [8, 10, 11].
Как правило, расщепление (эксфолиацию) предварительно интеркалированных додецилсульфат-анионами СГ РЗЭ проводят диспергированием в формамиде [8], описаны также методики эксфолиации в воде [12], бутаноле [13], толуоле [14] и с использованием сверхкритического CO2 [15]. Диспергирование суспензий СГ РЗЭ в формамиде (0.5–3 г/л) приводит к увеличению базального межплоскостного расстояния до ~35 Å за счет проникновения молекул формамида в межслоевое пространство СГ РЗЭ и в конечном итоге к расщеплению слоев и образованию коллоидных растворов 2D-частиц с выходом до 50% [8]. Толщина получаемых 2D-частиц составляет 16–17 Å, что превышает кристаллографическую толщину металл-гидроксидного слоя (9.3 Å) из-за присутствия додецилсульфат-анионов на их поверхности. Эксфолиацию в формамиде предложено использовать для получения коллоидных растворов СГ РЗЭ с заданными люминесцентными характеристиками [10, 16–19].
С точки зрения практического применения важнейшей характеристикой коллоидных растворов является их долговременная стабильность (включая химическую и агрегативную стабильность компонентов коллоидной системы). Анализ литературы показал, что вопрос долговременной (более нескольких суток) стабильности дисперсий СГ РЗЭ в формамиде и других полярных растворителях остается неисследованным. В то же время известно, что при относительно невысоких температурах формамид гидролизуется с заметной скоростью [20, 21] с образованием реакционноспособных соединений (в частности, муравьиной кислоты), которые могут вступать во взаимодействие с СГ РЗЭ.
Цель работы – анализ долговременной стабильности дисперсий в формамиде слоистых гидроксидов иттрия, гадолиния и европия, интеркалированных додецилсульфат-анионом, и установление состава и структуры образующихся при этом соединений.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для синтеза СГ РЗЭ в качестве исходных соединений использовали Y(NO3)3 · 6H2O (99.9%, Ланхит), GdCl3 · 6H2O (99.9%, Ланхит), EuCl3 · 6H2O (99.9%, Ланхит), NH4NO3 (х. ч., РеаХим), NaCl (х. ч., Компонент-Реактив), гексаметилентетрамин (ГМТА, 99%, Alfa Aesar), додецилсульфат натрия (≥98%, Sigma Aldrich), формамид (≥99.5%, Merck). Все эксперименты проводили с использованием деионизованной воды.
Для синтеза слоистых гидроксидов РЗЭ (Y, Gd, Eu) использовали метод гомогенного гидролиза. К 90 мл 1 М водного раствора соли РЗЭ (Y, Gd, Eu), 10 М нитратa аммония (для синтеза слоистых гидроксонитратов РЗЭ) или хлоридa натрия (для синтеза слоистых гидроксохлоридов РЗЭ) добавляли 1820 мл 0.07 M водного раствора ГМТА так, что в полученной смеси мольное соотношение РЗЭ : (${\text{NO}}_{{\text{3}}}^{--}$ или Cl–) : ГМТА составляло 1 : 10 : 1.43. Полученный раствор помещали в трехгорлую колбу с обратным холодильником, нагревали до 100°C и выдерживали в течение 1 ч. Осадок отделяли фильтрованием на фильтре Шотта (класс 4), промывали несколько раз деионизованной водой и сушили при относительной влажности 75% и температуре 60°C в течение суток.
Для синтеза додецилсульфат-интеркалированных СГ РЗЭ навески гидроксонитрата иттрия, гидроксохлорида европия или гидроксохлорида гадолиния (200 мг) диспергировали в 250 мл водного раствора додецилсульфата натрия (при мольном отношении РЗЭ : додецилсульфат = 1 : 3). Полученные суспензии перемешивали при комнатной температуре на магнитной мешалке в течение суток, осадки отделяли центрифугированием, промывали и сушили при 60°С в течение суток.
Для анализа взаимодействия слоистых гидроксидов РЗЭ с формамидом навески (10 мг) порошков слоистых гидроксидов РЗЭ, интеркалированных додецилсульфат-анионом, смешивали с 2 мл формамида в стеклянных виалах объемом 3.5 мл. Полученные суспензии подвергали ультразвуковой обработке (ультразвуковой генератор Bandelin Sonopuls 3200 с волноводом погружного типа, удельная поглощенная акустическая мощность около 10 Вт/см2) в течение 15 мин, после чего виалы герметично закрывали. Кристаллы соединений, образовавшихся из суспензий в формамиде слоистых гидроксидов иттрия, гадолиния и европия, интеркалированных додецилсульфат-анионами, далее обозначены 1, 2 и 3 соответственно.
Рентгеноструктурный анализ соединения 1 выполнен на автоматическом дифрактометре Bruker SMART APEX II при температуре 150 K (MoKα-излучение, λ = 0.71073 Å, графитовый монохроматор). Кристаллы соединения 1 (C5H9N2O8Y, Fw = = 314.05) моноклинные, пр. гр. C2, a = 11.2697(13), b = 7.0632(8), c = 6.5440(7) Å, β = = 109.097(1)°, V = 492.24(10) Å3, Z = 2, ρвыч = 2.119 г/см3, μ(MoKα) = = 5.957 мм–1, F(000) = 312. Интенсивности 2544 отражений (из них 1180 независимых, Rint = = 0.0166) измерены методом ω-сканирования в интервале 3.29° < θ < 27.92° (–14 ≤ h ≤ 14, –9 ≤ k ≤ 9, ‒8 ≤ l ≤ 8). Адсорбционная коррекция проведена на основании измерений интенсивностей эквивалентных отражений [22]. Структура расшифрована прямым методом; все неводородные атомы уточнены полноматричным анизотропным МНК по F2 (SHELXTL [23]). Атомы водорода, связанные с атомами углерода, помещены в рассчитанные позиции и уточнены с использованием схемы “наездника”; амидные атомы Н11 и Н12 найдены объективно и уточнены в изотропном приближении. Окончательное значение факторов расходимости составило R1 = 0.0212 для 1180 отражений с I > 2σ(I) и wR2 = 0.0531 по всему массиву данных с использованием 82 параметров уточнения. GOF = 1.047, Δρmin/max = –0.492/–0.330, параметр абсолютной структуры 0.028(6).
Рентгенофазовый анализ порошкообразных образцов проводили на дифрактометре Bruker D8 Advance (CuKα-излучение) в диапазоне углов 2θ 3°–55° с шагом 0.02° и выдержкой не менее 0.3 с на шаг. Уточнение параметров кристаллической структуры соединений 2 и 3 проводили с использованием программного обеспечение TOPAS 4.2. Растровую электронную микроскопию и рентгеноспектральный микроанализ (РСМА) образцов проводили с использованием микроскопа Carl Zeiss NVision 40, оснащенного анализатором Oxford Instruments X-Max (80 мм2).
Анализ суспензий в формамиде методом динамического рассеяния света проводили с использованием спектрометра динамического и статического рассеяния света Photocor Complex (ООО “Фотокор”, Россия). Измерения проводили на угле рассеяния 90° в термостатируемой ячейке при температуре 25°С. В качестве источника света выступал полупроводниковый лазер с длиной волны 638 нм. Среднюю интенсивность рассеяния суспензии находили усреднением 20 измерений, полученных с накоплением в течение 10 с. Измерения проводили раз в 1–2 сут в течение месяца.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В результате кипячения с обратным холодильником смешанных водных растворов ГМТА и солей РЗЭ происходит гидролиз катионов РЗЭ с образованием осадков белого цвета. Схему соответствующей реакции можно представить следующим образом:
(1)
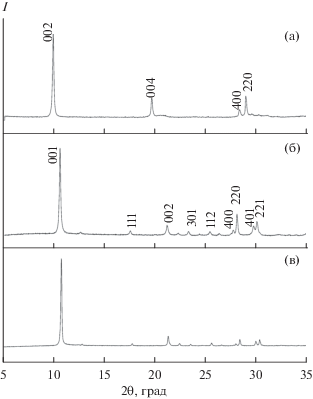
$\begin{gathered} {\text{2L}}{{{\text{n}}}^{{3 + }}}{\text{ + }}\frac{7}{4}{{{\text{C}}}_{{\text{6}}}}{{{\text{N}}}_{{\text{4}}}}{{{\text{H}}}_{{{\text{12}}}}} + {\text{ 6}}{{{\text{A}}}^{ - }}{\text{ + }}\left( {{\text{15}}\frac{1}{2} + n} \right){\text{H}}{}_{{\text{2}}}{\text{O}} \to \\ \to {\text{L}}{{{\text{n}}}_{2}}{{{\text{(OH)}}}_{5}}({\text{A}}) \cdot (n - {\text{2)}}{{{\text{H}}}_{{\text{2}}}}{\text{O}} + {\text{10}}\frac{1}{2}{{{\text{H}}}_{{\text{2}}}}{\text{CO}} + \\ + \,\,{\text{5N}}{{{\text{H}}}_{4}}{\text{A}} + 2{\text{N}}{{{\text{H}}}_{{\text{3}}}} \cdot {{{\text{H}}}_{{\text{2}}}}{\text{O,}} \\ \end{gathered} $На рис. 1 представлены рентгенограммы полученных соединений. Рентгенограммы проиндицированы согласно данным [24, 25] и соответствуют слоистому гидроксонитрату иттрия, слоистым гидроксохлоридам европия и гадолиния с базальными межплоскостными расстояниями 9.0, 8.3 и 8.4 Å соответственно. Полученные значения близки к литературным данным для соответствующих соединений: 9.2 [26], 8.4 [24] и 8.5 [24] соответственно. Уточненные параметры решетки для гидроксохлоридов европия и гадолиния составили a = 12.92(1), b = 7.33(1), c = 8.44(9) Å и a = = 12.88(1), b = 7.30(1), c = 8.45(5) Å соответственно. Эти значения близки к литературным для слоистого гидроксохлорида европия Eu2(OH)5Cl · · 1.6H2O (a = 12.92(1), b = 7.38(1), c = 8.71(1) Å) [27] и гадолиния Gd2(OH)5Cl · 1.5H2O (a = 12.8787(1), b = 7.3025(1), c = 8.4551(3) Å) [24] соответственно. Заниженное значение параметра c для синтезированного гидроксохлорида европия по сравнению с литературными данными можно объяснить тем, что нами была получена низкогидратированная фаза слоистого гидроксохлорида европия, характеризующаяся меньшим межслоевым расстоянием (в котором находятся хлорид-анионы и молекулы воды).
Рис. 1.
Рентгенограммы слоистого гидроксонитрата иттрия Y2(OH)5NO3 · nH2O (а), слоистых гидроксохлоридов европия Eu2(OH)5Cl · nH2O (б) и гадолиния Gd2(OH)5Cl · nH2O (в), полученных методом гомогенного осаждения в присутствии гексаметилентетрамина.
Согласно данным РСМА, состав полученных слоистых гидроксохлоридов европия и гадолиния отвечает формулам Eu2(OH)5.16Cl0.84 · nH2O и Gd2(OH)5.07Cl0.93 · nH2O, что указывает на принадлежность данных СГ РЗЭ к классу LREH-I [1], для которого анионы в межслоевом пространстве удерживаются только за счет электростатических взаимодействий.
На рис. 2 представлены рентгенограммы продуктов взаимодействия слоистых гидроксидов иттрия, гадолиния и европия с додецилсульфатом натрия. Для них рефлексы серии (00l) существенно сдвинуты в область меньших углов по сравнению с рентгенограммами исходных гидроксонитратов и гидроксохлоридов РЗЭ (рис. 1). Такой сдвиг соответствует увеличению базального межплоскостного расстояния dbasal c 8–9 Å для исходных основных солей до 24–25 Å для продуктов интеркаляции, что удовлетворительно согласуется с литературными данными для додецилсульфат-интеркалированных слоистых гидроксидов иттрия [28], гадолиния [29] и европия [30]. Полученные данные позволяют оценить величину межплоскостного расстояния в додецилсульфат-интеркалированных СГ РЗЭ, которая составилa 18–19 Å, что приблизительно соответствует размеру додецилсульфат-аниона (~18 Å) [31].
Рис. 2.
Рентгенограммы продуктов взаимодействия слоистого гидроксонитрата иттрия (а), слоистых гидроксохлоридов европия (б) и гадолиния (в) с додецилсульфатом натрия.
Данные РСМА также подтверждают интеркаляцию додецилсульфат-аниона в структуру слоистых гидроксидов РЗЭ. Так, для слоистого гидроксида иттрия, интеркалированного додецилсульфат-анионом, значение мольного соотношения S : Y составило 0.47. Таким образом, состав продукта соответствует формуле Y2(OH)5(C12H25OSO3).0.95(NO3)0.05 · nH2O.
На рис. 3 представлен внешний вид суспензий, полученных диспергированием слоистого гидроксида иттрия, интеркалированного додецилсульфат-анионом, в формамиде. Свежеприготовленная суспензия (рис. 3а) демонстрирует эффект Тиндаля, указывающий на образование коллоидных частиц в процессе эксфолиации. В то же время в аналогичной суспензии, выдержанной в течение месяца (рис. 3б), эффект Тиндаля отсутствует, и в ней наблюдаются одиночные достаточно крупные (0.1–0.5 мм) бесцветные кристаллы (рис. 3б). Данные наблюдения однозначно указывают на то, что при контакте формамида со слоистым гидроксидом иттрия, интеркалированным додецилсульфат-ионом, происходит химическое взаимодействие.
Рис. 3.
Внешний вид суспензий в формамиде слоистого гидроксида иттрия, интеркалированного додецилсульфат-анионом: а – свежеприготовленная суспензия, б – суспензия, выдержанная в течение месяца.

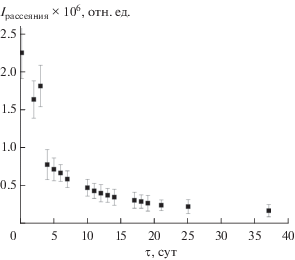
Динамику растворения коллоидных частиц слоистого гидроксида иттрия можно отслеживать по данным динамического рассеяния света (рис. 4). Интенсивность рассеяния света суспензий со временем постепенно уменьшается, что указывает на уменьшение концентрации коллоидных частиц [32]. Через месяц эксперимента интенсивность рассеяния уменьшилась примерно на порядок. Отметим, что двукратное уменьшение интенсивности рассеяния света происходит уже через трое суток хранения суспензии.
Рис. 4.
Зависимость от времени интенсивности рассеяния света суспензией слоистого гидроксида иттрия, интеркалированного додецилсульфат-анионом, в формамиде.
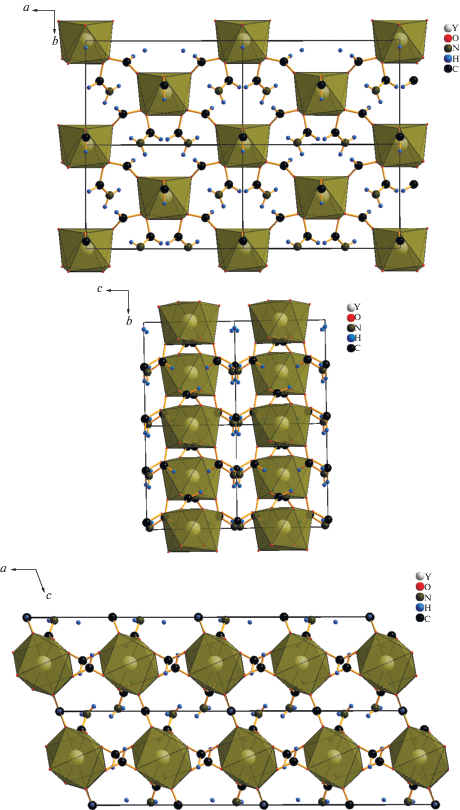
Кристаллы, образовавшиеся в суспензии в формамиде слоистого гидроксида иттрия, интеркалированного додецилсульфат-анионом, проанализированы методом рентгеноструктурного анализа (рис. 5, табл. 1). Установлено, что кристаллы отвечают сольватированному формамидом формиату иттрия состава Y(HCOO)3 · 2(HCONH2), изоструктурному ранее описанным сольватированным формамидом формиатам эрбия и диспрозия [33]. Y(HCOO)3 · 2(HCONH2) кристаллизуется в моноклинной сингонии (пр. гр. C2, a = 11.2697(13), b = = 7.0632(8), c = 6.5440(7) Å, β = 109.097(1)°, V = = 492.24(10) Å3, Z = 2).
Таблица 1.
| Параметр | Значение |
|---|---|
| Формула | C5H9N2O8Y |
| М, а.е.м. | 314.05 |
| T, K | 150(2) |
| λ, Å, излучение | 0.71073, MoKα |
| Сингония | Моноклинная |
| Пр. гр. | С2 |
| a, Å | 11.2697(13) |
| b, Å | 7.0632(8) |
| c, Å | 6.5440(7) |
| α, β, γ, град | 90, 109.097(1), 90 |
| V, Å3 | 492.24(10) |
| Z | 2 |
| ρтеор, г/cм–3 | 2.119 |
| Коэффициент поглощения, мм–1 | 5.957 |
| F(000) | 312 |
| Размер кристалла, мм | 0.35 × 0.15 × 0.04 |
| Диапазон θ, град | 3.29–27.92 |
| Диапазон hkl-индексов | –14 < h < 14 |
| –9 < k < 9 | |
| –8 < l < 8 | |
| Количество рефлексов | 2544 |
| Независимые рефлексы | 1180 |
| max/min пропускание | 0.2296/0.7966 |
| R-фактор (I > 2σ(I)) | 0.0212 |
| wR2 | 0.0531 |
| GOF | 1.047 |
| Δρmin/max | –0.492/–0.330 |
| Параметр абсолютной структуры | –0.028(6) |
Координационная сфера РЗЭ в указанных соединениях представляет собой 8-координационный полиэдр (квадратную антипризму), образованный атомами кислорода шести формиат-ионов и от двух молекул формамида. Формиат-ионы в элементарной ячейке занимают две неэквивалентныe позиции и являются мостиковыми лигандами по отношению к катионам иттрия, соединяющими полиэдры [YO8] в трехмерный каркас. Отметим, что в металлорганическом каркасе можно выделить два типа каналов (в направлениях b и c), в которых находятся молекулы формамида, координированного с катионами иттрия.
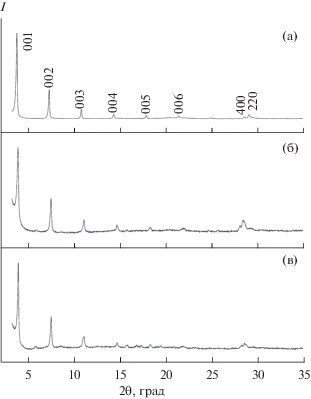
Аналогичным образом кристаллы образовались и в суспензиях в формамиде слоистых гидроксидов гадолиния и европия, интеркалированных додецилсульфат-ионами. На рис. 6а–6в представлены порошковые дифрактограммы соединений 2 и 3 в сравнении с дифрактограммой соединения 1. Анализ дифракционных данных указывает на изоструктурность полученных соединений. Таким образом, слоистые гидроксиды европия и гадолиния так же, как слоистый гидроксид иттрия, взаимодействуют с формамидом с образованием соответствующих формиатов, сольватированных формамидом. В табл. 2 приведены уточненные параметры кристаллической решетки полученных соединений. Из рис. 6г следует, что объем элементарной ячейки формиатов РЗЭ, сольватированных формамидом, линейно возрастает с увеличением радиуса катиона РЗЭ (для КЧ 8 [34]), что дополнительно подтверждает изоструктурность полученных соединений.
Рис. 6.
Рентгенограммы продуктов взаимодействия с формамидом слоистых гидроксидов иттрия (а), гадолиния (б) и европия (в), интеркалированных додецилсульфат анионом.
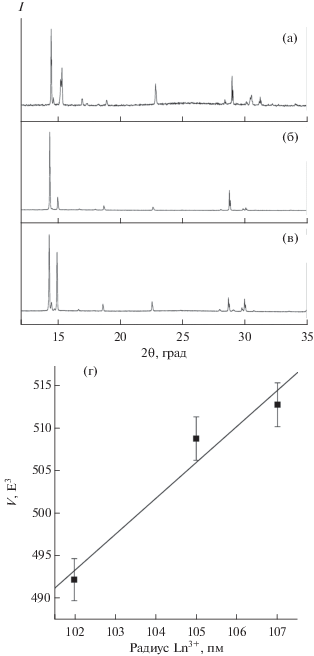
Таблица 2.
Параметры элементарной ячейки для соединений [Ln(HCOO)3 · 2(HCONH2)], где Ln = Y, Gd, Eu, пр. гр. С2
| Ln | R, пм | a, Å | b, Å | c, Å | β, град | V, Å3 |
|---|---|---|---|---|---|---|
| Y | 102 | 11.2697 | 7.0632 | 6.544 | 109.097 | 492.24 |
| Gd | 105 | 11.36161 | 7.18533 | 6.62141 | 109.7425 | 508.778 |
| Eu | 107 | 11.39707 | 7.2045 | 6.63906 | 109.8524 | 512.738 |
Анализ полученных результатов позволяет предположить, что взаимодействие с формамидом слоистых гидроксидов РЗЭ, интеркалированных додецилсульфат-анионом, протекает по следующей схеме:
(2)
$\begin{gathered} {\text{L}}{{{\text{n}}}_{{\text{2}}}}{{{\text{(OH)}}}_{{\text{5}}}}{\text{DS}} \cdot n{{{\text{H}}}_{{\text{2}}}}{\text{O}} + {\text{11HCON}}{{{\text{H}}}_{{\text{2}}}} \to \\ \to 2[{\text{Ln(HCOO}}{{{\text{)}}}_{3}} \cdot 2({\text{HCON}}{{{\text{H}}}_{{\text{2}}}}{\text{)]}} + {\text{N}}{{{\text{H}}}_{{\text{4}}}}{\text{DS}} + \\ + \,\,{\text{5N}}{{{\text{H}}}_{3}} + {\text{HCOON}}{{{\text{H}}}_{{\text{4}}}} + (n - 2){{{\text{H}}}_{{\text{2}}}}{\text{O,}} \\ \end{gathered} $ЗАКЛЮЧЕНИЕ
Установлено, что слоистые гидроксиды иттрия, гадолиния и европия, интеркалированные додецилсульфат-анионом, взаимодействуют с формамидом с образованием соединений состава [Ln(HCOO)3 · 2(HCONH2)] (Ln = Y, Gd и Eu), при этом ключевым компонентом, обусловливающим возможность гидролиза формамида и разрушения дисперсий слоистых гидроксидов РЗЭ в формамиде, по-видимому, является вода, находящаяся в межслоевом пространстве СГ РЗЭ. Стабильность коллоидных растворов 2D-частиц СГ РЗЭ, получаемых широко распространенной методикой диспергирования в формамиде, ограничена во времени несколькими сутками.
Список литературы
Yapryntsev A.D., Baranchikov A.Y., Ivanov V.K. // Russ. Chem. Rev. 2020. V. 89. https://doi.org/10.1070/RCR4920
Layered Double Hydroxides (Structure and Bonding. V. 119.) / Eds. Duan X., Evans D.G.). Berlin, Heidelberg: Springer-Verlag, 2006. https://doi.org/10.1007/b100426
Krasnobaeva O.N., Nosova T.A., Kondakov D.F., Danilov V.P. // Russ. J. Inorg. Chem. 2018. V. 63(9). P. 1122. https://doi.org/10.1134/S0036023618090085
Krasnobaeva O.N., Belomestnykh I.P., Nosova T.A. et al. // Russ. J. Inorg. Chem. 2019. V. 64(8) P. 1010. https://doi.org/10.1134/S0036023619080060
Yapryntsev A.D., Bykov A.Y., Baranchikov A.E. et al. // Inorg. Chem. 2017. V. 56(6). P. 3421. https://doi.org/10.1021/acs.inorgchem.6b02948
Yapryntsev A., Abdusatorov B., Yakushev I. et al. // Dalt. Trans. 2019. V. 48(18). P. 6111. https://doi.org/10.1039/C9DT00390H
Geng F., Ma R., Matsushita Y. et al. // Inorg. Chem. 2011. V. 50(14). P. 6667. https://doi.org/10.1021/ic200578r
Hu L., Ma R., Ozawa T.C., Sasaki T. // Chem. Asian J. 2010. V. 5(2). P. 248. https://doi.org/10.1002/asia.200900475
Feng P., Shao B., Wang X., Yang X. // Eur. J. Inorg. Chem. 2017. V. 2017(41). P. 4861. https://doi.org/10.1002/ejic.201700825
Xie L., Liu C., Ma L. et al. // Dalton Trans. 2017. V. 46(10). P. 3110. https://doi.org/10.1039/C6DT04870F
Wang X., Feng P., Zhao Y. et al. // Chem. Select. 2016. V. 1(1). P. 17. https://doi.org/10.1002/slct.201500012
Wu L., Chen G., Li Z. // Small. 2017. V. 13(23). P. 1 604 070. https://doi.org/10.1002/smll.201604070
Zhang L., Jiang D., Xia J. et al. // RSC Adv. 2014. V. 4(34). P. 17856. https://doi.org/10.1039/c4ra01637h
Lee B.-I., Bae J.-S., Lee E.-S., Byeon S.-H. // Bull. Korean Chem. Soc. 2012. V. 33(2). P. 601. https://doi.org/10.5012/bkcs.2012.33.2.601
Yapryntsev A.D., Ustinovich K.B., Rodina A.A. et al. // J. Supercrit. Fluids. 2019. V. 150. P. 40. https://doi.org/10.1016/j.supflu.2019.04.012
Gu Q., Liu X., Hu Y. et al. // J. Photochem. Photobiol. A. 2017. V. 335. P. 268. https://doi.org/10.1016/j.jphotochem.2016.12.011
Gu Q., Yuan M., Ma S., Sun G. // J. Lumin. 2017. V. 192. P. 1211. https://doi.org/10.1016/j.jlumin.2017.08.059
Su F., Liu C., Yang Y. et al. // J. Colloid Interface Sci. 2017. V. 496. P. 353. https://doi.org/10.1016/j.jcis.2017.02.039
Ma L., Yuan M., Liu C. et al. // Dalton Trans. 2017. V. 46(37). P. 12724. https://doi.org/10.1039/C7DT02662E
Hine J., King R.S.M., Midden W.R., Sinha A. // J. Org. Chem. 1981. V. 46(16). P. 3186. https://doi.org/10.1021/jo00329a007
Slebocka-Tilk H., Sauriol F., Monette M., Brown R.S. // Can. J. Chem. 2002. V. 80(10). P. 1343. https://doi.org/10.1139/v02-166
Sheldrick G.M. SADABS. Program for scaling and correction of area detector data. Germany: University of Göttingen, 1997.
Sheldrick G.M. // Acta Crystallogr A. 2008. V. 64. P. 112. https://doi.org/10.1107/S0108767307043930
Geng F., Matsushita Y., Ma R. et al. // J. Am. Chem. Soc. 2008. V. 130(48). P. 16344. https://doi.org/10.1021/ja807050e
Geng F., Matsushita Y., Ma R. et al. // Inorg. Chem. 2009. V. 48(14). P. 6724. https://doi.org/10.1021/ic900669p
Mcintyre L.J., Jackson L.K., Fogg A.M. // Chem. Mater. 2008. V. 20. P. 335. https://doi.org/10.1021/cm7019284
Geng F., Xin H., Matsushita Y. et al. // Chem. Eur. J. 2008. V. 14(30). P. 9255. https://doi.org/10.1002/chem.200800127
Yapryntsev A.D., Baranchikov A.E., Skogareva L.S. et al. // CrystEngComm. 2015. V. 17(13). P. 2667. https://doi.org/10.1039/C4CE02303J
Yapryntsev A.D., Baranchikov A.E., Zabolotskaya A.V. et al. // Russ. J. Inorg. Chem. 2014. V. 59(12). P. 1383. https://doi.org/10.1134/S0036023614120286
Baranchikov A.E., Yapryntsev A.D., Goldt A.E. et al. // Curr. Microw. Chem. 2015. V. 2(1). P. 1. https://doi.org/10.2174/2213335602666150119220922
Duplâtre G., Ferreira Marques M.F., da Graça Miguel M. // J. Phys. Chem. 1996. V. 100(41). P. 16608. https://doi.org/10.1021/jp960644m
Vysotskii V.V., Uryupina O.Y., Gusel’nikova A.V., Roldugin V.I. // Colloid J. 2009. V. 71(6). P. 739. https://doi.org/10.1134/S1061933X09060027
Legendziewicz J., Głowiak T., Oczko G., Ngoan D.C. // J. Less Common Met. 1986. V. 125. P. 45. https://doi.org/10.1016/0022-5088(86)90079-2
Shannon R.D., Prewitt C.T. // J. Inorg. Nucl. Chem. 1970. V. 32(5). P. 1427. https://doi.org/10.1016/0022-1902(70)80629-7
Samarasekere P., Wang X., Kaveevivitchai W., Jacobson A.J. // Cryst. Growth Des. 2015. V. 15. P. 1119. https://doi.org/10.1021/cg501421u
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии