Журнал неорганической химии, 2021, T. 66, № 3, стр. 358-363
Дикарбоксилаты трис(2-метокси-5-хлорфенил)сурьмы (5-Cl-2-MeO-C6H3)3Sb[OC(O)R]2, R = CH2Br, CH2C6H4F-3, C6H3F2-2,3. Синтез и строение
В. В. Шарутин a, *, О. К. Шарутина a
a Южно-Уральский университет
454080 Челябинск, пр-т Ленина, 76, Россия
* E-mail: sharutinvv@susu.ru
Поступила в редакцию 20.07.2020
После доработки 13.08.2020
Принята к публикации 27.08.2020
Аннотация
В кристалле сольвата трис(2-метокси-5-хлорфенил)сурьмы с бензолом (5-Cl-2-MeO-C6H3)3Sb (I) ⋅ ⋅ 1/2С6Н6, полученного из SbCl3 и 2-метокси-5-хлорфениллития в эфире и перекристаллизованного из бензола, атомы сурьмы имеют тригональное окружение лигандов с учетом координации атомов кислорода MeO-групп на атом металла (внутримолекулярные расстояния Sb∙∙∙OМе 3.053(1), 3.054(1) и 3.011(1) Å, КЧ = 3 + 3). Действие гидропероксида третичного бутила на смесь трис(2-метокси-5-хлорфенил)сурьмы и бромуксусной, 3-фторфенилуксусной, 2,3-дифторбензойной кислот в эфире приводит к синтезу тригонально-бипирамидальных дикарбоксилатов триарилсурьмы (5-Cl-2-MeO-C6H3)3Sb[OC(O)R]2, где R = CH2Br (II), CH2C6H4F-3 (III), C6H3F2-2,3 (IV), с карбоксильными лигандами в апикальных позициях. В кристаллах II−IV имеет место дополнительная координация атома металла с атомами кислорода О=С- и МеО-групп.
ВВЕДЕНИЕ
До недавнего времени наиболее изученными арильными соединениями сурьмы были фенильные и в меньшей степени п-толильные производные [1]. Наличие вакантных d-орбиталей у атомов сурьмы позволяет образовывать дополнительные координационные связи с лигандами, содержащими пространственно доступные атомы с неподеленными электронными парами, что приводит к увеличению координационного числа металла и часто влияет на реакционную способность соединений. Так, известны немногочисленные арильные производные сурьмы, имеющие в фенильных заместителях такие потенциальные координирующие центры, как атомы азота [2–8] или кислорода [9–17].
Известно, что дикарбоксилаты триарилсурьмы способны оказывать противоопухолевое, антилейшманиозное и антибактериальное действие, а также обладают электрохимическими и фотолюминесцентными свойствами [18–28]. Изучались фотокаталитические свойства этих соединений [29]. Установлено, что фторсодержащие замеcтители влияют на такие свойства, как способность к абсорбции и липофильность, а значит, на химическую и биологическую активность соединений [30, 31 ] . Фторсодержащие соединения в настоящее время используются в медицине [32, 33]. В работе [20] авторы отмечают, что антилейшманиозная активность сурьмаорганических производных повышается, если в молекулярных структурах присутствует большое количество взаимодействий, в частности, за счет атомов галогенов.
В настоящей работе впервые получена трис(2-метокси-5-хлорфенил)сурьма (I), изучены ее реакции с карбоновыми кислотами в присутствии трет-бутилгидропероксида и установлены особенности строения полученных соединений (5-Cl-2-MeO-C6H3)3Sb[OC(O)R]2, где R = CH2Br (II), CH2C6H4F-3 (III), C6H3F2-2,3 (IV).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ИК-спектры соединений записывали на ИК-фурье-спектрометре Shimadzu IRAffinity-1S в таблетках KBr.
Рентгеноструктурный анализ выполняли на автоматическом четырехкружном дифрактометре D8 QUEST фирмы Bruker (графитовый монохроматор) при 293 K. Сбор, редактирование данных, уточнение параметров элементарной ячейки, учет поглощения, определение и уточнение структур проводили по известным программам [34–36]. Структуры определены прямым методом и уточнены методом наименьших квадратов в анизотропном приближении для неводородных атомов. Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных.
Соединение I (CCDC 1 977 662): кристаллы моноклинные, пр. гр. Р21/n, a = 8.899(3), b = 21.324(12), c = 13.703(5) Å, β = 107.413(13)°, V = 2481.1(19) Å3, Z = 4, ρвыч = 1.567 г/см3; μ = 1.458 мм–1, F(000) = = 1164.0. Измерено 6270 независимых отражений (Rint = 0.0353), 294 параметра уточнения: R1 = = 0.0251, wR2 = 0.0564.
Соединение II (CCDC 1 985 087): кристаллы триклинные, пр. гр. Р$\bar {1},$ a = 9.604(13), b = 12.034(12), c = = 15.042(14) Å, α = 108.66(4)°, β = 95.24(5)°, γ = = 111.48(5)°, V = 1489(3) Å3, Z = 2, ρвыч = 1.834 г/см3; μ = 3.919 мм–1, F(000) = 800.0. Измерено 7530 независимых отражений (Rint = 0.0400), 357 параметров уточнения: R1 = 0.0301, wR2 = 0.0726.
Соединение III (CCDC 1 981 658): кристаллы триклинные, пр. гр. Р$\bar {1},$ a = 10.668(9), b = 12.434(8), c = = 14.239(8) Å, α = 106.48(2)°, β = 98.17(3)°, γ = = 95.42(3)°, V = 1775(2) Å3, Z = 2, ρвыч = 1.596 г/см3; μ = 1.063 мм–1, F(000) = 856.0. Измерено 8980 независимых отражений (Rint = 0.0514), 461 параметр уточнения: R1 = 0.0334, wR2 = 0.0718.
Соединение IV (CCDC 1 986 142): кристаллы триклинные, пр. гр. Р$\bar {1},$ a = 9.456(3), b = 11.929(7), c = 18.220(7) Å, α = 108.109(18)°, β = 90.379(16)°, γ = 94.94(3)°, V = 1945.0(16) Å3, Z = 2, ρвыч = = 1.536 г/см3; μ = 0.981 мм–1, F(000) = 898.0. Измерено 10023 независимых отражения (Rint = = 0.0249), 477 параметров уточнения: R1 = 0.0288, wR2 = 0.0741.
Сольват трис(2-метокси-5-хлорфенил)сурьмы с бензолом (I ⋅ 1/2C6H6) синтезировали по методике, описанной в [12]. Получили бесцветные кристаллы I ⋅ 1/2C6H6 (85%) c tпл = 178°С. ИК-спектр (ν, см−1): 3088, 3045, 2997, 2960, 2937, 2837, 2517, 2036, 1863, 1570, 1463, 1431, 1377, 1286, 1261, 1234, 1178, 1141, 1101, 1045, 1020, 887, 812, 802, 732, 715, 692, 673, 638, 545, 528, 441.
Соединения II−IV синтезировали способом, описанным в [13].
Соединение II. Бесцветные кристаллы с tпл = = 128°С. ИК-спектр (ν, см−1): 3102, 2991, 2839, 1726, 1665, 1580, 1477, 1437, 1383, 1315, 1283, 1256, 1186, 1146, 1111, 1047, 1015, 930, 891, 829, 812, 685, 642, 565, 484, 451.
Соединение III. Бесцветные кристаллы с tпл = = 169°С. ИК-спектр (ν, см−1): 3007, 2943, 2843, 1713, 1657, 1614, 1599, 1477, 1449, 1439, 1383, 1294, 1252, 1180, 1142, 1109, 1049, 1015, 962, 922, 908, 889, 827, 781, 729, 685, 644, 530, 484, 451.
Сольват IV с бензолом. Бесцветные кристаллы с tпл = 147°С. ИК-спектр (ν, см−1): 3088, 2980, 2843, 1645, 1589, 1479, 1439, 1383, 1342, 1323, 1271, 1254, 1182, 1151, 1049, 1015, 955, 836, 818, 765, 756, 681, 642, 519, 486, 447.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Трис(2-метокси-5-хлорфенил)сурьму (I) синтезировали из 5-хлор-2-метоксифениллития и SbCl3 по реакции:
3(5-Cl-2-MeO-C6H3)Li + SbCl3 →
→(5-Cl-2-MeO-C6H3)3Sb(I) + 3LiCl.
Исходное соединение лития получали по методике [12]. Соединение I выделяли после перекристаллизации из бензола в форме сольвата I ⋅ 1/2С6Н6.
Установлено, что дикарбоксилаты трис(2-метокси-5-хлорфенил)сурьмы можно синтезировать с высоким выходом из триарилсурьмы, окислителя и соответствующих карбоновых кислот:
I + 2HOC(O)R + t-BuOOH →
→ (5-Cl-2-MeO-C6H3)3Sb[OC(O)R]2 +
+ t-BuOH + H2O,
R = CH2Br (II), CH2C6H4F-3 (III), C6H3F2-2,3 (IV)
Соединение IV выделяли в виде сольвата IV ⋅ 1/2С6Н6.
В ИК-спектрах соединений I–IV наблюдаются интенсивные полосы при ∼450 (Sb–C), ∼1250 (О–C), ∼1670 (О=C), ∼1470 (Ar), ∼2835 (H–CAlk), ∼3050 см−1 (H–CAr).
По данным РСА, молекула соединения I имеет конфигурацию тригональной пирамиды (рис. 1).
Рис. 1.
Общий вид молекулы I. Для неводородных атомов приведена нумерация и показаны эллипсоиды атомных смещений 50%-ной вероятности.
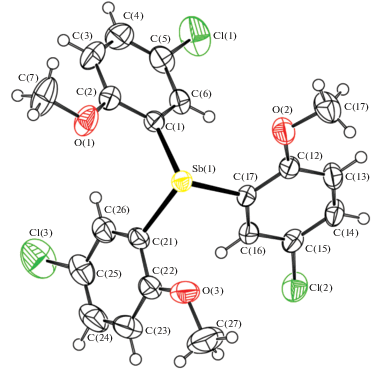
Длины связей Sb–C равны 2.167(2), 2.174(2) и 2.166(2) Å. Атомы кислорода MeO-групп координированы на атом сурьмы. Углы CSbC и внутримолекулярные расстояния Sb∙∙∙O составляют 92.30(7)°, 94.70(8)°, 94.63(8)° и 3.053(1), 3.054(1), 3.011(1) Å соответственно, что сравнимо с аналогичными углами и расстояниями в трис(2-метокси-5-бромфенил)сурьме (92.19(6)°, 94.23(6)°, 94.52(6)° и 2.985(1), 3.051(1), 3.052(1) Å) [12]). Наличие внутримолекулярных контактов в I обусловливает уменьшение валентных углов СSbС по сравнению с производными Ph3Sb (95.15–98.02° [37]) и p-Tol3Sb (97.3° [38]), в которых такие контакты отсутствуют.
В соединениях II–IV атомы Sb имеют искаженную тригонально-бипирамидальную координацию с карбоксилатными лигандами в аксиальных положениях (рис. 2–4). В кристалле II атом брома в одном из бромацетатных лигандов статистически разупорядочен между двумя положениями в соотношении 0.55 : 0.45. В кристалле IV ⋅ 0.5С6Н6 один из 2,3-дифторбензоатных фрагментов имеет ориентационную разупорядоченность.
Рис. 2.
Общий вид молекулы II. Для неводородных атомов приведена нумерация и показаны эллипсоиды атомных смещений 50%-ной вероятности. Для разупорядоченного атома брома показаны два положения: Br(2A) и Br(2B).
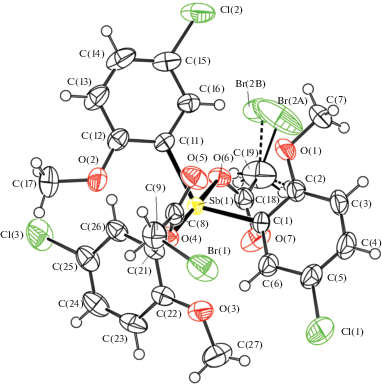
Рис. 3.
Общий вид молекулы III. Для неводородных атомов приведена нумерация и показаны эллипсоиды атомных смещений 50%-ной вероятности. Для разупорядоченного ароматического кольца С(31)–С(36) показаны два положения.
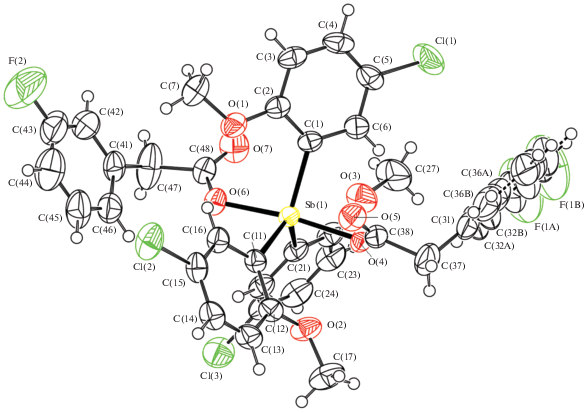
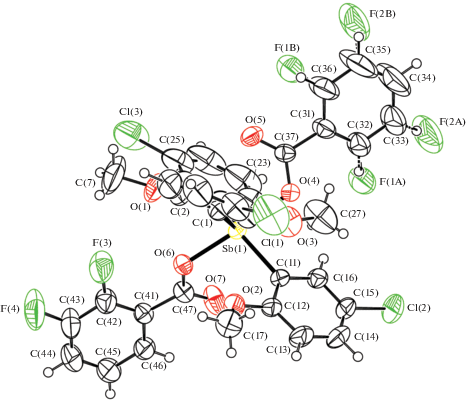
Рис. 4.
Общий вид молекулы IV. Для неводородных атомов приведена нумерация и показаны эллипсоиды атомных смещений 50%-ной вероятности. Один из дифторбензоатных фрагментов имеет ориентационную разупорядоченность.
Суммы валентных углов в экваториальной плоскости составляют 359.96° (II), 359.86° (III), 359.38° (IV). Углы OSbC несколько отклоняются от теоретического значения: 87.44(13)°–97.59(13)° (II), 83.12(9)°–96.14(9)° (III), 82.86(17)°–100.09(7)° (IV). Аксиальные углы OSbO (176.53(7)° в II, 172.97(7)° в III, 177.01(5)° в IV) отличаются от идеального значения 180°. Длины связей Sb−C имеют близкие значения: 2.101(3)–2.116(3) Å в II, 2.100(3)–2.120(2) Å в III, 2.100(2)–2.118(2) Å в IV. Расстояния Sb–O (2.109(3), 2.113(3) Å в II, 2.091(2), 2.091(2) Å в III, 2.1012(19), 2.1346(18) Å в IV) соизмеримы с ковалентными длинами связей Sb–O (2.05 Å [39]). В II–IV бидентатные карбоксилатные лиганды несимметричны, внутримолекулярные расстояния Sb⋅⋅⋅O(=С) равны 3.000(3), 3.181(3) Å в II, 3.171(3), 3.064(3) Å в III и 2.997(2), 3.124(2) Å в IV, что меньше суммы ван-дер-ваальсовых радиусов атомов Sb и O (3.58 Å [40]). Атомы кислорода метоксигрупп в II–IV координированы на атом сурьмы (3.155(1), 3.122(1), 3.110(1) Å для II, 3.182(1), 3.172(1), 3.170(1) Å для III и 3.203(1), 3.119(1), 3.060(1) Å для IV) в меньшей степени, чем в I.
Известно, что карбоксилатные лиганды в молекулах структурно охарактеризованных дикарбоксилатов триарилсурьмы, как правило, расположены таким образом, что внутримолекулярные контакты Sb⋅⋅⋅O(=C) формируются внутри одного экваториального угла, значение которого может возрастать до 161.47(6)° [41]. Однако в соединениях II, III и IV карбонильные атомы кислорода находятся напротив разных экваториальных углов, которые изменяются в интервалах 110.50(12)°–124.81(12)° в II, 115.57(10)°–123.08(10)° в III и 107.43(8)°–126.27(10)° в IV, как и в молекулах дикарбоксилатов трис(2-метокси-5-бромфенил)сурьмы [42], расстояния Sb···OMe (3.110(3)–3.155(3) Å в II, 3.170(3)–3.182(3) Å в III и 3.060(2)–3.203(2) Å в IV) несколько больше, чем в I.
Итак, наличие в II–IV карбоксилатных лигандов, имеющих в своем составе карбонильные атомы кислорода, обусловливает дополнительные невалентные внутримолекулярные взаимодействия Sb⋅⋅⋅O(=C), ослабленные из-за присутствия электроноакцепторных заместителей в радикале R карбоксилатных лигандов, и взаимодействия Sb⋅⋅⋅OMe, приводящие к увеличение КЧ атома сурьмы до 6 в I и 10 в II–IV.
Список литературы
Cambridge Crystallographic Data Center. 2019. deposit@ccdc.cam.ac.uk; http://www.ccdc.cam.ac.uk
Onishi K., Douke M., Nakamura T. et al. // J. Inorg. Biochem. 2012. V. 117. P. 77. https://doi.org/10.1016/j.jinorgbio.2012.09.009
Copolovici D., Isaia F., Breunig H.J. et al. // RSC Advances. 2014. V. 4. P. 26569. https://doi.org/10.1039/C4RA03482A
Copolovici D., Bojan V.R., Rat C.I. et al. // Dalton Trans. 2010. V. 39. P. 6410. https://doi.org/10.1039/C003318A
Okajima S., Yasuike S., Kakusawa N. et al. // J. Organomet. Chem. 2002. V. 656. P. 234. https://doi.org/10.1016/S0022-328X(02)01622-4
Yamamichi H., Matsukawa S., Kojima S. et al. // Heteroat. Chem. 2011. V. 22. P. 553. https://doi.org/10.1002/hc.20721
Reznicek T., Dostal L., Ruzicka A. et al. // Appl. Organomet. Chem. 2012. V. 26. P. 237. https://doi.org/10.1002/aoc.2845
Obata T., Matsumura M., Kawahata M. et al. // J. Organomet. Chem. 2016. V. 807. P. 17. https://doi.org/10.1016/j.jorganchem.2016.02.008
Matano Y., Nomura H., Hisanaga T. et al. // Organometallics. 2004. V. 23. P. 5471. https://doi.org/10.1021/om0494115
Sharutin V.V., Sharutina O.K. // Russ. J. Inorg. Chem. 2015. V. 60. № 12. P. 1491. [Шарутин В.В., Шарутина О.К. // Журн. неорган. химии. 2015. Т. 60. № 12. С. 1631. https://doi.org/10.7868/S0044457X15120211]https://doi.org/10.1134/S0036023615120219
Sharutin V.V., Senchurin V.S., Sharutina O.K. et al. // Russ. Coord. Chem. 2011. V. 37. № 10. С. 781. [Шарутин В.В., Сенчурин В.С., Шарутина О.К. и др. // Коорд. химия. 2011. № 10. С. 782.]https://doi.org/10.1134/S1070328411090089
Sharutin V.V., Senchurin V.S., Sharutina O.K. et al. // Russ. J. Gen. Chem. 2011. V. 81. № 10. P. 2102. [Шарутин В.В., Сенчурин В.С., Шарутина О.К. и др. // Журн. общей химии. 2011. Т. 81. № 10. С. 1649.]https://doi.org/10.1134/S1070363211100100
Sharutin V.V., Senchurin V.S., Sharutina O.K. et al. // Russ. J. Inorg. Chem. 2011. V. 56. № 10. P. 1561. [Шарутин В.В., Сенчурин В.С., Шарутина О.К. и др. // Журн. неорган. химии. 2011. Т. 56. № 10. С. 1640.]https://doi.org/10.1134/S0036023611100196
Matano Y., Nomura H., Suzuki H. // Inorg. Chem. 2000. V. 39. P. 1340. https://doi.org/10.1021/ic991120e
Matano Y., Nomura H., Suzuki H. // Inorg. Chem. 2002. V. 41. P. 1940. https://doi.org/10.1021/ic0110575
Sharutin V.V., Sharutina O.K., Senchurin V.S. et al. // Russ. J. Gen. Chem. 2012. V. 82. № 10. P. 1665. [Шарутин В.В., Шарутина О.К., Сенчурин В.С. и др. // Журн. общей химии. 2012. Т. 82. № 10. С. 1646.]https://doi.org/10.1134/S1070363212100064
Sharutin V.V., Sharutina O.K., Senchurin V.S. // Russ. J. Inorg. Chem. 2014. V. 59. № 4. P. 326. [Шарутин В.В., Шарутина О.К., Сенчурин В.С. // Журн. неорган. химии. 2014. Т. 59. № 4. С. 481. https://doi.org/10.7868/S0044457X14040217]https://doi.org/10.1134/S0036023614040202
Iftikhar T., Rauf M.K., Sarwar S. et al. // J. Organomet. Chem. 2017. V. 851. P. 89. https://doi.org/10.1016/j.jorganchem.2017.09.002
Mushtaq R., Rauf M.K., Bond M. et al. // Appl. Organomet. Chem. 2016. V. 30. № 6. P. 465. https://doi.org/10.1002/aoc.3456
Mushtaq R., Rauf M.K., Bolte M. et al. // Appl. Organomet. Chem. 2017. V. 31. № 5. P. e3606. https://doi.org/10.1002/aoc.3606
Ali M.I., Rauf M.K., Badshah A. et al. // J. Chem. Soc., Dalton Trans. 2013. V. 42. № 48. P. 16733. https://doi.org/10.1039/c3dt51382c
Ma Y.Q., Yu L., Li J.S. // Heteroat. Chem. 2002. V. 13. № 4. P. 299. https://doi.org/10.1002/hc.10033
Islam A., Da Silva J.G., Berbet F.M. et al. // Molecules. 2014. V. 19. № 5. P. 6009. https://doi.org/10.3390/molecules19056009
Liu R.C., Ma Y.Q., Yu L. et al. // Appl. Organomet. Chem. 2003. V. 17. № 9. P. 662. https://doi.org/10.1002/aoc.491
Li J.S., Liu R.C., Chi X.B. et al. // Inorg. Chim. Acta. 2004. V. 357. № 7. P. 2176. https://doi.org/10.1016/j.ica.2003.12.012
Ma Y., Li J., Xuan Z. et al. // J. Organomet. Chem. 2001. V. 620. № 1–2. P. 235. https://doi.org/10.1016/S0022-328X(00)00799-3
Li J.S., Ma Y.Q., Cui J.R. et al. // Appl. Organomet. Chem. 2001. V. 15. № 7. P. 639. https://doi.org/10.1002/aoc.200
Zhang X.-Y., Cui L., Zhang X. et al. // J. Mol. Struct. 2017. V. 1134. P. 742. https://doi.org/10.1016/j.molstruc.2017.01.039
Lowe K., Powell R. // J. Fluor. Chem. 2001. V. 109. № 1. P. 1. https://doi.org/10.1016/S0022-1139(01)00371-2
Smart B.E. // J. Fluor. Chem. 2001. V. 109. № 1. P. 3. https://doi.org/10.1016/S0022-1139(01)00375-X
Шарутин В.В., Шарутина О.К., Ефремов А.Н., Слепухин П.А. // Журнал неорган. химии. 2020. Т. 65. № 7. С. 907. https://doi.org/10.31857/ S0044457X20070193 [V.V. Sharutin, O.K. Sharutina, A.N. Efremov, and P.A. Slepukhin, Russ. J. Inorg. Chem., 65 (7), 992 (2020). https://doi.org/10.1134/S0036023620070190]
Park B.K., Kitteringham N.R. // Drug Metab. Rev. 1994. V. 26. № 3. P. 605. https://doi.org/10.3109/03602539408998319
Maienfisch P., Hall R.G. // Chimia Int. J. Chem. 2004. V. 58. № 3. P. 93. https://doi.org/10.2533/000942904777678091
Bruker (1998). SMART and SAINT-Plus. Versions 5.0. Data Collection and Processing Software for the SMART System. Bruker AXS Inc., Madison, Wisconsin, USA.
Bruker (1998). SHELXTL/PC. Versions 5.10. An Integrated System for Solving, Refining and Displaying Crystal Structures from Diffraction Data. Bruker AXS Inc., Madison, Wisconsin, USA.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Crystallogr. 2009. V. 42. P. 339. https://doi.org/10.1107/S0021889808042726
Adams E.A., Kolis J.W., Pennington W.T. // Acta Crystallogr. 1990. V. C46. P. 917. https://doi.org/10.1071/C96042
Sobolev A.N., Romm I.P., Belskii V.K. et al. // J. Organomet. Chem. 1979. V. 179. P. 153. https://doi.org/10.1016/S0022-328X(00)95217-3
Cordero B., Gómez V., Platero-Prats A.E. et al. // Dalton Trans. 2008. V. 21. P. 2832. https://doi.org/10.1039/B801115J
Mantina M., Chamberlin A.C., Valero R. et al. // J. Phys. Chem. A. 2009. V. 113. № 19. P. 5806. https://doi.org/10.1021/jp8111556
Sharutin V.V., Sharutina O.K., Senchurin V.S. et al. // Russ. J. Gen. Chem. 2009. V. 79. № 10. P. 2131. [Шарутин В.В., Сенчурин В.С., Шарутина О.К. и др. // Журн. общей химии. 2009. Т. 79. № 10. С. 1636.]https://doi.org/10.1134/S1070363209100107
Artem’eva E.V., Sharutin V.V., Sharutina O.K. et al. // Russ. J. Inorg. Chem. 2020. V. 65. № 1. P. 22. [Артемьева Е.В., Шарутин В.В., Шарутина О.К. // Журн. неорган. химии. 2020. Т. 65. № 1. С. 25. https://doi.org/10.31857/S0044457X20010031]https://doi.org/10.1134/S0036023620010039
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии


