Журнал неорганической химии, 2021, T. 66, № 3, стр. 307-316
Электрохимические свойства клозо-декаборатного аниона [B10H10]2– и новый метод получения аниона [B20H18]2–
В. В. Воинова a, И. Н. Клюкин a, *, А. С. Новиков b, А. Я. Козьменкова c, А. П. Жданов a, **, К. Ю. Жижин a, Н. Т. Кузнецов a
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
b Санкт-Петербургский государственный университет, Институт химии
199034 Санкт-Петербург, Университетская набережная, 7–9, Россия
c Институт органической химии им. Н.Д. Зелинского РАН
119991 Москва, Ленинский пр-т, 47, Россия
* E-mail: klukinil@gmail.com
** E-mail: zhdanov@igic.ras.ru
Поступила в редакцию 06.10.2020
После доработки 30.10.2020
Принята к публикации 02.11.2020
Аннотация
Работа посвящена теоретическому и экспериментальному исследованию электрохимических характеристик клозо-декаборатного аниона. Исследованы методом циклической вольтамперометрии области электрохимических превращений аниона [B10H10]2– для неводных растворителей разного строения (ацетонитрил, дихлорметан, тетрагидрофуран). Было показано, что в условиях анодного окисления образуется продукт димеризации – анион [B20H18]2–. Для синтеза октадекагидроэйкозоборатного аниона впервые был применен электрохимический синтез.
ВВЕДЕНИЕ
Поиск универсальных подходов к синтезу веществ с заданными свойствами – одна из основных задач неорганической химии. Данная проблема требует разработки комплексных методов, использующих новейшие разработки смежных областей знаний [1–3]. Использование арсенала электрохимии, фотохимии, металлокомплексного катализа позволяет находить оптимальные пути получения веществ, которые проблематично получить классическими методами координационной химии [4–6]. Применение такого междисциплинарного подхода является перспективной стратегией в синтезе кластерных соединений бора с заданной структурой.
Интерес к кластерным соединениям бора продиктован разнообразием строения и набором уникальных физико-химических свойств [7–10]. К данному классу веществ относятся нидо- и клозо-декабораты, карбораны, металлобораны [11–14]. Указанные соединения обладают высокой термической и окислительной стабильностью и низкой токсичностью [15, 16]. Наиболее актуальным применением кластерных соединений бора по-прежнему остается бор-нейтронозахватная терапия (БНЗТ) [17, 18]. Развитие этого направления требует создания комплекса методов, которые позволят получать кластерные соединения бора с заданным соотношением структура–свойство.
Одним из самых хорошо изученных классов борсодержащих соединений являются клозо-боратные анионы общего вида [BnHn]2–, где n = 10, 12 [19, 20]. Данный класс соединений зарекомендовал себя как одна из самых удобных стартовых платформ для создания бионеорганических борсодержащих платформ.
На данный момент существует множество подходов к направленной функционализации кластерных анионов бора [21–23]. Наиболее распространенным подходом являются процессы электрофильно-индуцируемого нуклеофильного замещения. На основе данного подхода можно получать производные клозо-боратного аниона с экзополиэдрическими связями B–O, B–N, B–S [24, 25].
Клозо-декаборатный анион [B10H10]2– может служить основой для получения октадекагидроэйкозаборатов [B20H18]2– различного строения [26–28]. Интерес к данному классу веществ обусловлен тем, что в одной молекуле октадекагидроэйкозабората содержится в два раза больше атомов бора по сравнению с клозо-декаборатным анионом, что делает этот класс соединений перспективной стартовой платформой для создания на его основе препаратов для БНЗТ. Основная стратегия получения анионов [B20H18]2– заключается в окислении аниона [B10H10]2– в присутствии сильных окислителей: Fe3+, Ce4+, MnO4– [27, 29]. Использование сильных окислителей требует строгого контроля за ходом проведения реакции окисления, так как в противном случае будет происходить полное окисление аниона [B10H10]2– до производных борной кислоты и ее солей. Использование электрохимического синтеза позволяет подобрать условия окисления, при которых происходит исключительно образование целевого октадекагидроэйкозабората [B20H18]2–. Для достижения этой задачи были изучены электрохимические свойства клозо-декаборатного аниона. Ранее [30, 31] было описано электрохимическое окисление аниона [B10H10]2– до октадекагидроэйкозабората [B20H18]2–. Однако в предыдущих работах не был освещен ряд важных моментов, в частности, не показано влияние растворителя на редокс-потенциал аниона [B10H10]2–.
Цель настоящей работы – проведение комплексных физико-химических исследований, направленных на изучение электрохимического поведения аниона [B10H10]2– для разработки метода направленного получения октадекагидроэйкозобората [B20H18]2–.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Элементный анализ на углерод, водород и азот осуществляли на автоматическом газовом анализаторе CHNS-3 FA 1108 Elemental Analyser (Carlo Erba). Определение бора методом ICP MS проводили на атомно-эмиссионном спектрометре с индуктивно-связанной плазмой iCAP 6300 Duo в ЦКП “Научно-аналитического центра ФГУП “ИРЕА” Национального исследовательского центра Курчатовский институт”.
ИК-спектры соединений записывали на ИК-фурье-спектрофотометре Инфралюм ФТ08 (НПФ АП “Люмекс”) в области 4000–400 см–1 с разрешением 1 см–1. Образцы готовили в виде раствора в хлороформе.
Спектры ЯМР 1H, 11B растворов исследуемых веществ в CD3CN записывали на импульсном фурье-спектрометре Bruker MSL-300 (Германия) на частотах 300.3 и 96.32 МГц соответственно с внутренней стабилизацией по дейтерию. В качестве внешнего стандарта использовали тетраметилсилан или эфират трехфтористого бора.
Масс-спектры реакционных растворов в CH3CN записывали на спектрометре API 3200 Qtrap (AppliedBiosysteм, USA). Условия ионизации: турбоионное распыление, ионное распыление, напряжение ±4500 В, декластеризации ±12 В, скорость потока 2–20 мкл/мин. Средняя аналитическая концентрация образцов 0.5–1.0 мг/л.
Растворители очищали по известным методикам [32]. Коммерчески доступные тетрафенилборат и гексафторфосфат тетрабутиламмония использовали без дополнительной очистки. (NBu4)2[B10H10] получали по методике, описанной в литературе [33].
Электрохимические измерения
Для определения электрохимических параметров процессов окисления и восстановления клозо-декабората тетрабутиламмония (NBu4)2[B10H10] методом циклической вольтамперометрии использовали трехэлектродную стеклянную ячейку, оснащенную двумя дополнительными отверстиями, выполняющими роль ввода и вывода для продувки ячейки газом. В качестве рабочего электрода выступал полированный дисковый стеклоуглеродный электрод с диаметром диска 1.7 мм. Перед использованием рабочую поверхность электрода полировали до зеркального блеска с помощью наждачной бумаги Р-2500 (с размером зерна 3–5 мкм) и пасты ГОИ № 1 (с абразивной способностью 0.1–0.3 мкм). Вспомогательным электродом служила платиновая проволока, предварительно обожженная на газовой горелке для удаления окислов и других возможных загрязнений. Потенциалы протекающих процессов измеряли относительно насыщенного хлоридсеребряного электрода сравнения (Е0 = 0.222 В), отделенного от основного объема электролита солевым мостиком. Исследуемые клозо-бораты растворяли в фоновом электролите, представлявшем собой 0.1 М раствор тетрафторбората тетрабутиламмония (NBu4BF4) в ацетонитриле (MeCN), тетрагидрофуране (ТГФ) или дихлорметане (CH2Cl2). Концентрация клозо-боратов составляла 5 × 10–3 М за исключением растворов в ТГФ из-за очень низкой растворимости соединений в последнем (в этом случае использовались концентрации (1–2) × 10–3 М). Перед проведением измерений электролит продували аргоном высокой чистоты через погруженный в раствор капилляр в течение 10 мин для удаления растворенного кислорода.
Запись циклических вольтамперограмм проводили при скорости развертки потенциала 100 мВ/с в диапазоне потенциалов –2.8–2.8 В отн. Ag/AgCl. Для проведения измерений использовали потенциостат IPC-Pro MF производства Эконикс.
Методология проведения квантово-химических расчетов. Полную оптимизацию геометрии всех рассматриваемых структур проводили на уровне теории ωB97X-D3/6-31++G(d,p) в пакете квантово-химических программ Orca 4.1.0 [34]. Размер пространственной сетки интегрирования в инпут-файле задавали с помощью ключевых слов Grid5 и FinalGrid6. Ограниченный по спину метод Кона–Шэма (restricted Kohn–Sham, RKS) использовали для систем с закрытыми оболочками, неограниченный по спину (unrestricted Kohn–Sham, UKS) – для систем с открытыми оболочками. При проведении процедуры оптимизации геометрии ограничения по симметрии для всех модельных структур не вводили. Сольватационные эффекты учитывали с помощью метода SMD. Матрица Гессе была вычислена численно для всех оптимизированных молекул с целью подтверждения того, что полученные структуры являются минимумами на поверхности потенциальной энергии. Orbital Composition Analysis проводили с помощью программы MultiWFN [35].
Функции Фукуи были рассчитаны на основе анализа заселенностей натуральных атомных орбиталей (NPA) [36] с помощью следующего уравнения:
где qk(1–) и qk(2–) – заряды на атоме k в системах 2– и 1– соответственно.Электрохимический синтез проводили на установке IKA ElectraSyn 2.0 в неразделенной электрохимической ячейке. В качестве рабочего использовали стеклоуглеродный электрод, в качестве противоэлектрода – медный электрод с платиновым покрытием, в качестве фонового электролита – 0.1 М растворы тетрафторбората тетрабутиламмония (NBu4BF4) и гексафторбората тетрабутиламмония (NBu4PF6) в ацетонитриле, дихлорметане или тетрагидрофуране. Концентрацию (NBu4)2[B10H10] в экспериментах поддерживали равной 0.045–0.05 моль/л. Синтез проводили в двух режимах: с контролем по потенциалу (0.5 и 2.0 В) и с контролем по току (1 мА).
По окончании процесса реакционную массу концентрировали на роторном испарителе, целевой продукт (NBu4)2[B20H18] перекристаллизовывали из смеси CH3COOH/CF3COOH. Полученный порошок промывали диэтиловым эфиром (2 × 5 мл) и сушили в вакууме. Выход 85%.
(NBu4)2[B20H18] (70% транс-форма, 30% изо-форма) ИК-спектр (CHCl3; см–1): 2553 (ν(B–H)), 1002 (δ(B–B–H)); 11B ЯМР (CD3CN; δ, м.д.): 29.48 (д, JB–H = 146.1 Гц), 14.85 (с), –3.94 (д, JB–H = 161.0 Гц), –8.12 (д, JB–H = 150.6 Гц), –13.58 (д, JB–H = 145.5 Гц), –17.05 (д, JB–H = 126.3 Гц), –20.58 (д, JB–H = 135.4 Гц), –26.76 (д, JB–H = 133.7 Гц), –28.32 (д, JB–H = 167.5 Гц), –29.89 (д, JB–H = 134.3 Гц). 1Н ЯМР (CD3CN; δ, м.д.): 3.10 (м, 16H, NBu4), 1.61 (м, 16H, NBu4), 1.37 (м, 16H, NBu4), 0.99 (м, 24H, NBu4), 1.90–0.20 (уш. м, 20Н, В20Н18).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Определение электрохимических параметров процессов окисления и восстановления (NBu4)2[B10H10] проводили методом циклической вольтамперометрии в трех различных растворителях: ацетонитриле, тетрагидрофуране и дихлорметане. Как видно из ЦВА-кривых (рис. 1, 2) для клозо-декаборатного аниона, во всех рассмотренных растворителях отсутствуют пики на ветвях восстановления, кроме роста тока, связанного с разложением растворителя (в случае дихлорметана). Напротив, при развертке потенциала в сторону его положительных значений наблюдаются хорошо выраженные пики, соответствующие протеканию процессов окисления с участием анализируемых соединений (рис. 1, 2). В табл. 1 представлены значения потенциалов наиболее ранних пиков окисления. Следует отметить, что для (NBu4)2[B10H10] характерен рост потенциала пика окисления в ряду ТГФ–МеСN–CH2Cl2.
Рис. 1.
ЦВА-кривые, полученные для 5 × 10–3 М раствора (NBu4)2[B10H10] в 0.1 M NBu4BF4/MeCN при скорости развертки потенциала 100 мВ/с на стеклоуглеродном дисковом электроде.
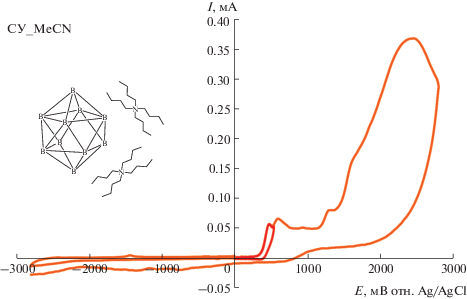
Рис. 2.
ЦВА-кривые, полученные для раствора (NBu4)2[B10H10] в 0.1 M NBu4BF4/ТГФ при скорости развертки потенциала 100 мВ/с на стеклоуглеродном дисковом электроде.
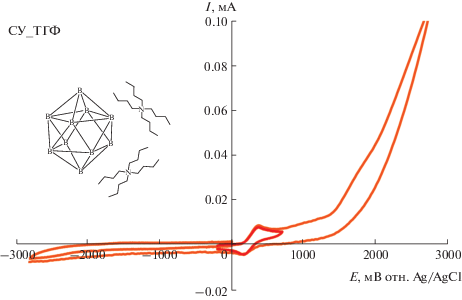
Таблица 1.
Потенциалы пиков окисления $\left( {E_{{\text{p}}}^{{{\text{ox}}}}} \right)$ в 0.1 М NBu4BF4/MeCN, 0.1 М NBu4BF4/ТГФ и 0.1 М NBu4BF4/CH2Cl2, полученные методом циклической вольтамперометрии на дисковом стеклоуглеродном рабочем электроде (d = 1.7 мм) при 298 K
| Соединение | $E_{{\text{p}}}^{{{\text{ox}}}}$ (мВ) отн. Ag/AgCl (100 мВ/с) | E0 (мВ) отн. Ag/AgCl | ||||
|---|---|---|---|---|---|---|
| MeCN | ТГФ | CH2Cl2 | MeCN | ТГФ | CH2Cl2 | |
| (NBu4)2B10H10 | 475 | 373 | 662 | – | 247 | – |
Запись ЦВА-кривых в узком диапазоне потенциалов, захватывающем только наиболее ранний пик окисления (красные кривые на рис. 1, 2), показала, что в случае (NBu4)2[B10H10] процесс является квазиобратимым во всех трех растворителях и ток ответного пика восстановления растет с увеличением скорости развертки потенциала (рис. 3, 4). Немаловажно, что при использовании ТГФ в качестве растворителя форма ЦВА-кривых становится близкой к той, что характерна для обратимых процессов (хотя полной обратимости не наблюдается, рис. 3). Это указывает на стабилизирующую роль ТГФ по отношению к клозо-декаборатному анион-радикалу. ЦВА-кривые, полученные для (NBu4)2[B10H10] в ТГФ при различных скоростях развертки потенциала, были проанализированы путем построения зависимостей потенциалов пиков окисления и восстановления от тока пика (рис. 5, 6). Аппроксимация данных зависимостей до нулевого значения тока позволила определить величины потенциалов окисления и ответного восстановления без влияния нескомпенсированного сопротивления, а также значение формального потенциала (табл. 2).
Рис. 3.
ЦВА-кривые, полученные для раствора (NBu4)2[B10H10] в 0.1 M NBu4BF4/ТГФ при скоростях развертки потенциала 50, 100, 200, 500 и 1000 мВ/с на стеклоуглеродном дисковом электроде.
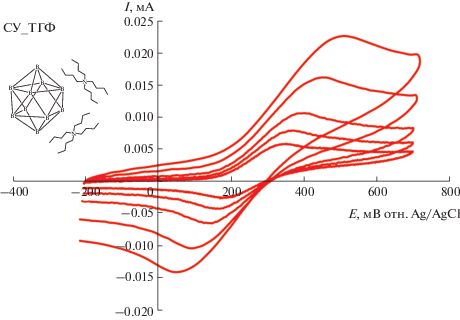
Рис. 4.
ЦВА-кривые, полученные для 5 × 10–3 М раствора (NBu4)2[B10H10] в 0.1 M NBu4BF4/СН2Cl2 при скоростях развертки потенциала 50, 100, 200, 500 и 1000 мВ/с на стеклоуглеродном дисковом электроде.
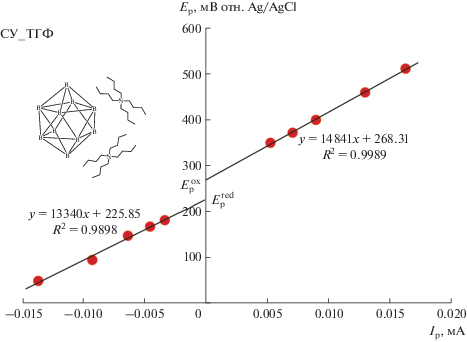
Рис. 5.
Зависимости потенциалов пиков окисления и восстановления от тока в пике для раствора (NBu4)2[B10H10] в 0.1 M NBu4BF4/ТГФ на стеклоуглеродном дисковом электроде.
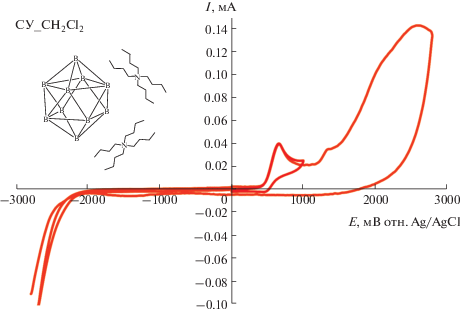
Рис. 6.
ЦВА-кривые, полученные для 5 × 10–3 М раствора (NBu4)2[B10H10] в 0.1 M NBu4BF4/СН2Cl2 при скорости развертки потенциала 100 мВ/с на стеклоуглеродном дисковом электроде.
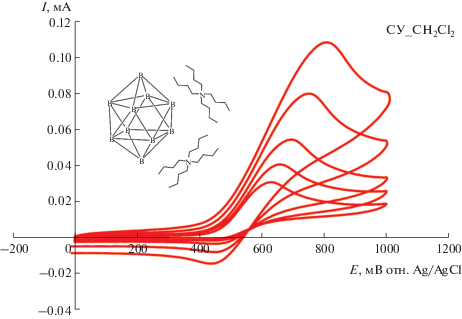
Таблица 2.
Электрохимические характеристики, полученные путем обработки вольтамперных кривых, зарегистрированных при разных скоростях развертки потенциала для (NBu4)2B10H10 в 0.1 М NBu4BF4/ТГФ на дисковом стеклоуглеродном рабочем электроде (d = 1.7 мм) при 298 K
| $E_{{\text{p}}}^{{{\text{red}}}}$ (мВ) отн. Ag/AgCl | $E_{{\text{p}}}^{{{\text{ox}}}}$ (мВ) отн. Ag/AgCl | E0 (мВ) отн. Ag/AgCl | ∆E, мВ |
|---|---|---|---|
| 226 | 268 | 247 | 42 |
В соответствии с полученными данными ЦВА нами был осуществлен подбор оптимальных условий синтеза октадекагидроэйкозаборатного аниона в условиях электрохимического окисления. Так, по данным 11B ЯМР-спектроскопии, проведение реакции в тетрагидрофуране не приводит к получению значимых количеств димерного продукта. Это, очевидно, связано с низкой растворимостью тетрабутиламмониевой соли клозо-декаборатного аниона. Проведение процесса анодного окисления в среде дихлорметана (контроль по току, 1 мА, 2 ч) приводит к образованию продуктов хлорирования кластера. Использование в качестве растворителя ацетонитрила позволяет избежать указанных негативных факторов и селективно получить целевой эйкозоборат.
Следует отметить, что строение анодной части фонового электролита не влияет на состав продуктов. Кроме того, нами был осуществлен электрохимический синтез без использования фонового электролита (рис. 4). Однако в таком случае протекают побочные процессы с участием растворителя, так как потенциал в системе резко возрастает со снижением концентрации носителей заряда.
Проведение синтеза в условиях контроля потенциала в области наиболее раннего пика окисления (0.5 В) позволяет получить продукт димеризации, время процесса при этом составляет порядка 20 ч. Повышение рабочего потенциала до 2.0 В существенно сокращает время синтеза. Так, полная конверсия исходного клозо-декабората наблюдается за 3 ч. Стоит отметить, что ни в одном из экспериментов не наблюдалось образования продуктов глубокого окисления борного остова (боратов, борной кислоты), в отличие от известных методик получения аниона [B20H18]2–.
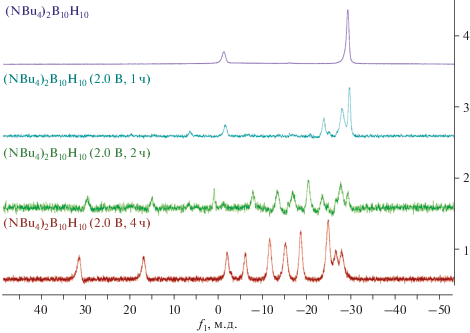
Контроль за ходом процесса осуществляли с помощью 11B ЯМР-спектроскопии. Так, на первоначальных стадиях удается зафиксировать образование продукта одноэлектронного окисления – [B10H10]–, который затем димеризуется с выделением водорода на аноде (рис. 7). В спектре (NBu4)2[B20H18] наблюдаются два набора сигналов: от продукта в транс-форме при 29.48, 14.85, –8.12, –13.58, –17.05, –20.58 и –28.32 м.д. с соотношением интегральных интенсивностей 1 : 1 : 1 : 2 : 2 : 2 : 1 и от изо-формы аниона [B20H18]2– при –3.94, –26.76 и –29.89 м.д. с соотношением интегральных интенсивностей 2 : 7 : 1. Полученные данные хорошо согласуются с найденными ранее [26, 37] для данного аниона.
Рис. 7.
11B ЯМР-спектры реакционных растворов процесса электрохимического окисления клозо-декаборатного аниона в условиях контроля потенциала (2.0 В, 0.1M NBu4PF6 в CH3CN).
Кроме того, состав реакционной смеси анализировали с помощью ESI-масс-спектрометрии. Так, в анионной части масс-спектров помимо интенсивного пика фонового электролита [PF6]– при 145.9 а. е. м. наблюдается пик аниона {[B20H18]2– + + NBu4}– при 477.5 а. е. м. (расч. 477.7 а. е. м.).
Одной из задач данной работы было определение активного центра в клозо-декаборатном анионе, в котором происходит первоначальный отрыв электрона с образованием анион-радикала [B10H10]–. Для решения этой задачи были использованы методы квантово-химического моделирования. Расчеты были проведены в газовой фазе и с учетом сольватационных эффектов. В качестве растворителей применяли ацетонитрил CH3CN, дихлорметан CH2Cl2, тетрагидрофуран C4H8O. Для определения целевого активного центра мы использовали функции Фукуи. Данные дескрипторы позволяют оценить изменения в электронной плотности при добавлении или отрыве электрона в целевой молекуле. Функции Фукуи были рассчитаны в газовой фазе и с учетом влияния растворителя. Заряды на атомах были рассчитаны с помощью метода натуральных орбиталей (NBO) (табл. 3). На основе рассчитанных зарядов было выявлено, что атомы бора в апикальных позициях имеют наибольшие отрицательные заряды. Чем большее значение функции Фукуи имеет атом, тем больше вероятность того, что отрыв электрона произойдет именно от этого атома. Было обнаружено, что в газовой фазе наибольшие значения функции Фукуи имеют атомы бора в экваториальных позициях, тогда как при учете сольватационных эффектов наибольшие значения имеют атомы бора в апикальных позициях. При этом функции Фукуи в дихлорметане CH2Cl2 и тетрагидрофуране C4H8O практически идентичны. В случае ацетонитрила CH3CN различие между функциями Фукуи для апикальных позиций и всех остальных атомов наиболее явное. Дополнительно мы использовали Orbital Composition Analysis по методу Хиршфилда, позволяющий оценить вклад атома в молекулярную орбиталь. Для данного исследования мы выбрали ВЗМО [B10H10]2–, так как процесс элиминирования электрона происходит именно с этой орбитали. Как видно из табл. 4, наибольший вклад вносят атомные орбитали апикальных атомов бора (рис. 8).
Таблица 3.
Заряды и функции Фукуи для атомов в клозо-декаборатном анионе [B10H10]2–, рассчитанные на основе анализа заселенностей натуральных атомных орбиталей (NPA) в газовой фазе и с учетом сольватационных эффектов. qk – заряд на атоме k. $f_{k}^{--}$ – функция Фукуи для атома k
| Вариант | qk | $f_{k}^{--}$ | qk | $f_{k}^{--}$ | qk | $f_{k}^{--}$ | qk | $f_{k}^{--}$ |
|---|---|---|---|---|---|---|---|---|
| газ. фаза | CH3CN | C4H8O | CH2Cl2 | |||||
| Bap(1) | –0.261 | 0.096 | –0.278 | 0.357 | –0.275 | 0.109 | –0.275 | 0.109 |
| Beq(2) | –0.200 | 0.078 | –0.215 | 0.246 | –0.213 | 0.086 | –0.214 | 0.086 |
| Beq (3) | –0.200 | 0.088 | –0.216 | 0.079 | –0.214 | 0.098 | –0.214 | 0.099 |
| Beq(4) | –0.200 | 0.078 | –0.215 | 0.246 | –0.213 | 0.086 | –0.214 | 0.086 |
| Beq(5) | –0.200 | 0.088 | –0.216 | 0.079 | –0.214 | 0.098 | –0.214 | 0.099 |
| Hap(6) | 0.003 | 0.020 | 0.023 | –0.004 | 0.020 | 0.008 | 0.021 | 0.008 |
| Heq(7) | 0.015 | 0.013 | 0.029 | –0.001 | 0.027 | 0.004 | 0.028 | 0.004 |
| Heq(8) | 0.015 | 0.013 | 0.029 | 0.000 | 0.027 | 0.003 | 0.028 | 0.003 |
| Heq(9) | 0.015 | 0.013 | 0.029 | –0.001 | 0.027 | 0.004 | 0.028 | 0.004 |
| Heq(10) | 0.015 | 0.013 | 0.029 | 0.000 | 0.027 | 0.003 | 0.028 | 0.003 |
| Beq(11) | –0.201 | 0.068 | –0.218 | 0.116 | –0.214 | 0.106 | –0.214 | 0.107 |
| Bap(12) | –0.261 | 0.096 | –0.275 | 0.353 | –0.274 | 0.108 | –0.274 | 0.108 |
| Beq(13) | –0.201 | 0.098 | –0.215 | 0.210 | –0.214 | 0.078 | –0.214 | 0.079 |
| Beq(14) | –0.201 | 0.068 | –0.218 | 0.116 | –0.214 | 0.106 | –0.214 | 0.107 |
| Beq(15) | –0.201 | 0.098 | –0.215 | 0.210 | –0.214 | 0.078 | –0.214 | 0.079 |
| Heq(16) | 0.015 | 0.013 | 0.029 | 0.000 | 0.027 | 0.002 | 0.027 | 0.002 |
| H(17) | 0.015 | 0.013 | 0.030 | –0.001 | 0.027 | 0.005 | 0.028 | 0.005 |
| H(18) | 0.015 | 0.013 | 0.029 | 0.000 | 0.027 | 0.002 | 0.027 | 0.002 |
| H(19) | 0.015 | 0.013 | 0.030 | –0.001 | 0.027 | 0.005 | 0.028 | 0.005 |
| Hap(20) | 0.003 | 0.020 | 0.023 | –0.004 | 0.020 | 0.009 | 0.021 | 0.008 |
Таблица 4.
Вклад атомов клозо-боратного аниона [B10H10]2– в ВЗМО на основе данных Orbital Composition Analysis по методу Хиршфилда, рассчитанный в газовой фазе и с учетом сольватационных эффектов, %
| Вариант | Газ. фаза | CH3CN | C4H8O | CH2Cl2 |
|---|---|---|---|---|
| Bap(1) | 15.93 | 15.95 | 15.95 | 15.95 |
| Beq(2) | 5.30 | 11.89 | 11.86 | 11.85 |
| Beq(3) | 9.61 | 3.02 | 3.05 | 3.05 |
| Beq(4) | 5.30 | 11.89 | 11.86 | 11.85 |
| Beq(5) | 9.61 | 3.02 | 3.05 | 3.05 |
| H(6) | 1.33 | 1.33 | 1.33 | 1.33 |
| H(7) | 0.42 | 1.35 | 1.34 | 1.34 |
| H(8) | 1.02 | 0.11 | 0.11 | 0.11 |
| H(9) | 0.42 | 1.35 | 1.34 | 1.34 |
| H(10) | 1.02 | 0.11 | 0.11 | 0.11 |
| Beq(11) | 3.55 | 7.53 | 8.00 | 8.04 |
| Bap(12) | 15.94 | 15.96 | 15.95 | 15.95 |
| Beq(13) | 11.37 | 7.38 | 6.92 | 6.87 |
| Beq(14) | 3.55 | 7.53 | 8.00 | 8.04 |
| Beq(15) | 11.37 | 7.38 | 6.92 | 6.87 |
| H(16) | 0.18 | 0.74 | 0.80 | 0.81 |
| H(17) | 1.27 | 0.72 | 0.65 | 0.64 |
| H(18) | 0.18 | 0.74 | 0.80 | 0.81 |
| H(19) | 1.27 | 0.72 | 0.65 | 0.64 |
| H(20) | 1.33 | 1.33 | 1.33 | 1.33 |
Рис. 8.
ВЗМО клозо-боратного аниона [B10H10]2–. Звездочкой отмечены атомы, вносящие наибольший вклад в ВЗМО на основе данных Orbital Composition Analysis по методу Хиршфилда.
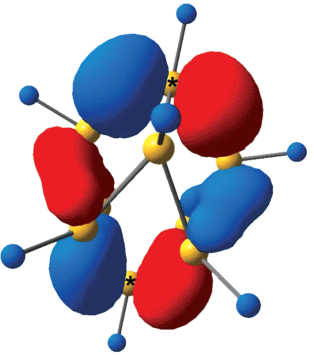
Таким образом, на основе квантово-химических расчетов установлено, что в клозо-боратном анионе первоначальный отрыв электрона происходит от апикальной позиции.
ЗАКЛЮЧЕНИЕ
В работе методом циклической вольтамперометрии изучены закономерности протекания процессов электрохимического окисления клозо-декаборатного аниона, на основе которого предложен селективный метод синтеза солей аниона [B20H18]2–. Кроме того, на основе квантово-химических расчетов проанализирован процесс одноэлектронного окисления в анионе [B10H10]2–.
Список литературы
Yan M., Kawamata Y., Baran P.S. // Chem. Rev. 2017. V. 117. № 21. P. 13230. https://doi.org/10.1021/acs.chemrev.7b00397
Reza Ghiasi, Rahimi M., Jamaat P.R. // Russ. J. Inorg. Chem. 2020. V. 65. № 1. P. 69. https://doi.org/10.1134/S0036023620010088
Tian A.X., Fu Y.B., Ni H.P. et al. // Russ. J. Inorg. Chem. 2020. V. 65. № 3. P. 359. https://doi.org/10.1134/S0036023620030183
Ming Zhao, Xiaoli Zhou // Russ. J. Inorg. Chem. 2020. V. 65. № 8. P. 1166. https://doi.org/10.1134/s0036023620080203
Xue-Wen Liu, Liu N.-Y., Deng Y.-Q. et al. // Russ. J. Inorg. Chem. 2020. V. 65. № 8. P. 1186. https://doi.org/10.1134/s0036023620080094
Sonone A.V., Shaikh M., Farooqui M. et al. // Russ. J. Inorg. Chem. 2020. V. 65. № 3. P. 390. https://doi.org/10.1134/S003602362003016X
Klyukin I.N., Novikov A.S., Zhdanov A.P. et al. // Mendeleev Commun. 2020. V. 30. № 1. P. 88. https://doi.org/10.1016/j.mencom.2020.01.029
Keener M., Hunt C., Carroll T.G. et al. // Nature. 2020. V. 577. № 7792. P. 652. https://doi.org/10.1038/s41586-019-1926-4
Avdeeva V.V., Malinina E.A., Vologzhanina A.V. et al. // Inorg. Chim. Acta. 2020. V. 509. № March. P. 119693. https://doi.org/10.1016/j.ica.2020.119693
Fisher S.P., Tomich A.W., Lovera S.O. et al. // Chem. Rev. 2019. V. 119. № 14. P. 8262. https://doi.org/10.1021/acs.chemrev.8b00551
Shmal’ko A.V., Sivaev I.B. // Russ. J. Inorg. Chem. 2019. V. 64. № 14. P. 1726. https://doi.org/10.1134/S0036023619140067
Nandi C., Kar S., Zafar M. et al. // Inorg. Chem. 2020. V. 59. № 6. P. 3537. https://doi.org/10.1021/acs.inorgchem.0c00122
Yan H., Tu D., Poater J. et al. // Angew. Chem. Int. Ed. 2020. https://doi.org/10.1002/anie.201915290
Hsu M.H., Hsieh C.Y., Kapoor M. et al. // Bioorg. Chem. 2020. V. 98. P. 103729. https://doi.org/10.1016/j.bioorg.2020.103729
Olid D., Núñez R., Viñas C. et al. // Chem. Soc. Rev. 2013. V. 42. P. 3318. https://doi.org/10.1039/c2cs35441a
Viñas I Teixidor C. // Future Med. Chem. 2013. V. 5. № 6. P. 617. https://doi.org/10.4155/fmc.13.41
Sivaev I.B., Bregadze V.V. // Eur. J. Inorg. Chem. 2009. № 11. P. 1433. https://doi.org/10.1002/ejic.200900003
Sivaev I.B., Prikaznov A.V., Naoufal D. // Collect. Czechoslov. Chem. Commun. 2010. V. 75. № 11. P. 1149. https://doi.org/10.1135/cccc2010054
Zhizhin K.Y., Zhdanov A.P., Kuznetsov N.T. // Russ. J. Inorg. Chem. 2010. V. 55. № 14. P. 2089. https://doi.org/10.1134/S0036023610140019
Semioshkin A.A., Sivaev I.B., Bregadze V.I. // Dalton Trans. 2008. V. 11. № 8. P. 977. https://doi.org/10.1039/b715363e
Laila Z., Yazbeck O., Ghaida F.A. et al. // J. Organomet. Chem. 2020. V. 910. P. 121132. https://doi.org/10.1016/j.jorganchem.2020.121132
Zhdanov A.P., Voinova V.V., Klyukin I.N. et al. // J. Clust. Sci. 2019. V. 2. https://doi.org/10.1007/s10876-019-01628-2
Burianova V.K., Bolotin D.S., Mikherdov A.S. et al. // New J. Chem. 2018. V. 42. № 11. P. 8693. https://doi.org/10.1039/c8nj01018h
Nelyubin A.V., Klyukin I.N., Zhdanov A.P. et al. // Russ. J. Inorg. Chem. 2019. V. 64. № 14. P. 1750. https://doi.org/10.1134/S0036023619140043
Zhdanov A.P., Nelyubin A.V., Klyukin I.N. et al. // Russ. J. Inorg. Chem. 2019. V. 64. № 7. P. 841. https://doi.org/10.1134/S0036023619070180
Avdeeva V.V., Buzin M.I., Dmitrienko A.O. et al. // Chem. A Eur. J. 2017. V. 23. № 66. P. 16819. https://doi.org/10.1002/chem.201703285
Hawthorne M.F., Shelly K., Li F. // Chem. Commun. 2002. V. 2. № 6. P. 547. https://doi.org/10.1039/b110076a
Bernhardt E., Brauer D.J., Finze M. et al. // Angew. Chem. Int. Ed. 2007. V. 46. № 16. P. 2927. https://doi.org/10.1002/anie.200604077
Muetterties E.L. // Inorg. Chem. 1964. V. 231. P. 1450.
Middaugh R.L., Farha F.J. // Inorg. Chem. 1965. P. 4147.
Schmitt A.P., Middaugh R.L. // Inorg. Chem. 1974. V. 13. № 1. P. 163. https://doi.org/10.1021/ic50131a031
Williams D.B.G., Lawton M. // J. Org. Chem. 2010. V. 75. № 24. P. 8351. https://doi.org/10.1021/jo101589h
Hawthorne M.F., Pilling R.L., Knoth W.H. // Inorg. Synth. 1967. P. 16. https://doi.org/10.1002/9780470132401.ch6
Neese F. // WIREs Comput. Mol. Sci. 2012. V. 2. № 1. P. 73. https://doi.org/10.1002/wcms.81
Lu T., Chen F. // J. Comp. Chem. 2011. V. 33. P. 580. https://doi.org/10.1002/jcc.22885
NBO 7.0. Glendening E.D., Badenhoop J.K. et al. Theoretical Chemistry Institute, University of Wisconsin, Madison. 2018
Avdeeva V.V., Malinina E.A., Goeva L.V. et al. // Dokl. Chem. 2017. V. 474. № 2. P. 141. https://doi.org/10.1134/S0012500817060052
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии


