Журнал неорганической химии, 2021, T. 66, № 4, стр. 498-509
Квазитройная система Bi2S3–Bi2Te3–BiI3
Э. Дж. Ахмедов a, З. С. Алиев b, Д. М. Бабанлы b, c, С. З. Имамалиева a, В. А. Гасымов a, М. Б. Бабанлы a, *
a Институт катализа и неорганической химии НАН Азербайджана
Az-1143 Баку, пр-т Г. Джавида, 113, Азербайджан
b Азербайджанский государственный университет нефти и промышленности
Az-1010 Баку, пр-т Азадлыг, 16/21, Азербайджан
c Азербайджано-французский университет
Az-1010 Баку, ул. Низами 183, Азербайджан
* E-mail: babanlymb@gmail.com
Поступила в редакцию 09.10.2020
После доработки 24.11.2020
Принята к публикации 30.11.2020
Аннотация
Методами дифференциального термического и рентгенофазового анализа, а также сканирующей электронной микроскопии изучены фазовые равновесия в квазитройной системе Bi2S3–Bi2Te3–BiI3. Построены изотермические сечения при 300, 750, 800 и 850 K, некоторые политермические разрезы, а также проекция поверхности ликвидуса. Определены поля первичной кристаллизации и области гомогенности фаз, а также типы и координаты нон- и моновариантных равновесий. Показано, что система характеризуется образованием ограниченных областей твердых растворов на основе сульфида и теллурида висмута, а также тройных соединений Bi2Te2S, BiSI и BiTeI.
ВВЕДЕНИЕ
Халькогалогениды элементов подгруппы мышьяка находятся в центре внимания исследователей с середины прошлого века как ценные сегнетоэлектрические, термоэлектрические, фотовольтаические, магнитные и оптические материалы [1–8]. В последние годы установлено, что теллурогалогениды висмута и фазы на их основе проявляют также свойства топологического изолятора и демонстрируют 3D спиновое расщепление Рашбы, что открывает возможности их использования при разработке спиновых электронных устройств [9–15].
Разработка физико-химических основ направленного синтеза новых многокомпонентных соединений и фаз переменного состава связана с фундаментальными исследованиями в области фазовых равновесий и термодинамических свойств соответствующих систем [16–19].
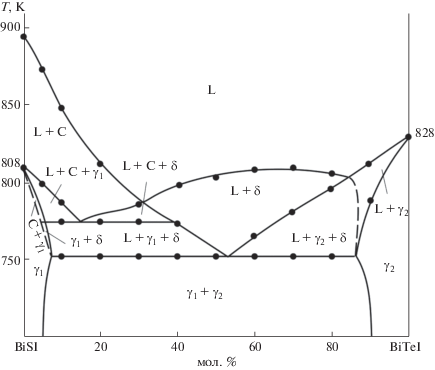
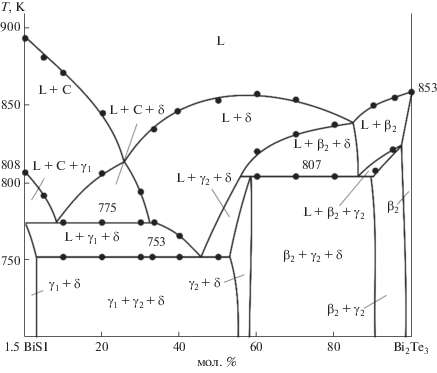
В работах [20–24] нами проведены подобные комплексные исследования тройных систем типа BV–X–I (BV = As, Sb, Bi; X = S, Se, Te), построены их полные фазовые диаграммы, определены термодинамические функции промежуточных фаз. Для получения твердых растворов на основе соединений типа BVXI целесообразно изучить фазовые равновесия в квазитройных ${\text{B}}_{2}^{{\text{V}}}{{{\text{Х}}}_{3}}{\kern 1pt} --{\kern 1pt} {\text{B}}_{2}^{{\text{V}}}{\text{Х}}_{3}^{'}{\kern 1pt} --{\kern 1pt} {{{\text{B}}}^{{\text{V}}}}{{{\text{I}}}_{3}}$ (Х и Х' – два разных халькогена) и взаимных Sb2X3 + + 2BiI3 ↔ Bi2X3 + 2SbI3 системах. В [25] нами приведены данные по фазовым равновесиям в системе Bi2Sе3–Bi2Te3–BiI3. В работе [26] представлен политермический разрез BiSI–BiTeI фазовой диаграммы системы Bi2S3–Bi2Te3–BiI3 (рис. 1). Установлено, что этот разрез в целом неквазибинарный в силу инконгруэнтного характера плавления BiSI, но стабильный ниже солидуса и характеризуется образованием ограниченных областей гомогенности на основе исходных соединений.
В настоящей работе представлена полная фазовая диаграмма квазитройной системы Bi2S3–Bi2Te3–BiI3 (А).
Исходные бинарные соединения системы А являются ценными функциональными материалами, как и вышеуказанные тройные. Соединения Bi2S3 и BiI3, благодаря уникальным оптическим свойствам, могут быть использованы в оптических транзисторах, широкополосных фотодетекторах и других фотоэлектрических приложениях [27–31], а известный термоэлектрик Bi2Te3 проявляет также свойства топологического изолятора [32–35] и чрезвычайно перспективен для разнообразных приложений, начиная от спинтроники и квантовых расчетов и кончая медициной и системами безопасности [36–38].
Соединения BiI3, Bi2Te3 и Bi2S3 плавятся конгруэнтно при 681, 859 и 1048 K соответственно [39]. Их кристаллографические свойства приведены в работах [40–47] (табл. 1).
Таблица 1.
Кристаллографические данные бинарных и тройных соединений системы Bi2Te3–BiI3–Bi2S3
| Соединение | Сингония, пр. гр., параметры, Å | Источник |
|---|---|---|
| Bi2S3 | Орторомбическая, Pbnm, a = 11.150, b = 11.300, c = 3.981 | [49] |
| Bi2Te3 | Гексагональная, R3m, a = 4.3849, c = 30.4971 | [48] |
| BiI3 | Тригональная, R$\bar {3}$, a = 7.535, c = 20.703 | [47] |
| BiSI | Орторомбическая, Pnma, a = 8.529, b = 4.172, c = 10.177 | [46] |
| Bi19S27I3 | Гексагональная, 63/m, a = 15.640, c = 4.029(2) | [50] |
| BiTeI | Тригональная, P3m1, a = 4.3392(1), c = 6.854(1) | [45] |
| Bi2Te2S | Гексагональная, R3m, a = 4.326, c = 30.07 | [44, 51] |
Граничные квазибинарные составляющие системы А подробно изучены. Согласно [47, 48], в системе Bi2Te3–Bi2S3 образуется фаза переменного состава, область гомогенности которой включает минерал тетрадимит Bi2Te2S. Это соединение плавится конгруэнтно при 898 K и имеет ромбоэдрическую структуру. Фазовая диаграмма системы Bi2Te3–BiI3 характеризуется образованием тройного соединения BiTeI с конгруэнтным плавлением при 828 K [24, 49, 50] и тригональной структурой. По данным [24, 51], существуют также теллуроиодиды висмута состава Bi2TeI и Bi4TeI1.25. В системе Bi2S3–BiI3 образуются два тройных соединения: BiSI и Bi19S27I3, которые плавятся с разложением по перитектическим реакциям при 808 и 990 K соответственно [22, 52]. Соединение BiSI кристаллизуется в орторомбической структуре, а Bi19S27I3 имеет гексагональную решетку. Типы и параметры кристаллических решеток всех указанных тройных соединений приведены в табл. 1.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез. Исходные соединения Bi2S3, Bi2Te3, BiI3, Bi2Te2S, BiTeI и BiSI были синтезированы сплавлением высокочистых (не менее 99.999 ат. %) элементарных компонентов в условиях вакуума (∼10–2 Па) при температурах на 30–50 K выше их температур плавления. Учитывая высокое давление паров элементарного иода и серы, иод- и серосодержащие соединения синтезировали в двухзонной печи. Температура “горячей” зоны была на 30–50 K выше температуры плавления синтезируемого соединения, а температура “холодной” зоны составляла 400 и 650 K (соответственно ниже температуры кипения иода и серы [53, 54]). Учитывая инконгруэнтный характер плавления соединения BiSI, после сплавления для его полной гомогенизации литой сплав отжигали при 750 K в течение 300 ч.
Индивидуальность всех синтезированных соединений контролировали методами ДТА и РФА, результаты которых находились в соответствии с литературными данными [22, 24, 39, 47] (табл. 1).
Сплавлением синтезированных соединений в различных соотношениях в вакуумированных кварцевых ампулах были получены две серии образцов различного состава (каждый по 0.5 г). После сплавления образцы подсистемы Bi2S3–BiSI–BiTeI–Bi2Te3 подвергали термообработке при 700 K, а образцы подсистемы BiSI–BiTeI–BiI3 – при 650 K в течение 600 ч.
Анализ. Исследования проводили методами дифференциального термического (ДТА), рентгенфазового (РФА) анализа и сканирующей электронной микроскопии (СЭМ).
Кривые ДТА снимали на дифференциальном сканирующем калориметре Netzsch 404 F1 Pegasus system и на установке многоканального ДТА, собранной на основе электронного регистратора данных TC-08 Thermocouple Data Logger. Скорость нагрева составляла 7–10 град/мин. При этом образцы находились в откачанных до остаточного давления ∼10–2 Па и запаянных кварцевых ампулах (внутренний диаметр 0.5 см, длина 2.5–3 см), свободные объемы которых не превышали 0.5 см2. Поэтому, несмотря на летучесть BiI3, изменение состава при снятии термограмм незначительно и им можно пренебречь.
Порошковые рентгенограммы исходных соединений и промежуточных сплавов снимали на дифрактометре Bruker D8 с CuKα1-излучением в интервале углов 2θ 5°–75° и индицировали с помощью программного обеспечения TopasV3.0.
СЭМ-картины снимали на растровом электронном микроскопе Tescan Vega 3 SBH.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Совместная обработка полученных экспериментальных результатов, а также литературных данных по граничным квазибинарным системам [22, 24, 47, 48] и внутреннему сечению BiSI–BiTeI [26] (рис. 1) позволила получить полную взаимосогласованную картину фазовых равновесий в системе А.
Твердофазные равновесия при 300 K
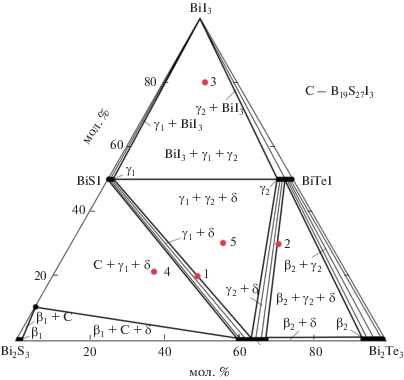
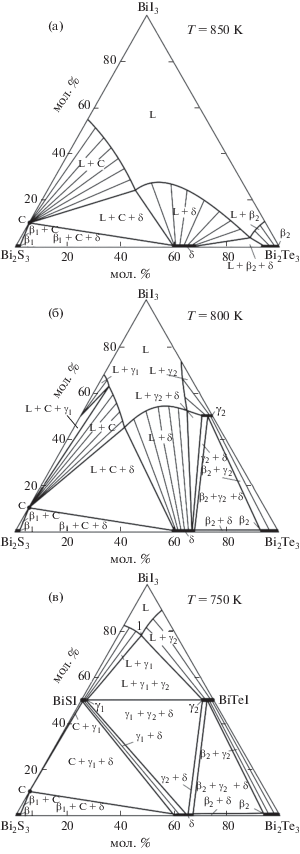
Изотермическое сечение фазовой диаграммы при 300 K (рис. 2) показывает, что в системе четверные соединения не образуются. Система характеризуется образованием ограниченных областей твердых растворов на основе бинарных Bi2S3 (β1-фаза), Bi2Te3 (β2) и тройных соединений BiSI (γ1), BiTeI (γ2), Bi2Te2S (δ). Растворимость на основе соединений BiI3 и Bi19S27I3 (С) незначительна. Вышеуказанные фазы образуют ряд двухфазных (β1 + C, β2 + γ2, δ + C, β2 + δ, γ1 + δ и γ2 + δ, γ1 + γ2, γ1 + BiI3, γ2 + BiI3) и трехфазных областей (β1 + C+ δ, C + γ1 + δ, γ1 + γ2 + δ, β2 + γ2 + δ и γ1 + + γ2 + BiI3).
Из рис. 2 видно, что в области концентраций Bi2S3–BiSI–BiTeI–Bi2Te3 система А обратимо взаимна, т.е. не имеет стабильной диагонали. Определяющая роль в формировании фазовых полей в этой подсистеме принадлежит δ-фазе на основе тетрадимита, которая образует конноды со всеми фазами подсистемы.
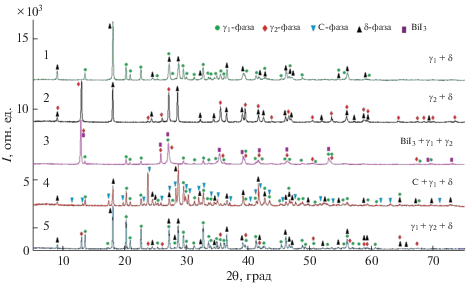
Все фазовые области на рис. 2 подтверждены методами РФА и СЭМ. В качестве примера на рис. 3 представлены порошковые дифрактограммы ряда сплавов из двух- и трехфазных областей (рис. 2, красные кружки 1–5). Видно, что дифрактограмма образца 1 состоит из совокупности линий отражения γ1 и δ, а образца 2 – линий отражения γ2 и δ. Остальные три дифрактограммы четко отражают их трехфазность и составы сосуществующих фаз: γ1 + γ2 + BiI3 (сплав 3), C + γ1 + δ (сплав 4), γ1 + γ2 + δ (сплав 5).
СЭМ-картины (рис. 4) поверхностей образцов 1, 2 и 5 также находятся в полном соответствии с рис. 2: первые две состоят из двухфазных смесей γ1 + δ и γ2 + δ, третья – из трехфазной смеси γ1 + + γ2 + δ.
Проекция поверхности ликвидуса
Ликвидус системы А (рис. 5) состоит из 7 полей, отвечающих первичной кристаллизации следующих фаз: C, β1, β2, γ1, γ2, δ, BiI3. Наибольшей протяженностью обладают области 1–3, отражающие первичную кристаллизацию β1-, C- и δ-фаз. Поверхность ликвидуса соединения BiI3 практически вырождена.
Рис. 5.
Проекция поверхности ликвидуса системы А. Поля первичной кристаллизации: 1 – β1; 2 – C; 3 – δ; 4 – β2; 5 – γ1; 6 – γ2; 7 – BiI3. Пунктирная прямая – разрез BiTeI–BiSI.
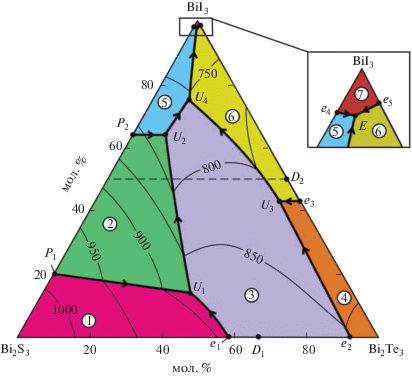
Поля первичной кристаллизации фаз разграничены двумя перитектическими (P1U1, P2U2) и девятью эвтектическими (e1U1, U1U2, e2U3, e3U3, U2U4, U3U4, U4E, e4E, e5E) кривыми равновесия. Точки пересечения кривых моновариантных равновесий отвечают нонвариантным переходным (U1, U2, U3 и U4) и эвтектическому (E) равновесиям (табл. 2, 3).
Таблица 2.
Нонвариантные равновесия в системе Bi2S3–Bi2Te3–BiI3
| Точка на рис. 5 | Равновесие | Состав, мол. % | T, K | |
|---|---|---|---|---|
| BiI3 | Bi2Te3 | |||
| D1 | L ↔ Bi2Te2S | − | 66.67 | 898 |
| D2 | L ↔ BiTeI | 50 | 50 | 828 |
| P1 | L + β1 ↔ C | 20 | − | 990 |
| P2 | L + C ↔ γ1 | 63 | − | 808 |
| U1 | L + β1 ↔ δ + c | 13 | 880 | |
| U2 | L + C ↔ γ1 + δ | 64 | 775 | |
| U3 | L + β2 ↔ γ2 + δ | 43 | 807 | |
| U4 | L + δ ↔ γ1 + γ2 | 74 | 753 | |
| e1 | L ↔ β1 + β2 | − | 59 | 895 |
| e2 | L ↔ β2 + δ | − | 91 | 853 |
| e3 | L ↔ β2 + γ2 | 43 | 57 | 823 |
| e4 | L ↔ γ1 + BiI3 | 97 | − | 670 |
| e5 | L ↔ γ2 + BiI3 | ~99 | ~1 | 680 |
| E | L ↔ γ1 + γ2 + BiI3 | ~99 | 1 | 668 |
Таблица 3.
Моновариантные равновесия в системе Bi2S3–Bi2Te3–BiI3
| Кривая на рис. 5 | Равновесие | T, K |
|---|---|---|
| e1U1 | L ↔ β1 + δ | 895–880 |
| P1U1 | L + β1 ↔ C | 990–880 |
| U1U2 | L ↔ C + δ | 880–775 |
| P2U2 | L + C ↔ γ1 | 808–775 |
| U2U4 | L ↔ γ1 + δ | 775–753 |
| e2U3 | L ↔ β2 + δ | 853–807 |
| e3U3 | L ↔ β2 + γ2 | 823–807 |
| U3U4 | L ↔ γ2 + δ | 807–753 |
| U4E | L ↔ γ1 + γ2 | 753–668 |
| e4E | L ↔ γ1 + BiI3 | 670–668 |
| e5E | L ↔ γ2 + BiI3 | 680–668 |
Политермические сечения
Для уточнения областей гомогенности, хода кривых моновариантных равновесий и координат нонвариантных точек нами построено несколько политермических разрезов (рис. 6–10), которые обсуждаются ниже, с поверхностью ликвидуса (рис. 5) и диаграммой твердофазных равновесий (рис. 2).
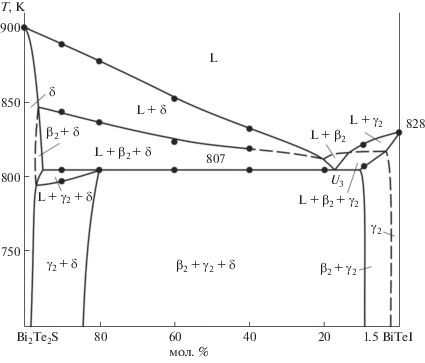
Разрез Bi2Te2S–BiTeI (рис. 6) является неквазибинарным, несмотря на конгруэнтное плавление обоих исходных соединений и наличие коннод, соединяющих твердые растворы (γ2- и δ-фазы) на их основе. Более того, он нестабилен в субсолидусе: линия, соединяющая стехиометрические составы соединений, проходит через трехфазную область β2 + γ2 + δ.
В области >20 мол. % Bi2Te2S из расплава первично кристаллизуется δ-фаза, а в области <15 мол. % Bi2Te2S – γ2-фаза. Первичная кристаллизация β2-фазы на основе Bi2Te3 происходит в очень узкой области (~15–20 мол. % Bi2Te2S). Эвтектические кривые, исходящие из точек e2 и e3, пересекаются в точке U3, и в системе устанавливается нонвариантное переходное равновесие L + + β2 ↔ γ2 + δ.
Ниже ликвидуса кристаллизация продолжается моновариантно по эвтектическим реакциям e2U3 (20–95 мол. % Bi2Te2S) и e3U3 (5–15 мол. % Bi2Te2S). Горизонталь при 807 K отвечает нонвариантному переходному равновесию U1 (табл. 2, рис. 5). В области 10–80 мол. % Bi2Te2S кристаллизация завершается этой реакцией и в субсолидусе образуется трехфазная область β2 + γ2 + δ. В области 80–97 мол. % Bi2Te2S кристаллизация продолжается моновариантно по эвтектической реакции (U2U4) и завершается образованием двухфазной области γ2 + δ.
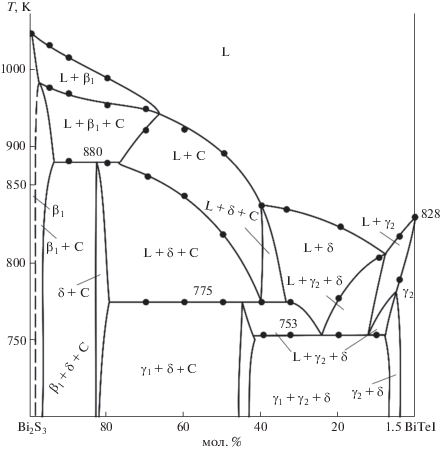
Разрез BiSI–Bi2Te3 (рис. 7) проходит через поля первичной кристаллизации соединения Bi19S27I3, а также δ- и β2-фаз. Точки пересечения кривых ликвидуса (25 и 85 мол. % Bi2Te3) соответствуют моновариантным эвтектическим равновесиям (рис. 5, кривые U1U2 и e2U3), которые охватывают области концентраций 8–33 и 55–86 мол. % Bi2Te3 соответственно. В интервале составов 0–8 мол. % Bi2Te3 протекает моновариантная перитектическая реакция (рис. 5), а в интервалах составов 33–45, 45–55 и 85–97 мол. % Bi2Te3 – эвтектические реакции (кривые U2U4, U3U4 и e3U3).
Горизонтальные линии при 807, 775 и 753 K относятся к нонвариантным переходным реакциям U3, U2 и U4 соответственно. После этих реакций в системе образуются трехфазные поля β2 + γ2 + δ, L + γ1 + δ и γ1 + γ2 + δ. При завершении кристаллизации по различным моновариантным реакциям формируются двухфазные области γ1 + δ, γ2 + δ и β2 + γ2 (рис. 7).
Разрез Bi2S3–BiTeI (рис. 8) в субсолидусе проходит через трехфазные поля β1 + C + δ, γ1 + C + δ, γ1 + γ2 + δ, пересекает области первичной кристаллизации четырех фаз (β1, C, δ и γ2) и отражает три переходные реакции (U1, U2, U4). Ниже кривой ликвидуса в интервалах составов 66–97, 34–77, 25–42 и 8–25 мол. % Bi2S3 протекают моновариантные реакции P1U1, U1U2, U2U1 и U3U4. По завершении кристаллизации в указанных интервалах образуются двухфазные (β1 + C, C + δ, γ1 + δ и γ2 + δ), а по завершении переходных реакций U1, U2 и U4 – трехфазные поля (β1 + C + δ, γ1 + δ + C и γ1 + γ2 + δ).
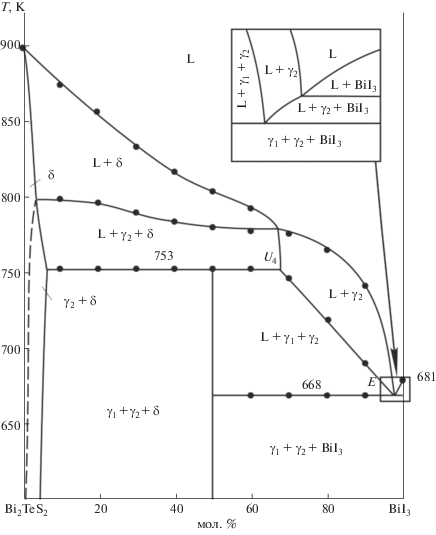
Разрез Bi2Te2S–BiI3 (рис. 9). Кривая ликвидуса состоит из двух ветвей, отвечающих первичной кристаллизации δ- и γ2-фаз. В очень узком интервале составов из жидкости первично кристаллизуется соединение BiI3. Ниже ликвидуса в интервалах составов 8–68 и 68–97 мол. % BiI3 кристаллизация продолжается моновариантно по эвтектическим кривым e2U3 и U3U4. В результате на T–x-диаграмме образуются области L + γ2 + δ и L + γ1 + γ2 соответственно. В области составов 8–68 мол. % BiI3 при 807 K протекает нонвариантная переходная реакция. В интервале 8–50 мол. % BiI3 эта реакция заканчивается избытком γ2-фазы и образованием трехфазной области γ1 + γ2 + δ, а в интервале 50–65 мол. % BiI3 – избытком жидкой фазы и образованием поля L + γ1 + γ2. В области >50 мол. % BiI3 кристаллизация завершается по эвтектической реакции E (668 K) и формируется трехфазное поле γ1 + γ2 + BiI3.
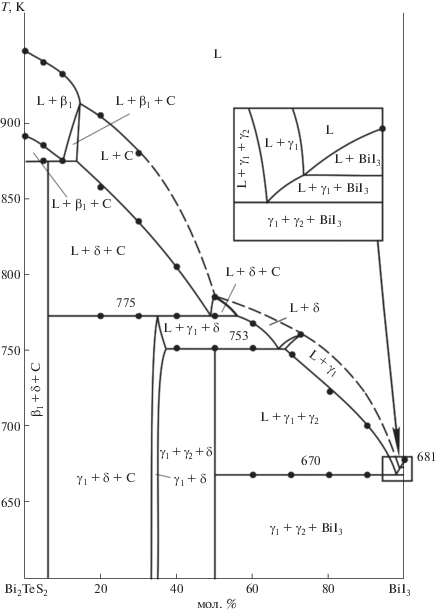
Разрез “Bi2TeS2”−BiI3 (рис. 10) пересекает четыре из пяти трехфазных полей системы (рис. 2) и отражает четырехфазные равновесия U1, U3, U4 и E. Данный разрез проходит вблизи кривых моновариантных равновесий U1U2, U2U4, U4E и пересекает прилегающие окрестности поверхностей ликвидуса C-, δ- и γ1-фаз. Поэтому слабые термические эффекты, отвечающие их первичной кристаллизации, перекрываются более интенсивными пиками моновариантных реакций. В этих областях кривые ликвидуса указаны пунктирными линиями (рис. 10).
Сопоставление рис. 5 и 10 показывает, что по этому разрезу протекает ряд моновариантных реакций (кривые e1U1, P1U1, U1U2, U2U4, U4E и е4Е). Процессы кристаллизации в различных областях составов заканчиваются нонвариантными реакциями U1, U2, U4 и E, что приводит к образованию в системе трехфазных областей β1 + δ + C, γ1 + δ + + C, γ1 + γ2 + δ и γ1 + γ2 + BiI3.
Изотермические разрезы
Изотермический разрез при 850 K (рис. 11a) отражает наличие широкой жидкой области (L), а также двух- (L + C, L + δ и L + β2) и трехфазных (С + β1, L + C + δ, L + С + δ и L + β2 + δ) полей.
Изотермический разрез при 800 K представлен на рис. 11б, из которого видно, что по сравнению с рис. 11а площадь жидкости в системе значительно уменьшилась, в то время как площади двух- (L + C и L + δ) и трехфазных областей (L + C + δ) увеличились. Кроме того, исчезли гетерогенные области L + β2 и L + β2 + δ и сформировались новые двух- (L + γ1, L + γ2, γ2 + δ, γ2 + β2) и трехфазные (L + C + γ1, L + γ2 + δ и β2 + γ2 + δ) поля.
Изотермический разрез при 750 K (рис. 11в) имеет ряд характерных особенностей, а именно: дальнейшее уменьшение площади жидкой фазы и сдвиг ее к вершине BiI3 концентрационного треугольника, а также образование ряда новых гетерогенных полей по сравнению с изотермическим разрезом при 800 K. Видно, что при 750 K в подсистеме Bi2S3–BiSI–BiTeI–Bi2Te3 нет фазовых областей с участием жидкой фазы, и картина фазовых равновесий почти такая же, как на диаграмме твердофазных равновесий при комнатной температуре (рис. 2).
ЗАКЛЮЧЕНИЕ
На основании комплекса экспериментальных данных получена полная взаимосогласованная картина фазовых равновесий в системе Bi2S3–Bi2Te3–BiI3. Показано, что она является квазитройной плоскостью четверной системы Bi–Te–S–I. Построены некоторые поли- и изотермические сечения фазовой диаграммы, а также проекция поверхности ликвидуса. Определены поля первичной кристаллизации и области гомогенности фаз, а также типы и координаты нон- и моновариантных равновесий системы. В системе выявлены ограниченные области твердых растворов на основе сесквисульфида и сесквителлурида висмута, а также тройных соединений Bi2Te2S, BiSI и BiTeI. Установлено, что определяющая роль в формировании фазовых полей на диаграмме твердофазных равновесий принадлежит δ-фазе на основе Bi2Te2S, которая находится в коннодной связи со всеми фазами системы, за исключением BiI3. Полученные фазы переменного состава представляют интерес как потенциальные топологические изоляторы, полупроводники Рашбы, термоэлектрические и оптические материалы.
Список литературы
Герзанич Е.И., Фридкин В.М. Сегнетоэлектрики типа AVBVICVII. М.: Наука, 1982. 227 с.
Koc H., Palaz S., Mamedov A.M. et al. // Ferroelectrics. 2017. V. 511. P. 22. https://doi.org/10.1080/00150193.2017.1332967
Mistewicz K. // J. Nanomaterials. 2018. P. 2651056. https://doi.org/10.1155/2018/2651056
Mistewicz K. // Nanomaterials. 2019. V. 4. № 9. P. 580. https://doi.org/10.3390/nano9040580
Hahn N.T., Rettie A.J.E., Beal S.K. et al. // J. Phys. Chem. C. 2012. V. 116. P. 24878. https://doi.org/10.1021/jp3088397
Peng B., Xu K., Zhang H. et al. // Adv. Theory Simul. 2018. V. 1. № 1. P. 1700005. https://doi.org/10.1002/adts.201700005
Khan W., Hussain S., Minar J. et al. // J. Electron. Mater. 2017. V. 47. № 2. P. 1131. https://doi.org/10.1007/s11664-017-5884-z
Ganose A.M., Butler K.T., Walsh A. et al. // J. Mater. Chem. 2016. V. 4. № 6. P. 2060. https://doi.org/10.1039/C5TA09612J
Ishizaka K., Bahramy M.S., Murakawa H. et al. // Nat. Mater. 2011. V. 10. № 7. P. 521. https://doi.org/10.1038/nmat3051
Landolt G., Eremeev S.V., Koroteev Y.M. et al. // Phys. Rev. Lett. 2012. V. 109. № 11. P. 116403. https://doi.org/10.1103/PhysRevLett.109.116403
Eremeev S.V., Nechaev I.A., Chulkov E.V. // Phys. Rev. B. 2017. V. 96. № 15. P. 155309. https://doi.org/10.1103/PhysRevB.96.155309
Li X., Sheng Y., Wu L. et al. // Npj. Comput Mater. 2020. V. 6. № 1. P. 107. https://doi.org/10.1038/s41524-020-00378-4
Wu L., Yang J., Zhang T. et al. // J. Phys.: Condens. Matter. 2016. V. 28. № 8. P. 085 801. https://doi.org/10.1088/0953-8984/28/8/085801
Maa H., Bentmann H., Seibel C. et al. // Nat. Commun. 2016. V. 7. P. 11621. https://doi.org/10.1038/ncomms11621
Gennep D.V., Maiti S., Graf D. et al. // J. Phys.: Condens. Matter. 2014. V. 26. № 34. P. 342 202. https://doi.org/10.1088/0953-8984/26/34/342202
Villars P., Prince A. Okamoto H. Handbook of ternary alloy phase diagrams. Materials Park, OH: ASM International, 1995
Babanly M.B., Chulkov E.V., Aliev Z.S. et al. // Russ. J. Inorg. Chem. 2017. V. 62. № 13. P. 1703. https://doi.org/10.1134/S0036023617130034
Babanly M.B., Mashadiyeva L.F., Babanly D.M. et al. // Russ. J. Inorg. Chem. 2019. № 13. P. 1649. https://doi.org/10.1134/S0036023619130035
Zlomanov V.P., Khoviv A.M., Zavrazhnov A.Y. // InTech. Materials Science – Advanced Topics. 2013. 103 p.
Aliev Z.S., Musayeva S.S., Babanlı M.B. // J. Phase Equilib. Diffus. 2017. V. 38. № 6. P. 887. https://doi.org/10.1007/s11669-017-0601-4
Aliev Z.S., Imamaliyeva S.Z., Babanlı M.B. et al. // J. Therm. Anal. Calorim. 2018. V. 133. № 2. P. 1115. https://doi.org/10.1007/s10973-017-6812-4
Aliev Z.S., Musayeva S.S., Jafarli F.Y. et al. // J. Alloys Compd. 2014. V. 610. P. 522. https://doi.org/10.1016/j.jallcom.2014.05.015
Imamaliyeva S.Z., Musayeva S.S., Babanly D.M. et al. // Thermochim. Acta. 2019. V. 679. P. 178 319. https://doi.org/10.1016/j.tca.2019.178319
Babanly M.B., Tedenac J.C., Aliev Z.S. et al. // J. Alloys Compd. 2009. V. 481. № 1–2. P. 349. https://doi.org/10.1016/j.jallcom.2009.02.139
Aliev Z.S., Ahmadov E.C., Babanly D.M. et al. // Calphad. 2019. V. 66. P. 101 650. https://doi.org/10.1016/j.calphad.2019.101650
Ahmadov E.J. // Az. Chem. J. 2020. № 1. P. 36. https://doi.org/10.32737/0005-2531-2020-1-36-40
Riahi M., Tomas C.M., Agouram S. et al. // Thin. Solid. Films. 2017. V. 626. P. 9. https://doi.org/10.1016/j.tsf.2017.02.022
Guo J., Lou Q., Qiu Y. et al. // Appl. Surf. Sci. 2020. V. 520. P. 146 341. https://doi.org/10.1016/j.apsusc.2020.146341
Hamdeh U.H., Nelson R.D., Ryan B.J. et al. // Chem. Mater. 2016. V. 28. P. 6567. https://doi.org/10.1021/acs.chemmater.6b02347
Lehner A.J., Wang H., Fabini D.H. et al. // Appl. Phys. Lett. 2015. V. 107. P. 131 109. https://doi.org/10.1063/1.4932129
Coutinho N.F., Cucatti S., Merlo R.B. et al. // Sci. Rep. 2019. V. 9. P. 11785. https://doi.org/10.1038/s41598-019-48194-1
Qiao J., Chuang M.-Y., Lan J.-C. et al. // J. Mater. Chem. C. 2019. V. 7. P. 7027. https://doi.org/10.1039/C9TC01885A
Wang M., Fu Q., Yan L. et al. // ACS Appl. Mater. Interfaces. 2019. V. 11. № 51. P. 47 868. https://doi.org/10.1021/acsami.9b15320
Wang Z.H., Gao X.P.A., Zhang Z.D. // Chin. Phys. B. 2018. V. 27. № 10. P. 107 901. https://doi.org/10.1088/1674-1056/27/10/107901
Sultana R., Neha P., Goyal R. et al. // J. Magn. Magn. Mater. 2017. V. 428. P. 213. https://doi.org/10.1016/j.jmmm.2016.12.011
Le P.H., Liu P.T., Luo C.W. et al. // J. Alloys Compd. 2017. V. 692. P. 972. https://doi.org/10.1016/j.jallcom.2016.09.109
Viti L., Aliev Z.S., Babanly M.B. et al. // Nano. Lett. 2016. V. 16. P. 80. https://doi.org/10.1021/acs.nanolett.5b02901
Pesin D., MacDonald A.H. // Nature Mater. 2012. V. 11. P. 409. https://doi.org/10.1038/nmat3305
Massalski T.B. Binary Alloy Phase Diagrams. ASM International, Materials Park, Ohio, USA. 1990. XXII. V. 3. 3589 p.
Voroshilov Yu.V., Evstigneeva T.L., Nekrasov I.Ya. Crystal Chemical Tables for Ternary Chalcogenides. M.: Nauka, 1989.
Shevelkov A.V., Dikarev E.V., Shpanchenko R.V. et al. // J. Solid State Chem. 1995. V. 114. P. 379. https://doi.org/10.1006/jssc.1995.1058
Haase-Wessel W. // Naturwissenschaften. 1973. V. 60. № 10. P. 474.
Ruck M. // Z. Kristallogr. Cryst. Mater. 1995. V. 210. P. 650.
Adam A. // Mater. Res. Bull. 2007. V. 42. P. 1986. https://doi.org/10.1016/j.materresbull.2007.02.027
Lukaszewicz K.J., Damm A.S., Pietraszko A. et al. // Polish J. Chem. 1999. V. 73. № 3. P. 541.
Miehe G., Kupcik V. // Naturwissenschaften. 1971. V. 58. № 4. P. 219.
Yusa K., Sugaki A., Kitakaze A. // J. Japan. Assoc. Min. 1979. V. 74. P. 162.
Бегларян М.Л., Абрикосов Н.Х. // Докл. АН СССР. 1959. Т. 129. № 1. С. 1529.
Valitova N.R., Aleshin V.A., Popovkin B.A., Novoselova A.V. // Inorg. Mater. 1976. V. 12. № 2. P. 225.
Oppermann H., Petasch U. // Z. Naturforsch. 2003. V. 58. № 8. P. 725.
Savilov S.V., Khrustalev V.N., Kuznetsov A.N. et al. // Russ. Chem. Bull. 2005. V. 54. № 1. P. 87. https://doi.org/10.1007/s11172-005-0221-8
Ryazantsev T.A., Varekha L.M., Popovkin B.A., Novoselova A.V. // Inorg. Mater. 1970. V. 6. P. 1175.
Leenson I.A. // J. Chem. Edu. 2005. V. 82. № 2. P. 241. https://doi.org/10.1021/ed082p241
Emsley J. The Elements. Clarendon, 1998.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии