Журнал неорганической химии, 2021, T. 66, № 4, стр. 540-548
Выбор оптимальных условий динамического концентрирования ионов серебра(I) из растворов сложного состава сульфоэтилированными полиаминостиролами
Л. М. к. Алифханова a, *, Ю. С. Петрова a, С. Н. Босенко a, Л. К. Неудачина a, А. В. Пестов a, b
a Уральский федеральный университет имени первого Президента России Б.Н. Ельцина
620002 Екатеринбург, ул. Мира, 19, Россия
b Институт органического синтеза им. И.Я. Постовского УрО РАН
620108 Екатеринбург, ул. Софьи Ковалевской, 22, Россия
* E-mail: alifkhanova@rambler.ru
Поступила в редакцию 17.08.2020
После доработки 17.10.2020
Принята к публикации 20.10.2020
Аннотация
Изучена селективность сорбции ионов серебра(I) сульфоэтилированными полиаминостиролами в динамических условиях. Показано, что селективность извлечения ионов серебра(I) в присутствии ионов меди(II) максимальна при рН 6.0 и скорости пропускания раствора 2 мл/мин. Получены динамические выходные кривые сорбции ионов переходных и щелочноземельных металлов сульфоэтилированными полиаминостиролами при их совместном присутствии в аммиачно-ацетатном буферном растворе. Установлено, что с увеличением степени модифицирования полиаминостирола увеличивается селективность сорбции ионов серебра(I) из растворов сложного состава. Проведена математическая обработка полученных динамических кривых моделями Томаса, Адамса–Бохарта и Юна–Нельсона. Определены значения динамической емкости сорбентов, константы скорости реакции, время выхода 50% сорбата. Показано, что для количественной десорбции ионов серебра(I) с поверхности сорбентов достаточно 20.0 мл раствора азотной кислоты с концентрацией 1 моль/л.
ВВЕДЕНИЕ
Серебро – металл, который широко используется в промышленности для изготовления ювелирных изделий, контактов, припоев, проводников, кино-, фотоматериалов и т.д. Применение в различных областях находят и соединения серебра: галогениды серебра(I) используются для изготовления фотографических пленок; дисцианоаргентат(I) натрия применяется в процессе серебрения гальваническим методом для изготовления столовых изделий, нитраты серебра(I) используются при изготовлении зеркал, получении токопроводящего слоя, в составе медицинских препаратов, таких как протаргол, колларгол и др. [1, 2]. Наночастицы серебра применяют для распознавания биологических объектов, а также в медицинской диагностике и биотехнологии [3]. С другой стороны, серебро является ферментным ядом и способно накапливаться в различных объектах окружающей среды и оказывать отрицательное влияние на ее состояние [1].
Предварительное сорбционное концентрирование серебра(I) при его определении в различных объектах позволяет значительно понизить предел его определения, осуществить “сброс” матрицы при анализе многокомпонентных проб, избежать спектральных наложений при использовании спектроскопических методов анализа. За последние 5 лет для извлечения серебра(I) предложены различные материалы природного происхождения [4–6], функционализированные сорбенты на основе неорганических [7–10] и органических матриц [11–13]. Однако многие из них характеризуются относительно невысокой селективностью: на извлечение серебра(I) оказывают мешающее влияние ионы свинца [14], меди(II), никеля(II), кобальта(II) [15, 16] и др. В ряде случаев сорбция исследуется из индивидуальных [17, 18], бинарных [19, 20], трехкомпонентных [11] растворов, что не позволяет достаточно полно охарактеризовать селективные свойства сорбентов.
Ранее [21, 22] изучены сорбционные свойства сульфоэтилированных полиаминостиролов с различными степенями модифицирования по отношению к ряду ионов переходных и щелочноземельных металлов в статических условиях. Показано, что сорбенты селективно извлекают ионы серебра(I), наибольшим мешающим влиянием обладают ионы меди(II). Значительный интерес представляет исследование сорбции в динамическом режиме, который во многих случаях обеспечивает более высокую эффективность разделения ионов металлов, не требует разделения фаз после сорбции и позволяет автоматизировать процесс разделения и концентрирования [23].
Целью настоящей работы является оптимизация условий селективного извлечения серебра(I) из растворов сложного состава материалами на основе сульфоэтилированного полиаминостирола в динамических условиях.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Сульфоэтилированный полиаминостирол со степенями замещения атомов водорода аминогруппы 0.5, 0.7 и 1.0 (СЭПАС 0.5, СЭПАС 0.7 и СЭПАС 1.0 соответственно) получали и идентифицировали по методикам, описанным в работах [21, 22].
Исследование сорбции ионов металлов СЭПАС в динамических условиях
Для выявления закономерностей влияния различных факторов (рН и скорости пропускания раствора, массы сорбента) на селективность сорбции ионов серебра(I) относительно меди(II) СЭПАС в динамических условиях использовали фракцию сорбента с диаметром зерна <0.071 мм. Исследование влияния кислотности среды на селективность сорбции ионов металлов СЭПАС проводили путем пропускания аммиачно-ацетатного буферного раствора с фиксированным значением рН (5.0, 5.5, 6.0, 6.5, 7.0), содержащего медь(II) и серебро(I) в концентрациях 5 × 10–4 моль/л, через концентрирующий патрон, в который предварительно помещали 0.0500 г сорбента с определенной степенью модифицирования. На выходе из патрона отбирали раствор порциями по 10.0 мл. Аналогично проводили исследование влияния скорости пропускания раствора (1, 2 и 5 мл/мин) и массы сорбента (50, 100 мг) на селективность сорбции ионов серебра(I) и меди(II) СЭПАС. Влияние степени сульфоэтилирования полиаминостирола на селективность сорбции ионов переходных и щелочноземельных металлов проводили при следующих условиях: рН 6.0, скорость пропускания раствора 2 мл/мин, масса сорбента 0.1000 г. После проведения сорбции осуществляли десорбцию ионов металлов путем пропускания через концентрирующий патрон с сорбентом 1 М раствора азотной кислоты.
Содержание ионов металлов в растворах до и после сорбции и десорбции определяли методом атомно-эмиссионной спектроскопии с индуктивносвязанной плазмой (iCAP 6500 Duo Thermo Electron).
По результатам экспериментов строили динамические выходные кривые в координатах С/С0 = f(V).
Полную динамическую обменную емкость (ДОЕ, мкмоль/г) сорбентов рассчитывали по формуле:
где V0 – общий объем выходящего раствора, пропущенный через сорбент до уравнивания концентраций выходящего и исходного раствора, мл; C0 – концентрация исходного раствора, мг/л; V – объем порции выходящего раствора, 10.0 мл; С – концентрация в порции выходящего раствора, мг/л; g – масса навески сорбента, г; М – молярная масса определяемого металла, г/моль.Коэффициенты селективности сорбции ионов серебра(I) по отношению к меди(II) (KAg(I)/Cu(II)) рассчитывали как отношение коэффициентов распределения ионов меди(II) и серебра(I) между раствором и сорбентом [24].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Влияние кислотности среды на селективность сорбции ионов серебра(I) по отношению к ионам меди(II) СЭПАС 1.0 в динамическом режиме
Ранее [22] показано, что в статических условиях возрастание степени модифицирования полиаминостирола приводит к увеличению селективности сорбции серебра(I) по сравнению с медью(II). Поэтому для оптимизации условий избирательного извлечения серебра(I) выбран сорбент с максимальной степенью модифицирования – СЭПАС 1.0.
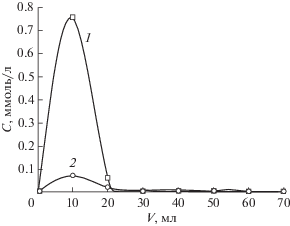
Первым этапом исследования свойств СЭПАС 1.0 было изучение влияния кислотности среды на сорбцию ионов серебра(I) в присутствии меди(II) в динамических условиях. Получены динамические выходные кривые сорбции ионов металлов СЭПАС 1.0 при различных значениях кислотности. На рис. 1 в качестве примера приведены зависимости, полученные при pH 5.0 и 6.0 (рис. 1). В табл. 1 приведены значения ДОЕ сорбента по ионам меди(II) и серебра(I) и коэффициентов селективности KAg(I)/Cu(II).
Рис. 1.
Динамические выходные кривые сорбции ионов серебра(I) и меди(II) СЭПАС 1.0 в зависимости от кислотности среды. Скорость пропускания раствора 2 мл/мин, масса сорбента 0.0500 г. Аммиачно-ацетатный буферный раствор: Cu(II): 1 – рН 5.0, 2 – рН 6.0; Ag(I): 3 – рН 5.0, 4 – рН 6.0.
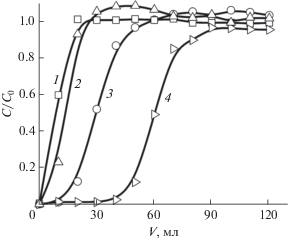
Таблица 1.
Влияние кислотности среды на значения ДОЕ и коэффициентов селективности KAg(I)/Cu(II) СЭПАС 1.0
| Параметр | pH | ||||||
|---|---|---|---|---|---|---|---|
| 5.0 | 5.5 | 6.0 | 6.5 | 7.0 | 7.5 | ||
| ДОЕ, мкмоль/г | Ag(I) | 219 | 314 | 460 | 501 | 346 | 345 |
| Cu(II) | 40 | 45 | 48 | 89 | 66 | 88 | |
| KAg(I)/Cu(II) | 10.0 | 9.3 | 28.6 | 5.3 | 19.5 | 10.4 | |
Из полученных результатов, представленных в табл. 1, видно, что из аммиачно-ацетатного буферного раствора в наибольшей степени ионы серебра(I) извлекаются СЭПАС 1.0 при рН 6.5, однако селективность их извлечения из бинарного раствора выше при рН 6.0. Низкие значения ДОЕ СЭПАС при рН 5.0–5.5 связаны с высокой степенью протонирования аминогрупп сорбента, а при рН 7.0–7.5 – с образованием устойчивых аммиачных комплексов серебра(I) в растворе. По сравнению со статическим режимом [22] в динамических условиях сорбция серебра(I) в значительно большей степени зависит от кислотности раствора, однако наибольшая селективность сорбции данного иона в обоих случаях реализуется при рН 6.0. В этих условиях на динамических кривых сорбции серебра(I) наблюдается участок, соответствующий его количественному извлечению, что определяет перспективность использования сорбента для предварительного селективного концентрирования данного иона.
Влияние скорости пропускания раствора на селективность сорбции ионов серебра(I) по отношению к ионам меди(II) СЭПАС 1.0 в динамическом режиме
Исследование скорости пропускания на селективность сорбции ионов серебра(I) по отношению к ионам меди(II) СЭПАС 1.0 проводили при их совместном присутствии в аммиачно-ацетатном буферном растворе с рН 6.0, полученные зависимости приведены на рис. 2.
Рис. 2.
Влияние скорости пропускания раствора на сорбцию ионов меди(II) и серебра(I) СЭПАС в динамическом режиме. Масса сорбента 0.0500 г. Скорость пропускания раствора: 5 мл/мин (1 – Cu(II), 4 – Ag(I)), 2 мл/мин (2 – Cu(II), 5 – Ag(I)), 1 мл/мин (3 – Cu(II), 6 – Ag(I)).
Рассчитаны значения динамической обменной емкости и коэффициентов селективности KAg(I)/Cu(II) СЭПАС 1.0 для различных скоростей пропускания раствора (табл. 2).
Таблица 2.
Влияние скорости пропускания раствора на значения ДОЕ (мкмоль/г) СЭПАС 1.0 по ионам серебра(I) и меди(II) и коэффициентов селективности KAg(I)/Cu(II)
| Ион металла |
Скорость пропускания раствора, мл/мин | ||
|---|---|---|---|
| 1 | 2 | 5 | |
| Ag(I) | 667 | 734 | 510 |
| Cu(II) | 71.2 | 100 | 50.5 |
| KAg(I)/Cu(II) | 2.04 | 2.69 | 2.51 |
Установлено, что с увеличением скорости пропускания раствора сорбция серебра(I) и меди(II) СЭПАС 1.0 изменяется немонотонно. Наибольшие значения ДОЕ по исследуемым ионам металлов и коэффициентов селективности наблюдаются при скорости пропускания раствора 2 мл/мин. Меньшие значения ДОЕ при скорости пропускания раствора 5 мл/мин связаны с меньшим временем взаимодействия сорбента и сорбата. При наименьшей скорости пропускания (1 мл/мин) значительный вклад в механизм сорбции вносит комплексообразование функциональных групп СЭПАС с медью(II) и серебром(I). В этом случае один ион металла координирует несколько функциональных групп сорбента (в соответствии со своим координационным числом), что определяет меньшие значения ДОЕ по сравнению со скоростью пропускания раствора 2 мл/мин, в случае которой вклад комплексообразования по сравнению с ионным обменом может быть несколько меньше.
Из рис. 2 видно, что на начальном участке динамических выходных кривых сорбции меди(II) СЭПАС 1.0 (при V = 50–130 мл) количество меди(II) в фильтрате превышает ее концентрацию в исходном растворе (на соответствующих кривых сорбции данного иона значение С/С0 превышает 1). Очевидно, это связано с вытеснением меди(II) ионами серебра (I), образующего с функциональными группами сорбента более устойчивые комплексы.
Влияние массы сульфоэтилированного полиаминостирола на селективность сорбции ионов серебра(I) по отношению к ионам меди(II) в динамических условиях
Исследование влияния массы СЭПАС 1.0 на сорбцию ионов серебра(I) и меди(II) проводили при их совместном присутствии в аммиачно-ацетатном буферном растворе в диапазоне массы сорбента 50–100 мг. Значения динамической емкости и коэффициентов селективности KAg(I)/Cu(II) СЭПАС 1.0 для различных масс сорбента приведены в табл. 3.
Таблица 3.
Влияние массы СЭПАС на сорбцию ионов серебра(I) и меди(II) в динамических условиях
| Масса СЭПАС 1.0, мг | Ион металла | ДОЕ, мкмоль/г | KAg(I)/Cu(II) |
|---|---|---|---|
| 50 | Ag(I) | 343 | 2.20 |
| Cu(II) | 38 | ||
| 100 | Ag(I) | 734 | 2.69 |
| Cu(II) | 100 |
Установлено, что с увеличением массы СЭПАС 1.0 увеличивается ДОЕ по ионам меди(II) и серебра(I) и коэффициент селективности KAg(I)/Cu(II). Влияние массы на сорбцию ионов серебра(I) и меди(II) объясняется с точки зрения теории тарелок: согласно основному уравнению данной теории, эффективность разделения компонентов возрастает с увеличением длины колонки (высоты сорбционного слоя) [24].
Исследование влияния степени сульфоэтилирования полиаминостирола на селективность сорбции ионов металлов при их совместном присутствии в растворе в динамических условиях
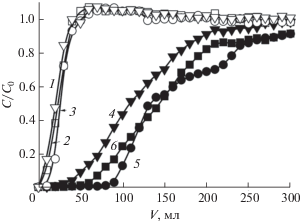
Исследование влияния степени сульфоэтилирования полиаминостирола на селективность сорбции ионов переходных и щелочноземельных металлов СЭПАС 1.0 проведено в условиях, соответствующих наибольшей селективности сорбции серебра(I) по сравнению с медью(II). В качестве примера на рис. 3 приведены динамические выходные кривые сорбции, полученные для СЭПАС 0.5 и СЭПАС 1.0. Значения ДОЕ сорбентов и коэффициентов селективности KAg(I)/Cu(II) СЭПАС с различными степенями модифицирования приведены в табл. 4.
Рис. 3.
Динамические выходные кривые сорбции ионов металлов СЭПАС 0.5 (а) и СЭПАС 1.0 (б). Совместное присутствие ионов металлов в растворе. Скорость пропускания раствора 2 мл/мин, масса сорбента 0.1000 г. 1 – Ag(I), 2 – Cu(II), 3–10 – Ni(II), Ba(II), Sr(II), Cd(II), Ca(II), Mg(II), Zn(II), Co(II) соответственно.
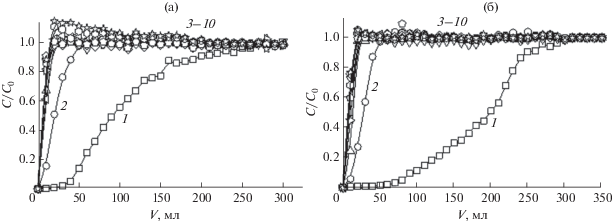
Таблица 4.
Влияние степени модифицирования (СМ) полиаминостирола на значения ДОЕ по ионам металлов и коэффициентов селективности KAg(I)/Cu(II) в условиях конкурентной сорбции
| СМ | ДОЕ, мкмоль/г | KAg(I)/Cu(II) | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Ag(I) | Cu(II) | Ni(II) | Co(II) | Zn(II) | Cd(II) | Mg(II) | Ca(II) | Sr(II) | Ba(II) | ||
| 0.5 | 459 | 86 | 2.6 | 0 | 23 | 0 | 8.3 | 5.0 | 8.3 | 23 | 1.94 |
| 0.7 | 694 | 115 | 20 | 0 | 28 | 0 | 4.0 | 3.0 | 17 | 28 | 2.60 |
| 1.0 | 759 | 87 | 28 | 0 | 14 | 6.3 | 8.8 | 8.3 | 38 | 36 | 3.52 |
Из рис. 3 видно, что на начальном участке динамических выходных кривых сорбции ряда сопутствующих ионов металлов (бария(II), кальция(II), кадмия(II), кобальта(II), магния(II), никеля(II), стронция(II) и цинка(II)) СЭПАС (при V = 20–90 мл) наблюдается увеличение их концентрации в фильтрате по сравнению с исходным раствором (на соответствующих кривых сорбции ионов металлов значение С/С0 превышает 1). В наибольшей степени этот эффект проявляется для СЭПАС 0.5 и значительно уменьшается с увеличением степени сульфоэтилирования сорбента. Наблюдаемое явление объясняется вытеснением с поверхности СЭПАС ионов, быстро сорбирующихся в первые минуты контакта фаз серебром(I), образующим с функциональными группами сорбента наиболее устойчивые комплексные соединения.
Установлено, что увеличение степени модифицирования (СМ) сорбентов сульфоэтильными группами приводит к значительному возрастанию ДОЕ СЭПАС по ионам серебра(I). ДОЕ по сопутствующим ионам металлов существенно меньше и изменяeтся немонотонно с ростом СМ СЭПАС. В случае ионов бария(II), стронция(II), кальция(II) и магния(II) наблюдается возрастание ДОЕ с увеличением содержания сульфоэтильных групп в составе сорбента, что позволяет сделать вывод об извлечении этих ионов за счет электростатического взаимодействия с рассматриваемыми группами.
Ранее [25] для сорбентов на основе сульфоэтилированного хитозана (СЭХ) выявлена аналогичная закономерность влияния СМ на сорбцию ионов щелочноземельных металлов в динамических условиях. Однако в случае СЭХ рост СМ приводит к значительному уменьшению сорбции серебра(I): при переходе от СЭХ 0.5 к СЭХ 1.0 ДОЕ по серебру(I) уменьшается от 90.0 до 71.6 мкмоль/г [25]. Аналогичная закономерность характерна и для сорбции в статических условиях [26]. Это связано с понижением общей основности атома азота аминогруппы СЭХ при увеличении степени его модифицирования. Данное обстоятельство приводит к уменьшению устойчивости комплексных соединений, образуемых ионами серебра(I) с функциональными группами СЭХ. Очевидно, что в случае СЭПАС увеличение СМ сорбента тоже должно приводить к уменьшению основности атома азота аминогруппы. Однако рост СМ данного сорбента в статических условиях не оказывает значительного влияния на сорбцию серебра(I) [22], а в динамических – приводит к возрастанию ДОЕ по данному иону, значения которых превышают соответствующие значения для СЭХ в 10 раз. Это обстоятельство объясняется, во-первых, меньшей молекулярной массой звена СЭПАС по сравнению с СЭХ, что определяет большие значения ДОЕ по серебру(I) и относительно меньшее мешающее влияние со стороны сопутствующих ионов металлов. Во-вторых, более близкое расположение аминогрупп по отношению друг к другу в случае СЭПАС в большей степени отвечает требованиям центрального атома: известно [27], что для серебра(I) характерно КЧ = 2 и комплексы линейной геометрии. В-третьих, аминогруппы в составе полиаминостирола (pKa = 7.44 [28]) обладают большей основностью по сравнению с хитозаном (pKa = 6.39–6.51 [29]), что определяет бóльшую устойчивость комплексов, образуемых СЭПАС с серебром(I), по сравнению с СЭХ.
В целом селективные свойства СЭПАС и СЭХ коррелируют с комплексообразующими свойствами их мономерного аналога – таурина, образующего наиболее устойчивые комплексы с медью(II) и серебром(I) [30].
Выявленная ранее [22] в статических условиях закономерность возрастания селективности сорбции серебра(I) по сравнению с медью(II) СЭПАС сохраняется и в динамическом режиме (табл. 4).
Определенный интерес представляет сравнение сорбционных характеристик исследуемых материалов с литературными данными. В табл. 5 обобщены результаты, характеризующие сорбцию серебра(I) различными сорбентами в динамических условиях из индивидуальных, бинарных и многокомпонентных растворов.
Таблица 5.
Сравнительные характеристики сорбционных материалов для извлечения серебра(I)
| Сорбционный материал | Ион металла | ДОЕ, мкмоль/г | Условия эксперимента | Литература |
|---|---|---|---|---|
| Хлорметилированный полистирол, модифицированный меркаптобензотиазолом | Ag(I) | 493 | рН 2; F = 5 мл/мин; C0 = 4.6 × 10–4 моль/л |
[31] |
| Гранулы кофе, модифицированные поливиниловым спиртом и борной кислотой | Ag(I) | 76.9 | рН 6; F = 0.5 мл/мин; C0 = 9.3 × 10–5 моль/л |
[32] |
| Хитозан | Ag(I) | 389 | рН 6; F = 0.6–0.7 мл/мин; C0 = 4.6 × 10–4 моль/л |
[33] |
| Биосорбент “Sargassum Filipendula” | Ag(I) Cu(II) |
387 642 |
рН 5; F = 0.5 мл/мин; C0 = 1–3 моль/л |
[34] |
| Нанопористый силикагель, модифицированный 3,4-дигидроксибензальдегидом | Ag(I), Au(III), Cu(II), Pd(II) |
1480 1472 2045 1456 |
рН 5; F = 16–18 мл/мин; C0(Ag(I)) = 1.8 × 10–5 моль/л C0(Au(III)) = 1.1 × 10–5 моль/л C0(Cu(II)) = 3.1 × 10–5 моль/л C0(Pd(III)) = 1.1 × 10–5 моль/л |
[35] |
| Дитиооксамидированный полисилоксан | Ag(I) Cu(II) Ni(II), Co(II), Zn(II), Cd(II), Pb(II), Mn(II), Ca(II), Mg(II) |
1150 150 <10 |
рН 6; F = 2 мл/мин; C0 = 2 × 10–4 моль/л |
[36] |
| СЭХ 1.0 | Ag(I) Cu(II) Ni(II), Co(II), Zn(II), Mn(II), Pb(II), Cd(II), Ca(II), Mg(II) Sr(II), Ba(II) |
71.6 34.4 <10.7 |
рН 6.5; F = 1 мл/мин; C0 = 1 × 10–4 моль/л |
[25] |
| СЭПАС 1.0 | Ag(I) Cu(II) Ni(II), Ba(II), Sr(II), Cd(II), Ca(II), Mg(II), Zn(II), Co(II) |
759 87 28–38 6.3–14 0 |
рН 6; F = 2 мл/мин; C0 = 5 × 10–4 моль/л |
Настоящая работа |
Из данных табл. 5 видно, что значения ДОЕ сорбентов в значительной степени зависят от условий эксперимента: начальной концентрации ионов металлов, кислотности раствора, скорости его пропускания и массы сорбционного материала. Тем не менее значения ДОЕ СЭПАС 1.0 по серебру(I) сопоставимы с аналогичными значениями для других исследованных сорбентов, а в ряде случаев значительно превосходят их. К тому же в случае бинарных и многокомпонентных растворов помимо ионов серебра(I) в значительной степени рассмотренными материалами сорбируются и другие ионы металлов [34, 35]. Сравнивая сорбционные характеристики сульфоэтилированных аминополимеров (табл. 1), можно заметить, что СЭПАС имеет более высокие значения ДОЕ по ионам серебра(I), чем СЭХ, что наглядно демонстрирует преимущества использования синтетической матрицы.
Математическая обработка динамических выходных кривых
Математическое компьютерное моделирование динамических кривых сорбции является важной с практической точки зрения задачей: определяемые при этом параметры (константа скорости сорбции, емкость колонки и т.д.) позволяют спрогнозировать вид динамических кривых сорбции при различных значениях высоты колонки, скорости пропускания раствора, исходной концентрации компонента. Опубликовано большое число работ [37–41], в которых рассмотрена возможность применения различных математических моделей для описания процесса сорбции и определения его параметров в динамическом режиме.
В настоящей работе полученные динамические выходные кривые сорбции ионов серебра(I) и меди(II) обрабатывали наиболее широко применяемыми моделями Томаса, Юна−Нельсона и Адамса−Бохарта [42].
Для описания динамики сорбции и определения значений параметров моделей для ионов серебра(I) и меди(II) проводили процедуру минимизации при помощи математического пакета OriginPro 8.0.
Из полученных результатов (табл. 6) видно, что константы скорости сорбции ионов серебра(I) СЭПАС, полученные при обработке зависимостей моделями Адамса–Бохарда, Томаса, Юна–Нельсона, для всех степеней модифицирования близки между собой. Аналогичный результат получен и для ионов меди(II). Анализируя полученные значения коэффициентов корреляции (R2), можно сделать вывод, что наилучшим образом динамические выходные кривые сорбции ионов серебра(I) и меди(II) СЭПАС описываются моделями Юна–Нельсона и Томаса. Поскольку данные модели имеют одинаковые формы уравнения, значения коэффициентов корреляции совпадают. Между тем параметры, входящие в уравнения моделей Томаса и Юна–Нельсона, имеют различный физический смысл. Так, применение уравнения Томаса для обработки динамических выходных кривых позволяет рассчитать значения константы скорости сорбции (в мл/(мг мин)) и емкости колонки, уравнения Юна–Нельсона – значения константы скорости сорбции (в мин–1) и время, требуемое для выхода из колонки 50% сорбата. Расчетные значения динамической емкости из уравнений Адамса–Бохарда, Томаса, Юна–Нельсона несколько превышают экспериментально полученные данные (табл. 6). Наиболее хорошо с экспериментальными данными согласуются значения ДОЕ, рассчитанные путем обработки кривых с помощью уравнения Томаса, что согласуется с соответствующими коэффициентами корреляции.
Таблица 6.
Результаты обработки динамических выходных кривых сорбции ионов серебра(I) и меди(II) СЭПАС с различными степенями модифицирования моделями Адамса–Бохарда, Томаса, Юна–Нельсона
| Модель | Параметры, единицы измерения |
Степень модифицирования СЭПАС | |||||
|---|---|---|---|---|---|---|---|
| 0.5 | 0.7 | 1.0 | 0.5 | 0.7 | 1.0 | ||
| Ag(I) | Cu(II) | ||||||
| Адамса–Бохарта | kAB × 104, л/(мин мг) | 1.92 | 3.18 | 2.61 | 1.30 | 1.59 | 2.31 |
| N0, мкмоль/г | 860 | 980 | 1027 | 220 | 273 | 180 | |
| R2 | 0.827 | 0.954 | 0.971 | 0.823 | 0.931 | 0.949 | |
| Томаса | kTh, мл/(мг мин) | 1.25 | 1.60 | 0.85 | 8.13 | 8.94 | 10.63 |
| Q0, мкмоль/г | 447 | 721 | 750 | 113 | 184 | 120 | |
| R2 | 0.983 | 0.996 | 0.992 | 0.984 | 0.982 | 0.996 | |
| Юна–Нельсона | kYN × 102, мин–1 | 3.06 | 3.98 | 2.23 | 14.0 | 15.6 | 14.6 |
| τ, мин | 98.7 | 156 | 154 | 20.9 | 33.5 | 27.7 | |
| R2 | 0.983 | 0.996 | 0.992 | 0.984 | 0.982 | 0.996 | |
Примечание. kAB – константа скорости адсорбции, описывающая массоперенос из жидкости в твердую фазу; N0 – динамическая емкость колонки; kTh – константа скорости Томаса; Q0 – максимальное извлечение иона металла; kYN – константа скорости, 1/мин; τ – время, требуемое для выхода из колонки 50% сорбата, мин.
Исследование регенерационных свойств СЭПАС в динамических условиях
Регенерационные свойства сорбента являются важным показателем, отражающим возможность его повторного использования. Для десорбции ионов металлов с поверхности сорбентов обычно применяют растворы минеральных кислот, слабых оснований или комплексообразующих веществ [43]. Чтобы оценить регенерационные свойства сорбентов, исследовали десорбцию ионов меди(II) и серебра(I) с поверхности СЭПАС в динамических условиях. Для этого после проведения сорбции рассматриваемых ионов 1 М раствор азотной кислоты объемом 70.0 мл пропускали со скоростью 2 мл/мин через концентрирующий патрон, заполненный 0.1000 г СЭПАС. Кривые элюирования (зависимость концентрации серебра(I) и меди(II) от объема элюата) ионов металлов с поверхности СЭПАС раствором азотной кислоты приведены на рис. 4.
По результатам проведенных исследований установлено, что ионы серебра(I) и меди(II) количественно десорбируются с поверхности СЭПАС 1 М раствором азотной кислоты. При этом для полной десорбции ионов меди(II) и серебра(I) в рассматриваемых условиях достаточно 20 мл раствора регенеранта (рис. 4). Бóльшая часть серебра(I) десорбируется уже первой порцией раствора азотной кислоты. Таким образом, показано, что поверхность исследуемых сорбентов может быть полностью регенерирована с использованием относительно небольшого количества разбавленного раствора азотной кислоты. Кроме того, установлено, что в таких условиях сорбенты могут выдерживать минимум три цикла сорбция–десорбция без существенной потери емкости.
ЗАКЛЮЧЕНИЕ
Выявлена закономерность увеличения динамической емкости и селективности сорбции ионов серебра(I) сорбентом на основе сульфоэтилированного полиаминостирола с увеличением степени его модифицирования в присутствии ряда сопутствующих ионов переходных и щелочноземельных металлов. Путем математической обработки динамических выходных кривых сорбции ионов серебра(I) и меди(II) СЭПАС моделями Томаса, Адамса–Бохарда и Юна–Нельсона определены значения параметров сорбции, в том числе значения констант скорости и динамической емкости по исследуемым ионам металлов. Установлено, что наибольшей селективности сорбции серебра(I) по сравнению с медью(II) отвечает скорость пропускания раствора 2 мл/мин и pH 6.0 Показано, что поверхность СЭПАС может быть полностью регенерирована в динамических условиях при использовании 20.0 мл 1 М раствора азотной кислоты. Показано, что использование синтетической полиаминостирольной матрицы для синтеза сульфоэтилированных материалов позволяет получить более эффективный сорбент для селективной сорбции серебра(I) по сравнению с хитозаном.
Список литературы
Хухрянский В.Г. Химия биогенных элементов. Киев: Выща шк., 1990. 207 с.
Скальный А.В. Химические элементы в физиологии и экологии человека. М.: Оникс 21 век; Мир, 2004. 216 с.
Садовников С.И. // Журн. неорган. химии. 2019. Т. 64. № 10. С. 1116. [Sadovnikov S.I. // Russ. J. Inorg. Chem. 2019. V. 64. № 10. P. 1309. https://doi.org/10.1134/S0036023619100115]https://doi.org/10.1134/S0044457X19100118
Cantuaria M.L., De Almeida Neto A.F., Nascimento E.S. et al. // J. Clean. Prod. 2016. V. 112. P. 1112. https://doi.org/10.1016/j.jclepro.2015.07.021
Freitas E.D., Carmo A.C.R., Almeida Neto A.F., Vieira M.G.A. // Appl. Clay Sci. 2017. V. 137. P. 69. https://doi.org/10.1016/j.clay.2016.12.016
Staron P., Chwastowski J., Banach M. // J. Clean. Prod. 2017. V. 149. P. 290. https://doi.org/10.1016/j.jclepro.2017.02.116
Zhang L., Zhang G., Wang S. et al. // J. Taiwan Inst. Chem. Eng. 2017. V. 71. P. 330. https://doi.org/10.1016/j.jtice.2017.01.001
Hong M., Wang X., You W. et al. // Int. J. Chem. Eng. 2017. V. 313. P. 1278. https://doi.org/10.1016/j.cej.2016.11.030
Taheri R., Bahramifar N., Zarghami M. et al. // Powder Technol. 2017. V. 321. P. 44. https://doi.org/10.1016/j.powtec.2017.08.022
Ding L., Shao P., Luo Y. et al. // Chem. Eng. J. 2019. V. 382. № 123 009. https://doi.org/10.1016/j.cej.2019.123009
Pestov A.V., Privar Yu.O., Ustinov A.Yu. // Chem. Eng. J. 2016. V. 283. P. 323. https://doi.org/10.1016/j.cej.2015.07.066
Liu X., Yang L., Luo X. et al. // Chem. Eng. J. 2018. V. 348. P. 224. https://doi.org/10.1016/j.cej.2018.04.179
Bhattarai S., Kim J., Yun Y. et al. // React. Funct. Polym. 2016. V. 105. P. 52. https://doi.org/10.1016/j.reactfunctpolym.2016.05.013
Huang Y., Zhao W., Zhang X. // Chem. Eng. J. 2019. V. 375. № 121 935. https://doi.org/10.1016/j.cej.2019.121935
Wang S., Li H., Chen X. // J. Environ. Sci. 2012. V. 24. № 12. P. 2166. https://doi.org/10.1016/S1001-0742(11)61052-8
Mahlangua T., Das R., Abia L.K. et al. // Chem. Eng. J. 2019. V. 360. P. 423. https://doi.org/10.1016/j.cej.2018.11.231
Kadukova J. // Bioresour. Technol. 2016. V. 216. P. 406. https://doi.org/10.1016/j.biortech.2016.05.104
Anekthirakun P., Imyim A. // Microchem J. 2019. V. 145. P. 470. https://doi.org/10.1016/j.microc.2018.11.008
Zhang M., Zhang Y., Helleur R. // Chem. Eng. J. 2015. V. 264. P. 56. https://doi.org/10.1016/j.cej.2014.11.062
Xiong C., Wang S., Zhang L. et al. // J. Mol. Liq. 2018. V. 254 P. 340. https://doi.org/10.1016/j.molliq.2018.01.129
Петрова Ю.С., Алифханова Л.М.к., Неудачина Л.К. и др. // Журн. прикл. химии. 2016. Т. 89. № 9. С. 1211. [Petrova Y.S., Alifkhanova L.M.k., Neudachina L.K. et al. // Russ. J. Appl. Chem. 2016. V. 89. № 9. P. 1500. https://doi.org/10.1134/s1070427216090184]
Alifkhanova L.M.k., Pestov A.V., Mekhaev A.V. et al. // J. Environ. Chem. Eng. 2019. V. 7. № 1. https://doi.org/10.1016/j.jece.2018.102846
Золотов Ю.А., Цизин Г.И., Моросанова Е.И. и др. // Успехи химии. 2005. Т. 74. № 1. С. 41.
Marhol M. Ion exchangers in analytical chemistry. Their properties and use in inorganic chemistry. Prague: Academia, 1982.
etrova Yu.S., Pestov A.V., Neudachina L.K. // Sep. Sci. Technol. 2016. V. 51. № 9. 10.1080/01496395.2016.115708
Petrova Y.S., Pestov A.V., Usoltseva M.K. et al. // J. Hazard. Mater. 2015. V. 299. P. 696. https://doi.org/10.1016/j.jhazmat.2015.08.001
Umland F., Iansen A., Tirig D. Комплексные соединения в аналитической химии. Теория и практика применения. М.: Химия, 1975. 532 с.
Басаргин Н.Н., Островская Е.Р., Юшковa Е.Ю. и др. // Журн. физ. химии. 2006. V. 80. № 1. С. 127. [Basargin N.N., Oskotskaya E.R., Yushkova E.Yu. et al. // Russ. J. Phys. Chem. 2006. V. 80. № 1. P. 115. https://doi.org/10.1134/S0036024406010183]
Wang Q.Z., Chen X.G., Liu N. et al. // Carbohydr. Polym. 2006. V. 65. P. 194. https://doi.org/10.1016/j.carbpol.2006.01.001
Петрова Ю.С., Неудачина Л.К. // Журн. неорган. химии. 2013. Т. 58. № 1. С. 697. [Petrova Yu.S., Neudachina L.K. // Russ. J. Inorg. Chem. 2013. V. 58. № 5. P. 617. https://doi.org/10.1134/s0036023613050173]https://doi.org/10.7868/S0044457X13050176
El-Menshawy A.M., Kenawy I.M., El-Asmy A.A. // J. Hazard. Mater. 2010. V. 173. P. 523. https://doi.org/10.1016/j.jhazmat.2009.08.116
Jeon C. // J. Ind. Eng. Chem. 2017. V. 53. № 25. P. 261. https://doi.org/10.1016/j.jiec.2017.04.034
Lasko C.L., Hurst M.P. // Environ. Sci. Technol. 1999. V. 33. № 20. P. 3622. https://doi.org/10.1021/es980443r
Nascimento Júnior W.J., Silva M.G.C., Vieira M.G.A. // J. Water Process Eng. 2020. V. 36. https://doi.org/10.1016/j.jwpe.2020.101294
Behbahani M., Najafi F., Amini M.M. et al. // J. Ind. Eng. Chem. 2014. V. 20. № 4. P. 2248. https://doi.org/10.1016/j.jiec.2013.09.057
Kholmogorova A.S., Chernysh M.L., Neudachina L.K. et al. // React. Funct. Polym. 2020. V. 151. https://doi.org/10.1016/j.reactfunctpolym.2020.104596
Calero M., Ronda A., Pérez A. et al. // Desal. and Water Treat. 2016. V. 57. P. 25140. https://doi.org/10.1080/19443994.2016.1150209
Tofan L., Paduraru C., Teodosiu C. et al. // Cellul. Chem. Technol. 2015. V. 49. P. 219.
Malkoc E., Nuhoglu Y. // J. Hazard Mater. 2006. V. 135. P. 328. https://doi.org/10.1016/j.jhazmat.2005.11.070
Kavianinia I., Plieger P.G. // Carbohydr. Polym. 2012. V. 90. № 2. P. 875. https://doi.org/10.1016/j.carbpol.2012.06.014
Simantiraki F., Gidarakos E. // J. Environ. Manage. 2015. V. 159. P. 218. https://doi.org/10.1016/j.jenvman.2015.04.043
Arima A.L., Neves K., Quina M.J. et al. // J. Clean. Prod. 2018. V. 183. P. 272. https://doi.org/10.1016/j.jclepro.2018.02.094
Мясоедова Г.В. Хелатообразующие сорбенты. М.: Наука, 1984. 171 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии