Журнал неорганической химии, 2021, T. 66, № 4, стр. 549-556
Сорбция комплексов иридия нанесенными ионными жидкостями
Н. М. Боднарь a, Т. М. Буслаева a, *, Г. В. Эрлих b, Т. А. Марютина c, Е. В. Копылова d, П. Г. Мингалев b
a МИРЭА – Российский технологический университет (Институт тонких химических технологий
им. М.В. Ломоносова)
119571 Москва, пр-т Вернадского, 86, Россия
b Московский государственный университет им. М.В. Ломоносова, Химический факультет
119991 Москва, Ленинские горы, 1, Россия
c Институт геохимии и аналитической химии им. В.И. Вернадского РАН
119334 Москва, ул. Косыгина, 19, Россия
d МИРЭА – Российский технологический университет (Физико-технологический институт)
119454 Москва, пр-т Вернадского, 78, Россия
* E-mail: buslaevatm@mail.ru
Поступила в редакцию 05.11.2020
После доработки 20.11.2020
Принята к публикации 26.11.2020
Аннотация
Работа посвящена выделению хлоридных комплексов платиновых металлов, в частности [IrCl6]3– и [IrCl6]2–, из солянокислых растворов с различным содержанием хлорид-иона методом сорбции. В качестве сорбентов использованы модифицированные кремнеземы, полученные химическим присоединением к их поверхности короткоцепочечных молекул полиэтиленимина (ПЭИ) c последующим сшиванием и кватернизацией, что приводит к образованию тонкого слоя наносимых ионных жидкостей. Подобран ПЭИ с низкой молекулярной массой (600, ~12 звеньев) и преимущественно линейными молекулами. Подвижность цепей полиэтиленимина предопределяет возможность его многоточечной прививки к поверхности кремнезема. Приведены методики синтеза сорбентов и их структурные характеристики. Выявлены зависимости сорбции ионов Ir(III) и Ir(IV) от концентрации HCl, H+, Cl–. Сорбционное равновесие достигается в течение 2–5 мин, что типично для материалов на основе мезопористого кремнезема и указывает на анионообменный механизм связывания. Количественная десорбция ионов Ir(IV) достигается горячим раствором NH4Cl. Сорбенты опробованы для отделения Ir(IV) от Pt(IV) и Rh(III). Полученные результаты могут быть рекомендованы для извлечения ионов платиновых металлов из хлоридных растворов сложного состава.
ВВЕДЕНИЕ
Иридий – редкий платиновый металл, годовое потребление которого в настоящее время составляет чуть более 8 т [1]. Он применяется для изготовления термоэлектрических генераторов, термопар, термоэмиссионных катодов и топливных баков, используемых в космических аппаратах [2]. Уникальные свойства иридия, такие как высокая прочность и твердость, огнеупорность и износостойкость, высокая коррозионная стойкость, делают его незаменимым для производства тиглей, которые используются для выращивания крупных монокристаллов в основном для лазерной техники и электронных приборов, свечей зажигания для двигателей с искровым зажиганием. Металлический иридий и его соединения применяются также в катализе и медицине.
Выделение иридия из растворов различного состава осложняется рядом факторов, среди которых в первую очередь следует выделить высокую кинетическую инертность комплексов иридия и наличие двух характерных состояний окисления (+3 и +4), легко переходящих друг в друга при изменении окислительно-восстановительного потенциала среды. Нельзя не учитывать также наличие в растворах преобладающих количеств других платиновых металлов, в частности, платины и родия.
Традиционно для извлечения ионов иридия из растворов и их отделения от ионов других платиновых металлов применяется жидкость-жидкостная экстракция [3] с использованием в качестве экстрагентов четвертичных аммониевых солей типа Aliquat 336 [4] или триалкилфосфиноксидов типа Cyanex 921 [5]. Недостатки данного метода хорошо известны – низкая эффективность и использование токсичных органических растворителей [6]. Альтернативные технологии представлены сорбционными процессами11 (см. недавние обзоры [7–9]) и экстракцией ионными жидкостями (см. обзоры [10, 11] и в качестве примера оригинальной работы по экстракции иридия(IV) – [12]). Симбиоз этих двух подходов заключается в использовании так называемых нанесенных ионных жидкостей, SIL [13, 14] – сорбентов, представляющих собой твердый носитель с нанесенной (в идеале привитой) ионной жидкостью. В качестве носителей предпочтительны пористые неорганические вещества, например кремнезем [13], хотя возможны и органические полимеры, включая природные (типа хитозана) [15].
Нанесенные ионные жидкости обычно представлены солями четвертичных аммониевых и фосфониевых солей, но, по нашему мнению, особого внимания заслуживают сорбенты с химически привитым к поверхности носителя полиэтиленимином (ПЭИ) [6, 15–17]. Многоточечная прививка молекулы ПЭИ к поверхности должна обеспечить высокую химическую стабильность сорбента. Наличие большого числа функциональных групп в составе полимера приведет к росту сорбционной емкости сорбента. Кроме того, аминогруппы могут быть легко трансформированы в четвертичные аммониевые группы либо в разнообразные комплексообразующие группы [17]. Еще одним преимуществом этих сорбентов является их значительно более низкая стоимость по сравнению с “каноническими” носителями ионных жидкостей.
Цель настоящей работы – выявление закономерностей сорбции иридия(III) и иридия(IV) из хлоридных растворов кремнеземом с химически привитым полиэтиленимином и его кватернизованными производными.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реагенты. К2[IrCl6], К3[IrCl6], Na2[PtCl6] ⋅ 6H2O и К3[RhCl6] ⋅ H2O синтезировали по известным методикам [18]. HCl, NaCl, NH4Cl, тиомочевина производства ООО “ТД “Химмед” имели квалификацию “х. ч.” Для синтеза сорбента использовали силикагель Davisil Grade 62 (W. R. Grace&Co., США), фракция 0.07–0.2 мм (60–200 меш). Применяли 3-хлорпропилтриметоксисилан, полиэтиленимин (м. у. 400–800), дибромэтан, метилиодид, бензилбромид и диизопропилэтиламин производства компании Sigma-Aldrich. Органические растворители – толуол, этанол, ацетонитрил (ООО “ТД “Химмед”) – использовали в синтезе без предварительной перегонки.
Методы. Структурные характеристики сорбентов определяли методом низкотемпературной адсорбции азота на автоматическом анализаторе ASAP 2020 (Micromeritics, США). Элементный анализ сорбентов на содержание углерода, водорода и азота проводили на CHN-анализаторе Perkin Elmer 2400. Электронные спектры поглощения растворов записывали на спектрофотометре Specord UV-Visible Heλios α (США) в диапазоне длин волн 200–800 нм в кварцевых кюветах с толщиной поглощающего слоя 1 см. Содержание ионов металлов в растворе определяли на атомно эмиссионном спектрометре с индуктивно связанной плазмой iCap-6500 Duo (Thermo Fisher Scientific, США).
Синтез сорбентов
Кремнезем с привитым ПЭИ (III). Навеску 100 г силикагеля Davisil (I), предварительно высушенного при 120°С в течение 4 ч, и 40 мл 3-хлорпропилтриметоксисилана в 500 мл толуола нагревали при механическом перемешивании в течение 12 ч. Полученный продукт II отфильтровывали, промывали толуолом и этанолом и сушили на фильтре. Продукт II помещали в колбу, снабженную механической мешалкой, добавляли раствор 30 мл ПЭИ в 500 мл этанола. Реакционную смесь нагревали с обратным холодильником при 80°С в течение 8 ч, затем переносили ее на фильтр, промывали осадок 1000 мл этанола и высушивали на фильтре.
Кремнезем со сшитым ПЭИ (IV). Навеску 50 г модифицированного кремнезема III помещали в колбу, снабженную механической мешалкой, прибавляли раствор 11.7 мл дибромэтана в 250 мл этанола. Смесь нагревали с обратным холодильником при 80°С в течение 11 ч, затем переносили на фильтр, осадок промывали 2 раза порциями по 150 мл этанола, 2 раза по 150 мл дистиллированной воды, 2 раза по 150 мл насыщенного раствора хлорида натрия, 3 раза по 150 мл дистиллированной воды, 2 раза по 150 мл этанола и сушили сначала на воздухе, а затем в сушильном шкафу при 100°С в течение 2 ч.
Кремнезем с ПЭИ, кватернизованным метилиодидом (Va). Навеску 20 г модифицированного кремнезема IV помещали в колбу, снабженную механической мешалкой, добавляли раствор 8.4 мл метилиодида и 7.5 мл диизопропилэтиламина в 150 мл ацетонитрила; смесь нагревали с обратным холодильником при 80°С в течение 8 ч, переносили на фильтр, промывали 2 раза 50 мл ацетонитрила, 2 раза порциями по 50 мл дистиллированной воды, 5 раз по 50 мл насыщенного раствора хлорида натрия, 3 раза по 50 мл дистиллированной воды, 2 раза по 50 мл этанола и сушили на воздухе.
Кремнезем с ПЭИ, кватернизованным бензилбромидом (Vb). Навеску 20 г модифицированного кремнезема IV помещали в колбу, снабженную механической мешалкой, добавляли раствор 16.2 мл бензилбромида и 7.5 мл диизопропилэтиламина в 150 мл ацетонитрила. Смесь нагревали с обратным холодильником при 80°С в течение 8 ч. Полученный продукт выделяли и промывали аналогично Va.
Синтезированные сорбенты охарактеризованы данными элементного анализа (табл. 1) и измерениями структурных параметров (табл. 2). Количество присоединенного ПЭИ определяли также прямым потенциометрическим титрованием кислотой в присутствии 1 М KNO322.
Таблица 1.
Характеристики синтезированных сорбентов
| Образец | Содержание элементов, мас. % | Поверхностная концентрация функциональных групп | |||
|---|---|---|---|---|---|
| C | H | N | ммоль/г | групп/нм2 | |
| II | 3.28 | 0.68 | – | 0.91 | 1.8 |
| III | 7.08 | 1.40 | 2.22 | 1.59 | 3.3* |
| IV | 7.61 | 1.44 | 2.20 | 1.57 | 3.3* |
| Va | 9.50 | 1.76 | 2.16 | 1.54 (0.77) | 3.3* (1.7**) |
| Vb | 18.2 | 2.12 | 1.95 | 1.39 (0.56) | 3.3* (1.3**) |
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
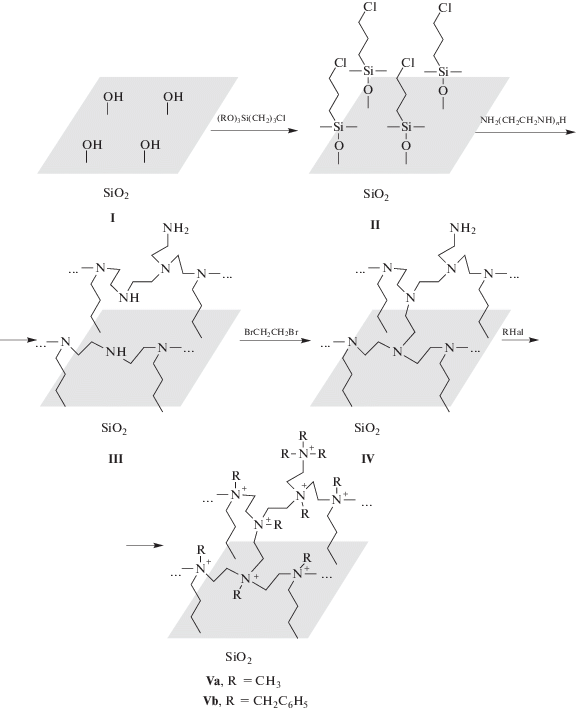
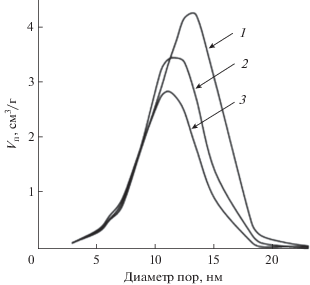
Сорбенты синтезировали по схеме, представленной на рис. 1. Поясним выбор этой схемы, а также используемых реагентов. Кремнезем марки Davisil, выбранный как носитель, с одной стороны, характеризуется достаточно высокой удельной поверхностью (325 м2/г) для получения сорбентов с высокой сорбционной емкостью, а с другой – имеет достаточно широкие поры (средний диаметр 13.6 нм) для проведения реакций химической модификации, наиболее значимых для стадии присоединения ПЭИ (табл. 2, рис. 2). Хотя диаметр пор в процессе модификации уменьшается, он все же остается достаточно большим для быстрой диффузии ионов металлов.
Полиэтиленимин очень хорошо сорбируется кремнеземом в органических и нейтральных водных средах [19], но в кислых растворах, в которых обычно осуществляется аффинаж платиновых металлов, он неизбежно десорбируется, что предопределяет необходимость химического прикрепления ПЭИ к поверхности кремнезема. Для этой цели оптимально использовать бифункциональные кремнийорганические соединения, что убедительно обосновано и показано в работах последних лет [20]. В данной работе использовали коммерчески доступный 3-хлорпропилтриметоксисилан (CH3O)3Si(CH2)3Cl и прививали его к поверхности кремнезема с образованием плотного монослоя.
Далее подбирали ПЭИ с низкой молекулярной массой (600, ~12 звеньев) и преимущественно линейными молекулами, которые могут проникнуть во все поры и покрыть их тонким слоем. Подвижность цепей ПЭИ предопределяет возможность многоточечной прививки молекул ПЭИ к поверхности. Для дополнительного повышения гидролитической стабильности сорбентов проводили сшивку нанесенных молекул ПЭИ дибромэтаном (аналогичный прием использовали ранее, например, в работе [21]).
Кватернизацию аминогрупп привитого ПЭИ проводили действием метилиодида или бензилбромида. Идея состояла в том, чтобы проверить влияние степени экранирования заряда на селективность сорбции. Отметим, что сорбент с бензильными группами Vb не очень хорошо смачивается водой, что затрудняет изучение сорбции из водных растворов. Поэтому перед проведением эксперимента необходимо смачивать сорбент этанолом.
Как отмечалось выше, модифицирование сопровождается уменьшением удельной поверхности сорбентов, но это только кажущийся эффект: добавление органического компонента приводит к снижению содержания носителя в сорбенте с пропорциональным уменьшением величины S. Происходит также уменьшение среднего диаметра пор, наиболее значительное на первом этапе модификации – прикреплении кремнийорганического спейсера. Плотность прививки достаточно высока и составляет 1.8 молекулы/нм2 [20, 22], уменьшение диаметра пор равно удвоенной длине присоединенной молекулы. Поскольку уменьшение диаметра пор после присоединения ПЭИ относительно невелико, можно предположить, что молекулы ПЭИ ориентированы в основном параллельно поверхности носителя, образуя очень тонкий слой ионной жидкости.
Степень протекания реакций сшивания и кватернизации можно оценить по данным об изменении содержания углерода в образцах (табл. 1). При сшивании каждая молекула дибромэтана реагирует с двумя атомами азота. Принимая во внимание данный факт, получаем, что в реакцию вступает 1 атом азота из 3.6, входящих в состав привитого ПЭИ. Увеличение содержания углерода после обработки метилиодидом составляет 1.9%, таким образом, в реакцию кватернизации вступает около 50% атомов азота. В случае сорбента Vb увеличение содержания углерода составляет 10.6%, т.е. в реакцию кватернизации вступает ~40% атомов азота. Но это нижняя граница оценки. В расчетах мы исходили из того, что при кватернизации две молекулы реагента вступают в реакцию с каждым атомом азота, что соответствует вторичным аминогруппам. Однако в ПЭИ достаточно велико содержание третичных аминогрупп, и их число увеличивается в результате сшивки, а для кватернизации третичных аминогрупп необходима одна молекула реагента.
Перейдем к рассмотрению закономерностей сорбции ионов иридия из кислых хлоридных сред, наиболее распространенных в аналитической и технологической практике. Иридий существует в таких растворах в виде комплексных анионов [IrCl6]3– и [IrCl6]2–. Нами были синтезированы соответствующие калийные соли иридия, которые использовали в качестве исходных для приготовления солянокислых и хлоридных растворов. Установлено, что электронные спектры поглощения растворов оставались неизменными в течение по крайней мере 3 сут, что свидетельствует о стабильности гексахлоридных комплексов Ir(III) и Ir(IV) (рис. 3а).
Рис. 3.
ЭСП растворов K3[IrCl6] (CIr = 1 × 10–2 моль/л) и K2[IrCl6] (CIr = 5.5 × 10–4 моль/л) (а) и сорбента III, насыщенного комплексом [IrCl6]2– (суспензия в вазелиновом масле) (б).
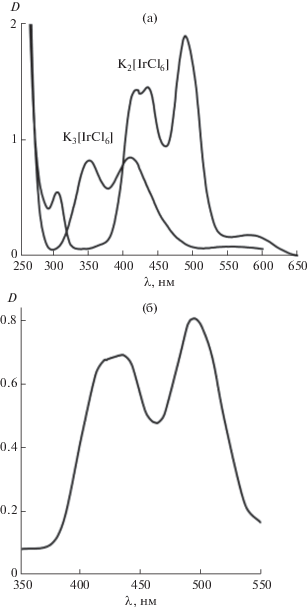
Сорбция на всех исследованных сорбентах в статических условиях протекает очень быстро: сорбционное равновесие устанавливается в течение 2–5 мин. Это характерно для сорбентов на основе мезопористого кремнезема [23, 24]. Кроме того, высокая скорость сорбции кинетически инертных комплексов иридия явно указывает на анионообменный механизм связывания. Одним из доказательств тому служит электронный спектр поглощения насыщенного иридием сорбента III, полученного сорбцией из солянокислого раствора соли K2[IrCl6] (рис. 3б), который идентичен спектру исходного раствора (рис. 3а).
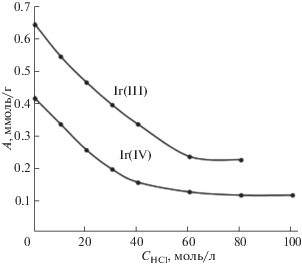
Типичные зависимости сорбции ионов иридия(III) и иридия(IV) от кислотности раствора представлены на рис. 4 на примере сорбента III. Отметим значительно большую (в среднем в 2–3 раза) сорбцию Ir(III) по сравнению с Ir(IV). На самом деле роль кислоты в сорбции на исследуемых сорбентах незначительна: все зависит от концентрации хлорид-ионов. На рис. 5 показана зависимость сорбции Ir(III) и Ir(IV) на сорбенте III при постоянной кислотности (0.1 M HCl) от концентрации добавленного в виде NaCl хлорид-иона. Сравнение зависимостей, представленных на рис. 4 и 5, показывает, что именно хлорид-ион подавляет сорбцию хлоридных комплексов иридия в полном соответствии с механизмом анионообмена.
Рис. 4.
Зависимость сорбции ионов Ir(III) и Ir(IV) на сорбенте III от концентрации HCl. СIr = 5 × 10–3 моль/л; m = = 0.05 г; V = 10 мл; время контакта фаз – 5 мин.
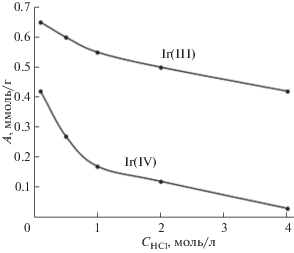
Рис. 5.
Зависимость сорбции ионов Ir(III) и Ir(IV) на сорбенте III от концентрации хлорид-иона: 0.1 M HCl, СIr = 5 × 10–3 моль/л; m = 0.05 г; V = 10 мл; время контакта фаз – 5 мин.
Сильные анионообменники Va и Vb наиболее эффективны для извлечения иридия(III) и иридия(IV). В идентичных условиях (0.1 М HCl, 90 г/л Cl–, CIr = 5 × 10–3 моль/л; mсорб = 0.05 г; Vраствора = 10 мл) сорбция иридия(IV) на сорбентах III, IV и Va, Vb составляет 0.09, 0.21 и 0.26, 0.28 ммоль/г соответственно.
Стадия элюирования вызывает наибольшие проблемы в сорбционных процессах. Эту часть работы мы провели в динамическом режиме, сосредоточив внимание на иридии(IV) как основной форме нахождения иридия в реальных растворах и сорбентах III и Va как примерах слабых и сильных анионообменников. Заметим, что для обоих сорбентов получены близкие результаты.
Мы протестировали следующие элюенты:
– растворы HCl (6–9 М) при температуре окружающей среды;
– растворы NaCl (20–30 мас. %) при различных температурах (20–80°С);
– растворы NH4Cl (20 мас. %) при различных температурах (20–80°С);
– растворы тиомочевины (5–10 мас. %) в HCl (0.01–0.1 М) при температуре окружающей среды.
Растворы HCl и NaCl, в принципе, элюируют сорбированные ионы иридия(IV), но для этого требуются большие объемы элюентов – более 40 свободных объемов колонки. При использовании растворов тиомочевины в элюате обнаруживаются только следовые количества иридия(IV). Наилучшие результаты получены для горячих растворов NH4Cl – количественная десорбция иридия(IV) происходит при прохождении 3–5 свободных объемов колонки.
Если говорить о десорбции иридия(III), то ввиду сильного связывания высокозарядных ионов [IrCl6]3– с сорбентами, выбрать элюент для их прямого элюирования не удалось. Эта проблема может быть решена путем in situ окисления иридия(III) до иридия(IV) добавлением гипохлорита натрия (или пропусканием газообразного хлора) в элюент (растворы HCl или NaCl). Не исключено, однако, что при этом может произойти частичное разрушение сорбента, поэтому необходим строгий контроль окислительно-восстановительного потенциала среды.33
Рассмотрим некоторые предварительные данные об использовании синтезированных сорбентов для отделения ионов Ir(IV) от ионов других платиновых металлов, а именно от ионов Pt(IV) и Rh(III).
Эксперимент проводили в сорбционной колонке с внутренним диаметром 24 мм, заполненной 8 г сорбента III, заполнение колонки осуществляли из суспензии сорбента в 0.1 М HCl. Через колонку пропускали 5 мл раствора следующего состава, типичного для реальных растворов: 0.1 М HCl + 30 г/л NaСl, Pt – 6.08 г/л, Rh – 0.58 г/л, Ir – 0.053 г/л. Колонку промывали 27 мл раствора 0.1 М HCl + 30 г/л NaСl, прошедшие растворы объединяли и определяли в них содержание платиновых металлов. Колонку промывали 23 мл 5%-ного раствора тиомочевины в 0.01 M HCl, полученный элюат 1 анализировали. Колонку промывали 11 мл воды (для удаления раствора тиомочевины) и затем пропускали 37 мл горячего (80°С) 20%-ного раствора NH4Cl, полученный элюат 2 анализировали.
Результаты типичного эксперимента представлены в табл. 3. Данные табл. 3 показывают, что разделения ионов платиновых металлов на стадии сорбции из 0.1 М HCl добиться не удается, поскольку комплексы [PtCl6]2– и [IrCl6]2– характеризуются близким сродством к анионообменному сорбенту. Можно было ожидать более сильного связывания ионов [RhCl6]3–, но степень извлечения родия оказалась меньше, чем у платины и иридия. По всей видимости, это обусловлено акватацией комплексов родия(III) в 0.1 М HCl, например, по реакции [25]:
Таблица 3.
Разделение ионов Ir(IV), Pt(IV) и Rh(III) на сорбенте III в динамическом режиме
| Металл | Содержание в исходном растворе, мг | Содержание в вытекающем растворе, мг | Извлечение, % |
Содержание в элюате 1, мг | Содержание в элюате 2, мг |
|---|---|---|---|---|---|
| Pt(IV) | 30 410 | * | 100 | 30 260 | * |
| Ir(IV) | 264 | * | 100 | * | 259 |
| Rh(III) | 2880 | 471 | 84 | 125 | 2220 |
[RhCl6]3– + H2O ↔ [Rh(H2O)Cl5]2–
и, как следствие, понижением заряда комплекса.
Предпочтительнее использовать для разделения селективное элюирование. Платину(IV) можно элюировать 5%-ным раствором тиомочевины в 0.01 М HCl: содержание Rh(III) в элюате тиомочевины не превышает 0.4% от содержания Pt(IV). Горячий раствор NH4Cl количественно элюирует Ir(IV) и Rh(III). Отметим, что в элюате отсутствует Pt(IV), которая присутствовала в исходном растворе в 115-кратном избытке по отношению к Ir(IV).
Нами также изучена возможность разделения Ir(IV) и Rh(III) в среде 6 М HCl, где родий присутствует в форме иона [RhCl6]3–. С целью повышения точности определения брали сопоставимые концентрации ионов Ir(IV) и Rh(III) в растворе, равные 4.7 и 5.5 ммоль/л или 0.902 и 0.567 г/л соответственно. Для этого эксперимента мы также применили колонку с внутренним диаметром 8 мм, заполненную 0.6 г сорбента III. Результаты представлены на рис. 6.
Рис. 6.
Сорбция иридия(IV) и родия(III) из 6 M HCl на сорбенте III в динамическом режиме в зависимости от объема пропущенного раствора.
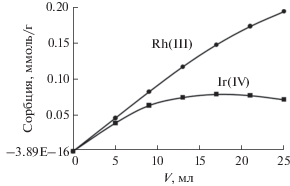
При пропускании первых порций раствора происходит количественное извлечение родия(III). По мере насыщения сорбента и приближения окрашенной зоны к нижнему краю колонки начинается проскок ионов родия(III), однако при этом общая степень извлечения родия(III) из раствора остается очень высокой – 85%. Поведение иридия(IV) принципиально отличается: при пропускании первых порций раствора происходит его практически количественное извлечение, однако в дальнейшем количество сорбированного иридия(IV) начинает уменьшаться. Это указывает на то, что сильно сорбирующиеся ионы родия(III) вытесняют ионы иридия(IV) из колонки, и при пропускании достаточно большого объема исходного раствора в колонке остаются только ионы родия(III).
ЗАКЛЮЧЕНИЕ
Описан достаточно простой и дешевый способ получения носителя ионных жидкостей путем химического прикрепления короткоцепочечных молекул полиэтиленимина к поверхности кремнезема с последующим сшиванием и кватернизацией. Полученные таким образом сорбенты обладают высокой стабильностью и высокой сорбционной способностью по отношению к ионам Ir(III) и Ir(IV) в растворах HCl. Извлечение происходит по анионообменному механизму и регулируется главным образом концентрацией хлорид-ионов. Количественная десорбция ионов Ir(IV) достигается горячим раствором NH4Cl, для десорбции ионов Ir(III) необходимо его окисление до Ir(IV). Ir(IV) можно легко отделить от 115-кратного избытка Pt(IV) на стадии селективного элюирования. Разделение Ir(IV) и Rh(III) возможно в 6 М HCl.
Список литературы
http://www.platinum.matthey.com/documents/new-item/pgm%20market%20reports/pgm_market_report_february_2020.pdf
Bilyalova A.A., Kalle P., Smirnov D.E. et al. // Russ. J. Inorg. Chem. 2019. V. 64. № 2. P. 207. [Билялова А.А., Татарин С.В., Калле П. и др. // Журн. неорган. химии. 2019. Т. 64. № 2. С. 172. https://doi.org/10.1134/S0044457X1902003X]https://doi.org/10.1134/S0036023619020037
Kedari S., Coll M.T., Fortuny A. et al. // Sep. Sci. Tech. 2005. V. 40. № 9. P. 1927. https://doi.org/10.1081/SS-200064551
Nguyen T.H., Sonu C.H., Lee M.S. // Hydrometallurgy. 2016. V. 164. P. 71. https://doi.org/10.1016/J.Hydromet.2016.05.014
Le M.N., Lee M.S. // Geosystem Engineering. 2018. V. 21. № 4. P. 210. https://doi.org/10.1080/12269328.2017.1392903
Anpilogova G.R., Baeva L.A., Nugumanov R.M. et al. // Russ. J. Inorg. Chem. 2018. V. 63. № 8. P. 1100. [Анпилогова Г.Р., Баева Л.А., Нугуманов Р.М. и др. // Журн. неорган. химии. 2018. Т. 63. № 8. С. 1065. https://doi.org/10.1134/S0044457X18080020]https://doi.org/10.31857/S0044457X2001002X
Ehrlich H.V., Buslaeva T.M., Maryutina T.A. // Russ. J. Inorg. Chem. 2017. V. 62. № 14. P. 1797. https://doi.org/10.1134/S0036023617140030
Nikoloski A.N., Ang K.-L. // Miner. Process. Extr. Metall. Rev. 2014. V. 35. P. 369. https://doi.org/10.1080/08827508.2013.764875
Hubicki Z., Wawrzkiewicz M., Wojcik G. et al. // Ion Exchange - Studies and Applications / Ed. Kilislioglu A. In Tech, 2015. https://doi.org/10.5772/60597
Ozokwelu D., Zhang S., Okafor O. et al. // Novel Catalytic and Separation Processes Based on Ionic Liquids. Elsevier, 2017. P. 280.
Zazybin A., Rafikova Kh., Yu V. et al. // Russ. Chem. Rev. 2017. V. 86. № 12. P. 1254. https://doi.org/10.1070/rcr4743
Papaiconomou N., Billard I., Chainet E. // RSC. Adv. 2014. V. 4. P. 48 260. https://doi.org/10.1039/c4ra06991a
Schwieger W., Selvam T., Klumpp M. et al. // Supported Ionic Liquids: Fundamentals and Applications / Eds. Fehrmann R. et al. Wiley-VCH Verlag., 2014. P. 37. https://doi.org/10.1002/9783527654789
Zhu L., Guo L., Zhang Z. et al. // Sci. China Chem. 2012. V. 55. P. 1479. https://doi.org/10.1007/s11426-012-4632-8
Ruiz M., Sastre A.M., Guibal E. // Solv. Extr. Ion Exch. 2007.V. 21. № 2. P. 307. https://doi.org/10.1081/SEI-120018952
Allen J., Rosenberg E., Karakhanov E. et al. // Appl. Organomet. Chem. 2011. V. 25. P. 245. https://doi.org/10.1002/aoc.1749
Hughes M.A., Wood J., Rosenberg E. // Ind. Eng. Chem. Res. 2008. V. 47. P. 6765. https://doi.org/10.1021/ie800359k
Brauer G. Manual of inorganic synthesis in 6 volumes. V. 5. M., 1985. 360 p.
Hostetler R.E., Swanson J.W. // J. Polym. Sci.: Polym. Chem. 1974. V. 12. P. 29.
Vansant E.F., van der Voort P., Vrancken K.C. // Characterization and chemical modification of the silica surface. Elsevier, 1995. 555 p.
Chanda M., Rempel G.L. // React. Polym. 1995. V. 25. P. 25. https://doi.org/10.1016/0923-1137(95)00004-3
Staroverov S.M., Serdan A.A., Lisichkin G.V. // J. Chrom. A. 1986. V. 364. P. 377.
Tikhomirova T.I., Fadeeva V.I., Kudryavtsev G.V. et al. // Talanta. 1991. V. 38. P. 267.
Kramer J., Driessen W.L., Koch K.R. et al. // J. Sep. Sci. Technol. 2004. V. 39. P. 63. https://doi.org/10.1081/SS-120027401
Буслаева Т.М., Симанова С.А. Аналитическая химия металлов платиновой группы. М.: Комкнига, 2005. 592 с. ISBN 5-484-00161-7
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии