Журнал неорганической химии, 2021, T. 66, № 4, стр. 492-497
Кристаллическая структура и термодинамические свойства титаната ErGaTi2O7
Л. Т. Денисова a, *, М. С. Молокеев a, b, В. В. Рябов c, Ю. Ф. Каргин d, Л. Г. Чумилина a, В. М. Денисов a
a Сибирский федеральный университет
660041 Красноярск, пр-т Свободный, 79, Россия
b Институт физики им. А.В. Киренского ФИЦ КНЦ СО РАН
660036 Красноярск, Академгородок, 50, Россия
c Институт металлургии УрО РАН
620016 Екатеринбург, ул. Амундсена, 101, Россия
d Институт металлургии и материаловедения им. А.А. Байкова РАН
119991 Москва, Ленинский пр-т, 49, Россия
* E-mail: ldenisova@sfu-kras.ru
Поступила в редакцию 21.10.2020
После доработки 23.11.2020
Принята к публикации 30.11.2020
Аннотация
Титанат эрбия-галлия получен твердофазным методом путем последовательного обжига исходных оксидов в воздушной атмосфере при температурах 1273 и 1573 K. С помощью полнопрофильного анализа рентгенограммы полученного порошкообразного образца определена кристаллическая структура ErGaTi2O7: пр. гр. Pcnb; a = 9.77326(15), b = 13.5170(2), c = 7.33189(11) Å, V = 918.58(3) Å3, ρ = 6.10 г/см3. Методом дифференциальной сканирующей калориметрии измерена высокотемпературная теплоемкость титаната эрбия-галлия в интервале температур 320–1000 K. На основе этих данных рассчитаны основные термодинамические функции ErGaTi2O7.
ВВЕДЕНИЕ
Титанаты редкоземельных элементов R2Ti2O7 (R = РЗЭ) длительное время привлекают внимание исследователей [1–7], что обусловлено возможностями их практического применения. Тем не менее многие
свойства указанных соединений исследованы недостаточно, особенно это относится к сложным
титанатам редкоземельных элементов 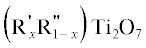 , (R', R" = РЗЭ) [8, 9] и RMTi2O7 (R = = Sm‒Lu, Y; M = Ga, Fe) [10]). Так, например, в последней работе сообщается о получении всех указанных соединений,
в то время как кристаллическая структура определена только для одного из них – GdGaTi2O7. Диаграммы состояния систем R2O3‒Ga2O3(Fe2O3)‒TiO2 полностью не построены. Для уточнения фазовых отношений в таких системах методами
термодинамического моделирования требуются надежные данные о свойствах образующихся
оксидных соединений.
, (R', R" = РЗЭ) [8, 9] и RMTi2O7 (R = = Sm‒Lu, Y; M = Ga, Fe) [10]). Так, например, в последней работе сообщается о получении всех указанных соединений,
в то время как кристаллическая структура определена только для одного из них – GdGaTi2O7. Диаграммы состояния систем R2O3‒Ga2O3(Fe2O3)‒TiO2 полностью не построены. Для уточнения фазовых отношений в таких системах методами
термодинамического моделирования требуются надежные данные о свойствах образующихся
оксидных соединений.
В настоящем сообщении приведены данные о кристаллической структуре титаната ErGaTi2O7 и его теплофизических свойствах (теплоемкость и основные термодинамические функции) в интервале температур 320–1000 K.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Оксидное соединение ErGaTi2O7 получали из Er2O3 (х. ч.), Ga2O3 и TiO2 (ос. ч.) с помощью твердофазных реакций. Методика синтеза описана ранее [11]. Для контроля состава образцов использовали рентгенофазовый анализ (дифрактометр D8 Advance фирмы Bruker; линейный детектор Vantec; CuKα-излучение). Условия проведения дифракционного эксперимента аналогичны приведенным в [11].
Для измерения теплоемкости ErGaTi2O7 использовали метод дифференциальной сканирующей калориметрии (STA 449 C Jupiter). Особенности проведения экспериментов описаны нами в работах [11–14].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Дифрактограмма синтезированного поликристаллического ErGaTi2O7 при комнатной температуре представлена на рис. 1.
Рис. 1.
Дифрактограмма ErGaTi2O7 при комнатной температуре. Экспериментальный (1), расчетный (2) и разностный (3) профили рентгенограмм после уточнения методом Ритвельда; штрихи указывают расчетные положение рефлексов.

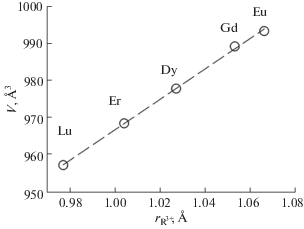
Все рефлексы экспериментальной рентгенограммы проиндицированы в ромбической ячейке (пр. гр. Pcnb) с параметрами, близкими к значениям для GdGaTi2O7 [10] (уточнение проведено методом Ритвельда в программе TOPAS 4.2 [15]). При этом ион Gd был заменен на ион Er. Согласно [10], в структуре GdGaTi2O7 один ион Ga разупорядочен по двум позициям: 4c (Ga) и 8d (Gai) с заселенностями позиций 0.78 и 0.11 соответственно. Мы использовали уточнение структуры по порошку, которое является менее точным, поэтому указанные заселенности были зафиксированы. Принимали также во внимание, что в исходной модели GdGaTi2O7 три позиции в независимой части ячейки заселены Ti/Ga. Это разупорядочение не включает в себя разупорядочения по нескольким позициям, как для случая Ga/Gai. Для повышения стабильности при уточнении заселенности позиций Ti/Ga на сумму количества ионов Ti и Ga в ячейке наложено ограничение в виде линейных уравнений. Полученные результаты приведены в табл. 1‒3. Линейная зависимость объема элементарной ячейки для соединений RGaTi2O7 (R = Eu, Gd, Dy, Er, Lu) от радиуса редкоземельных ионов (рис. 2) подтверждает, по-видимому, что предполагаемый химический состав близок к теоретическому. Значения объемов элементарных ячеек для этих соединений получены нами, а величины ионных радиусов редкоземельных ионов взяты из работы [16].
Таблица 1.
Параметры элементарной ячейки ErGa Ti2O7 и GdGaTi2O7
| Параметр | ErGaTi2O7 (наши данные) | GdGaTi2O7 [10] |
|---|---|---|
| Пр. гр. | Pcnb | Pcnb |
| a, Å | 9.77321(15) | 9.7804(3) |
| b, Å | 13.5170(2) | 13.605(1) |
| c, Å | 7.33189(11) | 7.4186(2) |
| V, Å3 | 968.58(3) | 987.16 |
| ρ, г/см3 | 6.10 | 5.848 |
| Rwp, % | 3.97 | |
| Rp, % | 3.02 | |
| RB, % | 0.81 | |
| χ2 | 1.62 |
Таблица 2.
Координаты атомов и изотропные тепловые параметры (Biso) структуры ErGaTi2O7
| Атом | x | y | z | Biso, Å2 | Occ |
|---|---|---|---|---|---|
| Er Ti1 Ga1 Ti2 Ga2 Ti3 Ga3 Ga Gai O1 O2 O3 O4 O5 O6 O7 |
0.2451(5) 0.2535(14) 0.2535(14) 0.5 0.5 0.0047(1) 9.0047(10) 0 0.049(5) 0.1616(12) 0.399(2) 0.101(2) 0.374(4) 0.367(3) 0.363(3) 0.381(3) |
0.13430(14) 0.3861(4) 0.3861(4) 0.25 0.25 0.4873(5) 0.4873(5) 0.25 0.290(4) 0.3934(12) 0.1142(17) 0.1540(10) 0.282(3) 0.282(3) 0.494(3) 0.489(3) |
0.0025(10) 0.499(3) 0.499(3) 0.251(2) 0.251(2) 0.2533(15) 0.2533(15) 0.3348(15) 0.158(7) 0.236(4) 0.257(4) 0.238(5) 0.443(4) 0.055(4) 0.435(4) 0.063(4) |
0.43(12) 1.00(17) 1.00(17) 1.0(4) 1.0(4) 1.0(3) 1.0(3) 2.1(3) 2.1(3) 0.5(19) 0.5(19) 0.5(19) 0.5(19) 0.5(19) 0.5(19) 0.5(19) |
1 0.856(16) 0.144(16) 0.727(56) 0.273(56) 0.781(32) 0.219(32) 0.78 0.11 1 1 1 1 1 1 1 |
Таблица 3.
Основные длины связей в структуре Er GaTi2O7
| Связь | d, Å | Связь | d, Å |
|---|---|---|---|
| Er–O2 Er–O2i Er–O3 Er–O3i Er–O4i Er–O5 Er–O6ii Er–O7iii (Ti1/Ga1)–O1 (Ti1/Ga1)–O1iv (Ti1/Ga1)–O4 (Ti1/Ga1)–O5iv (Ti1/Ga1)–O6 (Ti1/Ga1)–O7iv |
2.41(3) 2.31(3) 2.24(3) 2.47(3) 2.35(4) 2.35(4) 2.22(3) 2.42(3) 2.13(4) 1.92(4) 1.88(4) 1.88(4) 1.87(3) 1.97(3) |
Ga–O3 Ga–O5iv Gai–O1 Gai–O3 Gai–O3vi Gai–O4i (Ti2/Ga2)–O2 (Ti2/Ga2)–O4 (Ti2/Ga2)–O5 (Ti3/Ga3)–O1 (Ti3/Ga3)–O2v (Ti3/Ga3)–O3vi (Ti3/Ga3)–O6vii (Ti3/Ga3)–O7vii |
1.78(2) 2.12(3) 1.87(6) 2.00(6) 1.75(6) 1.76(6) 2.08(2) 1.92(4) 1.99(3) 1.995(16) 1.96(2) 2.176(18) 1.97(3) 1.84(3) |
Рис. 2.
Зависимость объема элементарной ячейки для соединений RGaTi2O7 (R = Eu, Gd, Dy, Er, Lu) от радиуса редкоземельных ионов.
Полученные экспериментальные результаты по изучению высокотемпературной теплоемкости титаната эрбия-галлия (рис. 3) показывают, что значения Cp при изменении температуры от 320 до 1000 K увеличиваются. Для описания зависимости Cp = f(T) использовано уравнение Майера–Келли [17]:
В нашем случае оно принимает следующий вид (коэффициент корреляции равен 0.9990, а максимальное отклонение экспериментальных точек от сглаживающей кривой – 0.65%):(2)
$\begin{gathered} {{C}_{p}} = \left( {255.85 \pm 0.43} \right) + \left( {30.9 \pm 0.5} \right) \times {{10}^{{ - 3}}}T - \\ - \,\,\left( {39.11 \pm 0.42} \right) \times {{10}^{5}}{{T}^{{--2}}}. \\ \end{gathered} $Рис. 3.
Экспериментальные (2, 4) и рассчитанные методом групповых вкладов (1, 3) значения молярной теплоемкости ErGaTi2O7 (1, 2) и Er2Ti2O7 (3, 4).

Из-за отсутствия других данных по теплоемкости ErGaTi2O7 сравнение проведено с Er2Ti2O7 [18] (рис. 3). Для титаната эрбия и титаната эрбия-галлия наблюдаются разные зависимости Cp = = f(T). При низких температурах значения Cp для замещенного титаната ниже, а при высоких – выше, чем для Er2Ti2O7. Следует отметить, что замещение части эрбия на галлий приводит к изменению кристаллической структуры титаната (пр. гр. Fd3m → пр. гр. Pcnb). Таким образом, замещение половины атомов эрбия на галлий приводит к образованию соединения ErGaTi2O7 с новыми индивидуальными физико-химическими свойствами. Это приводит к различию как в абсолютных значениях Cp, так и к различным зависимостям Cp = f(T).
Значения Cp,298, найденные по уравнению (2), можно сравнить с величинами, рассчитанными с помощью различных модельных представлений, а именно: аддитивным методом Неймана–Коппа (НК) [19, 20], инкрементным методом Кумока (ИМК) [21] и методом групповых вкладов (МГВ) [22] (для расчета методом Л.И. Ивановой [23] необходимы данные по температуре плавления ErGaTi2O7, которые в литературе отсутствуют) (табл. 4). Установлено, что лучшее согласие с экспериментом дает инкрементный метод Кумока. Необходимые значения теплоемкости простых оксидов (Er2O3, Ga2O3 и TiO2) при 298 K для расчетов методом НК взяты из работы [19].
Таблица 4.
Сравнение экспериментальных значений теплоемкости при 298 K с рассчитанными по модельным представлениям величинами для ErGaTi2O7 (Дж/моль K)
| Cp (2) | НК | Δ, % | ИМК | Δ, % | МГВ | Δ, % |
|---|---|---|---|---|---|---|
| 221.0 | 211.4 | –4.3 | 218.6 | –1.1 | 228.0 | +3.2 |
Метод групповых вкладов [22] позволяет прогнозировать температурную зависимость теплоемкости неорганических веществ. В этом методе коэффициенты температурной зависимости
для конкретного соединения находятся путем суммирования ионных вкладов составляющих ионов, образующих это соединение (в [22] приведены табличные значения). С помощью этого метода нами рассчитаны температурные зависимости теплоемкости титанатов ErGaTi2O7 и Er2Ti2O7 (рис. 3). Для ErGaTi2O7 рассчитанные значения практически совпадают с экспериментальными величинами во всей области исследованных температур. В то же время для Er2Ti2O7 рассчитанные значения Cp несколько больше экспериментальных величин (рис. 3), хотя зависимости Cp = f(T) симбатны.Анализ метода групповых вкладов, предложенный в [22] для прогнозирования теплоемкости твердых оксидов, проведен авторами работы [24]. Расчет Cp,298 для 113 оксидов показал, что средняя ошибка равна 4.3%, а максимальная погрешность – 26.3%. Отмечено, что этот метод не в состоянии различать структурные модификации. Кроме того, расчет теплоемкости на примере CaO, Al2O3 и ThO2 в интервале температур 300–2400 K показал, что при высоких температурах наблюдается снижение Cp. Последнее было связано с большим отрицательным значением коэффициента d из уравнения (3). Из общего числа (129) анализируемых катионов отрицательный вклад коэффициента d наблюдался в 25 случаях. На основании проведенного анализа авторы работы [24] заключили, что метод групповых вкладов [22] не всегда обеспечивает надежное прогнозирование зависимости Cp = f(T). Тем не менее, в ряде случаев этот метод может быть использован для расчета температурной зависимости теплоемкости твердых веществ: для сложных оксидных соединений, когда другая дополнительная информация отсутствует (в других методах такого прогнозирования требуются данные, например, о температуре плавления и значении Cp,298 (метод Кубашевского) [25–28], одного экспериментального значения теплоемкости и температурного ряда теплоемкости вещества-эталона (метод Эрдоса и Черны) [25] и т.д.); для небольшого интервала температур (до 1000 K). Кроме того, этим методом с использованием таблиц [29] можно рассчитать Δf$H_{{298}}^{^\circ }$ и Δf$G_{{298}}^{^\circ }$. Они равны ‒3274.2 ± 93.9 и ‒3089.4 ± 112.0 кДж/моль соответственно. Погрешности вычислений определены по правилу сложения погрешностей.
По экспериментальным данным Cp = f(T) для ErGaTi2O7 рассчитаны его основные термодинамические функции (табл. 5).
Таблица 5.
Термодинамические свойства ErGaTi2O7
| T, K | Cp, Дж/(моль K) | H°(T) – H°(320 K), кДж/моль |
S°(T) – S°(320 K), Дж/(моль K) |
–ΔG/T*, Дж/(моль K) |
|---|---|---|---|---|
| 320 350 400 450 500 550 600 650 700 750 800 850 900 950 1000 |
227.5 234.7 243.8 250.4 255.7 259.9 263.5 266.7 269.5 272.1 274.5 276.7 278.8 280.9 282.8 |
– 6.938 18.91 31.28 43.93 56.83 69.92 83.17 96.58 110.1 123.8 137.6 151.4 165.4 179.5 |
– 20.72 52.69 81.80 108.5 133.0 155.8 177.0 196.9 215.6 233.2 249.9 265.8 280.9 295.4 |
– 0.897 5.404 12.30 20.60 29.72 39.29 49.08 58.94 68.76 78.50 88.10 97.53 106.8 115.9 |
ЗАКЛЮЧЕНИЕ
Методом полнопрофильного анализа рентгенограммы синтезированного методом твердофазных реакций сложного оксида уточнена кристаллическая структура ErGaTi2O7: пр. гр. Pcnb; a = = 9.77326(15), b = 13.5170(2), с = 7.33189(11) Å, определены координаты атомов, заселенность позиций и изотропные тепловые параметры атомов в элементарной ячейке. Измерена его теплоемкость при высоких температурах (320‒1000 K) и определены термодинамические свойства.
Список литературы
Портной К.И., Тимофеева Н.И. Кислородные соединения редкоземельных элементов. М.: Металлургия, 1986. 480 с.
Щербакова А.Г., Мамсурова Л.Г., Суханова Г.Е. // Успехи химии. 1979. Т. 48. № 2. С. 423.
Комиссарова Л.Н., Шацкий В.М., Пушкина Г.Я. и др. Соединения редкоземельных элементов. Карбонаты, оксалаты, нитраты, титанаты. М.: Наука, 1984. 235 с.
Zhang W., Zhang L., Zhong H. et al. // Mater. Characteriz. 2010. V. 61. P. 154. https://doi.org/10.1016/j.matchar.2009.11.005
Farmer J.M., Boatner L.A., Chakoumakos B.C. et al. // J. Alloys Compd. 2014. V. 605. P. 63. https://doi.org/10.1016/j.allcom.2014.03.153
Liu C.G., Chen L.J., Yang D.Y. et al. // Comput. Mater. Sci. 2016. V. 114. P. 233. https://doi.org/10.1016/j.commatsci.2015.12.024
Shamblin J., Tracy C.L., Ewing R.C. et al. // Acta Mater. 2016. V. 117. P. 207. https://doi.org/10.1016/j.actamat.2016.07.017
Chen C., Gao Z., Yan H. et al. // J. Am. Ceram. Soc. 2016. V. 99. № 2. P. 523. https://doi.org/10.1111/jacs.13970
Gao Z., Shi B., Ye H. et al. // Adv. Appl. Ceram. 2014. V. 144. № 4. P. 191. https://doi.org/10.1179/1743676114Y.0000000221
Генкина Е.А., Андрианов В.И., Белоконева Е.Л. и др. // Кристаллография. 1991. Т. 36. № 6. С. 1408.
Denisova L.T., Molokeev M.S., Chumilina L.G. et al. // Inorg. Mater. 2020. V. 56. № 12. P. 1242. [Денисова Л.Т., Молокеев М.С., Чумилина Л.Г. и др. // Неорган. материалы. 2020. Т. 56. № 12. С. 1311. https://doi.org/10.31857/S0002337X20120052]https://doi.org/10.1134/S0020168520120055
Denisova L.T., Irtyugo L.A., Kargin Yu.F. et al. // Inorg. Mater. 2017. V. 53. № 1. P. 93. [Денисова Л.Т., Иртюго Л.А., Каргин Ю.Ф. и др. // Неорган. материалы. 2017. Т. 53. № 1. С. 71.] https://doi.org/10.1134/S00201168517010046https://doi.org/10.1134/S0036023617060043
Denisova L.T., Irtyugo L.A., Belousova N.V. et al. // Russ. J. Phys. Chem. 2019. V. 93. № 3. P. 598. [Денисова Л.Т., Иртюго Л.А., Белоусова Н.В. и др. // Журн. физ. химии. 2019. Т. 93. № 3. С. 476.]https://doi.org/10.1134/S004445371903004Xhttps://doi.org/10.1134/S003602441903004
Denisova L.T., Irtyugo L.A., Kargin Yu.F. et al. // Russ. J. Inorg. Chem. 2019. V. 64. № 9. P. 1161. [Денисова Л.Т., Иртюго Л.А., Каргин Ю.Ф. и др. // Журн. неорган. химии. 2019. Т. 64. № 9. С. 980. https://doi.org/ 10.1134/S0044457X19090071]https://doi.org/10.1134/S0036023619090079
Bruker AXS TOPAS 4V: General profile and structure analysis software for powder diffraction data. Userʼs Manual. Bruker AXS, Karlsruhe, Germany. 2008.
Shannon R.D. // Acta Crystallogr. 1976. V. A32. P. 751.
Maier C.G., Kelley K.K. // J. Am. Chem. Soc. 1932. V. 54. № 8. P. 3243.
Denisova L.T., Izotov A.D., Kargin Yu.F. et al. // Dokl. Phys. Chem. 2017. V. 475. Part 2. P. 139. [Денисова Л.Т., Изотов А.Д., Каргин Ю.Ф. и др. // ДАН. 2017. Т. 475. № 4. С. 415. https://doi.org/10.7868/S0869565217220121]https://doi.org/10.1134/S0012501617080012
Leitner J., Chuchvalec P., Sedmidubský D. et al. // Thermochim. Acta. 2002. V. 395. P. 27. https://doi.org/10.1016/S0040-6031(02)00176-6
Leitner J., Voňka P., Sedmidubský D. et al. // Thermochim. Acta. 2010. V. 497. P. 7. https://doi.org/10.1016/j.tca.2009.08.002
Кумок В.Н. Прямые и обратные задачи химической термодинамики. Новосибирск: Наука, 1987. С. 108.
Mostafa A.T.M.G., Eakman J.M., Montoya M.M. et al. // Ind. Eng. Chem. Res. 1996. V. 35. P. 343.
Иванова Л.И. // Журн. неорган. химии. 1961. Т. 35. № 9. С. 1809.
Leitner J., Sedmidubský D., Chuchvalec P. // Ceramics-Silikaty. 2002. V. 46. № 1. P. 29.
Морачевский А.Г., Сладков И.Б., Фирсова Е.Г. Термодинамические расчеты в химии и металлургии. СПб.: Лань, 2018. 2018 с.
Spencer P.J. // Thermochim. Acta. 1998. V. 314. P. 1.
Моисеев Г.К., Ватолин Н.А., Маршук Л.А. и др. Температурные зависимости приведенной энергии Гиббса некоторых неорганических веществ (альтернативный банк данных АСТРА. OWN). Екатеринбург: УрО РАН, 1987. 230 с.
Кубашевский О., Олкокк С.Б. Металлургическая термохимия. М.: Металлургия, 1982. 392 с.
Mostafa A.T.M.G., Eakman J.M., Yarbro S.L. // Ind. Eng. Chem. Res. 1995. V. 34. P. 4577.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии


