Журнал неорганической химии, 2021, T. 66, № 4, стр. 432-439
Мезокристаллы диоксида титана. Рабочая поверхность в фотокаталитических реакциях
А. А. Садовников a, b, Е. Г. Нечаев c, А. Н. Бельтюков d, А. И. Гаврилов a, А. М. Макаревич a, О. В. Бойцова a, e, *
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
b Институт нефтехимического синтеза им. А.В. Топчиева РАН
119991 Москва, Ленинский пр-т, 29, Россия
c Российский химико-технологический университет им. Д.И. Менделеева
125047 Москва, Миусская пл., 9, стр. 1, Россия
d Удмуртский федеральный исследовательский центр УрО РАН
426067 Ижевск, ул. Т. Барамзиной, 34, Россия
e Московский государственный университет имени М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
* E-mail: boytsova@gmail.com
Поступила в редакцию 13.07.2020
После доработки 08.10.2020
Принята к публикации 10.10.2020
Аннотация
Получены мезокристаллы диоксида титана в присутствии полиэтиленгликоля 400. Показано, что допирование мезокристаллов небольшим количеством ванадия увеличивает фотокаталитическую активность по сравнению с мезокристаллами анатаза без добавок. Впервые экспериментально с помощью мягкого ультразвукового воздействия на материал установлено, что в фотокаталитической реакции разложения кристаллического фиолетового участвует вся поверхность мезокристаллов диоксида титана.
ВВЕДЕНИЕ
Благодаря высокой химической стабильности, нетоксичности, низкой стоимости и уникальным физико-химическим свойствам диоксид титана широко применяется в областях, связанных с энергетикой и окружающей средой, в том числе как материал для солнечных элементов [1, 2], фотокатализаторов [3–5], литий-ионных аккумуляторов [6, 7]. К настоящему времени достигнут значительный прогресс в синтезе материалов TiO2 с контролируемыми фазовым составом, формой и размерами мезокристаллов, формой и упорядочением составляющих мезокристалл нанокристаллитов, поскольку именно эти параметры могут в значительной степени влиять на свойства материалов диоксида титана [8, 9]. Мезокристаллы представляют собой самоорганизованные твердые частицы, которые состоят из ориентированных в пространстве кристаллитов [10]. Такие структурные особенности позволяют исследователям рассчитывать на улучшение исходных характеристик материалов, например, в гетерогенном катализе или фотокаталическом разложении органических загрязнений [11]. Опубликованные результаты современных исследований свидетельствуют о многих успешных примерах применения мезокристаллов, в частности, о применении мезокристаллов диоксида титана с улучшенными за счет упорядочения структуры агрегатов наночастиц оптическими свойствами. Например, многие исследователи пытались синтезировать кристаллы TiO2 с гранями, ориентированными в определенных кристаллографических направлениях. Это обусловлено необходимым взаимодействием между молекулами/ионами и поверхностями кристаллов TiO2. Так, материалы, представляющие собой нанолистки анатаза TiO2 с высокоактивными гранями {001}, привлекают повышенный интерес, так как проявляют улучшенные фотокаталитические свойства [12]. С другой стороны, материалы на основе многослойных макрочастиц, состоящих из нанолистков TiO2 с открытыми гранями {001}, или мезокристаллов с аналогичной структурой обладают превосходными ион-обменными характеристиками, например, при хранении ионов Li+ [13, 14]. Они могут обеспечивать достаточную стабильность микроэлектродов при большой реактивной поверхности [15].
Известно несколько работ по легированию мезокристаллов. В работах [16, 17] авторы заявляют о простоте получения N,F-допированных мезокристаллов и о влиянии допирования на фотокаталитические свойства в видимой области. Допированные квантовыми точками CdS мезокристаллы диоксида титана демонстрируют способность к селективному окислению спиртов в видимом свете [18]. Допирование плазмонными наночастицами золота приводит к исключительной способности улавливать видимую часть света и повышает активность фотокаталитической генерации водорода [19]. Допирование диоксида титана ванадием возможно как при совместном гидролизе солей титана и ванадия [20, 21], так и при термолизе пропитанного ванадатами аммония или алкоголятами ванадия диоксида титана [22, 23]. Такое допирование приводит к смещению края полосы поглощения у диоксида титана вплоть до 560 нм [24], что значительно увеличивает фотокаталитическую активность данных образцов по отношению к недопированному диоксиду титана [25]. Были проведены также эксперименты по получению допированного ванадием диоксида титана в полимерных матрицах [26], но они не привели к образованию мезокристаллов.
Анализ существующих публикаций показывает перспективность исследований мезокристаллов диоксида титана, материалов на его основе, допированного диоксида титана. На настоящий момент других исследований по получению допированных ванадием мезокристаллов диоксида титана, кроме работ нашей группы, не найдено. То же можно сказать и об исследовании влияния ультразвукового воздействия на такие системы.
Цель настоящей работы – получение допированных ванадием мезокристаллов диоксида титана и установление полноты прохождения реакции фоторазложения в суспензии допированных ванадием мезокристаллов диоксида титана после ультразвукового воздействия.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве исходных соединений использовали гексафтортитанат аммония (ос. ч., Aldrich), полиэтиленгликоль 400 (ПЭГ 400, молекулярная масса 400 г/моль, ос. ч., Aldrich), борную кислоту (ос. ч., Aldrich), метаванадат аммония (ос. ч., Aldrich) и дистиллированную воду.
Синтез мезокристаллов прекурсора NH4TiOF3 проводили следующим образом: в 30 мл воды при непрерывном перемешивании последовательно растворяли 0.594 г (NH4)2TiF6 и 0.372 г H3BO3 (мольное соотношение реактивов 1 : 2), затем увеличивали скорость перемешивания и добавляли 9.5 г ПЭГ 400. Далее раствор помещали в сушильный шкаф, заранее разогретый до 35°С, где выдерживали в течение 20 ч.
Выпавший осадок отделяли центрифугированием, многократно промывали водой от оставшихся примесей при скорости вращения ротора 7000 об/мин. Затем осадок промывали от остатков воды, трижды центрифугируя его с ацетоном при той же скорости вращения. Время центрифугирования в обоих случаях составляло 5 мин. Окончательная сушка промытого осадка проходила на воздухе. Состояние поверхности оксофтортитаната аммония оценивали с помощью растровой электронной микроскопии.
Полученный порошок NH4TiOF3 подвергали термической обработке в алундовых тиглях в присутствии метаванадата аммония или без при 450°С в атмосфере воздуха в течение 2 ч со скоростью нагрева 5 град/мин до образования TiO2 [27, 28].
Рентгенофазовый анализ (РФА) образцов проводили на дифрактометре Bruker D8 Advance (CuKα‑излучение) в диапазоне углов 2θ 10°–80° с шагом 0.02° и выдержкой не менее 0.5 с на шаг. Идентификацию дифракционных максимумов осуществляли с помощью банка данных ICDD.
Растровую электронную микроскопию (РЭМ) и рентгеноспектральный микроанализ (РСМА) образцов проводили с использованием микроскопа Carl Zeiss NVision 40, оснащенного анализатором Oxford Instruments X-Max (80 мм2). Ускоряющее напряжение при проведении анализа методом РЭМ составляло 1 кВ, методом РСМА – 20 кВ.
Просвечивающая электронная микроскопия (ПЭМ) образцов и соответствующая электронная дифракция были реализованы на приборе FEI Tecnai G2 F30.
Измерения удельной площади поверхности порошков TiO2 проводили методом низкотемпературной адсорбции азота с помощью анализатора АТХ-06. В качестве газа-носителя использовали гелий марки А. Перед измерениями образцы массой 300 мг дегазировали при 200°С в токе гелия в течение 30 мин. Парциальное давление азота определяли с использованием катарометра, температуру которого поддерживали равной 45.00°С. Перед измерениями выполняли анализ стандартного образца с Sуд = 107 м2/г. На основании полученных данных рассчитывали величину удельной поверхности образцов с использованием модели Брюнауэра–Эммета–Теллера (БЭТ) по шести точкам.
Для определения фотокаталитической активности (ФКА) полученных образцов диоксида титана применяли модельную реакцию фотодеградации кристаллического фиолетового в водной среде. Исследование ФКА образцов TiO2 проводили в три этапа:
1. Подготовка суспензии. К навеске исследуемого образца массой 1.5 мг добавляли 2 мл воды, после чего проводили перемешивание полученной смеси в течение 45 мин для образования однородной суспензии.
2. Адсорбция красителя на поверхности фотокатализатора. К полученной суспензии добавляли водный раствор красителя кристаллического фиолетового. Суспензию интенсивно перемешивали в темноте в течение 45 мин для предотвращения возможности протекания реакции фотокаталитического разложения красителя на свету и для установления равновесия адсорбции–десорбции.
3. Измерение фотокаталитической активности. После установления равновесия адсорбции–десорбции проводили облучение суспензии диоксида титана с помощью дейтерий-галогеновой лампы Ocean Optics HPX-2000. Спектрофотометрический анализ суспензии осуществляли с помощью спектрофотометра Ocean Optics QE65000. Концентрацию красителя рассчитывали по значению оптической плотности в максимуме поглощения (λ = 598 нм) с вычетом фонового поглощения (λ = 710 нм). В качестве базовой линии использовали спектр суспензии диоксида титана без красителя.
Рентгеновскую фотоэлектронную спектроскопию (РФЭС) проводили на спектрометре SPECS (Германия). Для возбуждения использовали MgKα‑излучение с энергией 1253.6 эВ.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В результате взаимодействия фтортитаната аммония с борной кислотой в присутствии ПЭГ 400 во всех случаях получали оксофтортитанат аммония NH4TiOF3, о чем свидетельствует дифрактограмма, приведенная на рис. 1, что хорошо согласуется с литературными данными [29]. На рис. 1 приведена также дифрактограмма диоксида титана (анатаза) [ICDD # 00-021-1272], полученного в результате отжига на воздухе оксофтортитаната аммония NH4TiOF3 при 450°С в течение 2 ч. Следует подчеркнуть, что после термической обработки порошок представляет собой однофазный продукт диоксида титана в виде анатаза без примесей других полиморфов. Соориентированность наночастиц, составляющих макрочастицу, подтверждается картиной точечной электронной дифракции (рис. 2). Установлено, что плоские наночастицы кристаллизуются перпендикулярно направлению 00l. Внутри слоев также происходит упорядочение, о чем свидетельствует точечная картина электронной дифракции, представляющая из себя ортогональную сетку, построенную векторами [200] и [020] (рис. 2б). Такая картина электронной дифракции доказывает, что макрочастица является мезокристаллом.
Рис. 1.
Дифрактограммы образца NH4TiOF3, полученного осаждением в полимерной матрице ПЭГ 400, и соответствующего образца TiO2, полученного после термического отжига NH4TiOF3 в среде воздуха при 450°С в течение 2 ч.
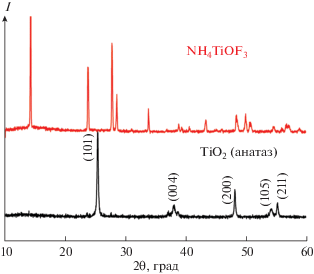
Рис. 2.
Микрофотография ПЭМ образца TiO2, полученного после термического отжига NH4TiOF3 в среде воздуха при 450°С в течение 2 ч (а) и соответствующая электронная дифракция (б).

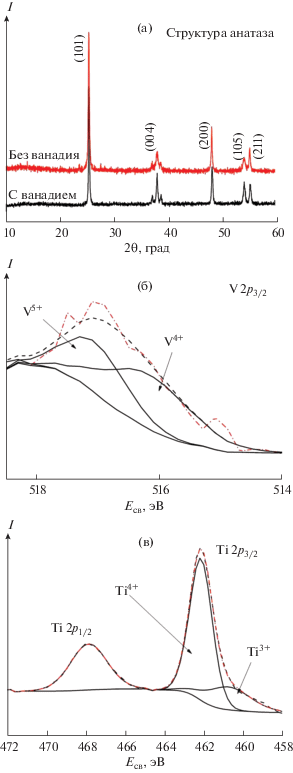
Добавление в смесь исходных прекурсоров ванадийсодержащего компонента приводило к вхождению ванадия в состав макрочастиц. Из всех образцов, содержавших ванадий (1 или 3 ат. % по количеству вещества, введенного в исходную смесь реагентов), после термической обработки получали однофазный продукт со структурой диоксида титана в форме анатаза, о чем свидетельствуют данные рентгеновской дифракции (рис. 3а). По положению рефлексов на дифрактограммах корректно оценить изменение параметров кристаллической решетки невозможно из-за сходства ионных радиусов Ti(IV) и V(IV) и малого количества вводимого допанта. Присутствие других кристаллических фаз не обнаружено. Наличие ванадия в мезокристаллах диоксида титана было доказано методом РФЭС. В спектре (рис. 3б) присутствуют пики, соответствующие V4+ и V5+, V5+ может являться продуктом окисления V(IV) в процессе проведения измерений [30, 31]. Зафиксировать присутствие ванадия в порошке с помощью РCМА не удалось ввиду малого количества введенного компонента. На основании данных рентгеновских методов можно утверждать, что ванадий входит в кристаллическую решетку анатаза. Достоверно можно утверждать, что на поверхности наночастиц диоксида титана (рис. 3в) ванадий преимущественно находится в состоянии V4+.
Рис. 3.
Дифрактограммы недопированного и допированного 3% V образцов TiO2 (а), V2p3/2 РФЭС-спектр образца TiO2, допированного 3% V (б) (точка-пунктир – эксперимент; пунктир – описание спектра; сплошные линии соответствуют базовой линии и линиям разложения на индивидуальные компоненты V4+ и V5+ , которые обозначены стрелками), Ti2p РФЭС-спектр образца TiO2, допированного 3% V (в) (точка-пунктир – эксперимент; пунктир – описание спектра; сплошные линии соответствуют базовой линии и линиям разложения на индивидуальные компоненты Ti4+ и Ti3+, которые обозначены стрелками).
Предложенное авторами [29] мольное соотношение 1 : 2 : 8 (NH4TiF6 : H3BO3 : ПЭГ 400) позволяет получить частицы правильной октагональной формы с диаметром основания 3–5 мкм и толщиной 1.5–2.5 мкм (рис. 4а). В процессе отжига оксофтортитаната аммония происходит фазовый переход по топотактическому механизму. Допирование ванадием не приводит к разрушению мезокристаллов TiO2 (рис. 4а, 4б).
Рис. 4.
РЭМ-изображения образцов NH4TiOF3 (а), TiO2, допированного 1% V (б), TiO2, допированного 3% V (в, г).

Для мезокристаллов допированного ванадием диоксида титана были измерены площадь удельной поверхности и фотокаталитическая активность в реакции разложения кристаллического фиолетового (табл. 1). Можно утверждать, что допирование мезокристаллов диоксида титана ванадием приводит к увеличению фотокаталитической активности (рис. 5). Приведено сравнение с литературными данными по разложению фиолетового кристаллического в аналогичных условиях на коммерческом образце Evonik aeroxide TiO2 P25. До настоящего момента влияние утразвукового воздействия на сохранение целостности и физико-химические свойства мезокристаллов изучено не было. Для изучения вовлеченной в процесс фоторазложения пигмента поверхности мезокристаллов было предпринято искусственное разрушение микрочастиц с помощью ультразвукового воздействия (в ультразвуковой ванне). Установлено, что после ультразвукового воздействия (35 кГц) в течение 20 мин мезокристаллы диоксида титана разрушаются до единичных кристаллитов и агрегатов небольшого размера (рис. 6а, бв, 6г). На основании данных низкотемпературной адсорбции азота можно утверждать, что после ультразвукового воздействия существенных изменений площади удельной поверхности не происходит (табл. 1). На рис. 6в предложена схема разрушения мезокристалла после ультразвукового воздействия.
Таблица 1.
Свойства допированного ванадием диоксида титана
| Название образца | Фотокаталитическая активность, %/мин | Площадь удельной поверхности по БЭТ, м2/г |
|---|---|---|
| PEG400 | 0.12 ± 0.01 | 7 |
| PEG400_1V | 0.27 ± 0.03 | 3 |
| PEG400_1V_US | 0.27 ± 0.03 | 3 |
| PEG400_3V | 0.29 ± 0.04 | 4 |
| PEG400_3V_US | 0.29 ± 0.02 | 3 |
Рис. 5.
Кинетические кривые фотокаталитического разложения красителя кристаллического фиолетового в присутствии различных образцов диоксида титана.
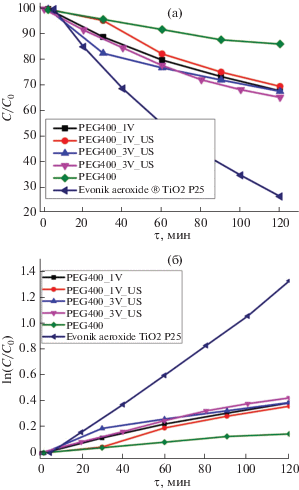
Рис. 6.
РЭМ-изображения образцов TiO2, допированных 1% V (а) и 3% V (б), после ультразвукового воздействия (35 кГц) в течение 20 мин. Схема разрушения мезокристалла после ультразвукового воздействия (в). TiO2, допированный 1% V, после ультразвукового воздействия (35 кГц) в течение 20 мин – отдельные кристаллиты и агрегаты небольшого размера (г).

Исследование фотокаталитической активности допированных ванадием мезокристаллов диоксида титана показало увеличение активности у допированных образцов (рис. 5), в то время как площадь удельной поверхности уменьшается по сравнению с недопированным диоксидом титана. Из рис. 5а, 5б следует, что обработка порошков в ультразвуке и последующее разрушение макрочастиц не приводят к заметному изменению фотокаталитической активности, что связано с незначительным изменением площади удельной поверхности. На основании вышеизложенного можно предположить, что в процессе фотокаталитического разложения органического красителя участвует вся площадь поверхности мезокристаллов диоксида титана.
ЗАКЛЮЧЕНИЕ
В ходе работы проанализировано влияние ультразвукового воздействия на морфологию, физико-химические и фотокаталитические свойства допированных ванадием мезокристаллов диоксида титана, полученных в присутствии ПЭГ 400. Показано, что допирование мезокристаллов небольшим количеством ванадия увеличивает фотокаталитическую активность по сравнению с мезокристаллами анатаза без добавок. После разрушения мезокристаллов до наночастиц или их небольших агрегатов с помощью ультразвукового воздействия не происходит изменения площади удельной поверхности и фотокаталитических свойств. Это свидетельствует о том, что в фотокаталитической реакции разложения участвует как внутренняя, так и внешняя поверхность мезокристалла.
Список литературы
Chu L., Qin Z., Yang J., Li X. // Sci Rep. 2015. V. 5. P. 12 143. https://doi.org/10.1038/srep12143
Kozyukhin S., Sadovnikov A., Presniakov M. et al. // Key Engineering Materials. 2015. V. 670. P. 177. https://doi.org/10.4028/www.scientific.net/KEM.670.156
Sadovnikov A.A., Baranchikov A.E., Zubavichus Y.V. et al. // J. Photochem. Photobiol., A. Chem. 2015. V. 303–304. P. 36. https://doi.org/10.1016/j.jphotochem.2015.01.010
Kaushal S., Kaur H., Kumar S. et al. // Russ. J. Inorg. Chem. 2020. V. 65. P. 616. https://doi.org/10.1134/S0036023620040087
Zhang D., Wang J. // J. Struct. Chem. 2018. V. 59. P. 1353. https://doi.org/10.1134/S0022476618060148
Hong Z., Wei M., Lan T., Cao G. // Nano Energy. 2012. V. 1. № 3. P. 466. https://doi.org/10.1016/j.nanoen.2012.02.009
Ye J., Liu W., Cai J. et al. // J. Am. Chem. Soc. 2011. V. 133. № 4. P. 933. https://doi.org/10.1021/ja108205q
Boytsova O.V., Sadovnikov A.A., Yorov K.E. et al. // CrystEngComm. 2017. V. 19. № 24. P. 3281. https://doi.org/10.1039/c6ce01985d
Boytsova O.V., Baranchikov A.E., Yapryntsev A.D. et al. // Russ. J. Inorg. Chem. 2018. V. 63. № 5. P. 567. https://doi.org/10.1134/S0036023618050029
Cölfen H., Antonietti M. // Angew. Chem. Int. Ed. 2005. V. 44. P. 5576. https://doi.org/10.1002/anie.200500496
Zhou L., Obrien P. // J. Phys. Chem. Lett. 2012. V. 3. P. 620. https://doi.org/10.1021/jz2015742
Guo Y., Li H., Chen J. et al. // J. Mater. Chem. A. 2014. V. 2. № 46. P. 19589. https://doi.org/10.1039/c4ta05068a
Uchaker E., Cao G. // Nano Today. 2014. V. 9. P. 499. https://doi.org/10.1016/j.nantod.2014.06.004
Hong Z., Wei M., Lan T. et al. // Energy Environ. Sci. 2012. V. 5. P. 5408. https://doi.org/10.1039/c1ee02551a
Tachikawa T., Majima T. // NPG Asia Materials. 2014. V. 6. P. 1. https://doi.org/10.1038/am.2014.21
Zhang P., Tachikawa T., Fujitsuka M., Majima T. // ChemSusChem. 2016. V. 9. № 6. P. 617. https://doi.org/10.1002/cssc.201501558
Elbanna O., Zhang P., Fujitsuka M., Majima T. // Appl. Catal., B. 2016. V. 192. P. 80. https://doi.org/10.1016/j.apcatb.2016.03.053
Li X., Wang J., Men Y., Bian Z. // Appl. Catal., B. 2016. V. 187. P. 115. https://doi.org/10.1016/j.apcatb.2016.01.034
Yu X., Fan X., Li Z., Liu J. // Dalton Trans. 2017. V. 46. № 35. P. 11 898. https://doi.org/10.1039/c7dt02824e
Wu J.C.S., Chen C.H. // J. Photochem. Photobiol., A. 2004. V. 163. P. 509. https://doi.org/10.1016/j.jphotochem.2004.02.007
Asgharinezhad M., Eshaghi A., Arab A. // Optik. 2016. V. 127. P. 8130. https://doi.org/10.1016/j.ijleo.2016.06.008
Mohamed M.M., Al-Esaimi M.M. // J. Mol. Catal. A: Chem. 2006. V. 255. P. 53. https://doi.org/10.1016/j.molcata.2006.03.071
Masih D., Yoshitake H., Izumi Y. // Appl. Catal., A. 2007. V. 325. P. 276. https://doi.org/10.1016/j.apcata.2007.02.037
Rossi G., Pasquini L., Catone D. et al. // Appl. Catal., B. 2018. V. 237. P. 603. https://doi.org/10.1016/j.apcatb.2018.06.011
Lin W.-C., Lin Y.-J. // Environ. Eng. Sci. 2012. V. 29. P. 447. https://doi.org/10.1089/ees.2010.0350
Doong R.-an, Chang P.-Y., Huang C.-H. // J. Non. Cryst. Solids. 2009. V. 355. P. 2302. https://doi.org/10.1016/j.jnoncrysol.2009.07.017
Zhou L., Smyth-Boyle D., O’Brien P. // J. Am. Chem. Soc. 2008. V. 130. P. 1309. https://doi.org/10.1021/ja076187c
Zhou L., O’Brien P. // Phys Status Solidi. 2008. V. 205. P. 2317. https://doi.org/10.1002/pssa.200879447
Boytsova O., Dovgaliuk I., Chernyshov D. et al. // J. Appl. Crystallogr. 2019. V. 52. № 1. P. 23. https://doi.org/10.1107/S1600576718016606
Motola M., Satrapinskyy L., Čaplovicová M. et al. // Appl. Surf. Sci. 2018. V. 434. P. 1257. https://doi.org/10.1016/j.apsusc.2017.11.253
Wang B., Zhang G., Leng X. et al. // J. Hazard. Mater. 2015. V. 285. P. 212. https://doi.org/10.1016/j.jhazmat.2014.11.031
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии


