Журнал неорганической химии, 2021, T. 66, № 6, стр. 822-829
Селективное радиосенсибилизирующее действие аморфного диоксида гафния, модифицированного органическими квантовыми точками, по отношению к нормальным и малигнизированным клеткам
Н. Р. Попова a, b, *, Г. С. Таран a, А. Л. Попов a, b, Д. Д. Колманович b, А. Е. Баранчиков a, С. С. Сорокина b, К. Ю. Жижин a, В. К. Иванов a
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
b Институт теоретической и экспериментальной биофизики РАН
142290 Пущино, Институтская, 3, Россия
* E-mail: nellipopovaran@gmail.com
Поступила в редакцию 14.01.2021
После доработки 18.01.2021
Принята к публикации 19.01.2021
Аннотация
Гидротермальной обработкой аморфного гидратированного диоксида гафния в присутствии цитрата аммония получены водные золи диоксида гафния, модифицированного органическими квантовыми точками, обладающие выраженными люминесцентными свойствами. Показано, что малигнизированные клетки человека линий U-251, MCF-7 и MNNG/Hos поглощают полученные наночастицы в существенно более высокой степени, чем мезенхимальные стволовые клетки человека. В условиях рентгеновского излучения (15 Гр) полученные наночастицы проявляют радиосенсибилизирующие свойства в отношении малигнизированных клеток линий U-251 и MCF-7, значительно снижая их жизнеспособность. Напротив, по отношению к клеткам остеосаркомы человека линии MNNG/Hos радиосенсибилизирующие свойства полученного материала существенно менее выражены.
ВВЕДЕНИЕ
Материалы на основе оксидных соединений гафния находят широкое применение в различных отраслях промышленности, включая микроэлектронику, производство специальных стекол и огнеупоров, стержней для ядерных реакторов [1–3]. Широкий спектр областей промышленного применения таких соединений основан на их уникальных физических и химических свойствах, включающих в себя термическую устойчивость, высокую диэлектрическую проницаемость и высокое сечение захвата тепловых нейтронов [4, 5].
С недавних пор соединения гафния используются в ядерной медицине [6]. В частности, нанокристаллический диоксид гафния рассматривают в качестве перспективного радиосенсибилизатора в лучевой терапии онкологических заболеваний, поскольку он обладает комплексом необходимых свойств, включая эффективное поглощение рентгеновского и гамма-излучения, а также относительную биоинертность [7]. Основной принцип использования радиосенсибилизаторов заключается в их способности накапливаться в раковых клетках, а во время облучения эффективно поглощать ионизирующее излучение, вызывая локальные повреждения клеточных структур [8]. Благодаря этому удается снизить дозу ионизирующего излучения и локализовать его эффект в зоне опухолевого роста.
На сегодняшний день предложен ряд эффективных методов синтеза нанокристаллического диоксида гафния [9–13]. Отметим, что биомедицинское применение материалов на основе соединений гафния требует получения устойчивых водных золей, которые обеспечивают возможность прецизионного дозирования препарата, а также его эффективного накопления в зоне опухолевого роста и контроля локализации с помощью современных методов визуализации [14].
В рамках настоящей работы был создан новый биосовместимый материал на основе диоксида гафния, характеризующийся выраженными люминесцентными свойствами, проведено исследование его цитотоксичности и радиосенсибилизирующих свойств на культурах раковых клеток линий U-251, MCF-7 и MNNG/Hos, а также мезенхимальных стволовых клеток человека in vitro.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез проводили в два этапа, которые включали получение гидратированного диоксида гафния и его последующую гидротермальную обработку в присутствии цитрата аммония. Гидратированный диоксид гафния получали добавлением аммиака (3 М) к водному раствору хлорида гафния (0.1 М) при постоянном перемешивании до достижения pH 9. Полученный осадок HfO2 ⋅ xH2O тщательно промывали дистилированной водой с промежуточным центрифугированием (~20 000g), полученную пасту не высушивали. Навески пасты HfO2 · xH2O (0.40 г в пересчете на безводный оксид) смешивали с раствором цитрата аммония (0.19 г) и добавляли аммиак таким образом, чтобы объем полученной суспензии составлял 8 мл, а pH суспензии – 6 или 10. Полученные суспензии помещали в стальные автоклавы емкостью 12 мл (степень заполнения ~67%) и проводили гидротермальную обработку при 160°С в течение 24 ч.
УФ-видимые спектры поглощения регистрировали на спектрофотометре СФ-2000 (ОКБ “Спектр”, Россия) с использованием дейтериевой лампы в диапазоне длин волн от 200 до 500 нм с шагом 0.1 нм, ширина оптической щели составляла 0.2 нм. В некоторых случаях перед проведением анализа образцы разбавляли дистиллированной водой.
Спектры люминесценции регистрировали с помощью люминесцентного спектрометра Perkin Elmer LS55 и модульной оптической системы Ocean Optics, включающей в себя спектрометр QE 65000. Спектры испускания регистрировали в диапазоне 420–550 нм, спектры возбуждения – в диапазоне 230–350 нм при комнатной температуре.
ИК-спектры нарушенного полного внутреннего отражения регистрировали в области 400–4000 см–1 на ИК-спектрометре Bruker Alpha.
Рентгенофазовый анализ порошков, полученных высушиванием коллоидных растворов при 50°С, проводили с использованием дифрактометра Bruker D8 Advance (CuKα-излучение, θ–2θ-геометрия) в диапазоне углов 10°–80° 2θ с шагом 0.02° и временем накопления сигнала не менее 0.3 с на точку.
Микроструктуру образцов изучали методом просвечивающей электронной микроскопии (ПЭМ) на электронном микроскопе Leo912 AB Omega при ускоряющем напряжении 100 кВ.
Анализ распределения частиц по размерам в золях проводили методом динамического рассеяния света (ДРС) с помощью лазерного анализатора Photocor Complex, в качестве источника света использовали гелий-неоновый лазер (длина волны излучения 657.8 нм). Измерения проводили в одноразовых кюветах, объем измеряемой пробы составлял 3 мл.
Анализ цитотоксичности и радиосенсибилизирующих свойств золей в условиях воздействия рентгеновского излучения проводили с использованием МТТ-теста на четырех клеточных культурах человека: мезенхимальных стволовых клетках (нормальные клетки, использовали в качестве контроля), аденокарциномы молочной железы линии MCF-7, глиобластомы линии U-251, остеосаркомы линии MNNG/Hos. Клетки высевали в плотности 30 тыс/см2 в культуральную среду ДМЕМ/Ф12, содержащую 10% эмбриональной телячьей сыворотки и комплекса антибиотиков (пенициллин и стрептомицин 5000 ед.) и культивировали в условиях СО2 инкубатора при 5% СО2 и температуре 37°С. Через 12 ч после посева среду заменяли на свежую, содержащую анализируемые коллоидные растворы различной концентрации (1.25–15 мкг/мл в пересчете на безводный диоксид гафния), далее после 6 ч культивирования клетки подвергали воздействию рентгеновского излучения в дозе 15 Гр с использованием медицинской терапевтической установки РУТ-15. Через 96 ч после облучения жизнеспособность клеточных культур определяли с помощью стандартного МТТ-теста.
Анализ внутриклеточной локализации и механизма проникновения наночастиц диоксида гафния выполняли методом конфокальной флуоресцентной микроскопии на микроскопе Zeiss Cell Observer A1, используя функцию Z-stack.
Статистическая обработка данных была проведена с использованием GraphPad 8.5 и Origin 7.0. Для выявления достоверных различий применяли t-критерий Стьюдента.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Гидротермальный синтез коллоидных растворов проводили при 160°С в течение суток, используя в качестве исходных соединений гидратированный диоксид гафния и цитрат аммония. Были получены коллоидные растворы HfO2CitNH4 (гидротермальная обработка суспензии при pH 6) и HfO2CitNH4(NH3) (гидротермальная обработка суспензии при pH 10). Дополнительно гидротермальной обработкой были получены коллоидные растворы HfO2CitNH4×5 и HfO2CitNH4×10, для синтеза которых в исходные суспензии HfO2 ⋅ xH2O добавляли увеличенное в 5 или 10 раз количество цитрата аммония, а обработку проводили при pH 6. Концентрация диоксида гафния во всех полученных коллоидных растворах, определенная гравиметрическим методом, составляла ~7 г/л.
Согласно данным рентгенофазового анализа, наночастицы в полученных золях являются рентгеноаморфными, на дифрактограммах наблюдаются гало с максимумами при ~30° и ~55° 2θ, что может свидетельствовать о наличии в полученном материале аморфного гидратированного диоксида гафния. Известно, что в гидротермальных условиях скорость кристаллизации диоксида гафния является достаточно низкой даже при повышенных температурах (до 250°С) [10].
Отличительной особенностью всех полученных коллоидных растворов является их интенсивная синяя люминесценция при облучении ультрафиолетовым светом. Наиболее вероятно, что в ходе гидротермальной обработки гидратированного диоксида гафния в присутствии цитрата аммония происходит разложение последнего с формированием производных цитразиновой кислоты [15], в том числе так называемых органических квантовых точек. Органические квантовые точки были ранее получены нами [16] путем термолиза лимонной кислоты в присутствии мочевины. Гидротермальная обработка солей лимонной кислоты в относительно мягких условиях (160–180°С) также приводит к формированию органических квантовых точек, причем полученные материалы, как правило, характеризуются высокой стабильностью оптических свойств и достаточно высоким квантовым выходом (>20%) [17, 18].
На рис. 1а приведены спектры поглощения золей HfO2CitNH4 и HfO2CitNH4(NH3), из которых видно, что максимум поглощения в УФ-области соответствует 345 нм, что хорошо согласуется с оптическими характеристиками органических квантовых точек [16]. Эта длина волны была выбрана для анализа люминесцентных характеристик коллоидных растворов. На рис. 1б представлены спектры люминесценции золей HfO2CitNH4 и HfO2CitNH4(NH3), характеризующиеся широкой полосой испускания с максимумом около 450 нм (2.8 эВ), что полностью соответствует люминесцентным характеристикам органических квантовых точек [16]. Данные ДРС полученных золей (табл. 1) указывают на наличие в них двух фракций частиц с размерами порядка 10 и 100 нм, которые, вероятнее всего, соответствуют индивидуальным частицам и их агрегатам. Отметим, что данные ДРС удовлетворительно коррелируют с результатами ПЭМ образцов.
Рис. 1.
УФ-видимые спектры поглощения золей, синтезированных при различных значениях рН (а) и спектры их фотолюминесценции (б): 1 – HfO2CitNH4, 2 – HfO2CitNH4(NH3).
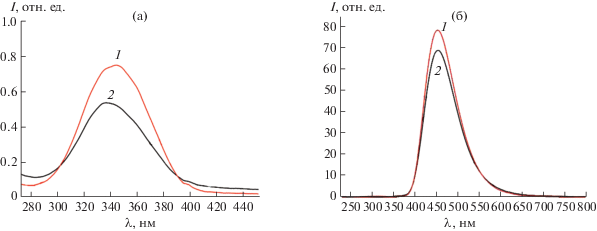
Таблица 1.
Данные динамического рассеяния света для золей аморфного диоксида гафния, модифицированного органическими квантовыми точками
| Образец | Rср, нм | Стандартное отклонение |
|---|---|---|
| HfO2CitNH4 | 13 | 3 |
| 100 | 45 | |
| HfO2CitNH4(NH3) | 25 | 6 |
| 119 | 40 |
Важным свойством полученных коллоидных растворов является сохранение их оптических характеристик после высушивания (при 50°С в течение суток) и последующего редиспергирования в дистиллированной воде. В частности, это иллюстрируют приведенные на рис. 2 спектры поглощения и люминесценции золя HfO2CitNH4×10 до и после редиспергирования, из которых следует, что положение максимумов поглощения и люминесценции, а также форма соответствующих максимумов в результате редиспергирования не изменяются. Параметры распределения частиц по размерам в исходном и редиспергированном золе, определенные по данным динамического рассеяния света, также остаются практически неизменными (табл. 2). Из результатов, приведенных в табл. 2, также следует, что увеличение концентрации цитрата аммония в исходной реакционной смеси в 10 раз приводит к увеличению гидродинамического радиуса коллоидных частиц в получаемых золях примерно в 3 раза.
Рис. 2.
Спектры фотолюминесценции золя HfO2CitNH4×10 до (1) и после (2) редиспергирования (а), соответствующие УФ-видимые спектры поглощения (б). Для сравнения приведен спектр фотолюминесценции золя HfO2CitNH4 (3).
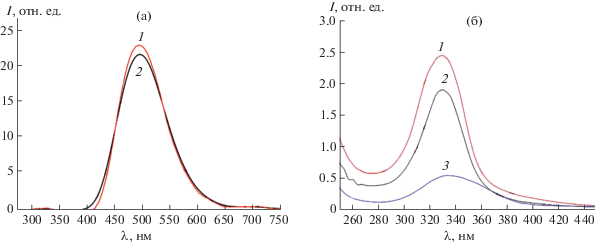
Таблица 2.
Данные динамического рассеяния света для золей аморфного диоксида гафния, модифицированного органическими квантовыми точками, до и после редиспергирования в воде
| Образец | Rср, нм | Стандартное отклонение |
|---|---|---|
| HfO2CitNH4×10 | 31 | 4 |
| 348 | 55 | |
| Редиспергированный HfO2CitNH4×10 | 52 | 8 |
| 368 | 73 |
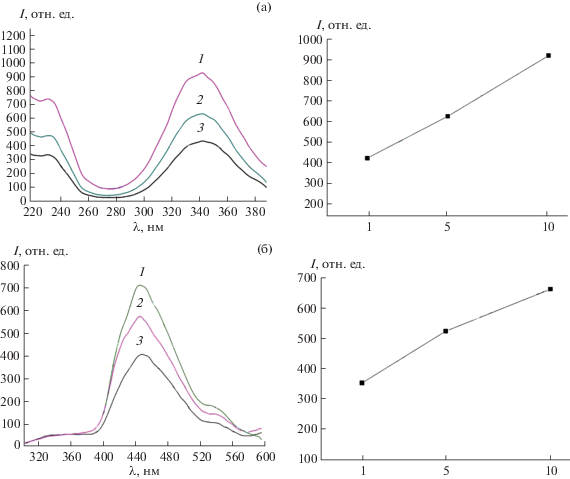
Из рис. 2 также следует, что интенсивность люминесценции золя HfO2CitNH4 существенно ниже, чем аналогичная характеристика золя HfO2CitNH4×10 при той же концентрации по гафнию. На рис. 3 приведены спектры возбуждения и испускания золей HfO2CitNH4, HfO2CitNH4×5, HfO2CitNH4×10, характеризующихся одинаковой концентрацией оксида гафния. Спектры возбуждения, зарегистрированные для соответствующих полос люминесценции, существенно не различаются для всех исследованных золей и характеризуются одной интенсивной полосой при 450 нм. Из приведенных данных следует, что интенсивность люминесценции коллоидных растворов практически линейно зависит от концентрации цитрата аммония в исходной реакционной смеси. Это, очевидно, обусловлено возрастанием концентрации органических квантовых точек, образующихся в гидротермальных условиях.
Рис. 3.
Спектры возбуждения (а) и испускания (б) золей, полученных при различный концентрации цитрата аммония в исходной реакционной смеси: HfO2CitNH4 (1), HfO2CitNH4×5 (2), HfO2CitNH4×10 (3). Справа приведены соответствующие зависимости интенсивности возбуждения и испускания от относительного количества цитрата аммония в исходной реакционной смеси.
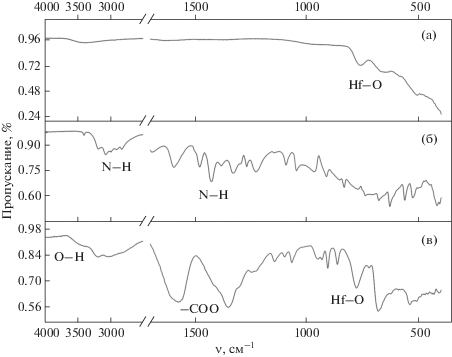
На рис. 4 приведены данные ИК-спектроскопии полученных образцов. В ИК-спектре образца диоксида гафния, полученного в гидротермальных условиях при 160°С в течение 1 сут (контрольный образец, синтезирован по идентичной методике в отсутствие цитрата аммония при pH 6), наблюдаются полосы поглощения, соответствующие литературным данным для кристаллического гидратированного диоксида гафния [19]. Две низкочастотные полосы с максимумами при 763 и 652 см–1 соответствуют модам валентных колебаний HfO2 (моноклинная модификация) [20]. В области 3000–3500 см–1 наблюдается малоинтенсивная широкая полоса, характерная для молекул воды и гидроксогрупп.
В ИК-спектре образца HfO2CitNH4 положение полос, отвечающих валентным колебаниям Hf–O, несколько смещено относительно ИК-спектра образца гидратированного диоксида гафния (779 и 681 см–1), что указывает на присутствие оксокомплексов гафния в анализируемом материале. Для ИК-спектра образца HfO2CitNH4 также характерно меньшее расщепление полос валентных колебаний –COO (1574 и 1351 см–1) по сравнению с цитратом аммония (1595 и 1330 см–1), что указывает на образование бидентатных или мостиковых карбоксильных комплексов гафния. В ИК-спектре образца HfO2CitNH4 также присутствует широкая полоса валентных колебаний гидроксогрупп, но на нее накладываются полосы валентных (2500–3300 см–1) и деформационных (1350–1500 см–1) колебаний N–H-групп, характерных для иона аммония. Наиболее вероятно, что в составе органических продуктов поликонденсации лимонной кислоты часть карбоксильных групп выступает в качестве лигандов по отношению к металлоцентрам (гафнию), а часть остается в свободном виде, образуя ионные связи с катионами аммония.
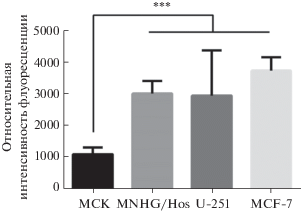
Таким образом, совокупность полученных данных указывает, что в результате гидротермальной обработки гидратированного диоксида гафния в присутствии цитрата аммония происходит образование оксосоединений гафния, координационно связанных с органическими квантовыми точками. Известно, что материалы на основе органических квантовых точек обладают не только выраженными люминесцентными свойствами, но и характеризуются высокой биосовместимостью, низкой токсичностью, эффективным эндоцитозом клетками эукариот и стабильностью физико-химических характеристик [16]. В связи с этим нами была проанализирована цитотоксичность полученных материалов (на примере образца HfO2CitNH4) на различных культурах клеток in vitro. Для оценки внутриклеточной локализации наночастиц был использован метод конфокальной микроскопии в режиме Z-stack, который позволяет анализировать локализацию наночастиц непосредственно в цитоплазме, а не на поверхности клетки. Согласно полученным данным, наночастицы эффективно поглощались клетками аденокарциномы молочной железы линии MCF-7, глиобластомы линии U-251 и остеосаркомы линии MNNG/Hos, что подтверждалось яркой флуоресценцией цитоплазмы уже через 2 ч после внесения наночастиц. Эндоцитоз наночастиц мезенхимальными стволовыми клетками происходил в незначительной степени (<20%) в сравнении с раковыми культурами U-251, MNNG/Hos и MCF-7, что подтверждалось методом конфокальной флуоресцентной микроскопии (рис. 5).
Рис. 5.
Поглощение наночастиц золя HfO2CitNH4 клетками культуры мезенхимальных стволовых клеток, аденокарциномы молочной железы линии MCF-7, глиобластомы линии U-251, остеосаркомы линии MNNG/Hos через 2 ч после внесения. Данные представлены как средняя интенсивность флуоресценции цитоплазмы клеток через 24 ч после инкубации. n = = 15, *** p ≤ 0.001, t-test.
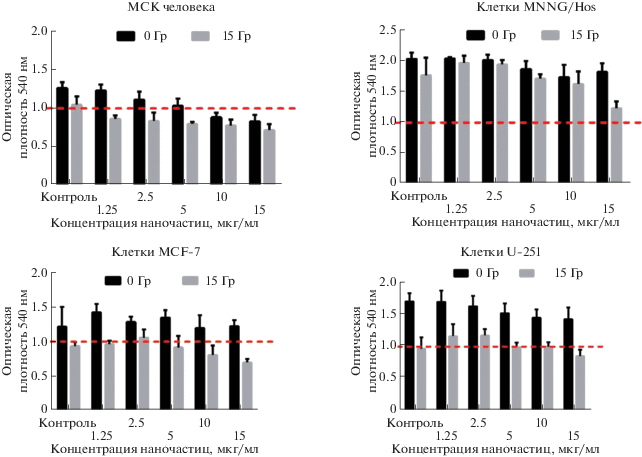
Анализ цитотоксичности и радиосенсибилизирующих свойств наночастиц аморфного диоксида гафния, модифицированного органическими квантовыми точками, проводили в концентрациях от 1.25 до 15 мкг/мл (рис. 6). Облучение клеточных культур осуществляли рентгеновским излучением в дозе 15 Гр, которая была заранее подобрана [21] с учетом плотности посева клеточной культуры и времени анализа жизнеспособности после облучения, с целью выявления величины ЛД50. Облучение достоверно снижало жизнеспособность клеточных культур раковых линий MCF-7 и U-251, в то время как культура клеток остеосаркомы MNNG/Hos не показала снижения жизнеспособности. Предварительная обработка наночастицами культур клеток MCF-7 и U-251 не показала достоверного снижения их жизнеспособности, однако при сочетанном воздействии наночастиц в концентрациях выше 2.5 мг/мл и рентгеновского излучения в дозе 15 Гр происходило снижение жизнеспособности более чем на 30%. Мезенхимальные стволовые клетки человека лишь незначительно снижали свою жизнеспособность (не более чем на 10%) при внесении наночастиц в высоких концентрациях (свыше 10 мг/мл), но при этом сочетанное воздействие наночастиц и рентгеновского облучения не приводило к гибели клеток. Такой различный отклик клеточных культур, по всей видимости, связан с различной эффективностью интернализации наночастиц диоксида гафния в цитоплазму нормальных и раковых клеток. При этом стоит отметить, что клетки остеосаркомы проявляют более низкую радиочувствительность в присутствии наночастиц диоксида гафния при относительно высокой эффективности их эндоцитоза в сравнении с клетками аденокарциномы и глиобластомы человека, что требует дальнейшего детального изучения молекулярных механизмов проникновения и процессинга наночастиц аморфного диоксида гафния, модифицированного органическими квантовыми точками, для данного типа клеток.
Рис. 6.
Жизнеспособность культуры мезенхимальных стволовых клеток (нормальные клетки в качестве контроля), культуры аденокарциномы молочной железы линии MCF-7, культуры глиобластомы линии U-251, культуры остеосаркомы линии MNNG/Hos в присутствии золя HfO2CitNH4 через 96 ч после облучения рентгеновским излучением в дозе 15 Гр.
ЗАКЛЮЧЕНИЕ
Предложен метод получения водных золей аморфного диоксида гафния, модифицированного органическими квантовыми точками. Синтезированные золи с концентрацией ~7 г/л в пересчете на диоксид гафния демонстрируют интенсивную люминесценцию (450 нм при возбуждении УФ-излучением с длиной волны 345 нм), при этом оптические характеристики золей не изменяются при их высушивании и последующем редиспергировании в воде. Показан селективный эндоцитоз наночастиц раковыми клетками глиобластомы, остеосаркомы и аденокарциномы человека по сравнению с мезенхимальными стволовыми клетками человека. Показан селективный радиосенсибилизирующий эффект полученных наночастиц по отношению к культурам глиобластомы и аденокарциномы человека.
Таким образом, предложен метод получения гибридного материала на основе аморфного диоксида гафния, модифицированного органическими квантовыми точками, проявляющего избирательный цитотоксический эффект в отношении некоторых линий раковых клеток при совместном действии рентгеновского излучения.
Список литературы
Giacobbe J., Dunning D.N. // Nucl. Sci. Eng. 1958. V. 4. P. 467. https://doi.org/10.13182/NSE58-A25543
Cunningham G.W., Foulds A.K., Keller D.L., Ray W.E. // Nucl. Sci. Eng. 1958. V. 4. P. 449. https://doi.org/10.13182/NSE58-A25541
Smirnova T.P., Yakovkina L.V., Kitchai V.N. // J. Phys. Chem. Solids. 2008. V. 69. P. 685. https://doi.org/10.1016/j.jpcs.2007.07.123
Lee B.H., Kang L., Nieh R. et al. // Appl. Phys. Lett. 2000. V. 76. P. 1926. https://doi.org/10.1063/1.126214
Curtis C.E., Doney L.M., Johnson J.R. // J. Am. Ceram. Soc. 1954. V. 37. P. 458. https://doi.org/10.1111/j.1151-2916.1954.tb13977.x
Maggiorella L., Barouch G., Levy L. et al. // Future Oncol. 2012. V. 8. P. 1167. https://doi.org/10.2217/fon.12.96
Li Y., Qi Y., Zhang H. et al. // Biomaterials. 2020. V. 226. P. 119538. https://doi.org/10.1016/j.biomaterials.2019.119538
Rancoule C., Magné N., Vallard A. et al. // Cancer Lett. 2016. V. 375. P. 256. https://doi.org/10.1016/j.canlet.2016.03.011
Wan Y., Zhou X. // RSC Adv. 2017. V. 7. P. 7763. https://doi.org/10.1039/C6RA26663K
Meskin P.E., Sharikov F.Yu., Ivanov V.K. et al. // Mater. Chem. Phys. 2007. V. 104. P. 439. https://doi.org/10.1016/j.matchemphys.2007.03.042
Ivanov V.K., Kopitsa G.P., Baranchikov A.Ye. et al. // Russ. J. Inorg. Chem. 2009. V. 54. P. 2091. https://doi.org/10.1134/S0036023609140022
Ivanov V.K., Kopitsa G.P., Ivanova O.S. et al. // J. Phys. Chem. Solids. 2014. V. 75. P. 296. https://doi.org/10.1016/j.jpcs.2013.10.006
Taran G.S., Baranchikov A.E., Ivanova O.S. et al. // Russ. J. Inorg. Chem. 2020. V. 65. P. 800. https://doi.org/10.1134/S0036023620060236
Buha J., Arčon D., Niederberger M., Djerdj I. // Phys. Chem. Chem. Phys. 2010. V. 12. P. 15537. https://doi.org/10.1039/C0CP01298J
Masoud M.S., Mohamed G.B., Abdul-Razek Y.H. et al. // J. Korean Chem. Soc. 2002. V. 46. № 2. P. 99. https://doi.org/10.5012/JKCS.2002.46.2.099
Zholobak N.M., Popov A.L., Shcherbakov A.B. et al. // Beilstein J. Nanotechnol. 2016. V. 7. P. 1905. https://doi.org/10.3762/bjnano.7.182
Qu D., Zheng M., Zhang L. et al. // Sci. Rep. 2014. V. 4. P. 5294. https://doi.org/10.1038/srep05294
Guo Y., Wang Z., Shao H. et al. // Carbon. 2013. V. 52. P. 583. https://doi.org/10.1016/j.carbon.2012.10.028
Kumar P.H., Vidya S., Kumar S.S. et al. // J. Asian Ceram. Soc. 2015. V. 3. P. 64. https://doi.org/10.1016/j.jascer.2014.10.009
Rochat N., Dabertrand K., Cosnier V. et al. // Phys. Status Solidi. 2003. V. 0(8). P. 2961. https://doi.org/10.1002/pssc.200303858
Popova N., Popov A., Ermakov A. et al. // Molecules. 2020. V. 25. P. 2957.https://doi.org/10.3390/molecules25132957
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии