Журнал неорганической химии, 2021, T. 66, № 7, стр. 911-920
Моделирование фазового комплекса трехкомпонентной взаимной системы Na+,Sr2+||Cl–,${\text{WO}}_{{\text{4}}}^{{{\text{2}}-}}$
А. В. Бурчаков a, *, И. К. Гаркушин a, И. М. Кондратюк a, Е. М. Егорова a, С. Н. Милов a
a Самарский государственный технический университет
443100 Самара, ул. Молодогвардейская, 244, Россия
* E-mail: turnik27@yandex.ru
Поступила в редакцию 26.11.2020
После доработки 20.02.2021
Принята к публикации 20.02.2021
Аннотация
Проведено моделирование фазовых равновесий для трехкомпонентной взаимной системы Na+,Sr2+||Cl–,${\text{WO}}_{{\text{4}}}^{{{\text{2}}-}}$ в программе КОМПАС-3D в виде трехмерной фазовой диаграммы. Система была изучена ранее и координаты нонвариантных точек использованы для построения модели. Наибольшее поле кристаллизации занимает вольфрамат стронция вследствие высокой температуры плавления компонента (1535°С). В системе образуется конгруэнтно плавящееся соединение Na3ClWO4, фазовый комплекс разбивается на три стабильных треугольника. С помощью модели построены прогностические сечения (изотермические и политермические), а также получены изотермы поверхности ликвидуса системы. Кроме того, в работе описан мольный баланс компонентов и фаз системы и алгоритм расчета в программе MO Excel, позволяющий для смеси с произвольным составом описать химические реакции в количественном виде и рассчитать продукты взаимодействия.
ВВЕДЕНИЕ
Изучение взаимодействия солей щелочных металлов в расплавленном состоянии имеет как теоретический, так и практический интерес. Ликвидусы изучаемых солевых систем дают отражение химических равновесий, имеющих место в расплавах этих солей. В практическом отношении изучение этих систем важно при выборе солевых смесей для ванных печей и электродно-соляных ванных печей, широко применяемых при термической обработке металлов [1]. В настоящее время твердые кристаллические соединения привлекают большое внимание в связи с исследованиями их внутренней структуры, механизма образования зародышей в жидкой фазе и при решении задач получения новых неорганических материалов различного целевого назначения [2]. Ионные расплавы вольфраматов щелочных металлов важны и интересны с точки зрения высокой активности взаимодействия с оксидами, солями других р- и d-элементов, образования наноструктур в виде нитей, стержней, трубок и др. Изученные диаграммы плавкости тройных систем на основе вольфраматов позволяют значительно расширить и модифицировать область использования расплавов для синтеза многих монокристаллов, их изучения и применения [3, 4]. Дальнейшее развитие получил метод электрохимического осаждения щелочных оксидных бронз вольфрама [3]. Установлено, что выбор составов электролитов, пригодных для получения бронз, необходимо рационально осуществлять на основе применения таких диаграмм [5, 6]. Расчет, моделирование фазовых равновесий и исследование систем позволяют выявить оптимальные составы для синтеза функциональных материалов [7–15].
АНАЛИЗ ОБЪЕКТА ИССЛЕДОВАНИЯ
Трехкомпонентная взаимная система Na+,Sr2+||Cl–,${\text{WO}}_{{\text{4}}}^{{{\text{2}}--}}$ образована четырьмя индивидуальными солями, в ней образуется одно соединение конгруэнтного плавления Na3ClWO4. Температуры плавления и полиморфных превращений указаны в табл. 1. Элементами огранения являются четыре двухкомпонентные системы эвтектического типа плавления. Внутри системы в каждом стабильном треугольнике образуется трехкомпонентная эвтектика. Данные по составу и температуре плавления эвтектик представлены в табл. 1. Приведены дополнительные сведения по линиям ликвидуса двухкомпонентных систем для более точного моделирования.
Таблица 1.
Исходные данные по системе Na+,Sr2+||Cl–,${\text{WO}}_{{\text{4}}}^{{{\text{2}}--}}$ для построения 3D-модели фазового комплекса
| Символ | Состав, экв. % | tпревращения, 0С | Фазовая реакция | Источник | |||
|---|---|---|---|---|---|---|---|
| Na2WO4 | SrWO4 | SrCl2 | NaCl | ||||
| Na2WO4 | 100 | 0 | 0 | 0 | 696 | L⇄ γ-Na2WO4 | [16, 17] |
| Na2WO4 | 100 | 0 | 0 | 0 | 589 | γ-Na2WO4⇄ β-Na2WO4 | |
| Na2WO4 | 100 | 0 | 0 | 0 | 576 | β-Na2WO4⇄ α-Na2WO4 | |
| SrWO4 | 0 | 100 | 0 | 0 | 1535 | L ⇄ SrWO4 | [17] |
| SrCl2 | 0 | 0 | 100 | 0 | 874 | L ⇄ SrCl2 | [16] |
| NaCl | 0 | 0 | 0 | 100 | 801 | L ⇄ NaCl | [16, 17] |
| e 785 | 0 | 1.7 | 0 | 98.3 | 785 | L ⇄ NaCl + SrWO4 | [18] |
| е 780 | 0 | 93 | 7 | 0 | 780 | L ⇄ SrWO4 + SrCl2 | [18] |
| e 685 | 98 | 2 | 0 | 0 | 685 | L ⇄ γ-Na2WO4 + SrWO4 | [19] |
| Na2WO4–SrWO4 | 97.5 | 2.5 | 0 | 0 | 690 | Ликвидус: L ⇄ SrWO4 | |
| Na2WO4–SrWO4 | 95 | 5 | 0 | 0 | 820 | Ликвидус: L ⇄ SrWO4 | |
| Na2WO4–SrWO4 | 90 | 10 | 0 | 0 | 922 | Ликвидус: L ⇄ SrWO4 | |
| Na2WO4–NaCl | 32.8 | 0 | 0 | 67.2 | 731 | Ликвидус: L ⇄ NaCl | [20] |
| e 662 | 50.7 | 0 | 0 | 49.3 | 662 | L ⇄ γ-Na2WO4 + Na3ClWO4 | |
| Na2WO4–NaCl | 57.1 | 0 | 0 | 42.9 | 672 | Ликвидус: L ⇄ Na3ClWO4 | |
| D 680 (Na3ClWO4) | 66.7 | 0 | 0 | 33.3 | 680 | L ⇄ Na3ClWO4 | |
| Na2WO4–NaCl | 75 | 0 | 0 | 25 | 672.46 | Ликвидус: L ⇄ Na3ClWO4 | |
| е 630 | 88.3 | 0 | 0 | 11.7 | 630 | L ⇄ γ-Na2WO4 + Na3ClWO4 | |
| Na2WO4–NaCl | 94.7 | 0 | 0 | 5.3 | 667 | Ликвидус: L ⇄ γ-Na2WO4 | |
| e 553 | 0 | 0 | 68.5 | 31.5 | 553 | L ⇄ NaCl + SrCl2 | [21, 22] |
ФАЗОВАЯ 3D-МОДЕЛЬ СИСТЕМЫ
На основании экспериментальных данных, представленных в табл. 1, в программе КОМПАС-3D [23] сконструирована пространственная модель фазового комплекса трехкомпонентной взаимной системы Na+,Sr2+||Cl–,${\text{WO}}_{{\text{4}}}^{{{\text{2}}--}}$ (рис. 1) [24].
Рис. 1.
Проекция 3D-модели фазового комплекса трехкомпонентной взаимной системы Na+,Sr2+||Cl–,${\text{WO}}_{{\text{4}}}^{{{\text{2}}--}}$ на плоскость.
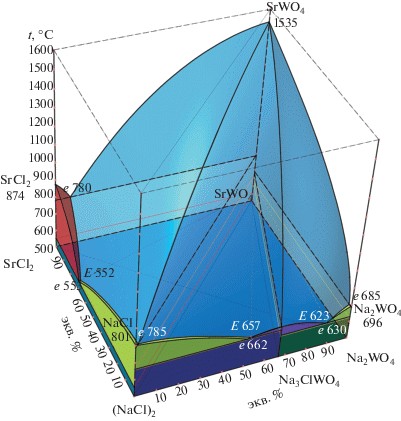
3D-Модель позволила выполнить прогноз фазовых равновесий. С помощью модели получена проекция поверхности ликвидуса на квадрат составов с изотермами с шагом в 100°С (рис. 2). Из диаграммы квадрата составов видно, что бо́льшую область кристаллизации занимает поле вольфрамата стронция из-за высокой температуры плавления соединения. Вследствие этого трехкомпонентные эвтектики прижаты к двухкомпонентным эвтектикам, т.е. вырождены по содержанию SrWO4.
Рис. 2.
Проекция поверхности ликвидуса системы Na+,Sr2+||Cl–,${\text{WO}}_{{\text{4}}}^{{{\text{2}}--}}$ с изотермами, выполненными с помощью 3D-модели.

Кроме того, модель позволяет прогнозировать изотермические сечения для произвольной температуры в диапазоне моделирования 500–1600°С (рис. 1). Они получаются в результате сечения модели горизонтальными плоскостями с соответствующей температуре аппликатой. На рис. 3 представлены сечения при температурах 700 и 600°С. С понижением температуры в системе уменьшается область жидкой фазы и увеличивается двухфазная область сосуществования жидкой фазы и твердой фазы SrWO4. При температуре 700°С отмечается появление трехфазных треугольных областей жидкой фазы и двух твердых фаз: L + SrWO4 + SrCl2 и L + SrWO4 + NaCl, причем область гомогенности жидкой фазы невелика. Также образуются двухфазные области L + + SrCl2 и L + NaCl.
Рис. 3.
Полученные из модели изотермические сечения системы Na+,Sr2+||Cl–,${\text{WO}}_{{\text{4}}}^{{{\text{2}}--}}$ при температурах 700 и 600°C.
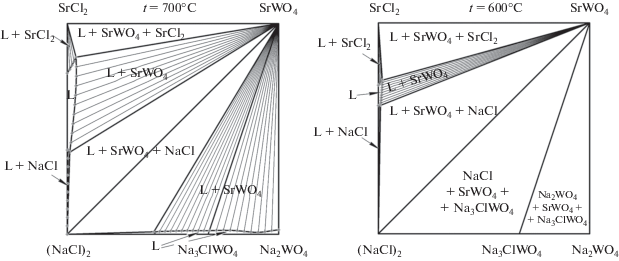
Пространство двухфазных областей описывается набором конод-отрезков, соединяющих составы равновесных фаз. При дальнейшем понижении температуры область жидкой фазы продолжает уменьшаться до исчезновения, одновременно увеличиваются трехфазные области. Двухфазные области обычно вначале увеличиваются, затем уменьшаются и исчезают.
Из 3D-модели получено политермическое сечение нестабильной диагонали SrCl2–Na2WO4 (рис. 4). Данное сечение получено рассечением модели вертикальной плоскостью. Из разреза выявлены направления на все три трехкомпонентные эвтектики, образующиеся в системе: $\bar {E}552,$ $\bar {E}657,$ $\bar {E}623.$
ХИМИЧЕСКАЯ МОДЕЛЬ СИСТЕМЫ
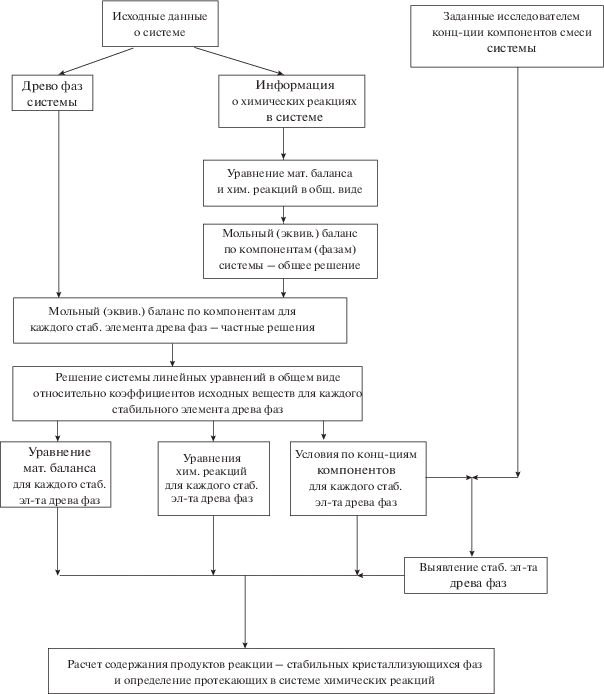
Под химической моделью системы подразумевается совокупность систем уравнений, устанавливающих связь количеств реагирующих веществ и продуктов реакций в системе. При получении химической модели составляется система линейных уравнений, основанная на мольном балансе компонентов системы. Далее для каждого стабильного элемента древа фаз определяется решение, которое представляет собой совокупность уравнений, позволяющих рассчитать коэффициенты при продуктах взаимодействия (количество кристаллизующихся фаз) и коэффициенты химических реакций (количество прореагироваших веществ) через коэффициенты (количество) исходных веществ [24–26].
Суммарное уравнение, описывающее мольный баланс в системе, представлено в общем виде (для всех возможных продуктов реакций в мольном количестве):
(1)
$\begin{gathered} a{\text{NaCl}} + b{\text{SrC}}{{{\text{l}}}_{{\text{2}}}} + c{\text{N}}{{{\text{a}}}_{{\text{2}}}}{\text{W}}{{{\text{O}}}_{{\text{4}}}} + d{\text{SrW}}{{{\text{O}}}_{{\text{4}}}} = \\ = \,\,e{\text{NaCl}} + f{\text{SrC}}{{{\text{l}}}_{{\text{2}}}} + g{\text{N}}{{{\text{a}}}_{{\text{2}}}}{\text{W}}{{{\text{O}}}_{{\text{4}}}} + \\ + \,\,h{\text{SrW}}{{{\text{O}}}_{{\text{4}}}} + i{\text{N}}{{{\text{a}}}_{{\text{3}}}}{\text{ClW}}{{{\text{O}}}_{{\text{4}}}}{\text{.}} \\ \end{gathered} $Элементарные реакции, протекающие в системе (рис. 2):
Для точки K1:
(2)
$j{\text{SrC}}{{{\text{l}}}_{{\text{2}}}} + j{\text{N}}{{{\text{a}}}_{{\text{2}}}}{\text{W}}{{{\text{O}}}_{{\text{4}}}} = {\text{2}}j{\text{NaCl}} + j{\text{SrW}}{{{\text{O}}}_{{\text{4}}}}{\text{.}}$Для точки D (Na3ClWO4):
(3)
$k{\text{NaCl}} + k{\text{N}}{{{\text{a}}}_{{\text{2}}}}{\text{W}}{{{\text{O}}}_{{\text{4}}}} = k{\text{N}}{{{\text{a}}}_{{\text{3}}}}{\text{ClW}}{{{\text{O}}}_{{\text{4}}}}{\text{.}}$Мольный баланс по непрореагировавшим веществам:
(4)
$\left\{ \begin{gathered} {\text{NaCl}}:a - k~ = e - 2j \hfill \\ {\text{SrC}}{{{\text{l}}}_{2}}:b - j~ = f \hfill \\ {\text{N}}{{{\text{a}}}_{2}}{\text{W}}{{{\text{O}}}_{4}}:c - j - k~ = g \hfill \\ {\text{SrW}}{{{\text{O}}}_{4}}:d~ = h - j \hfill \\ {\text{N}}{{{\text{a}}}_{3}}{\text{ClW}}{{{\text{O}}}_{4}}:0~ = i - k \hfill \\ \end{gathered} \right..$Отсюда мольный баланс по продуктам реакции:
(5)
$\left\{ \begin{gathered} {\text{NaCl}}:e~\, = a - k~ + ~\,2j \hfill \\ {\text{SrC}}{{{\text{l}}}_{2}}:f\,~ = b - j \hfill \\ {\text{N}}{{{\text{a}}}_{2}}{\text{W}}{{{\text{O}}}_{4}}:g~\, = c - j - k \hfill \\ {\text{SrW}}{{{\text{O}}}_{4}}:h\,~ = d~ + ~j \hfill \\ {\text{N}}{{{\text{a}}}_{3}}{\text{ClW}}{{{\text{O}}}_{4}}:i~ = k \hfill \\ \end{gathered} \right..$Поскольку древо фаз системы (рис. 5) представлено пятью стабильными симплексами (три стабильных треугольника, стабильная диагональ и стабильная секущая), система уравнений (5) имеет пять решений (табл. 2).
Таблица 2.
Химическая модель системы Na+,Sr2+||Cl–,${\text{WO}}_{{\text{4}}}^{{{\text{2}}--}}$
| Стабильный симплекс | Условие для симплекса и уравнения для расчета продуктов реакции и участников химических реакций | Уравнение материального баланса и протекающих в симплексе реакций |
|---|---|---|
| Стабильный треугольник NaCl–SrCl2–SrWO4 |
$b > c$ $\left\{ \begin{gathered} g~\, = i~\, = k~\, = 0 \hfill \\ e~\, = a~\, + \,~2c \hfill \\ j~\, = c \hfill \\ f~ = b - c \hfill \\ h~\, = d~\, + ~\,c \hfill \\ \end{gathered} \right.$ |
aNaCl + bSrCl2 + cNa2WO4 + dSrWO4 =
= eNaCl + fSrCl2 + hSrWO4 K1: jSrCl2 + jNa2WO4 = 2jNaCl + + jSrWO4 |
| Стабильная диагональ NaCl–SrWO4 |
$b~\, = c$. $\left\{ \begin{gathered} f~ = g~\, = i~\, = k~\, = 0 \hfill \\ e~\, = a~\, + \,~2c \hfill \\ j~\, = c \hfill \\ h~\, = d~\, + \,~c \hfill \\ \end{gathered} \right.$ |
aNaCl + bSrCl2 + cNa2WO4 + dSrWO4 = eNaCl + hSrWO4 K1: jSrCl2 + jNa2WO4 = 2jNaCl + jSrWO4 |
| Стабильный треугольик NaCl–SrWO4–Na3ClWO4 | $\left\{ \begin{gathered} b < c \hfill \\ a - c~\, + ~\,3b > 0 \hfill \\ \end{gathered} \right.$ $\left\{ \begin{gathered} f~ = g~\, = 0 \hfill \\ j~\, = b \hfill \\ k~ = c - b \hfill \\ e~\, = a - c~\, + \,~3b \hfill \\ h~\, = b~\, + \,~d \hfill \\ i~\, = c - b \hfill \\ \end{gathered} \right.$ |
aNaCl + bSrCl2 + cNa2WO4 + dSrWO4 =
= eNaCl + hSrWO4 + iNa3ClWO4 K1: jSrCl2 + jNa2WO4 = 2jNaCl + jSrWO4 D (Na3ClWO4): kNaCl + kNa2WO4 = kNa3ClWO4 |
| Стабильная секущая SrWO4–Na3ClWO4 | $a~\, = c - 3b$ $\left\{ \begin{gathered} e~\, = f~ = g~\, = 0 \hfill \\ j~\, = b \hfill \\ k~\, = i~\, = c - b \hfill \\ h~\, = b~\, + \,~d \hfill \\ \end{gathered} \right.$ |
aNaCl + bSrCl2 + cNa2WO4 + dSrWO4 =
= hSrWO4 + iNa3ClWO4 K1: jSrCl2 + jNa2WO4 = 2jNaCl + jSrWO4 D (Na3ClWO4): kNaCl + kNa2WO4 = kNa3ClWO4 |
| Стабильный треугольник SrWO4–Na2WO4–Na3ClWO4 | $c - a - 3b > 0$ $\left\{ \begin{gathered} e~\, = f~ = 0 \hfill \\ k~\, = i~\, = a~\, + \,~2b \hfill \\ j~\, = b \hfill \\ g~\, = c - a - 3b \hfill \\ h~\, = b~\, + \,~d \hfill \\ \end{gathered} \right.$ |
aNaCl + bSrCl2 + cNa2WO4 + dSrWO4 =
= hSrWO4 + gNa2WO4+ iNa3ClWO4 K1: jSrCl2 + jNa2WO4 = 2jNaCl + jSrWO4 D (Na3ClWO4): kNaCl + kNa2WO4 = kNa3ClWO4 |
Данная химическая модель позволяет для смеси компонентов системы с произвольным соотношением рассчитать продукты реакции и кристаллизующиеся фазы в количественном выражении. Для этого в работе предлагается написать алгоритм расчета в программе MO Excel (рис. 6). Предварительно необходимо пересчитать состав исходной смеси (например, представленный в граммах) в моли. Таким образом выявляются значения исходных веществ (a, b, c, d) в системе.
Для примера рассмотрим смесь системы, содержащую m(NaCl) = m(SrCl2 ) = m(Na2WO4) = = m(SrWO4) = 0.075 г. Соответственно, a = = 0.00128 моль, b = 0.00047 моль, c = 0.00026 моль, d = 0.00022 моль. Под условием 1, условием 2 и т.д. (табл. 3, столбцы В, С … F) понимается реализация симплекса в той же последовательности, что в табл. 2.
Таблица 3.
Реализация алгоритма расчета материального баланса системы Na+,Sr2+||Cl–,${\text{WO}}_{{\text{4}}}^{{{\text{2}}--}}$
| № | A | B | C | D | E | F | G |
|---|---|---|---|---|---|---|---|
| 1 | Условие 1 | Условие 2 | Условие 3 | Условие 4 | Условие 5 | n, моль | |
| 2 | Коэффициент | 1 | 0 | 0 | 0 | 0 | |
| 3 | e | 0.00179383 | 0 | 0 | 0 | 0 | 0.001794 |
| 4 | f | 0.00021784 | 0 | 0 | 0 | 0 | 0.000218 |
| 5 | g | 0 | 0 | 0 | 0 | 0 | 0 |
| 6 | h | 0.00047883 | 0 | 0 | 0 | 0 | 0.000479 |
| 7 | i | 0 | 0 | 0 | 0 | 0 | 0 |
| 8 | j | 0.00025526 | 0 | 0 | 0 | 0 | 0.000255 |
| k | 0 | 0 | 0 | 0 | 0 | 0 |
Реализация симплекса – это определенное соотношение компонентов в исходной смеси, в результате сплавления которых протекают физико-химические процессы и образуются фазы, соответствующие данному симплексу. Имеются условия по соотношению компонентов в исходной смеси для реализации данного симплекса. Поэтому для ячеек B2, C2, D2, E2 и F2 вносим логическую формулу “ЕСЛИ” (табл. 3). В случае выполнения условия принимаем значение ячейки, равное 1, в случае невыполнения – 0. Если требуется выполнение нескольких условий, например, как в стабильном треугольнике NaCl–SrWO4–Na3ClWO4, то используем функцию “И”. Далее рассмотрим заполнение ячеек MO Excel на примере условия 1 (стабильный треугольник NaCl–SrCl2–SrWO4). Для ячеек B3, B4, B6 и B8 прописываем функцию “ЕСЛИ”, в качестве логического выражения будет равенство ячейки B2 = 1, т.е. реализация симплекса по условию. Если “истина”, в качестве значения выбираем выражение для расчета количества (например, для ячейки B3 это уравнение e = a + 2c), если “ложь”, то 0. Для остальных ячеек (B5, B7, B9) значения всегда равны 0.
Аналогично заполняются ячейки для остальных условий (массив ячеек С3–F9). Столбец G представляет собой сумму значений по строчкам, например, ячейка G3 = сумма (B3, F3). Далее пересчитывают количество веществ в массы. Проверкой материального баланса является равенство сумм масс веществ до взаимодействия компонентов системы и после сплавления и протекания химических реакций с образованием стабильных закристаллизованных фаз (табл. 4).
Таблица 4.
Результат расчета материального баланса для смеси системы Na+,Sr2+||Cl–,${\text{WO}}_{{\text{4}}}^{{{\text{2}}--}}$
| Компо-ненты и фазы | M, г/моль | До реакций | После реакций | ||
|---|---|---|---|---|---|
| m, г | n, моль | m, г | n, моль | ||
| NaCl | 58.44 | 0.075 | 0.00128 | 0.1048 | 0.0018 |
| SrCl2 | 158.53 | 0.075 | 0.00047 | 0.0345 | 0.00021 |
| Na2WO4 | 293.82 | 0.075 | 0.00026 | 0 | 0 |
| SrWO4 | 335.46 | 0.075 | 0.00022 | 0.1606 | 0.00048 |
| Na3ClWO4 | 352.26 | 0 | 0 | 0 | 0 |
| Сумма | 0.3 | 0.00224 | 0.3 | 0.00249 | |
В системе протекает следующая химическая реакция (6):
(6)
$\begin{gathered} 0.00026{\text{ моль SrC}}{{{\text{l}}}_{{\text{2}}}}{\text{ + 0}}{\text{.00026 моль N}}{{{\text{a}}}_{{\text{2}}}}{\text{W}}{{{\text{O}}}_{{\text{4}}}} \to \hfill \\ \to \,\,{\text{0}}{\text{.00052 моль NaCl + 0}}{\text{.00026 моль SrW}}{{{\text{O}}}_{{\text{4}}}}{\text{.}} \hfill \\ \end{gathered} $МЕТОД ИОННОГО БАЛАНСА
Для проверки корректности описания химического взаимодействия по химической модели, описанной выше, выполним расчет для состава из табл. 4 методом ионного баланса [27, 28]. Сущность метода ионного баланса заключается в уравнивании коэффициентов при ионах в левой и правой частях уравнений реакций при переборе симплексов. Положительные коэффициенты в правой части уравнения позволяют однозначно определить симплекс, в который после расплавления и кристаллизации попадает исходная смесь.
Мольное содержание компонентов смеси из табл. 4 для упрощения расчета умножим на 104 и представим в виде коэффициентов. Получим следующий состав:
(7)
${\text{12}}{\text{.8NaCl}} + {\text{4}}{\text{.7SrC}}{{{\text{l}}}_{{\text{2}}}} + {\text{2}}{\text{.6N}}{{{\text{a}}}_{{\text{2}}}}{\text{W}}{{{\text{O}}}_{{\text{4}}}} + {\text{2}}{\text{.2SrW}}{{{\text{O}}}_{{\text{4}}}}{\text{.}}$Рассмотрим симплекс – стабильный треугольник NaCl–SrCl2–SrWO4. Запишем левую часть уравнения в приведенном выше виде, а правую – с неопределенными коэффициентами при солях, являющихся вершинами симплекса:
(8)
$\begin{gathered} {\text{12}}{\text{.8NaCl}} + {\text{4}}{\text{.7SrC}}{{{\text{l}}}_{{\text{2}}}} + {\text{2}}{\text{.6N}}{{{\text{a}}}_{{\text{2}}}}{\text{W}}{{{\text{O}}}_{{\text{4}}}} + {\text{2}}{\text{.2SrW}}{{{\text{O}}}_{{\text{4}}}} \to \\ \to \,\,{{{\text{X}}}_{{\text{1}}}}{\text{NaCl}} + {{{\text{X}}}_{{\text{2}}}}{\text{SrC}}{{{\text{l}}}_{{\text{2}}}} + {{{\text{X}}}_{{\text{3}}}}{\text{SrW}}{{{\text{O}}}_{{\text{4}}}}{\text{.}} \\ \end{gathered} $Приравнивая коэффициенты для всех ионов правой и левой частей приведенного выше уравнения, получаем:
Отсюда получаем систему линейных уравнений:
(9)
$\left\{ \begin{gathered} {{X}_{1}}~ = 18 \hfill \\ {{X}_{2}}~ + ~{{X}_{3}}~ = 6.9 \hfill \\ {{X}_{3}}~ = 4.8 \hfill \\ \end{gathered} \right..$Решая данную систему уравнений, получаем: X1 = 18, X2 = 2.1, X3 = 4.8. Все коэффициенты положительные, следовательно, реализуется симплекс NaCl–SrCl2–SrWO4 и количество продуктов реакции следующее (делим полученные значения на 104):
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Сравнение результатов, полученных методом мольного баланса (химическая модель (табл. 4) и выражение (10)), указывает на идентичность данных. Следовательно, можно утверждать, что химическая модель корректно описывает химическое взаимодействие в системе Na+,Sr2+||Cl–,${\text{WO}}_{{\text{4}}}^{{{\text{2}}--}}.$
Сравнение экспериментальных значений состава и температуры плавления трехкомпонентных эвтектик с этими же значениями, полученными в результате компьютерного 3D-моделирования фазового комплекса (построенного на основе данных ограняющих двухкомпонентных систем), представлено в табл. 5. Результаты показывают близкие значения, следовательно, 3D-модель можно считать адекватной фазовому комплексу системы Na+,Sr2+||Cl–,${\text{WO}}_{{\text{4}}}^{{{\text{2}}--}}.$
Таблица 5.
Сравнение экспериментальных и смоделированных значений координат тройных эвтектик системы Na+,Sr2+||Cl–,${\text{WO}}_{{\text{4}}}^{{{\text{2}}--}}$
| Точка | Характеристика | Экспериментальное значение | Смоделированное значение | Абсолютное отклонение |
|---|---|---|---|---|
| E 623 | Na2WO4, экв. % | 89 | 90 | 1 |
| SrWO4, экв. % | 0.5 | 1 | 0.5 | |
| NaCl, экв. % | 10.5 | 9 | 1.5 | |
| tпл, °С | 623 | 625 | 2 | |
| Е 657 | Na2WO4, экв. % | 52.1 | 51 | 1.1 |
| SrWO4, экв. % | 0.75 | 1 | 0.25 | |
| NaCl, экв. % | 47.15 | 48 | 0.85 | |
| tпл, °С | 657 | 660 | 3 | |
| Е 552 | SrWO4, экв. % | 1 | 2 | 1 |
| SrCl2, экв. % | 68.3 | 69 | 0.7 | |
| NaCl, экв. % | 30.7 | 29 | 1.7 | |
| tпл, °С | 552 | 560 | 8 |
ЗАКЛЮЧЕНИЕ
1. Выполнено компьютерное 3D-моделирование фазового комплекса трехкомпонентной взаимной системы Na+,Sr2+||Cl–,${\text{WO}}_{{\text{4}}}^{{{\text{2}}--}}$ по экспериментальным данным о системе и его элементам огранения в программе КОМПАС-3D.
2. Проведен анализ фазового комплекса системы с помощью 3D-модели и спрогнозирована поверхность ликвидуса, изотермические сечения и политермический разрез нестабильной диагонали. Выявлено, что наибольшую область занимает поле кристаллизации вольфрамата стронция. С понижением температуры уменьшается область жидкой фазы и увеличиваются трехфазные области.
3. Составлена химическая модель системы, позволяющая для смеси с произвольным составом выполнить расчет продуктов реакции и количественно описать протекающие химические реакции. В работе приведен алгоритм программирования расчета мольного баланса в среде MO Excel.
4. Проведено сравнение результатов прогноза продуктов кристаллизации, осуществленных с помощью химической модели и метода ионного баланса. Следан вывод о корректности применения химической модели.
5. Выполнено сравнение результатов расчета состава и температуры плавления тройных эвтектик с экспериментальными значениями, которое показало возможность 3D-моделирования фазовых равновесий в системе Na+,Sr2+||Cl–,${\text{WO}}_{{\text{4}}}^{{{\text{2}}--}}.$
Список литературы
Баранский В.Д., Волков Н.Н. // Тр. юб. конф. Новосибирск: Изд-во Сибирского отделения АН СССР, 1962. С. 133.
Витинг Л.М. Высокотемпературные растворы-расплавы. М.: Изд-во МГУ, 1991. № 22. С. 2.
Дробашева Т.И., Спицын В.И. // Оксидные бронзы. М.: Наука, 1982. С. 40.
Мохосоев М.В., Базарова Ж.Г. Сложные оксиды молибдена и вольфрама с элементами I–IV групп. М.: Наука, 1990. 256 с.
Zimmerl T., Schubert W.-D., Bicherl A., Bockb A. // Int. J. Refract. Met. Hard Mater. 2017. V. 62. Part B. P. 87. https://doi.org/10.1016/j.ijrmhm.2016.06.015
Delgado D., Soriano M.D., Solsona B. et al. // Appl. Catal., A: General. 2019. V. 582. P. 1. https://doi.org/10.1016/j.apcata.2019.05.026
Chang Y.A., Chen S., Zhang F. et al. // Prog. Mater. Sci. 2004. V. 49. № 3. P. 313. https://doi.org/10.1016/S0079-6425(03)00025-2
Fu Taibai, Zheng Zhoushun, Du Yong et al. // Comput. Mater. Sci. 2019. V. 159. P. 478. https://doi.org/10.1016/j.commatsci.2018.12.036
Kang J., Liu B. // J. Alloys Compd. 2016. V. 673. P. 309. https://doi.org/10.1016/j.jallcom.2016.02.200
Nipan G.D. // J. Alloys Compd. 2004. V. 371. P. 160. https://doi.org/10.1016/j.jallcom.2003.08.107
Xie Wei, Morgan D. // Comput. Mater. Sci. 2018. V. 143. P. 505. https://doi.org/10.1016/j.commatsci.2017.11.042
Имамалиева С.З., Гасанлы Т.М., Садыгов Ф.М. и др. // Журн. неорган. химии. 2018. № 2. С. 251. https://doi.org/10.7868/S0044457X1802018
Расулов А.И., Ахмедова П.А., Гаматаева Б.Ю. и др. // Журн. неорган. химии. 2019. Т. 64. № 1. С. 99. https://doi.org/10.1134/S0044457X19010161
Солиев Л. // Журн. неорган. химии. 2020. Т. 65. № 2. С. 212. https://doi.org/10.31857/S0044457X2002018X
Na Li, Dajian Li, Weibin Zhang // Progress in Natural Science: Materials International. 2019. V. 29. P. 265. https://doi.org/10.1016/j.pnsc.2019.05.007
Термические константы веществ. Справочник / Под ред. Глушко В.П. и др. М.: ВИНИТИ ИВТ АН СССР, 1981. Вып. 10. Ч. 1. С. 42.
Термические константы веществ. База данных. Институт теплофизики экстремальных состояний РАН Объединенного института высоких температур РАН. Химический факультет МГУ им. М.В. Ломоносова. http://www.chem.msu.su/cgi-bin/tkv.pl?show=welcom.html
Гаркушин И.К., Вердиев Н.Н., Гаджиева С.Г. и др. // Изв. ВУЗов. Цветная металлургия. 1988. Вып. 6. С. 121.
Мохосоев М.В., Алексеев Ф.П., Луцык В.И. Диаграммы состояния молибдатных и вольфраматных систем. Новосибирск: Наука, 1978. 319 с.
Гаркушин И.К., Чугунова М.В., Бурчаков А.В. и др. // Изв. Саратовск. ун-та. Сер. Химия. Биология. Экология. 2018. Т. 18. Вып. 3. С. 268.
Беляев И.Н., Дорошенко А.К. // Физико-химический анализ солевых систем. Ростов-на-Дону: Изд-во Ростовск. гос. ун-та, 1962. С. 12.
Диаграммы плавкости солевых систем. Ч. II. Двойные системы с общим анионом / Под ред. Посыпайко В.И., Алексеевой Е.А. М.: Металлургия, 1977. 304 с.
Зиновьев Д. Основы проектирования в КОМПАС-3D V16. М.: Изд-во Студия Vertex, 2017. 329 с.
Бурчаков А.В., Дворянова Е.М., Кондратюк И.М. // Журн. неорган. химии. 2015. Т. 60. № 8. С. 1100. https://doi.org/10.7868/S0044457X15080036 [Burchakov A.V., Dvoryanova E.M., Kondratyuk I.M. // Russ. J. Inorg. Chem. 2015. V. 60. P. 999.] 10.7868/S0044457X15080036
Бурчаков А.В., Дворянова Е.М., Кондратюк И.М. // Журн. неорган. химии. 2016. Т. 61. № 4. С. 519. https://doi.org/10.7868/S0044457X1604005X [Burchakov A.V., Dvoryanova E.M., Kondratyuk I.M. // Russ. J. Inorg. Chem. 2016. V. 61. P. 496.] 10.7868/S0044457X1604005X
Бурчаков А.В., Гаркушин И.К., Милов С.Н., Калинина И.П. // Бутлеровские сообщения. 2019. Т. 59. № 8. С. 103.
Сечной А.И., Гаркушин И.К. Фазовый комплекс многокомпонентных систем и химическое взаимодействие. Самара: Самарский гос. техн. ун-т, 1999. 116 с.
Сечной А.И., Гаркушин И.К., Трунин А.С. // Журн. неорган. химии. 1988. Т. 33. Вып. 4. С. 1014.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии