Журнал неорганической химии, 2021, T. 66, № 7, стр. 857-862
Синтез и глубокая очистка тетрахлорида олова
М. В. Мастрюков a, Л. И. Демина b, Л. В. Моисеева a, c, А. Д. Солдаткина d, М. Н. Бреховских a, *
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
b Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119991 Москва, Ленинский пр-т, 31, корп. 4, Россия
c Институт общей физики им. А.М. Прохорова РАН
119991 Москва, ул. Вавилова, 38, Россия
d Российский химико-технологический университет им. Д.И. Менделеева
125047 Москва, Миусская пл., 9, Россия
* E-mail: mbrekh@mail.ru
Поступила в редакцию 02.03.2021
После доработки 12.03.2021
Принята к публикации 13.03.2021
Аннотация
Изложены результаты исследований по разработке физико-химических основ синтеза и глубокой очистки тетрахлорида олова. Образцы SnCl4 были синтезированы из элементов в специально сконструированной кварцевой установке. Синтезированный SnCl4 очищали ректификацией на ситчатой колонне. Методом масс-спектрометрического анализа обнаружено, что содержание примесей свинца после ректификационной очистки SnCl4 уменьшается от 120 до 2 м. д., а также значительно снижаются примеси остальных металлов. Рассчитаны коэффициенты разделения в системе жидкость–пар для трудноразделимых примесей. Чистота образцов SnCl4 подтверждена методами ИК- и КР-спектроскопии. Получены образцы SnCl4 с содержанием микропримесей 10–4 мас. %.
ВВЕДЕНИЕ
Соединения четырехвалентного олова широко используются в органическом синтезе [1–5]. Значительное внимание уделено оловоорганическим карбоксилатным комплексам, поскольку они находят широкое применение в промышленности в качестве катализаторов, противообрастающих агентов, консервантов для древесины, средств защиты растений и т.д. [1, 6].
Оловоорганические соединения (IV) используются как потенциальные биологические средства при лечении различных заболеваний [7, 8]. Из-за биологической активности оловоорганические соединения (IV) нашли применение в ветеринарии, а также в качестве антибактериальных, противогрибковых, противоопухолевых, противомалярийных [9] и амебицидных [10] препаратов.
Моно- и диоловоорганические соединения обладают высокой каталитической активностью из-за связывающей способности неподеленной пары электронов у олова [11, 12]. В химическом синтезе оловоорганические соединения (IV) используются в качестве катализаторов этерификации и переэтерификации [13]. Катализаторы на основе олова не разлагаются при высоких температурах. Катализаторы на основе оловоорганического соединения (IV) используются для образования различных типов полимеров, которые применяются для нанесения покрытий [14].
Тетрахлорид олова является как прекурсором для синтеза оловоорганических соединений, так и катализатором в органическом синтезе [15]. Присутствие примесей в четырехвалентных соединениях галогенидов олова приводит к изменениям их характеристик и физических свойств, которые могут существенно отличаться от свойств тех же соединений высокой чистоты [16–18].
В технологии получения особо чистых веществ используются адсорбционные методы очистки, которые обладают высокой селективностью к извлечению ряда микропримесей и применимы для газов, жидкостей и растворов, а также не требуют использования высоких температур. Однако решающую роль в данном методе играют выбор адсорбента и его подготовка [19].
Другим способом получения особо чистых веществ является дистилляционный метод, который применим и к жидкостям, и к твердым веществам. Преимущество данного способа заключается в простом аппаратурном оформлении по сравнению с ректификационными методами, которые требуют гораздо более тщательной подготовки оборудования [20].
Цель работы – разработка физико-химических основ синтеза и глубокой очистки SnCl4 от примесей методом высокотемпературной ректификации с получением образцов чистотой 99.999 мас. % (марки 5N).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве исходных компонентов использовали Sn (ч., Lanhit.ltd) и Cl2 (ч., Lanhit.ltd). Для синтеза четыреххлористого олова собирали кварцевую установку, состоящую из дефлегматора (холодильника), куба, кварцевого рукава и приемника для отбора синтезированного хлорида олова (рис. 1).
Рис. 1.
Установка синтеза тетрахлорида олова: 1 – дефлегматор, 2 – куб, 3 – кварцевая трубка, 4 – кварцевый “рукав”, 5 – приемник.

Глубокую очистку тетрахлорида олова проводили в кварцевой ситчатой ректификационной колонне, изготовленной из кварца особой чистоты (рис. 2). Ректификационная колонна является цельнопаянной; скорость отбора регулируется с помощью игольчатого вентиля. Загрузку в куб и отбор проб осуществляли в условиях, исключающих контакт тетрахлорида с окружающей атмосферой. Температуру в кубовой части поддерживали 120°С, в колонне – 113°С. Скорость отбора проб составляла 1 мл/мин. Отбор каждой фракции составлял 25 мл.
Рис. 2.
Схема установки глубокой очистки тетрахлорида олова: 1 – куб, 2 – ситчатая колонна, 3, 9 – печь сопротивления, 4 – игольчатый вентиль, 5 – холодильник, 6 – кварцевая воронка, 7 – приемник, 8 – термометр

Примесный состав определяли атомно-эмиссионным методом на спектрометре с индуктивно связанной плазмой iCAP 6300 Duo (Thermo). Коэффициенты разделения для системы жидкость–пар на основе SnCl4 определяли методом равновесной перегонки в ампуле по методике [21]. Спектры комбинационного рассеяния регистрировали на спектрометре комбинационного рассеяния inVia Renishaw. Возбуждение производили лазерным излучением с длиной волны λ = 633 нм и мощностью <1 мВт с разрешением 2 см–1. ИК-спектры регистрировали на ИК-Фурье-спектрометре Jasco FT/IR-6600 методом нарушенного полного внутреннего отражения на приставке с алмазным кристаллом в диапазоне 4000–225 см–1.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В основе синтеза лежит уравнение химической реакции взаимодействия металлического олова и хлора:
(1)
${\text{Sn}} + {\text{2C}}{{{\text{l}}}_{{\text{2}}}} = {\text{SnC}}{{{\text{l}}}_{{\text{4}}}}.$Энтальпия реакции (1) $\Delta Н_{{{\text{298}}}}^{^\circ }$ = –528.9 кДж/моль [22] составляет отрицательную величину и характеризует экзотермический процесс. Именно поэтому необходимо охлаждать дефлегматор во время синтеза, в котором конденсируется образующийся хлорид олова, и, регулируя температурные режимы, отводить его через кварцевый рукав в приемник. В процессе синтеза температура в кубе будет постоянно увеличиваться за счет выделения огромного количества тепла, поэтому нагревание в кубе необходимо проводить только в начале синтеза для инициирования реакции (рис. 1).
В процессе очистки тетрахлорида олова на ситчатой ректификационной колонне отобрали 8 проб: 2 головные фракции, 4 основные фракции и 2 фракции кубового остатка. Все пробы отличались не только по примесному составу, как будет показано ниже, но и по цвету – от бесцветного до рыжего.
Полагаем, что все примеси металлов присутствуют в виде хлоридов, и селективность в хлорировании примесей маловероятна. Примесный состав определяли с применением метода масс-спектрометрии с индуктивносвязанной плазмой для 4 проб тетрахлорида олова, а именно: полученного после синтеза из элементов, головной фракции, основной фракции, кубового остатка. В табл. 1 представлено содержание примесей в образцах SnCl4, полученное из значений, записанных на спектрометре с индуктивно связанной плазмой iCAP 6300 Duo (Thermo).
Таблица 1.
Содержание примесей в синтезированном SnCl4 после ректификационной очистки
| Примесь | C × 10–4, маc. % | |||
|---|---|---|---|---|
| фракция SnCl4 | ||||
| после синтеза | головная фракция | основная фракция | кубовый остаток | |
| Al | 45 | 15 | 2 | 10 |
| B | 3 | 2 | <1.0 | <2.0 |
| Ba | 5 | <0.4 | <0.4 | <0.4 |
| Bi | 20 | 5 | <1.0 | 3 |
| Ca | 6 | 2 | <1.0 | 4 |
| Cd | <1.0 | <1.0 | <0.2 | <0.2 |
| Co | <1.0 | <1.0 | <0.4 | <0.4 |
| Cr | 5 | <1.0 | <0.5 | <0.5 |
| Cu | 30 | 2 | <0.5 | <0.5 |
| Fe | 60 | 10 | <1.0 | 5 |
| Ge | 20 | 18 | <0.5 | <0.5 |
| K | <1.0 | <0.5 | <0.5 | <0.5 |
| Li | <1.0 | <1.0 | <0.1 | <0.1 |
| Mg | 5 | <1.0 | <1.0 | 2 |
| Mn | <1.0 | <1.0 | <1.0 | <1.0 |
| Na | <0.5 | <0.5 | <0.5 | <0.5 |
| Ni | 10 | 3 | <0.5 | <0.5 |
| Pb | 120 | 20 | 2 | 5 |
| Sb | 20 | 10 | <1.0 | 4 |
| Si | <1.3 | <1.3 | <1.3 | <1.3 |
| Sr | <1.0 | <1.0 | <0.5 | <1.0 |
| Ti | 2 | <1.0 | <0.5 | <1.0 |
| V | <1.0 | <0.5 | <0.5 | <1.0 |
| Zn | 15 | 6 | <1.0 | 2 |
Как и в случае с дииодидом олова [23], тетрахлорид олова загрязнен нежелательными примесями тяжелых металлов: Fe, Pb, Cu, Al и др. Как видно из табл. 1, содержание свинца в SnCl4 до ректификационной очистки значительно превышает содержание остальных примесей. Показано, что после ректификационной очистки SnCl4 содержание примесей свинца уменьшается от 120 до 2 м. д., а также значительно снижаются примеси остальных металлов, большая часть которых концентрируется в кубовом остатке и не загрязняет основную фракцию из-за разницы температур кипения хлоридов этих металлов. Легколетучие примеси, такие как тетрахлорид германия, отгоняются в головную фракцию.
С целью оценки эффективности ректификационной очистки рассчитаны идеальные коэффициенты разделения (αрасч) для некоторых примесей: Bi, Ge, Al, Pb, Cu, Fe. Для них экспериментально определен коэффициент разделения (αэксп), представленный в табл. 2.
Таблица 2.
Коэффициенты распределения для некоторых примесей SnCl4
| Примесь | BiCl3 | GeCl4 | CuCl | FeCl3 | AlCl3 | PbCl2 |
|---|---|---|---|---|---|---|
| tпл, °С | 234 | –49.5 | 426 | 306 | 192.4 | 498 |
| Концентрация, мас. % | 0.2 | 0.2 | 0.3 | 0.6 | 0.45 | 1.2 |
| αэксп | 2.51 ± 0.01 | 14.5 ± 0.01 | 8.2 ± 0.01 | 1.33 ± 0.01 | 2.27 ± 0.01 | 7.4 ± 0.01 |
| αраcч | 2.19 | 14.15 | 7.18 | 1.35 | 2.15 | 6.13 |
Для идентификации образцов использовали методы КР- и ИК-спектроскопии. Известно, что тетраэдрические (Td) пятиатомные молекулы SnCl4 характеризуются четырьмя типами нормальных колебаний: два валентных (A1 и F2) и два деформационных (E и F2). Все четыре колебания активны в спектре комбинационного рассеяния (КР). По данным [24–26], этим колебаниям соответствуют следующие частоты:
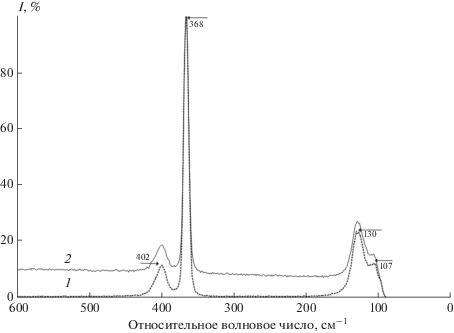
Для образцов SnCl4 непосредственно после синтеза (рис. 3, спектр 2) и после очистки ректификацией (рис. 3, спектр 1) зарегистрированы спектры КР в диапазоне 50–600 см–1. КР-спектры обоих образцов идентичны. Отсутствие люминесценции в спектрах, зарегистрированных на установке для КР, позволяет их использовать для идентификации полученного соединения. Полосы при 368 и 402 см–1 характеризуют симметричное νs(Sn–Cl) и асимметричное νas(Sn–Cl) валентные колебания Sn–Cl соответственно. Полосы при 107 и 130 см–1 относятся к деформационным колебаниям δ(Cl–Sn–Cl). Полученные результаты согласуются с литературными данными. Отсутствие дополнительных полос в спектрах обоих образцов (очищенный и до очистки) свидетельствует о том, что примеси в неочищенном образце неактивны в этой области спектра либо их содержание лежит за пределами чувствительности метода.
ИК-спектры регистрировали в диапазоне 250–800 см–1 методом нарушенного полного внутреннего отражения. Для группы симметрии Td в ИК-спектрах активны только два колебания F2: одно валентное и одно деформационное (ν3 и ν4). В исследуемый диапазон ν4 не попадает, а ν3 описывается в спектре очищенного SnCl4 (рис. 4, спектр 1) интенсивной полосой νas(Sn–Cl) при 392 см–1. Появление на этой полосе плеча при 366 см–1, характеризующего колебание νs(Sn–Cl), можно объяснить нарушением симметрии молекулы. В спектре неочищенного образца полоса (рис. 4, спектр 2) νas(Sn–Cl) несколько смещена в низкочастотную область до 386 см–1 и уширена по сравнению с этой полосой в спектре чистого вещества. Уширение полосы не позволяет отдельно вычленить полосу νs(Sn–Cl).
ЗАКЛЮЧЕНИЕ
Разработан способ синтеза тетрахлорида олова из элементов. Показано, что с помощью ректификационной очистки можно получить SnCl4 особой чистоты с содержанием примесей менее 10–4 мас. %. Установлено, что экспериментальные коэффициенты распределения примесей хорошо согласуются с рассчитанными. Методом масс-спектрометрического анализа обнаружено, что содержание примесей свинца после ректификационной очистки SnCl4 уменьшается от 120 до 2 м. д., а также значительно уменьшаются примеси остальных металлов. Образцы тетрахлорида олова идентифицированы методами КР- и ИК-спектроскопии. Полученные результаты КР-спектроскопии образцов SnCl4 до и после ректификационной очистки хорошо согласуются с литературными данными (ν1(A1) = 368 см–1, ν2(E) = 106 см–1, ν3(F2) = 403см–1, ν4(F2) = 131 см–1). В ИК-спектрах очищенного тетрахлорида олова в исследованном диапазоне интенсивная полоса при 392 см–1 соответствует валентному колебанию νas(Sn–Cl) в молекуле SnCl4.
Список литературы
Win Y.F., Teoh S.G., Yousif E. // Asian J. Chem. 2013. V. 25. № 16. https://doi.org/10.14233/ajchem.2013.15086
Antsyshkina A.S., Sadikov G.G., Sevastyanov V.G. et al. // Russ. J. Inorg. Chem. 2011. V. 56. № 4. P. 530. https://doi.org/10.1134/S0036023611040036
Radulov P.S., Belyakova Yu.Yu., Demina A.A. et al. // Russ. Chem. Bull. 2019. V. 68. № 6. P. 1289. https://doi.org/10.1007/s11172-019-2555-7
Попов В.С., Севастьянов В.Г., Симоненко Е.П. и др. // Успехи в химии и химической технологии. 2010. Т. 24. № 7. С. 103.
Chizhova N.V., Mal’tseva O.V., Mamardashvili N.Z., Zav’yalov A.V. // Russ. J. Inorg. Chem. 2017. V. 62. № 5. P. 683. https://doi.org/10.1134/S0036023617050072
Yousif E., Mehdi B.I., Yusopet R. et al. // J. Taibah University Sci. 2014. V. 8. № 3. P. 276. https://doi.org/10.1016/j.jtusci.2014.01.005
Osada S., Nishikawa J., Nakanish T. et al. // Toxicol. Lett. 2005. V. 155. № 2. P. 329. https://doi.org/10.1016/j.toxlet.2004.10.009
Jeyaseelan E.C., Tharmila S., Niranjan K. // Spectrochim. Acta, A. 2005. V. 61. № 1-2. P. 77. https://doi.org/10.1016/j.saa.2004.03.018
Wasi N., Singh H.B., Gajanana A., Raichowdhary A.N. // Inorg. Chim. Acta. 1987. V. 135. № 2. P. 133. https://doi.org/10.1016/S0020-1693(00)83277-6
Saxena A.K., Koacher J.K., Tandon J.P., Das S.R. // J. Toxicol. Environ. Health. 1982. V. 10. № 4–5. P. 709. https://doi.org/10.1080/15287398209530289
Yousif E. // J. King Saud University-Sci. 2012. V. 24. № 2. P. 167. https://doi.org/10.1016/j.jksus.2010.12.002
Yousif E., Farina Y., Graisa A. et al. // Iran. J. Chem. Chem. Engineer. 2011. V. 30. № 2. P. 67. https://doi.org/10.30492/IJCCE.2011.6287
Ferreira A.B., Lemos Cardoso A., da Silva M.J. // Int. Schol. Res Not. 2012. V. 2012. https://doi.org/10.5402/2012/142857
Jung K.D., Joo O.S., Han S.H. et al. // Catal. Lett. 1995. V. 35. № 3. P. 303. https://doi.org/10.1007/BF00807187
Pilgrim W., Murphy P.V. // J. Org. Chem. 2010. V. 75. № 20. P. 6747. https://doi.org/10.1021/jo101090f
Li X. // MRS Online Proceedings Library Archive. 2009. V. 1165. https://doi.org/10.1557/PROC-1165-M06-04
Yavari M., Ebadi F., Meloni S. et al. // J. Mater. Chem. 2019. V. 7. № 41. P. 23838. https://doi.org/10.1039/C9TA01744E
Dhere R.G., Moutinho H.R., Asher S. et al. // AIP Conference Proceedings. – American Institute of Physics, 1999. V. 462. № 1. P. 242. https://doi.org/10.1063/1.57901
Степин Б.Д., Горштейн И.Г., Блюм Г.З. и др. Методы получения особо чистых неорганических веществ. Л.: Химия, 1960. 127 с.
Девятых Г.Г., Чурбанов М.Ф. Методы получения веществ особой чистоты. М.: Знание, 1976. 63 с.
Нисельсон Л.А. Межфазовые коэффициенты распределения. М.: Наука, 1992.
CRC handbook of chemistry and physics / Ed. Lide D.R. CRC press, 2004.
Brekhovskikh M.N., Mastryukov M.V., Kornev P.V. et al. // Inorg. Mater. 2019. V. 55. № 9. P. 974. https://doi.org/10.1134/S0002337X1909001X
Welsh H.L., Crawford M.F., Scott G.D. // J. Chem. Phys. 1948. V. 16. № 2. P. 97. https://doi.org/10.1063/1.1746824
Long D.A., Spencer T.V., Waters D.N. et al // Proc. R. Soc. London, Ser. A. 1957. V. 240. № 1223. P. 499. https://doi.org/10.1098/rspa.1957.0103
Накамото К. ИК-спектры и спектры КР неорганических и координационных соединений / Пер. с англ. Христенко Л.В., под ред. Пентина Ю.А. М.: Мир, 1991.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии