Журнал неорганической химии, 2021, T. 66, № 8, стр. 964-976
КОСТНЫЕ ЦЕМЕНТЫ НА ОСНОВЕ СТРУВИТА: ВЛИЯНИЕ ВВЕДЕНИЯ ВАНКОМИЦИНА, ОЦЕНКА БИОСОВМЕСТИМОСТИ И ОСТЕОКОНДУКТИВНЫХ ПОТЕНЦИЙ IN VIVO
П. А. Крохичева a, *, М. А. Гольдберг a, Д. Р. Хайрутдинова a, О. С. Антонова a, С. А. Ахмедова b, В. А. Кирсанова b, И. К. Свиридова b, Н. С. Сергеева b, А. В. Леонов c, А. С. Баикин a, И. В. Смирнов a, С. М. Баринов a, В. С. Комлев a
a Институт металлургии и материаловедения им. А.А. Байкова РАН
119334 Москва, Ленинский пр-т, 49, Россия
b Национальный медицинский исследовательский центр радиологии
Министерства здравоохранения Российской Федерации
249036 Обнинск, ул. Королева, 4, Россия
c Московский государственный университет им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
* E-mail: polinariakroh@gmail.com
Поступила в редакцию 10.02.2021
После доработки 17.03.2021
Принята к публикации 22.03.2021
Аннотация
В последние годы магний-кальцийфосфатные материалы рассматриваются в качестве альтернативы материалам на основе фосфатов кальция в реконструктивно-восстановительной хирургии. Работа посвящена созданию и изучению костных цементов на основе системы фосфаты кальция–фосфаты магния, образующих при взаимодействии с цементной жидкостью в качестве основной фазы струвит (MgNH4PO4 · 6H2O). Полученные материалы обладают прочностью при сжатии до 54 ± 5 МПа, временем схватывания ~6–7 мин и нейтральным значением рН. Исследовано влияние введения в цементные материалы ванкомицина. Изучение кинетики выделения ванкомицина показало, что в течение 21 сут происходит выделение антибиотика в количестве до 98%. Материалы проявляют выраженную антибактериальную активность в отношении штаммов Staphylococcus aureus и Escherichia coli. При введении ванкомицина зона подавления роста бактерий возрастает более чем в 2 раза по сравнению с контрольными образцами. Проведены исследования in vivo и рассчитаны структурные факторы на основе результатов микро-КТ. По макро- и микропризнакам цементные материалы являются полностью биосовместимыми, к 6-ой неделе наблюдается образование новой костной ткани.
ВВЕДЕНИЕ
Разработка основ создания новых композиционных магний-кальцийфосфатных цементных (МКФЦ) материалов, предназначенных для замещения и регенерации костных тканей, является актуальной задачей современного материаловедения. В настоящее время значительные усилия направлены на изучение костных цементов на основе минералов фосфата магния, таких как струвит (MgNH4PO4 · 6H2O) или ньюберит (MgHPO4 · · 3H2O), перспективных в качестве альтернативы кальцийфосфатным цементам (КФЦ) [1]. Это связано с их способностью к более высокой кинетике растворения в условиях in vivo, что приводит к более быстрой резорбции и ремоделированию костной ткани благодаря высвобождению ионов магния [2, 3]. Такие материалы характеризуются биосовместимостью и остеокондуктивностью, что было продемонстрировано на модели костного дефекта кролика [4], а также большеберцовой кости овцы [5].
Инфекции, связанные с имплантацией, являются серьезной проблемой в реконструктивно-восстановительной хирургии. Грамположительные бактерии (Staphylococcus aureus (S. aureus), Enterococcus spp., Streptococcus spp.) являются основными возбудителями инфекций костей и суставов, на долю грам-отрицательных бактерий (Escherichia coli (E. coli), Pseudomonas aeruginosa) приходится 10–22% всех случаев инфицирования [6]. Основным методом локальной антибиотикотерапии при инфекциях костной ткани, в том числе в качестве дополнения к системной терапии [7], является использование замещающего кость материала с введенным в него антимикробным препаратом широкого спектра действия [8, 9]. При использовании такого метода осуществляется локальная антибактериальная терапия, которая обеспечивает надежную локализованную доставку антибиотика к очагу поражения. На практике широко используются несколько видов антибиотиков: гентамицин, тобрамицин, ванкомицин [10]. Основные достижения в этой области были достигнуты при использовании костных цементов на основе полиметилметакрилата (ПММА) [11, 12]. Одним из существенных недостатков костных цементов на основе ПММА является экзотермическая реакция при затвердевании, поэтому одним из главных требований, предъявляемых к выбору антибиотика, является его термостабильность. Также антибиотик должен обладать широким спектром бактерицидной активности при низких концентрациях, а антибактериальный эффект импрегнированного препаратом материала, препятствующий размножению бактерий и формированию микробных биопленок, должен составлять 14–21 сут для обеспечения процессов первичного заживления костного дефекта [13].
По сравнению с материалами на основе ПММА, КФЦ обладают остеокондуктивными свойствами, биорезорбируемостью и высокой способностью к адсорбированию лекарственных препаратов [14]. Их основное преимущество – способность не только служить агентом доставки, но и способствовать восстановлению костной ткани вследствие близости химического состава кальцийфосфатных материалов к минеральной составляющей костей. В работе [15] в исследованиях in vivo на модели костного дефекта крысы было показано, что при введении 10% антибиотика в цементы на основе ПММА и КФЦ материалы имеют одинаковую эффективность для лечения и профилактики остеомиелита, однако цемент на основе фосфата кальция ускоряет заживление костного дефекта за счет улучшенного ремоделирования костной ткани в условиях остеомиелита.
В то же время при смешении цементного порошка и цементной жидкости происходит химическая реакция, которая может привести к деструкции антимикробного препарата из-за его окисления или восстановления, это приводит к тому, что антимикробный препарат в КФЦ зачастую вводят методом пропитки схватившихся образцов [14]. Необходимо отметить, что введение антибиотика в виде порошка или жидкости непосредственно в цементный материал, а не методом пропитки готового затвердевшего образца, позволяет сохранить основные преимущества костных цементов как класса остеозамещающих материалов, в том числе способность к заполнению костного дефекта сложной формы in situ пластичной пастой с ее последующим схватыванием и твердением. В связи с вышесказанным важным является изучение влияния формы введения ванкомицина в костный цемент, а также выявление антимикробных свойств после прохождения схватывания и твердения материала.
В то же время работы, посвященные введению ванкомицина в МКФЦ, единичны. В работе [16] были получены цементные материалы, преимущественно состоящие из брушита и ньюберита, в качестве метода введения ванкомицина авторы использовали пропитку и введение через цементный порошок, которое показало аномально быстрое выделение препарата по сравнению с пропиткой. Была показана антимикробная активность в отношении S. aureus. Также были исследованы импрегнированные ванкомицином коммерческие магнийфосфатные цементы, где в качестве основного компонента цементного порошка выступал MgО, но данных о фазовом составе и механических свойствах цементов не было представлено [17]. Ванкомицинсодержащие цементы показали отсутствие цитотоксичности и антимикробную активность в отношении S. aureus.
В связи с вышесказанным цель настоящей работы – получение нового МКФЦ и изучение его микроструктуры и фазового состава, исследование влияния введения антимикробного препарата широкого спектра действия – ванкомицина на физико-химические и механические свойства костных цементов на основе струвита, выявление антибактериальной активности костных цементов в отношении грамположительных (S. aureus) и грамотрицательных бактерий (E. coli), а также исследование кинетики выделения препарата в модельную жидкость. В исследованиях in vivo оценивали биосовместимость и остеокондуктивные потенции полученных цементных материалов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез цементных порошков
Синтез цементных порошков с соотношением (Ca + Mg)/P = 2 и 60 мол. % замещения Mg проводили методом осаждения из водных растворов солей согласно уравнению (1), описанному в нашей предыдущей статье [18]. В качестве контрольного материала исследовали цементы, полученные на основе известного в литературе тетракальциевого фосфата (ТеТКФ) [19], Ca/P = 2, 0 мол. % Mg, синтезированного согласно реакции (2).
(1)
$\begin{gathered} 1.6{\text{Ca}}{{\left( {{\text{N}}{{{\text{O}}}_{{\text{3}}}}} \right)}_{2}} + 2.4{\text{Mg}}{{\left( {{\text{N}}{{{\text{O}}}_{{\text{3}}}}} \right)}_{2}} + \\ + \,\,4{{\left( {{\text{N}}{{{\text{H}}}_{{\text{4}}}}} \right)}_{{\text{2}}}}{\kern 1pt} {\text{HP}}{{{\text{O}}}_{4}} + 8{\text{N}}{{{\text{H}}}_{{\text{4}}}}{\text{OH}} = \\ = {\text{C}}{{{\text{a}}}_{{(1.6)}}}{\text{M}}{{{\text{g}}}_{1}}_{{2.4}}{\text{O}}{{\left( {{\text{P}}{{{\text{O}}}_{{\text{4}}}}} \right)}_{2}} + 16{\text{N}}{{{\text{H}}}_{{\text{4}}}}{\text{N}}{{{\text{O}}}_{{\text{3}}}} + 6{{{\text{H}}}_{{\text{2}}}}{\text{O}}, \\ \end{gathered} $(2)
$\begin{gathered} 4{\text{Ca}}{{\left( {{\text{N}}{{{\text{O}}}_{{\text{3}}}}} \right)}_{2}} + 4{{\left( {{\text{N}}{{{\text{H}}}_{{\text{4}}}}} \right)}_{{\text{2}}}}{\kern 1pt} {\text{HP}}{{{\text{O}}}_{{\text{4}}}} + 8{\text{N}}{{{\text{H}}}_{{\text{4}}}}{\text{OH}} = \\ = {\text{C}}{{{\text{a}}}_{{\text{4}}}}{\text{O}}{{\left( {{\text{P}}{{{\text{O}}}_{{\text{4}}}}} \right)}_{{\text{2}}}} + {\text{16N}}{{{\text{H}}}_{{\text{4}}}}{\text{N}}{{{\text{O}}}_{{\text{3}}}} + 6{{{\text{H}}}_{{\text{2}}}}{\text{O}}. \\ \end{gathered} $В качестве основных фаз, формирующихся при синтезе магнийзамещенного фосфата, были получены MgO и Ca3Mg3(PO4)4, Ca2.589Mg0.411(PO4)2, что соответствует диаграмме состояния СаО–P2O5–MgO [20].
Осажденные порошки выпаривали для сохранения заданного химического состава, включая избыток катионов [21], сушили на воздухе, подвергали термообработке при 300°C в течение 6 ч для удаления NH4NO3 и прокаливали при 1150°C на воздухе в течение 2 ч для образования кристаллической фазы. Полученные спеченные блоки перетирали в агатовой ступке и измельчали в планетарной шаровой мельнице в течение 20 мин в среде изопропилового спирта. После помола порошки сушили на воздухе.
Получение цементных материалов
Цементные материалы готовили смешением исходных компонентов (цементный порошок, цементная жидкость) в стерильных условиях на предметном стекле с помощью шпателя в соотношении 2 : 1. Цементная жидкость была синтезирована на основе фосфата аммония (NH4)3PO4 и двузамещенного фосфата магния MgHPO4 с контролируемым значением pH 4.6.
Согласно литературным данным, период полувыведения ванкомицина составляет от 6 до 12 ч, а терапевтический уровень сохраняется при введении через сыворотку, содержащую от 15 до 20 мг/л антибиотика, уровень содержания ванкомицина ниже 10 мг/л приводит к развитию резистентности [22]. Однако введение ванкомицина для локальной антибактериальной терапии приводит к значительному превышению минимальной ингибирующей концентрации, что позволяет снизить количество вводимого препарата [23]. На основании исследований, проведенных в работе [24], были выбраны две концентрации ванкомицина (Ванкомицин Эльфа, Elfa Laboratories, Индия): 160 и 100 мг/г (16 и 10% соответственно) на расчет массы образца, полученного при смешении цементного порошка с цементной жидкостью.
Выбранные концентрации ванкомицина вводили в цементное тесто двумя способами: добавлением в цементную жидкость (образование суспензии) и в цементный порошок. С технологической точки зрения метод введения ванкомицина в цементный порошок обеспечивал более равномерное распределение компонентов.
Физико-химические свойства материалов
Гранулометрический состав полученных цементных порошков исследовали на лазерном анализаторе частиц FRITSCH Analysis 22. Фазовый состав материалов определяли методом рентгенофазового анализа (РФА, Shimadzu XRD-6000, CuKα-излучение, диапазон углов 2θ от 10° до 70°, шаг 0.02°) по базе данных ICDD, PDF2. Количественный фазовый анализ проводили по методу Ритвельда согласно методике, описанной в работе [25], с использованием программного обеспечения PHAN%. С помощью растровой электронной микроскопии (РЭМ, Tescan Vega II) проводили исследования размера частиц цементных порошков, а также микроструктуры цементных материалов.
Время схватывания цементных материалов определяли путем погружения иглы Вика с диаметром индентора 1.0 мм (400 г) в образец до тех пор, пока игла не переставала образовывать полное круглое углубление на цементном образце в соответствии с ISO 9917 (2007). Значения pH экстрактов определяли через 1, 7 и 28 сут инкубации затвердевших в течение 24 ч при 100%-ной влажности цементных образцов в модельных жидкостях: растворе Kokubo Simulated Body Fluid (SBF) [26] и в фосфатно-солевом буферном растворе Дульбекко без кальция и магния (DPBS) (Thermo Scientific) в соотношении 0.2 г/мл при комнатной температуре.
Механические исследования при одноосном сжатии проводили согласно ASTM D695-91 на оборудовании Instron 5581 со скоростью нагружения 1 мм/мин (погрешность измерения скорости 0.2%, погрешность измерения нагрузки 0.5%), окончательные статистические расчеты проводили по пяти образцам цементных материалов.
Исследование антибактериальных свойств и кинетики выделения ванкомицина
Исследование кинетики выделения ванкомицина проводили методом спектрофотомерии в соответствии с [27]. Образцы помещали в раствор DPBS при отношении образец/жидкость = 0.003 г/мл на срок до 21 сут и подвергали термостатированию при 37°С. Отбор проб осуществляли в объеме 4 см3 экстракта в чистую сухую кварцевую кювету с длиной оптического пути 1 см после выдержки в течение 1, 2, 6, 12, 24 ч и 2, 7, 14, 21 сут. Оптическую плотность экстракта измеряли при длинах волн 230 и 280 нм (спектрофотометр Lambda 25, 0083 ОС, 2007), затем количественно переносили экстракт из кюветы во флакон, из которого он был отобран перед измерением. Расчет концентрации ванкомицина в экстракте реализовывали по заранее построенной градуировочной зависимости.
Исследование антибактериальной активности проводили в отношении штаммов грамположительных бактерий S. aureus (ATCC 6538) и грам-отрицательных бактерий E. coli (XL1-Blue) в соответствии с ГОСТ ISO 20645. На поверхность застывшего агара накладывали испытуемые тест-образцы. Аккуратно придавливали их стерильным шпателем, чтобы добиться полного контакта образцов с агаром. Чашки Петри помещали в термостат при 37.0°С. Учет результатов антибактериальной активности проводили через 24 ч. Величину зоны задержки роста тест-микроорганизмов определяли путем измерения расстояния от края тест-образца до границы роста микроорганизмов вокруг теста, а также путем отсутствия или присутствия бактериального роста в зоне контакта образца с агаровой средой.
Исследования in vivo по оценке биосовместимости цементных образцов на модели их подкожной имплантации
Все испытания in vivo проводили в соответствии с национальными нормативными актами, регламентирующими принципы работы с лабораторными животными. Биосовместимость разработанных составов цементных материалов проводили на модели подкожной имплантации образцов МКФЦ мышам-самцам линии BDF1 согласно ГОСТ Р ИСО 10993-6-2009 (“Исследование местного действия после имплантации”) и ГОСТ Р ИСО 10993-2-2009 (“Изделия медицинские. Оценка биологического действия медицинских изделий. Ч. 2. Требования к обращению с животными”). Через 2, 4, 8 и 12 недель после операции мышей выводили из эксперимента, извлекали образцы материалов и проводили плановые морфологические исследования.
Исследования in vivo по изучению остеокондуктивных потенций цементных образцов на модели костного дефекта у крыс
Остеокондуктивные потенции свежезатворенных МКФЦ ex tempore исследовали на модели костного дефекта (краевая резекция большеберцовой кости) у крыс-самцов линии Wistar. Было сформировано две опытные группы животных по 7 голов в каждой и контрольная группа (костный дефект без материала). Исследования проводили на контрольном цементе без ванкомицина и магния – цементе на основе порошка ТеТКФ и на образце, содержащем ванкомицин и магний, выбранном на основании данных предварительных исследований.
Через 3, 6 и 12 недель после формирования дефектов проводили плановые морфологические исследования оперированных конечностей. После приготовления гистологических срезов их окрашивали гематоксилин-эозином и проводили световую микроскопию.
Рентгеновская компьютерная микротомография
Для оценки процесса образования новой костной ткани в динамике на образцах после исследований in vivo в модели краевой резекции большеберцовой кости у крыс была произведена экстракция участков кости с дефектом после 6 и 12 нед. эксперимента. Для исследования использовали лабораторную систему Микро-КТ Skyscan 1275 (Bruker, Бельгия). Было выбрано ускоряющее напряжение 20 кВ и ток пучка 175 мкА. Установлен эффективный размер пикселя 4.5 мкм. В диапазоне 360° было получено 1200 проекций по углам. В каждом угловом положении было получено девять изображений с выдержкой 0.6 с. После реконструкции с помощью программного обеспечения производителя полученный набор данных был импортирован в программное обеспечение VGStudio MAX 2.1 для визуализации и сегментации интересующих структур (например, соотношение объема кости к объему ткани (BV/TV) и соотношение объема цементного материала к объему ткани (СV/TV)) [28].
Объем костной ткани (BV) и объем цементного материала (CV) получают путем умножения количества вокселей (voxels), соответствующих характеристикам поглощения рентгеновского излучения в томографе рассматриваемого материала, на объем одного вокселя. Объем ткани (TV) – это объем, занимаемый всеми материалами в рассматриваемом наборе данных. Соотношения BV/TV и СV/TV вычисляли с помощью умножения полученных значений на разрешение микротомографа и выражали в процентном соотношении.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Характеристика цементных порошков
После измельчения цементных порошков проводили измерение гранулометрического состава на лазерном анализаторе частиц, данные представлены в табл. 1.
Таблица 1.
Распределение частиц по размеру цементного порошка (Ca + Mg)/P = 2, 60 мол. % Mg и 0 мол. % Mg
| Цементный порошок | (Ca + Mg)/P соотношение, согласно данным энерго-дисперсионного анализа (±0.1) | Mg, мол. % | Распределение частиц, мкм | ||
|---|---|---|---|---|---|
| D10 | D50 | D90 | |||
| (Ca + Mg)/P = 2, 60 мол. % Mg | 2.0 | 60 | 1.3 | 10.0 | 35.5 |
| ТеТКФ | 2.0 | 0 | 0.5 | 17.7 | 35.4 |
Согласно данным РФА, после синтеза и термообработки при 1150°C основная фаза цементного порошка с 60 мол. % замещения Mg представлена в количестве 49 мас. % MgO (пр. гр. Fm3m, а = = 4.216(9) Å). В количестве 34 мас. % присутствует фаза станфилдита (Mg3Ca3(PO4)4 JCPDS 73-1182) – фосфат кальция и магния моноклинной модификации, обогащенный магнием, с параметрами a = = 22.841(1), b = 9.994(3), c = 17.087(5) Å, а также магнийзамещенный витлокит (Ca2.589Mg0.411(PO4)2 – JCPDS 87-1582) в количестве 17 мас. % (тригональная сингония, a = 10.328(5), c = 37.244(2) Å), рис. 1а. Цементный порошок, содержащий 0 мол. % замещения Mg, представляет собой фазу ТеТКФ (JCPDS 25-1137) с параметрами a = 7.022(1), b = = 11.986 (3), c = 9.472(4) Å, пр. гр. P21 (рис. 1б).
Рис. 1.
Дифрактограммы цементных порошков и затворенных цементных материалов системы Ca/P = 2 (а) и системы (Ca + Mg)/P = 2, 60 мол. % (б): 1 – станфилдит Mg3Ca3(PO4)4, 2 – струвит MgNH4PO4(H2O)6, 3 – магнийзамещенный витлокит (Ca2.589 Mg0.411)(PO4)2, 4 – брушит CaHPO4(H2O)2, 5 – ТеТКФ, 6 – оксид магния MgO.

По данным РЭМ, цементные порошки, содержащие 60 мол. % Mg, характеризуются наличием частиц призматической морфологии размером 10–20 мкм и более мелких частиц пластинчатой морфологии размером 2–5 мкм (рис. 2а). Цементные порошки, содержащие 0 мол. % Mg, после помола представляют собой более крупные призматические частицы размером 20–40 мкм (рис. 2б).
Характеристика цементных материалов
Обозначения цементных материалов системы (Ca + Mg)/P = 2, чистых и с добавлением антибиотика – ванкомицина, полученных согласно эксперименту, представлены в табл. 2. Следует отметить, что получить цементный материал на основе ТеТКФ путем добавления антибиотика в суспензию не удалось вследствие быстрого времени схватывания цементной массы (~1 мин). Среднее время схватывания цементов составляет 6 мин, при введении ванкомицина в суспензию происходит уменьшение времени схватывания, влияние количества вводимого ванкомицина на скорость схватывания не выявлено. Известно, что оптимальное время схватывания костных цементов составляет 3–10 мин, что соответствует требованиям при проведении медицинского вмешательства [29].
Таблица 2.
Обозначение цементных материалов системы (Ca + Mg)/P = 2 и их характеристики
| Образец | Mg, мол. % | Метод введения ванкомицина | Концентрация ванкомицина, мг/г | Соотношение П : Ж | Время схватывания ±1, мин | Предел прочности, МПа |
|---|---|---|---|---|---|---|
| S0 | 60 | – | 0 | 2 : 1 | 6 | 54 ± 5 |
| V1 | Через | 160 | 6 | 32 ± 2 | ||
| V2 | порошок | 100 | 7 | 39 ± 2 | ||
| V3 | Через | 160 | 4 | 38 ± 2 | ||
| V4 | суспензию | 100 | 5 | 41 ± 3 | ||
| T0 | 0 | – | 0 | 1 : 1 | 2 | 8 ± 1 |
| V5 | Через | 160 | 2 | <5 | ||
| V6 | порошок | 100 | 2 | <5 |
Исследование значений рН экстрактов модельных жидкостей цементных материалов системы (Ca + Mg)/P = 2 в динамике наблюдения показало нейтральные значения рН (7.1–7.8), что характерно для МКФЦ на основе струвита [30]. Для экстрактов цементов на основе порошка ТеТКФ наблюдалась щелочная реакция (8.4–9.8) в растворах DPBS и SBF. Введение ванкомицина в цементные материалы не приводило к значительным изменениям значений рН.
Исследование фазового состава цементных материалов, содержащих 60 мол. % Mg, показало образование новой основной фазы – струвита (MgNH4PO4 · 6H2O), JSPDS 77-2303, пр. гр. Pmn21, а = 6.958(3), b = 6.148(1), c = 11.240(9) Å (рис. 1б). Необходимо отметить, что разницы в фазовом составе между материалами, в которые вводили лекарственный препарат в виде порошка или в виде жидкости, не наблюдалось (табл. 3).
Таблица 3.
Зависимость фазового состава цементных материалов системы (Са + Mg)/P = 2 от способа и концентрации введенного лекарственного средства ванкомицина
| Образец | Содержание фаз, мас. % | ||||
|---|---|---|---|---|---|
| витлокит β-(Ca2.589Mg0.411)(PO4)2 |
станфилдит Mg3Ca3(PO4)4 |
MgO | брушит CaHPO4 · 2H2O |
струвит MgNH4PO4 · 6H2O |
|
| V0 | 1 | 18 | 1 | 4 | 76 |
| V1 | 1 | 17 | 1 | 4 | 77 |
| V2 | 1 | 20 | 1 | 3 | 75 |
| V3 | 1 | 23 | 2 | 3 | 71 |
| V4 | 1 | 22 | 2 | 3 | 72 |
| ТеТКФ | 100 | – | – | – | – |
| V5 | 100 | – | – | – | – |
| V6 | 100 | – | – | – | – |
При контакте фосфатных солей (NH4)3PO4 и MgHPO4 с водным раствором происходит диссоциация молекул и в течение нескольких секунд образуется цементная жидкость, насыщенная ионами, в соответствии с реакциями (3)–(5):
(3)
${\text{MgHP}}{{{\text{O}}}_{{{\text{4}}\left( {{\text{вод}}} \right)}}} \to {\text{HPO}}_{{4\left( {{\text{вод}}} \right)}}^{{2 - }} + {\text{Mg}}_{{\left( {{\text{вод}}} \right)}}^{{2 + }},~$(4)
${\text{HPO}}_{{4\left( {{\text{вод}}} \right)}}^{{2 - }} \to {\text{PO}}_{{4\left( {{\text{вод}}} \right)}}^{{3 - }} + {\text{H}}_{{\left( {{\text{вод}}} \right)}}^{ + },$(5)
${{({\text{N}}{{{\text{H}}}_{{\text{4}}}}{\text{)}}}_{{\text{3}}}}{\text{P}}{{{\text{O}}}_{{{\text{4}}\left( {{\text{вод}}} \right)}}} \to {\text{PO}}_{{4\left( {{\text{вод}}} \right)}}^{{3 - }} + {\text{3NH}}_{{4\left( {{\text{вод}}} \right)}}^{ + }{\text{.}}$При контакте цементного порошка с цементной жидкостью происходит взаимодействие ионов с основной фазой – оксидом магния MgO по реакции (6), в результате чего образуется цементный материал на основе струвита. Схожий механизм фазообразования был продемонстрирован для цементов, содержащих оксид магния, в работе [19].
(6)
$\begin{gathered} {\text{MgO}} + 7{{{\text{H}}}_{{\text{2}}}}{\text{O}} + {{{\text{(N}}{{{\text{H}}}_{{\text{4}}}}{\text{)}}}_{{\text{2}}}}{\text{Mg(HP}}{{{\text{O}}}_{{\text{4}}}}{{{\text{)}}}_{2}} \cdot 4{{{\text{H}}}_{{\text{2}}}}{\text{O}} = \\ = 2{\text{MgN}}{{{\text{H}}}_{{\text{4}}}}{\text{P}}{{{\text{O}}}_{{\text{4}}}} \cdot 6{{{\text{H}}}_{{\text{2}}}}{\text{O }}\left( {{\text{струвит}}} \right). \\ \end{gathered} $Процесс фазообразования протекает в несколько этапов и приводит к образованию кристаллогидратов в структуре цементных материалов (рис. 3).
Рис. 3.
Графическое изображение процессов формирования фазы струвита при взаимодействии цементного порошка с цементной жидкостью.

Таким образом, частицы MgO реагируют с ионами раствора на основе фосфатов, образуя цементирующие фазы в процессе схватывания, где некоторые частицы остаются несвязанными. Небольшое количество непрореагировавших частиц MgO может играть роль упрочняющей фазы, которая контролирует распространение трещин в микроструктуре и увеличивает вязкость разрушения цементного материала. По данным РФА, во всех образцах цементных материалов содержание оксида магния составляет 2–3 мас. %. Авторами [21] было показано, что, напротив, большое содержание частиц оксида магния приводит к нестабильности структуры цементного материала и отрицательно влияет на механические свойства.
Формирование фазы дикальцийфосфата дигидрата (брушит) связано с перекристаллизацией магнийсодержащих станфилдита и витлокита в присутствии фосфат-ионов, содержащихся в цементной жидкости.
Необходимо отметить, что в связи с высоким содержанием фосфатных групп и катионов магния в цементной жидкости происходит полная перекристаллизация основной фазы цементных материалов на основе ТеТКФ в фазу магнийзамещенного витлокита Ca2.589Mg0.411(PO4)2 (рис. 1а). Из работ [31, 32] известно, что магний стабилизирует структуру β-трехкальциевого фосфата (витлокита) при синтезе гидроксиапатита и спекании бифазной керамики, в нашей работе мы наблюдаем аналогичный процесс при схватывании и твердении костных цементов.
Согласно РЭМ, полученные магнийсодержащие цементы S0 представляют собой плотные структуры, образованные цементной фазой, которая покрывает исходные частицы (рис. 4). Цементы на основе ТеТКФ (Т0) характеризуются формированием каркаса на основе цементирующей фазы, соответствующего подобным материалам [18].
При введении ванкомицина в концентрации 100 мг/г образуется плотная и равномерная структура (V2, V4), близкая к микроструктуре цементов, не содержащих антибиотик (S0). С увеличением концентрации до 160 мг/г происходит формирование более рыхлой и пористой матрицы, формирующей цементные материалы (V1, V3). На микрофотографии образца V1 видна внутренняя ячеисто-слоистая структура, характерная для кристаллогидратов. С увеличением содержания ванкомицина увеличивается количество аморфной фазы на поверхности материалов. Наблюдалось формирование более рыхлой за счет присутствия инертного наполнителя и, следовательно, менее прочной структуры цементов, в которые ванкомицин вводили через порошок, по сравнению с материалами, для которых была предварительно подготовлена суспензия ванкомицина на основе цементной жидкости. В случае материалов, в которые препарат был введен через жидкость (V3, V4), наблюдается формирование более связанной структуры кристаллов, обволакивающих частицы исходной фазы.
Микроструктура цементных материалов на основе ТеТКФ с добавлением антибиотика, введенного через порошок (V5, V6), схожа с микроструктурой чистого цемента (T0), увеличение концентрации препарата приводит к росту пористости.
Исследование прочности при сжатии образцов показало, что материалы, содержащие 60 мол. % Mg без ванкомицина, характеризуются прочностью при сжатии до 54 ± 5 МПа (табл. 2). Известные цементные материалы на основе струвита обладают прочностью при сжатии в диапазоне 45–65 МПа [33]. При введении ванкомицина в цементные материалы происходит снижение прочности на 15–30%. С увеличением концентрации ванкомицина до 160 мг/г происходит более значительное падение прочности, что связано, по данным РЭМ, с ростом пористости образцов. При введении ванкомицина в цементный материал через суспензию значение прочности выше, чем для материалов, в которых ванкомицин водили через порошок. Полученные результаты подтверждают предыдущие исследования. Так, авторы в работе [34] отмечали, что при введении антибиотика в количестве 30% от объема цементного материала прочность на сжатие составляет <11 МПа, т.е. ниже значений нормальной губчатой кости. По данным [35], увеличение содержания антибиотика в КФЦ увеличивает время схватывания и снижает его прочность при сжатии. В то же время полученные в данной работе материалы, содержащие ванкомицин, характеризуются приемлемыми характеристиками прочности (>30 МПа), сопоставимыми и превышающими прочность брушитовых КФЦ [36] и кальцийсульфатных цементов [37] благодаря формированию струвита.
Результаты исследований кинетики высвобождения ванкомицина
Исследование кинетики высвобождения ванкомицина, проведенное методом спектрофотометрии, показало, что из цементов, содержащих 60 мол. % Mg, высвобождается достоверно больше ванкомицина (более 80% за 504 ч), чем из цементов на основе ТеТКФ (рис. 5). Это связано с сохранением антимикробного препарата при взаимодействии между цементным порошком, содержащим в качестве активного компонента оксид магния, и цементной жидкостью, в то время как при взаимодействии более щелочного ТеТКФ возможно разрушение молекулы препарата.
Антибактериальные исследования
Исследованы антимикробные свойства цементных материалов с добавлением ванкомицина с концентрацией 160 мг/г путем введения в порошок, а также образцы цементных материалов без ванкомицина (табл. 4).
Таблица 4.
Зона подавления роста бактерий и оценка эффективности антибактериального препарата
| Образец | Концентрация тест-культуры: 1.0 × 108 КОЕ/мл (10 ед. по ОСО) | ||
|---|---|---|---|
| зона подавления роста, мм | рост бактерий под образцом | оценка | |
| Staphylococcus aureus, ATCC 6538 | |||
| S0 | 5 | Подавлен полностью | Хороший эффект |
| V1 | 11 | Подавлен полностью | Хороший эффект |
| T0 | 0 | Средний рост | Недостаточный эффект |
| V5 | 11 | Подавлен полностью | Хороший эффект |
| Escherichia coli, XL1-Blue | |||
| S0 | 0 | Средний рост | Недостаточный эффект |
| V1 | 9 | Подавлен полностью | Хороший эффект |
| T0 | 0 | Средний рост | Недостаточный эффект |
| V5 | 9 | Подавлен полностью | Хороший эффект |
Для материалов системы (Ca + Mg)/P = 2 выявлен антимикробный эффект в отношении S. aureus, который наблюдался даже для чистого МКФЦ без добавления антибиотика (S0). Работы, подтверждающие способность струвита оказывать антимикробное действие в отношении S. aureus, известны в литературе (например, [38]). При введении ванкомицина зона подавления роста бактерий возрастала более чем в 2 раза, достигая величины 11 мм (V1, V5). Исследование антимикробных свойств на штамме E. coli также продемонстрировало хорошие антимикробные свойства, величина зоны подавления роста бактерий составляла 9 мм. Для материалов, не содержащих ванкомицин, зоны подавления роста бактерий не наблюдалось.
Результаты исследований in vivo на модели подкожной имплантации
Согласно данным эксперимента in vivo (рис. 6), через две недели после имплантации вокруг образцов исследуемых цементных материалов образуется прозрачная, тонкая, прилежащая капсула с отчетливым капиллярным рисунком по поверхности разной степени выраженности.
При световой микроскопии гистологических препаратов образца костного цемента на основе ТеТКФ(Т0) через две недели после его подкожной имплантации обнаружена тонкая (4–5 слоев), правильно организованная соединительно-тканная капсула, количество слоев которой нарастает с увеличением сроков наблюдения. Слабая лимфоидная инфильтрация выявлена только на раннем сроке опыта. Цементный образец, содержащий 160 мг/г ванкомицина (V1), обладает плотной толстой капсулой на первых двух сроках и более упорядоченной – на поздних. Структура цементного материала после декальцинации ячеистая, прорастает с периферии соединительной тканью.
Результаты исследований in vivo на модели резекции большеберцовой кости у крыс
На рис. 7а представлена закрытая область дефекта (большеберцовая резекция кости) у крыс с использованием цементных материалов. На рис. 7б показаны микро-КТ изображения участков кости с дефектом после 6 и 12 недель эксперимента в 3D- и 2D-проекциях. По данным миро-КТ было установлено, что цементные материалы в изученные сроки показывают постепенную резорбцию. В качестве визуального контроля использовали образец с дефектом без цементного материала.
Рис. 7.
Закрытая область дефекта с использованием цементных материалов (а), микро-КТ цементных образцов T0, V1 и контрольного образца без цемента в 3D- и 2D-проекциях через 6 и 12 нед. исследования (б), гистологические срезы цементных образцов T0 и V1 через 6 и 12 нед. исследования, окраска – гематоксилин-эозин, увеличение ×200 (в).
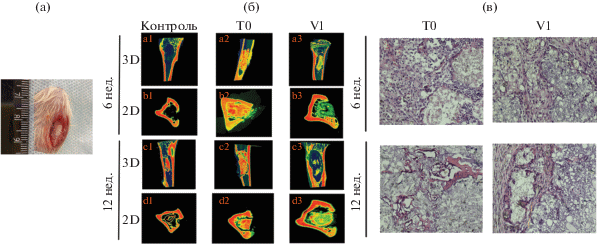
При световой микроскопии гистологических препаратов (рис. 7в) у цементного образца на основе ТеТКФ(Т0) наблюдается формирование нежной ячеистой структуры и активное прорастание фибробластоподобными клетками в межгранулярном пространстве. Так, через 6 недель после операции имплантат фрагментирован и окружен соединительной тканью с гигантскими клетками инородных тел. Между фрагментами цемента визуализируется небольшое количество лейкоцитов, в отдельных полях в межгранулярном пространстве формируются кровеносные сосуды. Через 12 нед. наблюдения снаружи область дефекта закрыта многослойной соединительной тканью. О начале остеогенеза в этот срок свидетельствует формирование de novo единичных костных балок со стороны материнского ложа.
МКФЦ с добавлением ванкомицина (V1) на ранних сроках наблюдения (6 нед.) с периферии замещен неваскуляризированной соединительной тканью, в которую вкраплены небольшие частицы цемента (декальцинация полная и равномерная). На этом сроке и через 12 нед. после операции центральная область дефекта представлена бесклеточной мелкоячеистой структурой. Отличия гистопрепаратов на сроке 12 нед. заключаются в формировании новых сосудов в толще соединительной ткани и островков неоостеогенеза с периферии имплантата (рис. 7в).
К 12 нед. эксперимента происходит образование новой костной ткани на фоне деградации всех цементных материалов согласно сегментации данных микро-КТ (рис. 8). Интенсивнее образование костной ткани наблюдается у образца на основе ТеТКФ (T0), к 12 нед. прирост составляет 10%. У образца МКФЦ (V1) на фоне быстрой деградации цементного материала из-за присутствия ванкомицина прирост костной ткани составляет 7%. Гистологические данные подтверждают, что образцы, содержащие ванкомицин, растворяются быстрее, чем образцы, не содержащие антибиотик. Прирост костной ткани у контрольного образца составляет 3%, известно, что дефекты размером меньше критического обладают способностью самостоятельно восстанавливать костную ткань [39].
ЗАКЛЮЧЕНИЕ
Получены МКФЦ на основе струвита, которые характеризуются прочностью до 54 ± 5 МПа, временем схватывания 6–7 мин, нейтральным значением рН вытяжек для реконструктивно-восстановительной хирургии. Показано, что такие цементные материалы могут являться носителем лекарственных средств (ванкомицина) и проявлять антимикробные свойства в течение 21 сут в отношении грамположительных (S. aureus) и грамотрицательных бактерий (E. coli). По макро- и микропризнакам, полученные цементные материалы являются биосовместимыми: отсутствуют признаки воспаления, лимфоидной инфильтрации, отека окружающих тканей. Наличие клеток инородных тел, фрагментация цементных дисков, их прорастание соединительной тканью в сроки 3–12 нед. являются косвенным подтверждением процесса разрушения (деструкции/биодеградации) цементных материалов различных составов, наиболее динамично протекающих в группах образцов, в состав которых включен антибиотик – ванкомицин.
Список литературы
Haque M.A., Chen B. // Materialia. 2020. V. 13. P. 100852. https://doi.org/10.1016/j.mtla.2020.100852
Nabiyouni M., Brückner T., Zhou H. et al. // Acta Biomaterialia. 2018. V. 66. P. 23. https://doi.org/10.1016/j.actbio.2017.11.033
Северин А.В., Рудин В.Н., Пауль М.Э. // Журн. неорган. химии. 2020. T. 65. № 9. C. 1283. https://doi.org/10.31857/s0044457x20090172
Zeng D., Xia L., Zhang W. et al. // Tissue Engineering, Part A. 2012. V. 18. № 7–8. P. 870. https://doi.org/10.1089/ten.tea.2011.0379
Kanter B., Vikman A., Brückner T. et al. // Acta Biomaterialia. 2018. V. 69. P. 352. https://doi.org/10.1016/j.actbio.2018.01.035
Murillo O., Grau I., Lora-Tamayo J. et al. // Clinical Microbiology and Infection. 2015. V. 21. № 3. P. 254.e1. https://doi.org/10.1016/j.cmi.2014.09.007
Niikura T., Lee S.Y., Iwakura T. et al. // J. Orthopaedic Sci. 2016. V. 21. № 4. P. 539. https://doi.org/10.1016/j.jos.2016.05.003
Li T., Fu L., Wang J. et al. // Infection and Drug Resistance. 2019. V. 12. P. 2191. https://doi.org/10.2147/IDR.S203740
Lee J.H., Shin S.J., Cho S.N. et al. // J. Arthroplasty. 2020. V. 35. № 3. P. 864. https://doi.org/10.1016/j.arth.2019.10.023
Божкова C.А., Новокшонова А.А., Конев В.А. Современные возможности локальной антибиотикотерапии перипротезной инфекции и остеомиелита (обзор литературы). М., 2015.
Boelch S.P., Jordan M.C., Arnholdt J. et al. // J. Mater. Sci.: Materials in Medicine. 2017. V. 28. P. 104. https://doi.org/10.1007/s10856-017-5915-6
Bishop A.R., Kim S., Squire M.W. et al. // J. Mechanical Behavior of Biomedical Materials. 2018. V. 87. P. 80. https://doi.org/10.1016/j.jmbbm.2018.06.033
https://www.rfbr.ru/rffi/portal/books/o_2089037
Loca D., Sokolova M., Locs J. et al. // Mater. Sci. Eng., C. 2015. V. 49. № 1. P. 106. https://doi.org/10.1016/j.msec.2014.12.075
Boyle K.K., Sosa B., Osagie L. et al. // PLOS ONE 2019. V. 14. № 9. P. E0222034. https://doi.org/10.1371/journal.pone.0222034
Cabrejos-Azama J., Alkhraisat M.H., Rueda C. et al. // Mater. Sci. Eng., C. 2016. V. 61. P. 72. https://doi.org/10.1016/j.msec.2015.10.092
Roller B.L., Stoker A.M., Cook J.L. // J. Clinical Orthopaedics and Trauma. 2020. V. 11. P. S729. https://doi.org/10.1016/j.jcot.2020.06.011
Goldberg M.A., Krohicheva P.A., Fomin A.S. et al. // Bioactive Materials. 2020. V. 5. № 3. P. 644. https://doi.org/10.1016/j.bioactmat.2020.03.011
Tsai C.H., Lin R.M., Ju C.P. et al. // Biomaterials. 2008. V. 29. № 8. P. 984. https://doi.org/10.1016/j.biomaterials.2007.10.014
Hill W.L., Faust G.T., Reynolds D.S. et al. // Am. J. Sci. V. 242. № 9. P. 457. https://doi.org/10.2475/ajs.242.9.45721
Goldberg M.A., Smirnov V.V., Antonova O.S. et al. // Mendeleev Commun. 2018. V. 28. № 3. https://doi.org/10.1016/j.mencom.2018.05.034
Klapkova E., Nescakova M., Melichercik P. et al. // Folia Microbiologica. 2020. V. 65. № 3. P. 475. https://doi.org/10.1007/s12223-019-00752-w
Cervera C., Castaneda X., de la Maria C.G. et al. // Clinical Infectious Diseases. 2014. V. 58. № 12. P. 1668. https://doi.org/10.1093/cid/ciu183
Joosten U., Joist A., Gosheger G. et al. // Biomaterials. 2005. V. 26. № 25. P. 5251. https://doi.org/10.1016/j.biomaterials.2005.01.001
Shelekhov E.V., Sviridova T.A. // Programs for X-Ray Analysis of Polycrystals, 2000.
Abe Y., Kokubo T., Yamamuro T. // J. Mater. Sci.: Materials in Medicine. 1990. V. 1. № 4. P. 233. https://doi.org/https://doi.org/10.1007/BF00701082
Казайкин В.Н., Пономарев В.О., Вохминцев А.С. et al. // Практическая медицина. 2016. Т. 1. С. 85.
Komlev V., Mastrogiacomo M., Pereira R. et al. // Eur. Cells Mate. 2010. V. 19. P. 136. https://doi.org/10.22203/ecm.v019a14
Großardt C., Ewald A., Grover L.M. et al. // Tissue Engineer. A. 2010. V. 16. № 12. P. 3687. https://doi.org/10.1089/ten.tea.2010.0281
Ostrowski N., Roy A., Kumta P.N. // ACS Biomater. Sci. Eng. 2016. V. 2. № 7. P. 1067. https://doi.org/10.1021/acsbiomaterials.6b00056
Kannan S., Lemos I.A.F., Rocha J.H.G. et al. // J. Solid State Chem. 2005. V. 178. № 10. P. 3190. https://doi.org/10.1016/j.jssc.2005.08.003
Chaudhry A.A., Goodall J., Vickers M. et al. // J. Mater. Chem. 2008. V. 18. № 48. P. 5900. https://doi.org/10.1039/b807920j
Vorndran E., Ewald A., Müller F.A. et al. // J. Mater. Sci.: Mater. Med. 2011. V. 22. № 3. P. 429. https://doi.org/10.1007/s10856-010-4220-4
Chen G., Liu B., Liu H. et al. // Orthopaedics and Traumatology: Surgery and Res. 2018. V. 104. № 8. P. 1271. https://doi.org/10.1016/j.otsr.2018.07.007
Sakamoto Y., Ochiai H., Ohsugi I. et al. // J. Craniofacial Surgery. 2013. V. 24. № 4. P. 1447. https://doi.org/10.1097/SCS.0b013e31829972de
Mestres G., Ginebra M.P. // Acta Biomaterialia. 2011. V. 7. № 4. P. 1853. https://doi.org/10.1016/j.actbio.2010.12.008
Uskoković V., Graziani V., Wu V.M. et al. // Mater. Sci. Eng., C. 2019. V. 94. P. 798. https://doi.org/10.1016/j.msec.2018.10.028
Smirnov V.V., Khayrutdinova D.R., Smirnov S.V. et al. // Dokl. Chem. 2019. V. 485. № 1. P. 100. https://doi.org/10.1134/S0012500819030029
Schemitsch E.H. // J. Orthopaedic Trauma. 2017. V. 31. P. S20. https://doi.org/10.1097/BOT.0000000000000978
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии







