Журнал неорганической химии, 2022, T. 67, № 11, стр. 1581-1587
Первые моноиодацетатные комплексы уранила: синтез и строение
Л. Б. Сережкина a, *, Д. С. Митина a, А. В. Вологжанина b, М. С. Григорьев c, Д. В. Пушкин a, В. Н. Сережкин a
a Самарский национальный исследовательский университет им. академика С.П. Королева
443011 Самара, ул. Академика Павлова, 1, Россия
b Институт элементоорганических соединений им. А.Н. Несмеянова РАН
119991 Москва, ул. Вавилова, 28, Россия
c Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва, Ленинский пр-т, 31, корп. 4, Россия
* E-mail: lserezh@samsu.ru
Поступила в редакцию 31.03.2022
После доработки 11.05.2022
Принята к публикации 16.05.2022
- EDN: OJMTMA
- DOI: 10.31857/S0044457X22100427
Аннотация
Проведены синтез, ИК-спектроскопическое, термографическое и рентгеноструктурное исследование кристаллов (CN3H6)3[UO2(mia)3]2(NO3) (I) и (CN3H6)3[UO2(mia)3]2(OН) (II), где mia – моноиодацетат-ион CH2ICOO–. Уранилсодержащим комплексам [UO2(mia)3]– в структурах I и II отвечает кристаллохимическая формула А(B01)3, где A = ${\text{UO}}_{2}^{{2 + }},$ B01 = mia. С помощью метода молекулярных полиэдров Вороного–Дирихле проведен анализ невалентных взаимодействий в структуре кристаллов I. С учетом имеющихся литературных данных выяснено, что природа иодсодержащих карбоксилат-ионов (алифатические или ароматические) не влияет на геометрические характеристики (d(I⋅⋅⋅O) и ∠С–I⋅⋅⋅O) невалентных взаимодействий с участием атомов иода.
ВВЕДЕНИЕ
В последние десятилетия активно исследуются карбоксилатные комплексы уранила, в том числе и ацетатоуранилаты. Так, изучены кристаллические структуры около трехсот разных ацетатсодержащих комплексов уранила, некоторые из которых применяются при переработке урансодержащих руд и материалов [1–4]. В то же время сведения о галогензамещенных ацетатных комплексах уранила ограничены. Так, к настоящему времени изучено строение одного фторацетатного [5], четырех хлорацетатных [6, 7] и одного бромацетатного [8] комплексов уранила. Сведения о каких-либо иодацетатных комплексах уранила в литературе отсутствуют, хотя они представляют несомненный теоретический интерес с точки зрения участия катионов уранила в галогенных связях Y⋅⋅⋅X–R, где атом галогена Х участвует в образовании контакта за счет электрофильной области, R – атом или группа атомов, ковалентно связанная с атомом галогена, а Y – атом, обладающий нуклеофильной областью (например, НЭП или π-системой) [9]. Среди охарактеризованных галогенацетатных комплексов уранила лишь в бромацетатном [8] реализуется укороченное расстояние U=О⋅⋅⋅Br, и поскольку прочность галогенных связей усиливается в ряду F < Cl < Br < I [10, 11], можно ожидать, что именно в иодацетатах уранила влияние галогенных связей на особенности супрамолекулярной структуры соединений U(VI) будет проявляться наиболее отчетливо. Поэтому данная работа посвящена изучению строения и некоторых свойств впервые синтезированных моноиодацетатных комплексов уранила (CN3H6)3[UO2(mia)3]2(L), где mia = = CH2ICOO–, а L = ${\text{NO}}_{3}^{ - }$ (I) или ОН– (II).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез I и II. В качестве исходных веществ использовали оксид урана(VI), моноиодуксусную кислоту и нитрат или сульфат гуанидиния.
К оксиду урана в количестве 0.2 г (0.7 ммоль) добавляли водный раствор моноиодуксусной кислоты (0.5203 г (3 ммоль) кислоты в 7 мл воды) и перемешивали до полного растворения. К полученному раствору добавляли 5 мл водного раствора нитрата гуанидиния (0.2559 г, 2 ммоль), рН раствора отвечал 1. Мольное соотношение реагентов составляло 1 : 4 : 3. Через 2 сут из раствора выпадали желтые призматические кристаллы состава (CN3H6)3[UO2(CH2ICOO)3]2(NO3) (I). Найдено, %: U 25.6; для I вычислено, %: U 25.2. Выход 69%.
Соединение II получено по аналогичной методике заменой нитрата гуанидиния сульфатом гуанидиния при мольном соотношении реагентов 1 : 6 : 2. Найдено, %: U 25.2; для (CN3H6)3[UO2(CH2ICOO)3]2(ОН) вычислено, %: U 25.8. Выход 72%.
Дифференциальный термический и термогравиметрический анализ был проведен на дериватографе Shimadzu DTG-60 при скорости нагрева 10 град/мин. Навески составляли 7–8 мг. Прокаливание проводили до 900°С в платиновых тиглях с использованием Pt–Pt/Rh-термопары и эталона из прокаленного оксида алюминия в воздушной атмосфере.
ИК-спектры синтезированных соединений записывали на Фурье-спектрометре ФТ-801 в виде таблеток с KBr в диапазоне 4000–500 см–1. Отнесение полос поглощения проведено на основании литературных данных (табл. S1 ).
Рентгенодифракционные эксперименты проведены на автоматическом четырехкружном дифрактометре с двумерным детектором Bruker Quest при 100.0(2) K. Параметры элементарной ячейки уточнены по всему массиву данных [12]. В экспериментально определенные значения интенсивности рефлексов внесены поправки на поглощение с использованием программы SADABS [13]. Структуры расшифрованы методом сопряженного пространства, реализованным в программе SHELXT [14] и уточнены полноматричным методом наименьших квадратов SHELXL-2014 [15] по F2 по всем данным в анизотропном приближении для всех неводородных атомов. Атом иода в структуре II разупорядочен по двум позициям с заселенностью 0.9 : 0.1. Атомы водорода помещены в геометрически рассчитанные положения и уточнены в модели “наездника” с изотропными тепловыми параметрами, равными Uизо = 1.2Uэкв(X), где Uэкв(X) – эквивалентные изотропные тепловые параметры атомов, с которыми связан атом водорода.
Параметры рентгеноструктурного эксперимента и окончательные значения факторов недостоверности для кристаллов I и II приведены в табл. 1, характеристики основных длин связей и валентных углов полиэдров UO8 – в табл. 2. Координационные числа атомов в структурах рассчитаны с помощью метода пересекающихся сфер [16]. Координаты атомов и величины температурных параметров депонированы в Кембриджском центре кристаллографических данных под номерами CCDC 2152380 и 2152381 для I и II соответственно.
Таблица 1.
Кристаллографические данные, параметры эксперимента и уточнения структур I и II
| Параметр | I | II |
|---|---|---|
| Химическая формула | (CN3H6)3[UO2(CH2ICOO)3]2(NO3) | (CN3H6)3[UO2(CH2ICOO)3]2(OН) |
| M | 1891.91 | 1846.91 |
| Сингония, пр. гр., Z | Тригональная, $R\bar {3}$c, 6 | |
| a = b, Å | 13.2797(2) | 12.8232(9) |
| c, Å | 41.0122(10) | 41.359(8) |
| V, Å3 | 6263.5(2) | 5889.7(14) |
| dx, г/см3 | 3.009 | 3.124 |
| μ, мм–1 | 12.260 | 13.030 |
| F(000) | 5064 | 4932 |
| T, K | 100 | |
| Излучение, λ, Å | MoKα, 0.71073 | |
| Размер образца, мм | 0.22 × 0.15 × 0.09 | 0.28 × 0.22 × 0.2 |
| θmax, град | 35.404 | 31.163 |
| Область h, k, l | –15 < h < 21 –20 < k < 16 –65 < l < 61 |
–18 < h < 18 –18 < k < 18 –52 < l < 59 |
| Число отражений: измеренных/независимых (N1), Rint/с I > 2σ(I) (N2) | 30 944/2948, 0.0471/2577 | 14 837/2100, 0.0982/1711 |
| Метод уточнения | Полноматричный МНК по F2 | |
| Число уточняемых параметров | 81 | 79 |
| Весовая схема | w = 1/[σ2(Fo2) + (0.0296P)2 + 97.3187P], где P = (Fо2 + 2Fc2)/3 | w = 1/[σ2(Fo2) + (0.0563P)2 + 299.0131P], где P = (Fо2 + 2Fc2)/3 |
| Факторы недостоверности: | ||
| wR2 по N1 | 0.0746 | 0.1388 |
| R1 по N2 | 0.0323 | 0.0509 |
| S | 1.102 | 1.067 |
| Остаточная электронная плотность Δρmax/Δρmin, э/Å3 | 2.764/–3.551 | 4.063/–4.484 |
Таблица 2.
Основные геометрические параметры гексагональных бипирамид UO8
| Связь | d, Å | Ω, %* | Угол | ω, град |
|---|---|---|---|---|
| Структура (CN3H6)3[UO2(CH2ICOO)3]2(NO3) (I) | ||||
| U–O(1) | 1.782(4) | 22.01 | O(1)UO(2) | 180.0 |
| U–O(2) | 1.774(5) | 21.64 | O(4)UO(3) (×2) | 67.84(9) |
| U–O(3) (×3) | 2.507(3) | 9.06 | O(4)UO(3) (×3) | 52.32(9) |
| U–O(4) (×3) | 2.458(3) | 9.73 | O(4)UO(3) | 67.84(10) |
| Структура (CN3H6)3[UO2(CH2ICOO)3]2(OН) (II) | ||||
| U–O(1) | 1.802(10) | 21.51 | O(1)UO(2) | 180.0 |
| U–O(2) | 1.796(12) | 21.35 | O(4)UO(3) (×3) | 52.8(2) |
| U–O(3) (×3) | 2.462(7) | 9.49 | O(4)UO(3) (×3) | 67.2(2) |
| U–O(4) (×3) | 2.458(7) | 9.56 | ||
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
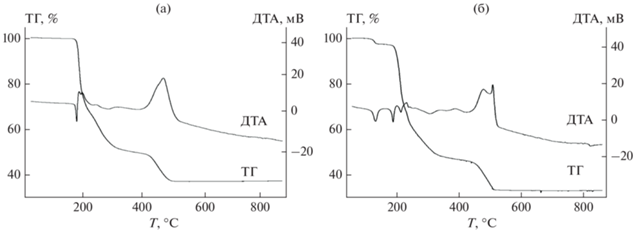
Термическое разложение I и II можно охарактеризовать приведенными ниже схемами (над стрелками указаны интервалы температур превращения, под стрелками – вычисленная и экспериментальная потеря массы, выраженная в процентах от исходной навески):
На термограмме I эндоэффект (начало при 175°С, рис. 1а) переходит в экзотермический и сопровождается убылью массы, отвечающей образованию смеси UO2(CH2ICOO)2 и UO3. Дальнейшее разложение происходит в интервале температур 440–550°С с присутствием экзотермического пика и образованием конечного продукта U3O8.
Разложение II протекает в три стадии (рис. 1б), первую из которых можно отнести к удалению гидроксида гуанидиния. Дальнейшее нагревание в интервале 185–320°С приводит к получению тех же веществ, которые образуются на первой стадии разложения I. Сопровождается эта стадия двумя эндоэффектами и экзоэффектом, переходящими друг в друга. Третья стадия, как и следовало ожидать, аналогична второй стадии разложения комплекса I и заканчивается образованием U3O8.
В ИК-спектрах I и II присутствуют характеристические полосы поглощения, вызванные колебаниями ионов ${\text{UO}}_{2}^{{2 + }}$ [17], моноиодацетат-анионов [18], катионов гуанидиния [19], а также нитрат-ионов [17] и ОН-групп [17] (табл. S1 ). Наличие дублетов при 928, 915 (I) и 927, 912 см–1 (II), отвечающих асимметричным валентным колебаниям иона уранила, вероятно, обусловлено участием, как показано будет ниже, только одного из двух уранильных атомов кислорода в образовании галогенных связей с атомами иода соседних комплексных группировок. Асимметричные и симметричные колебания карбоксильной группы в виде интенсивных узких пиков наблюдаются в областях (табл. S1 ), отвечающих их характеристическим колебаниям.
Изученные кристаллы имеют состав (CN3H6)3[UO2(CH2ICOO)3]2(L) и различаются только природой ацидолигандов L– (соответственно нитрат-ион в I и гидроксид-ион в II). Если не учитывать природу L, то комплексы I и II можно считать изоструктурными (табл. 1). Оба вещества кристаллизуются в пр. гр. R$\bar {3}$c и содержат в независимой части ячейки по одному кристаллографическому сорту атомов урана, которые расположены в частных позициях 12(с) с точечной симметрией С3, аниону CH2ICOO– в общем положении, половине катиона и 1/3 ацидолиганда (рис. 2). Координационным полиэдром атомов U(VI) является гексагональная бипирамида UO8, на главной оси которой находятся атомы кислорода группы ${\text{UO}}_{2}^{{2 + }}.$ В экваториальной плоскости бипирамиды располагается шесть атомов кислорода, принадлежащих трем разным ионам CH2ICOO–, каждый из которых связан с ураном бидентатно-циклически (тип координации В01–4). В итоге в структурах I и II возникают урансодержащие комплексы [UO2(mia)3]–, которым соответствует кристаллохимическая формула (КХФ) А(В01)3, где A = ${\text{UO}}_{2}^{{2 + }},$ B01 = mia–. Типы координации лигандов и опирающиеся на них КХФ записаны в соответствии с [20]. Отметим, что указанные гексагонально-бипирамидальные комплексы [UO2(L)3]– являются наиболее характерным типом комплексов U(VI) c анионами одноосновных насыщенных и ненасыщенных органических кислот [1, 21, 22].
Рис. 2.
Строение соединений (CN3H6)3[UO2(CH2ICOO)3]2(NO3) (I) и (CN3H6)3[UO2(CH2ICOO)3]2(OH) (II) в представлении атомов эллипсоидами температурных смещений (р = 50%). Подписаны неводородные атомы независимой части элементарной ячейки. Для II показано основное положение атома иода.

Диоксокатионы ${\text{UO}}_{2}^{{2 + }}$ в изученных моноиодацетатах линейны. Объем полиэдров Вороного–Дирихле (ПВД) атомов урана, имеющих форму гексагональной призмы, для I и II составляет 9.55 и 9.48 Å3 соответственно, что хорошо согласуется со средним значением 9.3(4) Å3, установленным для атомов U(VI) в координационных полиэдрах UOn (n = 5, 6, 7 или 8) [23].
В изученных кристаллах комплексы [UO2(mia)3]– и располагающиеся между ними катионы гуанидиния ${\text{C}}({\text{N}}{{{\text{H}}}_{2}})_{3}^{ + },$ нитрат- (структура I) или гидроксид-ионы (структура II) связаны между собой в псевдогексагональные сдвоенные слои, параллельные плоскости (001) (рис. 3), за счет совокупности электростатических и невалентных взаимодействий. Анализ межмолекулярных невалентных взаимодействий проводили с помощью метода молекулярных полиэдров Вороного–Дирихле (ММПВД) [24] на примере структуры I (табл. 3), в которой отсутствует статистическое размещение атомов (в II некоторые атомы неметаллов разупорядочены, что затрудняет анализ с помощью ММПВД).
Рис. 3.
Фрагмент слоя в структуре кристаллов (CN3H6)3[UO2(CH2ICOO)3]2(NO3) (I): а – проекция слоя на плоскость (001); б – проекция слоя вдоль направления [110].

Таблица 3.
| Контакт A/Z | kAZ | d, Å | SAZ, Å2 | ΔAZ, % |
|---|---|---|---|---|
| I/I | 30 | 4.498–4.609 | 64.82 | 5.25 |
| O/I | 48 | 3.320–4.538 | 101.99 | 8.26 |
| N/I | 48 | 3.614–4.387 | 31.99 | 2.59 |
| C/I | 36 | 3.964–4.626 | 45.18 | 3.66 |
| H/I | 120 | 3.279–4.737 | 196.87 | 15.94 |
| O/O | 18 | 3.024–3.484 | 19.07 | 1.54 |
| N/O | 4 | 2.755–2.755 | 7.30 | 0.59 |
| H/O | 192 | 2.072–4.037 | 525.22 | 42.53 |
| H/N | 48 | 2.659–4.519 | 28.29 | 2.29 |
| H/C | 72 | 2.814–3.556 | 30.87 | 2.50 |
| H/H | 120 | 2.270–4.574 | 183.37 | 14.85 |
| Сумма | 736 | 2.072–4.737 | 1234.96 | 100.00 |
* kAZ – общее число граней с РГ = 0 у МПВД состава (CN3H6)3[UO2(CH2ICOO)3]2(NO3); d – диапазон соответствующих межатомных расстояний A/Z; SAZ – общая площадь граней указанного типа у ПВД атомов, содержащихся в одной формульной единице вещества; ΔAZ – парциальный вклад (в процентах) соответствующих невалентных контактов A/Z в величину интегрального параметра 0S = ΣSAZ МПВД (указан в нижней строке).
В кристаллах I содержатся атомы шести химических элементов, поэтому в структуре теоретически возможен 21 тип межмолекулярных контактов, которым должны отвечать грани ПВД нулевого ранга [24]. Однако реально в кристаллах I встречается только 11 типов межмолекулярных контактов. Судя по имеющимся данным, взаимное связывание комплексных ионов [UO2(mia)3]–, ${\text{NO}}_{3}^{ - }$ и ${\text{C}}({\text{N}}{{{\text{H}}}_{2}})_{3}^{ + }$ в 3D-каркас структуры I происходит в основном за счет водородных связей (контакты H/O, H/I, H/N) и дисперсионных взаимодействий (H/H, I/I, H/C, O/O), которым отвечают соответственно суммарные парциальные вклады ΔAZ ~ 61 и 24% (табл. 3). Кроме того, существенную роль во взаимном связывании комплексов [UO2(mia)3]– играют галогенные связи U=O⋅⋅⋅I–C, в которых роль акцептора галогенной связи играет один из атомов кислорода иона уранила. Так, из табл. 3 видно, что парциальный вклад, отвечающий галогенным связям O/I, равен ~8.3% и занимает четвертое место, уступая только межмолекулярным взаимодействиям H/O, H/I и Н/Н. Дополнительным подтверждением связывающей природы галогенных связей U=O⋅⋅⋅I–C является величина телесного угла Ω грани I/O атомного ПВД (12.3 и 13.14% соответственно для I и II), поскольку для ряда галогенных связей с участием атомов брома было показано [25], что величина Ω(I/Y) ≥ 10% дает лишь 2% ложноположительных результатов, а в 98% случаев отвечает контактам, для которых в рамках теории Р. Бейдера “Атомы в молекулах” были обнаружены критические точки связи.
Из двух атомов кислорода иона уранила (О(1) и О(2)) в образовании галогенных связей в I участвует только О1, который образует по три симметрично эквивалентных контакта I(1)⋅⋅⋅O(1)=U c d(I(1)⋅⋅⋅O(1)) = 3.320(3) Å (94.9% суммы ван-дер-ваальсовых радиусов I и O), а угол С(2)–I(1)⋅⋅⋅O(1) равен 167.02(13)°. Аналогичная ситуация наблюдается и в структуре II, в которой d(I(1)⋅⋅⋅O(1)) = = 3.130(5) Å (89.4% суммы ван-дер-ваальсовых радиусов), а углы С(2)–I(1)⋅⋅⋅O(1) равны 169.0(3)°. С учетом уже имеющихся в литературе данных [26, 27] полученные для I и II результаты показывают, что природа иодсодержащих карбоксилат-ионов в комплексах уранила практически не влияет на геометрические характеристики невалентных взаимодействий с участием атомов иода. Так, в структурах комплексов U(VI), включающих иодсодержащие анионы некоторых ароматических карбоновых кислот [26, 27], d(I⋅⋅⋅O) лежит в диапазоне 3.05–3.42 Å (соответственно от 87.1 до 97.7% суммы ван-дер-ваальсовых радиусов I и O [28]), при этом угол С–I⋅⋅⋅O изменяется от 174.3° до 163.3°.
Отметим также, что в известных комплексах уранила с ароматическими иодсодержащими карбоксилат-ионами в роли акцептора Y в галогенных связях Y⋅⋅⋅I–C обычно выступает один из двух атомов кислорода иона уранила. При этом во всех охарактеризованных комплексах одним из следствий образования связей U=O⋅⋅⋅I–C является неравноплечность иона уранила, поскольку мостиковая связь U=O в составе фрагмента U=O⋅⋅⋅I длиннее, чем диаметрально противоположная концевая связь U=O. Заметим, что такая же неравноплечность реализуется и в изученных кристаллах с алифатическими карбоксилат-ионами, хотя различие длины связей U=O для них невелико и поэтому в пределах 2σ они совпадают.
Список литературы
Loiseau T., Mihalcea I., Henry N., Volkringer C. // Coord. Chem. Rev. 2014. V. 266–267. № 1. P. 69.
Комплексные соединения урана / Под ред. Черняева И.И. М.: Наука, 1964. 492 с.
The Chemistry of the Actinide and Tranactinide Elements / Eds. Morss L.R. et al. Springer, 2006. Ch. 10–12. P. 1444.
Корольков Д.В., Скоробогатов Г.А. Теоретическая химия. СПб.: Изд-во СПбГУ, 2005. 503 с.
Navaza A., de Rango C. // Acta Crystallogr. 1983. V. 39. P. 1625.
Alcock N.W., Flanders D.J. // Acta Crystallogr. 1986. V. 42. P. 634.
Savchenkov A.V., Uhanov A.S., Grigoriev M.S. et al. // Dalton Trans. 2021. V. 50. P. 4210.
Uhanov A.S., Sokolova M.N., Fedoseev A.M. et al. // ACS Omega. 2021. V. 6. P. 21485.
Desiraju G.R., Ho P.S., Kloo L. et al. // Pure Appl. Chem. 2013. V. 85. P. 1711. https://doi.org/10.1351/PAC-REC-12-05-10
Cavallo G., Metrangolo P., Milani R. et al. // Chem. Rev. 2016. V. 116. P. 2478. https://doi.org/10.1021/acs.chemrev.5b00484
Барташевич Е.В., Цирельсон В.Г. // Успехи химии. 2014. Т. 83. № 12. С. 1181. http://dx.doi.org/RCR4440?locatt=label:RUS
SAINT-Plus (Version 7.68) // Bruker AXS Inc., Madison, Wisconsin, USA. 2007.
SADABS. Bruker AXS Inc., Madison, Wisconsin, USA.
Sheldrick G.M. // Acta Crystallogr. 2015. V. 71A. № 1. P. 3.
Sheldrick G.M. // Acta Crystallogr. 2015. V. 71C. № 1. P. 3.
Cережкин В.Н., Михайлов Ю.Н., Буслаев Ю.А. // Журн. неорган. химии. 1997. Т. 42. № 12. С. 2036.
Nakamoto K. Infrared and Raman Spectra of Inorganic and Coordination Compounds. Hoboken: John Wiley & Sons. Inc., 2009. Part B. 419 p.
Katon J.E., Carll T.P. // J. Mol. Struct. 1971. V. 7. P. 391.
Drozd M. // Mater. Sci. Eng. 2007. V. B136. P. 20.
Serezhkin V.N., Vologzhanina A.V., Serezhkina L.B. et al. // Acta Crystallogr. 2009. V. B65. Part 1. P. 45.
Сережкина Л.Б., Григорьев М.С., Клепов В.В. и др. // Кристаллография. 2019. Т. 64. № 2. С. 252. [Serezhkina L.B., Grigoriev M.S., Klepov V.V. et al. // Crystallography Reports. 2019. V. 64. № 2. Р. 270.]
Klepov V.V., Serezhkina L.B., Serezhkin V.N., Alekseev E.V. // J. Solid State Chem. 2016. V. 244. P. 100.
Serezhkin V.N., Savchenkov A.V., Pushkin D.V., Serezhkina L.B. // Appl. Solid State Chem. 2018. № 2. P. 2.
Serezhkin V.N., Savchenkov A.V. // Cryst. Growth Des. 2020. V. 20. P. 1997. https://doi.org/10.1021/acs.cgd.9b01645
Vologzhanina A.V., Buikin P.A., Korlyukov A.A. // CrystEngComm. 2020. V. 22. P. 7361. https://doi.org/10.1039/D0CE00288G
Kalaj M., Carter K.P., Cahill C.L. // Acta Crystallogr. 2017. V. B73. P. 234. https://doi.org/10.1107/S2052520617001639
Carter K.P., Kalaj M., McNeil S. et al. // Inorg. Chem. Front. 2021. V. 8. P. 1128. https://doi.org/10.1039/D0QI01319F
Bondi A. // J. Phys. Chem. 1964. V. 68. № 3. P. 441.
Дополнительные материалы
- скачать ESM.docx
- Table S1. Assignement of absorption bands in IR spectra (CN3H6)3[UO2(CH2ICOO)3]2(NO3) (I) and (CN3H6)3[UO2(CH2ICOO)3]2(OН) (II)
Инструменты
Журнал неорганической химии