Журнал неорганической химии, 2022, T. 67, № 4, стр. 466-475
Влияние аминокислот на состав и дисперсность карбоната кальция, осажденного в желчи
С. С. Леончук a, *, О. А. Голованова a
a Омский государственный университет им. Ф.М. Достоевского
644050 Омск, пр-т Мира, 11, Россия
* E-mail: ssleonchuk@yandex.ru
Поступила в редакцию 09.08.2021
После доработки 11.10.2021
Принята к публикации 13.10.2021
- EDN: AQSZYI
- DOI: 10.31857/S0044457X22040110
Аннотация
Проведено экспериментальное моделирование процесса кристаллизации карбоната кальция в модельном растворе желчи человека. Получены образцы CaCO3 в присутствии гистидина (His), аргинина (Arg), метионина (Met) и триптофана (Trp) при варьировании их концентраций. Методами рентгенофазового анализа и ИК-фурье-спектроскопии установлен фазовый и структурно-групповой состав синтезированных образцов. Определено содержание CaCO3 в составе полученных порошков, их дисперсность и объемные доли размерных фракций. Максимальный выход в пересчете на беспримесный CaCO3 имеют образцы, полученные в присутствии Arg, минимальный выход – в присутствии Met. Повышение концентрации аминокислоты приводит к росту массовой доли карбоната кальция в синтезах с His и Arg и к ее снижению в синтезах с Met и Trp. Основной компонент фазового состава всех полученных порошков представлен метастабильной модификацией CaCO3 – ватеритом. С ростом концентрации аминокислот Arg и Met в желчи отмечено увеличение массовой доли арагонита в составе твердой фазы. Установлено, что микрочастицы карбоната кальция радиусом <10 мкм представлены тремя размерными фракциями. С ростом концентрации аминокислот His и Trp в модельном растворе желчи выявлено увеличение доли мелкоразмерной фракции и снижение доли крупноразмерных при возрастании радиусов частиц всех фракций.
ВВЕДЕНИЕ
Ионы кальция играют важную роль во многих биохимических и бионеорганических процессах в организме человека, особое место они занимают в минерализации костной и зубной тканей, а также в процессах патогенного минералообразования [1–3]. Актуальность изучения данных процессов сложно переоценить, поскольку за последние несколько десятков лет сформировалось целое направление в современной науке о материалах, связанное с патологическими кристаллами [4].
К таким кристаллам относятся, в частности, желчные камни (холелиты), образование которых в организме человека приводит к желчнокаменной болезни (холелитиазу). При этом важную роль играют состав желчи и концентрация различных ее компонентов [2, 5, 6]. Особое значение при формировании желчных камней имеет процесс образования микрокристаллов карбоната кальция, свойства которых (фазовый состав, морфология, размер частиц) тесно связаны с кристаллизацией холестерина из желчи и, как следствие, с ростом холелитов, что является главным фактором в определении механизма образования желчных камней [1, 2, 6]. Этот факт также подтверждается недавними исследованиями процессов кристаллизации карбоната кальция, согласно которым в отсутствие неорганических солей кальция самопроизвольная нуклеация холестерина невозможна, так как она требует пересыщения раствора ~300%. Такая концентрация холестерина в желчи человека невозможна физиологически, поэтому нуклеация холестерина происходит в результате гетерогенной кристаллизации с участием карбоната и билирубината кальция [1, 7, 8].
В норме в состав желчи человека входят как неорганические (ионы), так и органические компоненты (желчные кислоты, лецитин, холестерин, билирубин и др.), составляющие основу сухого остатка [3, 9, 10].
Полиморфный по своей природе карбонат кальция характеризуется существованием трех различных кристаллических модификаций: кальцит (стабилен), арагонит и ватерит (метастабильны) [11].
Важно отметить, что в неорганической составляющей желчных камней преобладающей фазой является именно метастабильная модификация карбоната кальция – ватерит, а арагонит и кальцит содержатся в холелитах в примесных количествах, что непосредственно связано с условиями протекания процесса кристаллизации CaCO3 [4–7, 12, 13].
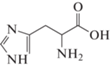
Математическое моделирование, проведенное в исследовании [14], показывает, что аминокислоты гистидин (His), аргинин (Arg), метионин (Met) и триптофан (Trp) в составе пептида имеют сильные межфазные связи Ca–O, а также водородные связи O···H с поверхностью (001) арагонита, т.е. теоретически могут стабилизировать образование данной кристаллической модификации при осаждении CaCO3 из раствора.
Однако теоретические расчеты требуют экспериментального подтверждения. Интерес представляет влияние данных аминокислот на карбонат кальция, осаждаемый из желчи, потому что, как было отмечено ранее, в данных условиях обычно происходит формирование ватерита. Перевод CaCO3 в другую фазу при его кристаллизации в естественных условиях в организме человека может снизить стабильность образующихся микрочастиц, привести к ингибированию кристаллизации холестерина. Известно также, что при различных билиарных патологиях (в том числе при ЖКБ) наблюдается изменение концентрации аминокислот в желчи и крови [15].
Детальное исследование механизма и условий кристаллизации CaCO3, образующегося в реальных условиях в организме человека, можно проводить путем экспериментального моделирования данного процесса, а именно – синтеза и анализа получаемых образцов [2, 16–20]. Некоторые из используемых методов синтеза неорганических соединений кальция применяются и в создании современных наноматериалов [21–24].
Цель настоящей работы – экспериментальное исследование влияния аминокислот гистидина (His), аргинина (Arg), метионина (Met) и триптофана (Trp) при варьировании их концентраций на состав и свойства карбоната кальция, осаждаемого из желчи.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Подбор модельных концентраций
Модельные концентрации. Концентрация свободных аминокислот (АК) в желчи человека зависит от их концентрации в плазме крови и, как правило, имеет близкие значения [25]. В работе [26] для изучения стабилизирующей активности аминокислот по отношению к образованию ватерита из водного раствора использовали данные АК с концентрацией 10–50 ммоль/л, что на 1–2 порядка больше концентрации АК в плазме крови.
Для повышения точности и воспроизводимости результатов экспериментального моделирования в работе при синтезе CaCO3 использовали модельные концентрации ионов Ca2+, ${\text{HCO}}_{3}^{ - }$ и аминокислот, в 10 раз превышающие средние концентрации этих же веществ в желчи человека. Такое пропорциональное увеличение сохраняет соотношения между концентрациями исследуемых веществ, не превышая при этом суммарную ионную силу раствора желчи, содержащего в норме и другие ионы, и позволяет проводить синтез CaCO3 в малых объемах.
Как указано ранее, в исследовании будут рассмотрены только четыре аминокислоты, которые представляют интерес с точки зрения их влияния на кристаллизацию и фазообразование CaCO3. Для удобства основная информация об этих АК представлена в табл. 1.
Для синтеза карбоната кальция использовали гидрокарбонат натрия и дигидрат хлорида кальция как наиболее подходящие по химическому составу желчи человека. Информация об их концентрации с пересчетом на модельные условия представлена в табл. 2.
Синтез карбоната кальция
План эксперимента. Исследование влияния аминокислот на процесс кристаллизации CaCO3 проводили путем варьирования модельных концентраций АК при постоянных модельных концентрациях ионов Ca2+ и ${\text{HCO}}_{3}^{ - }$ и pH в реакционной смеси. Варьирование концентраций АК осуществляли путем кратного изменения модельной концентрации в 0.5, 2 и 10 раз (табл. 3). Синтезы 2 и 3 отличались только объемами при прочих равных условиях, это необходимо для проверки воспроизводимости результатов экспериментального моделирования. Таким образом, для исследования влияния каждой из аминокислот синтезировано по пять образцов CaCO3. Получены также два образца CaCO3 в отсутствие аминокислот при прочих равных условиях.
Таблица 3.
Кодировка названий образцов CaCO3 с АК
| № п/п | 1 | 2 | 3 | 4 | 5 |
|---|---|---|---|---|---|
| C(АК) | 0.5Cмод | 1Cмод | 2Cмод | 10Cмод | |
| V(синтеза), мл | 200 | 200 | 100 | 200 | 200 |
| Аминокислота | Название образца CaCO3 | ||||
| His (H) | H1 | H2 | H3 | H4 | H5 |
| Arg (R) | R1 | R2 | R3 | R4 | R5 |
| Met (M) | M1 | M2 | M3 | M4 | M5 |
| Trp (W) | W1 | W2 | W3 | W4 | W5 |
Поскольку эксперимент подразумевает получение большого числа однотипных образцов, проводили кодирование их названий. Для этого каждому синтезу (образцу) присваивали определенный порядковый номер (в порядке увеличения концентрации) и букву (однобуквенное обозначение соответствующей аминокислоты, использованной в синтезе), табл. 3.
Общая схема синтеза. Перед проведением синтеза готовили модельный раствор желчи: сухую желчь для биохимии (желчь КРС сухая, очищенная, ТУ 10.02.01.112-89, Омскреактив) растворяли в дистиллированной воде в концентрации 105 г/л.
Синтез образцов CaCO3 осуществляли по уравнению:
Основные этапы синтеза:
1. Подготовка модельного раствора желчи (200 или 100 мл).
2. Разделение его на две равные части (растворы 1 и 2).
3. Введение необходимого количества NaHCO3 в раствор 1 и CaCl2 · 2H2O и аминокислоты в раствор 2.
4. Добавление раствора 1 из бюретки к раствору 2 на магнитной мешалке, перемешивание в течение 10 мин, доведение pH до 7.0 (с 2 М NaOH или HCl 1 : 1).
5. Введение формалина для создания 1%-ной концентрации формальдегида в полученном растворе (для консервации желчи).
6. Выдерживание полученного раствора в шкафу-термостате БИОТРОН-4 в течение 7 сут при температуре 310 ± 1 K.
7. Вакуумное фильтрование, осадок на фильтре дважды промывали дистиллированной водой по 50 мл.
8. Сушка осадка в течение 24 ч в шкафу-термостате Биотрон-4 при 310 ± 1 K, затем 24 ч в эксикаторе при комнатной температуре до постоянной массы (для удаления всей химически не связанной воды).
9. Взвешивание сухого обезвоженного порошка для определения выхода, далее его физико-химические исследования.
Рентгенофазовый анализ (РФА) полученных образцов проводили на рентгеновском дифрактометре ДРОН-3М (Россия) методом порошковой дифрактометрии в CuKα-излучении в интервале углов 2θ от 10° до 60° с шагом 0.2°. Качественный и количественный анализ фазового состава образцов осуществляли в программе Match! 3 (Crystal Impact, Германия) на основе открытой кристаллографической базы данных (COD, 2020). Графическое представление дифрактограмм получено при помощи программ MS Excel 2019 и OriginPro 2021.
ИК-фурье-спектроскопию полученных порошков проводили на спектрофотометре ФСМ-2202 (Инфраспек, Россия) таблетированием с KBr с применением оригинального программного обеспечения FSpec. Разрешение получаемых спектров – 4 см−1, область сканирования – от 400 до 4000 см–1. Обработку ИК-спектров выполняли в программах MS Excel 2019 и OriginPro 2021 с использованием спектральных баз данных SDBS (Aist, Япония) и ICSD (Nist, США), а также литературных источников ИК-спектров неорганических соединений [9, 28–31].
Оптическая микроскопия синтезированных образцов выполнена с помощью микроскопа XSZ-107 (Армед, Россия), оборудования ToupCam (ToupTek, Китай) с фотоматрицей 3.1 Мп и программы ToupView.
Определение гидродинамических радиусов частиц методом фотонной корреляционной спектроскопии (ФКС) в полученных образцах осуществляли на анализаторе размера частиц Photocor Compact (Фотокор, Россия) с применением оригинального пакета программ: Photocor-FC для управления измерениями и DynaLS для последующей обработки корреляционных функций (ГОСТ Р 8.774-2011). В качестве жидкой фазы для приготовления суспензий из исследуемых порошков использовали дистиллированную воду, очищенную при помощи шприцевого фильтра Chromafil Xtra PET (Macherey-Nagel, Германия) с порами 200 нм. Концентрация анализируемых суспензий составляла 0.1 мг/мл. Порошки диспергировали в ультразвуковой ванне Ultrasonic Cleaner JP-010S (Skymen, Китай) на частоте 40 кГц в течение 10 мин.
Определение содержания ионов Ca2+ в пересчете на CaCO3 в твердой фазе методом комплексонометрического титрования полученных порошков с предварительным переводом проб в раствор проводили по методике, разработанной на основе ГОСТ 21138.5-78 и ГОСТ 23268.5-78 и адаптированной под исследуемый объект. Обработка результатов выполнена с помощью программ MS Excel 2019 и OriginPro 2021.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Комплексонометрическим методом установлено содержание кальция, пересчитанное на беспримесный стехиометрический CaCO3 в составе синтезированных образцов. Полученные данные статистически обработаны и представлены в виде доверительных интервалов в табл. 4. Для каждой серии синтезов результаты проверены однофакторным дисперсионным анализом, достоверно установившим наличие зависимостей.
Таблица 4.
Содержание CaCO3 в синтезированных образцах в пересчете с содержания Ca2+, установленного комплексонометрически
| Амино-кислота | С(АК) | Образец | ω(CaCO3), % |
|---|---|---|---|
| Без АК | 0Cмод | 01 | 42.9 ± 0.4 |
| 02 | 41.2 ± 0.4 | ||
| Среднее | 42.1 ± 0.7 | ||
| His (H) | 0.5Cмод | H1 | 43.6 ± 1.0 |
| 1Cмод | H2 | 46.9 ± 0.9 | |
| H3 | 46.3 ± 0.7 | ||
| Среднее | 46.6 ± 0.5 | ||
| 2Cмод | H4 | 52.2 ± 1.2 | |
| 10Cмод | H5 | 50.3 ± 1.6 | |
| Met (M) | 0.5Cмод | M1 | 40.1 ± 0.6 |
| 1Cмод | M2 | 38.4 ± 0.4 | |
| M3 | 39.8 ± 0.5 | ||
| Среднее | 39.1 ± 0.6 | ||
| 2Cмод | M4 | 34.3 ± 0.7 | |
| 10Cмод | M5 | 32.3 ± 0.4 | |
| Arg (R) | 0.5Cмод | R1 | 45.0 ± 0.6 |
| 1Cмод | R2 | 48.2 ± 1.7 | |
| R3 | 49.0 ± 0.9 | ||
| Среднее | 48.6 ± 0.8 | ||
| 2Cмод | R4 | 52.7 ± 0.8 | |
| 10Cмод | R5 | 58.5 ± 1.3 | |
| Trp (W) | 0.5Cмод | W1 | 40.4 ± 0.8 |
| 1Cмод | W2 | 35.6 ± 1.3 | |
| W3 | 36.8 ± 1.4 | ||
| Среднее | 36.2 ± 0.9 | ||
| 2Cмод | W4 | 31.2 ± 1.7 | |
| 10Cмод | W5 | 32.9 ± 1.2 | |
| Среднее содержание по всем образцам | ~ 42.7 | ||
Содержание карбоната кальция варьируется. В синтезах с His и Arg наблюдается рост содержания CaCO3 в твердой фазе при увеличении концентрации этих аминокислот в желчи. Это может быть связано с тем, что данные аминокислоты имеют основный характер. Met и Trp не имеют какого-либо сходства в своем строении и кислотно-основных свойствах, однако проявляют схожий эффект по отношению к карбонату кальция: содержание последнего в образцах уменьшается при увеличении концентрации этих аминокислот, т.е. они ингибируют кристаллизацию CaCO3.
Для синтезов с Met и Arg зависимости ω(CaCO3) от концентрации АК в желчи имеют экспоненциальный вид, это видно из коэффициентов корреляции при наложении такой зависимости на имеющиеся точки (рис. 1).
Рис. 1.
Зависимости содержания CaCO3 (в пересчете с содержания Ca2+) в синтезированных образцах от концентрации Met (M) и Arg (R) в желчи.

Исследование образцов методом качественного РФА показало присутствие ватерита в качестве основной фазы в составе всех образцов, пики при углах 2θ = 24.9°, 27.0°, 32.7°, 44.5°, 50.0° являются наиболее интенсивными и визуально различимыми. Арагонит (2θ = 26.3°, 27.3°, 38.5°, 33.2°, 36.2°, 43.0°, 46.0° и др.) и кальцит (2θ = 29.4°, 39.5°, 43.1°, 48.5° и др.) также обнаружены во всех порошках, однако в значительно меньшем количестве. Дифрактограммы всех синтезированных образцов CaCO3 имеют почти идентичный вид, отличаясь лишь небольшим набором пиков и их относительной интенсивностью. На рис. 2 представлены дифрактограммы порошков, полученных в присутствии аргинина. Для всех линеек синтезов можно отметить смещение характеристических углов отражения в область меньших углов 2θ (максимальный сдвиг ~1.5°) без изменения общего вида дифрактограмм при повышении концентрации аминокислот в желчи, что свидетельствует об увеличении межплоскостных расстояний в кристаллической структуре образующейся кристаллической фазы CaCO3. Это может быть вызвано внедрением в кристаллическую структуру карбоната кальция объемных анионов аминокислотных остатков.
Рис. 2.
Дифрактограммы образцов CaCO3, полученных в присутствии Arg в желчи (А – арагонит, В – ватерит, К – кальцит).

Более подробный количественный РФА установил содержание ватерита, арагонита и кальцита в кристаллической фазе. В табл. 5 видно изменение содержания арагонита в полученных порошках.
Таблица 5.
Фазовый состав образцов (%), установленный методом РФА (А – арагонит, В – ватерит, К – кальцит)
| С(АК)мод | 0CАК | 0.5CАК | 1CАК | 2CАК | 10CАК | |||
|---|---|---|---|---|---|---|---|---|
| код образца | X0 | X1 | X2 | X3 | Среднее | X4 | X5 | |
| Аминокислота (X) | His (H) | 85.0 В 12.5 А 2.5 К |
80.7 В 12.5 А 6.8 К |
92.1 В 7.5 А 0.4 К |
87.4 В 7.5 А 5.1 К |
89.8 В 7.5 А 2.7 К |
89.5 В 3.0 А 7.5 К |
88.8 В 3.7 А 7.5 К |
| Met (M) | 82.4 В 8.5 А 9.1 К |
79.3 В 8.7 А 12.0 К |
80.7 В 6.6 А 12.7 К |
80.0 В 7.7 А 12.3 К |
83.0 В 9.2 А 7.8 К |
73.2 В 19.1 А 7.7 К |
||
| Arg (R) | 82.4 В 9.8 А 7.8 К |
81.3 В 10.7 А 8.0 К |
86.5 В 8.9 А 4.6 К |
83.9 В 9.8 А 6.3 К |
78.1 В 12.8 А 9.1 К |
66.0 В 23.1 А 10.9 К |
||
| Trp (W) | 78.2 В 11.3 А 10.5 К |
84.7 В 11.8 А 3.5 К |
89.2 В 8.0 А 2.8 К |
86.9 В 9.9 А 3.2 К |
79.3 В 15.0 А 5.7 К |
88.1 В 9.5 А 2.4 К |
||
Интерес представляет наличие зависимости (достоверно установлен дрейф) между содержанием арагонита в твердой фазе и концентрацией аминокислоты в желчи для синтезов с Met и Arg: содержание фазы арагонита увеличивается с ростом концентрации данных аминокислот. Для образцов CaCO3 с His наблюдается обратная зависимость. Для синтезов в желчи с Trp таковая зависимость отсутствует.
Результаты ИК-фурье-спектроскопии коррелируют с данными предыдущих анализов. ИК-спектры полученных образцов содержат все характеристические колебания треугольного аниона ${\text{CO}}_{3}^{{2 - }}{\text{:}}$ невырожденное полносимметричное валентное колебание ν1 (νs) при 1040–1110 см–1; дважды вырожденное симметричное деформационное колебание ν2 (δs) при 856–875 см–1; трижды вырожденное асимметричное валентное колебание ν3 (νas) при 1408–1490 см–1; трижды вырожденное деформационное колебание ν4 (δas) при 700–745 см–1.
Остальные полосы в ИК-спектрах характеризуют функционально-групповой состав органической составляющей полученных порошков. Для всех образцов характерно наличие пиков при 2800–3000 см–1, включающих валентные колебания связей С–H, перекрывающиеся с валентными колебаниями связи N–H, характерными для билирубина, лецитина и аминокислот. Во всех спектрах при 3200–3700 см–1 наблюдается широкая полоса колебаний связи O–H, включенной в водородную связь, характерная для холестерина и лецитина. При 2350 см–1 наблюдаются паразитные пики валентных колебаний связи C=O углекислого газа воздуха. В области 1500–1600 см–1 присутствует набор пиков, отвечающих валентным колебаниям карбоксилат-аниона O–C–O– и деформационным колебаниям связи N–H в билирубине и группы ${\text{NH}}_{3}^{ + }$ в аминокислотах.
Важно, что в сериях синтезов с Met и Trp для полученных образцов не наблюдается каких-либо значимых качественных изменений в соответствующих ИК-спектрах. В данном случае концентрация аминокислот недостаточна для их влияния на структурно-групповой состав получаемых порошков. В синтезах с His и Arg (рис. 3) действие аминокислот более явное: с увеличением их концентрации в желчи происходит рост интенсивности колебаний при 875 см–1 и 1480–1490 см–1, указывающий на повышение доли карбоната кальция в составе твердой фазы, причем полоса колебаний ν3 принимает вид, характерный для арагонита, что коррелирует с данными определения ω(CaCO3) в твердой фазе и результатами РФА. С ростом концентрации аминокислот становятся также более интенсивными пики деформационных колебаний группы ${\text{NH}}_{3}^{ + }$ и валентных колебаний группы O–C–O– при 1540–1640 см–1, что может говорить о повышении содержания данных аминокислот в составе синтезированных порошков, где они могут присутствовать как в свободном виде в смеси с аморфной и органической фазами, так и в адсорбированном состоянии на поверхности кристаллических фаз карбоната кальция.
Данные оптической микроскопии подтверждают результаты всех предыдущих исследований: основу всех образцов составляют сферолитические микрочастицы ватерита (до ~10 мкм) [2, 5].
В образцах, синтезированных с His и Met, наблюдается большое количество агломерированных частиц и аморфных включений органической природы, число сферолитов ватерита уменьшается с увеличением концентрации данных аминокислот в желчи. Для образцов, полученных в присутствии Arg и Trp (рис. 4), наблюдается наибольшее число сферических частиц ватерита, причем с ростом концентрации этих аминокислот в желчи происходит увеличение числа таких частиц и уменьшение их размера.
Методом ФКС установлены размеры и объемные доли частиц во фракциях порошка размером <10 мкм для всех исследуемых образцов. Результаты измерений каждого из синтезированных порошков представлены в табл. 6 в виде доверительных интервалов. Для большинства образцов наблюдается тримодальное распределение частиц по размерам. Таким образом, порошки характеризуются наличием трех фракций: I фракция – частицы радиусом порядка сотых микрометра; II фракция – частицы радиусом порядка десятых микрометра; III фракция – частицы радиусом порядка единиц микрометра. В образцах 01, 02, H1, H2, H3, M1, M4, M5) распределение частиц по размерам носит бимодальный характер.
Таблица 6.
Радиусы частиц (r) и объемные доли (w) их фракций в образцах
| АК | C(АК) | Образец | Номер фракции | |||||
|---|---|---|---|---|---|---|---|---|
| I | II | III | ||||||
| r, мкм | w, % | r, мкм | w, % | r, мкм | w, % | |||
| Без АК | 0Cмод | 01 | – | – | 0.14 ± 0.02 | 27.8 ± 5.6 | 4.6 ± 0.6 | 72.2 ± 7.9 |
| 02 | – | – | 0.16 ± 0.02 | 29.8 ± 2.7 | 4.9 ± 0.3 | 70.2 ± 5.1 | ||
| Среднее | – | – | 0.15 ± 0.01 | 28.8 ± 2.8 | 4.7 ± 0.3 | 71.2 ± 3.8 | ||
| His (H) | 0.5Cмод | H1 | – | – | 0.19 ± 0.01 | 47.1 ± 7.6 | 5.5 ± 0.5 | 52.9 ± 3.0 |
| 1Cмод | H2 | – | – | 0.19 ± 0.02 | 41.1 ± 5.9 | 4.1 ± 0.5 | 58.9 ± 7.3 | |
| H3 | – | – | 0.19 ± 0.01 | 39.8 ± 6.5 | 3.9 ± 0.4 | 60.2 ± 6.6 | ||
| Среднее | – | – | 0.19 ± 0.01 | 40.4 ± 3.7 | 4.0 ± 0.2 | 59.6 ± 4.4 | ||
| 2Cмод | H4 | 0.042 ± 0.006 | 8.8 ± 1.1 | 0.28 ± 0.04 | 49.6 ± 6.4 | 3.8 ± 0.7 | 41.6 ± 5.0 | |
| 10Cмод | H5 | 0.049 ± 0.002 | 23.4 ± 1.8 | 0.55 ± 0.05 | 36.9 ± 4.6 | 5.8 ± 0.3 | 39.7 ± 4.1 | |
| Met (M) | 0.5Cмод | M1 | – | – | 0.12 ± 0.02 | 23.7 ± 2.8 | 6.1 ± 0.8 | 76.3 ± 4.3 |
| 1Cмод | M2 | 0.044 ± 0.011 | 12.9 ± 4.5 | 0.24 ± 0.03 | 47.0 ± 2.0 | 5.2 ± 0.8 | 40.1 ± 3.7 | |
| M3 | 0.043 ± 0.007 | 12.8 ± 1.7 | 0.23 ± 0.03 | 50.9 ± 1.2 | 4.8 ± 0.8 | 36.3 ± 1.6 | ||
| Среднее | 0.044 ± 0.005 | 12.9 ± 2.0 | 0.23 ± 0.02 | 48.9 ± 1.8 | 5.0 ± 0.5 | 38.2 ± 2.0 | ||
| 2Cмод | M4 | – | – | 0.18 ± 0.02 | 35.3 ± 3.8 | 4.8 ± 0.7 | 64.7 ± 4.9 | |
| 10Cмод | M5 | – | – | 0.15 ± 0.01 | 26.1 ± 2.4 | 4.2 ± 0.4 | 73.9 ± 1.8 | |
| Arg (R) | 0.5Cмод | R1 | 0.055 ± 0.009 | 4.4 ± 0.9 | 0.24 ± 0.03 | 49.8 ± 4.5 | 4.8 ± 0.6 | 45.8 ± 2.9 |
| 1Cмод | R2 | 0.039 ± 0.003 | 2.4 ± 0.4 | 0.21 ± 0.01 | 59.7 ± 1.4 | 3.5 ± 0.3 | 37.9 ± 1.9 | |
| R3 | 0.031 ± 0.009 | 3.2 ± 0.8 | 0.22 ± 0.03 | 57.0 ± 3.0 | 3.7 ± 0.4 | 39.8 ± 2.1 | ||
| Среднее | 0.034 ± 0.006 | 2.3 ± 0.3 | 0.22 ± 0.01 | 58.4 ± 2.3 | 3.6 ± 0.2 | 38.8 ± 1.2 | ||
| 2Cмод | R4 | 0.035 ± 0.007 | 1.8 ± 0.4 | 0.21 ± 0.03 | 40.3 ± 4.1 | 4.6 ± 0.5 | 57.9 ± 2.4 | |
| 10Cмод | R5 | 0.039 ± 0.004 | 6.0 ± 1.5 | 0.23 ± 0.04 | 36.4 ± 4.5 | 4.1 ± 0.4 | 57.7 ± 3.5 | |
| Trp (W) | 0.5Cмод | W1 | 0.036 ± 0.003 | 8.3 ± 1.1 | 0.27 ± 0.03 | 36.9 ± 3.4 | 7.0 ± 0.4 | 54.8 ± 2.8 |
| 1Cмод | W2 | 0.053 ± 0.006 | 2.3 ± 0.7 | 0.22 ± 0.01 | 43.3 ± 3.8 | 7.8 ± 1.3 | 54.4 ± 6.4 | |
| W3 | 0.045 ± 0.005 | 1.8 ± 0.4 | 0.24 ± 0.01 | 46.1 ± 5.2 | 7.0 ± 0.9 | 52.1 ± 3.4 | ||
| Среднее | 0.049 ± 0.004 | 2.1 ± 0.4 | 0.23 ± 0.01 | 44.7 ± 2.8 | 7.4 ± 0.7 | 53.2 ± 3.1 | ||
| 2Cмод | W4 | 0.042 ± 0.001 | 1.8 ± 0.6 | 0.25 ± 0.03 | 38.6 ± 4.5 | 7.1 ± 1.1 | 59.6 ± 4.9 | |
| 10Cмод | W5 | 0.042 ± 0.004 | 16.2 ± 1.7 | 0.26 ± 0.02 | 46.7 ± 1.7 | 9.1 ± 1.3 | 37.1 ± 2.6 | |
По фракционному составу полученных образцов CaCO3 методом однофакторного дисперсионного анализа можно определить наличие зависимостей между концентрацией аминокислот в желчи, размером частиц каждой фракции и их объемной долей в составе общей фракции радиусом до 10 мкм.
В синтезе с His при увеличении концентрации аминокислоты в желчи происходит рост размера частиц фракций II и III, понижение их содержания и увеличение доли фракции I (ее появление в составе осадков наблюдается при увеличении Смод гистидина до 2Смод и 10Смод).
В серии образцов, полученных с Met, фракция I появляется только при концентрации метионина 1Смод. Размер частиц практически не изменяется (незначительно снижается после скачкообразного увеличения при 1Смод) при увеличении концентрации Met в желчи, однако содержание фракций II и III варьируется, при 1Смод происходит скачкообразное изменение их содержания.
Образцы, полученные в присутствии Arg, характеризуются полным набором всех трех фракций. Радиусы частиц практически не изменяются при увеличении концентрации аминокислоты в желчи, однако средний размер фракции I достоверно отличается от размера частиц, полученных в отсутствие аминокислот. Для фракций II и III наблюдается скачкообразное изменение их долей при 1Смод аргинина с повышением доли фракции II и снижением доли фракции III при дальнейшем введении АК.
Синтезированные с Trp осадки характеризуются фракцией I, достоверно большей по размерам, чем образцы без АК, при этом с ростом концентрации Trp размеры фракций I и II практически не изменяются, а размер фракции III возрастает. Доля фракций I и II снижается, а III – увеличивается при повышении концентрации Trp в желчи. Такой эффект снижения доли “крупных” частиц и повышения доли “малых” может иметь ингибирующее действие на рост и агрегацию образующихся холелитов.
ЗАКЛЮЧЕНИЕ
Cинтезировано 22 образца карбоната кальция в желчи при варьировании концентрации аминокислот His, Met, Arg и Trp.
Комплексонометрическим титрованием установлено содержание кальция в пересчете на CaCO3 в составе твердой фазы всех синтезированных образцов. Максимальный выход по CaCO3 имеют образцы, полученные с Arg, минимальный – с Met. Повышение концентрации аминокислоты приводит к росту массовой доли карбоната кальция в случае с His и Arg и к ее снижению в синтезах с Met и Trp. Замечено ингибирующее действие Met на кристаллизацию CaCO3 и образование осадка в желчи в целом.
С помощью РФА установлено, что основным компонентом фазового состава всех полученных порошков является ватерит. Для аминокислот Met и Arg доказан их стабилизирующий эффект по отношению к метастабильному арагониту: с ростом их концентрации в желчи происходит увеличение массовой доли арагонита в составе твердой фазы. Это может иметь ингибирующий эффект на дальнейший рост и агрегацию желчных камней, так как арагонит отличается от ватерита своей морфологией, дзета-потенциалом и, как следствие, адгезией к холестерину. Результаты ИК-фурье-спектроскопии коррелируют с данными РФА.
Оптическая микроскопия показала присутствие сферолитов ватерита во всех полученных порошках. Методом ФКС установлено, что микрочастицы карбоната кальция радиусом <10 мкм представлены тремя фракциями. Наибольший интерес представляют синтезы с His и Trp, в которых с ростом концентрации аминокислот наблюдается увеличение доли мелкоразмерной фракции и снижение доли крупноразмерных фракций. Радиус частиц всех фракций при этом возрастает.
Полученные результаты указывают на необходимость дальнейшего исследования минералообразования в желчи человека на модельных системах с целью выявления механизмов, установления функциональных зависимостей и определения причин образования зародышей желчных камней. В дальнейшем планируется исследование влияния рассмотренных в работе аминокислот на состав и свойства CaCO3 в иной области концентраций и при их совместном присутствии.
Список литературы
Тихонов Д.Г. // Якутский медицинский журн. 2015. № 4. С. 91.
Golovanova O.A., Leonchuk S.S. // Russ. J. Inorg. Chem. 2020. V. 65. № 4. P. 449. https://doi.org/10.1134/S0036023620040063
Guyton A.C., Hall J.E. Textbook of Medical Physiology. Elsevier Inc., 2006. 1152 p.
Poloni L.N., Ward M.D. // Chem. Mater. 2014. V. 26. № 1. P. 477. https://doi.org/10.1021/cm402552v
Пальчик Н.А., Столповская В.Н., Мороз Т.Н. и др. // Журн. неорган. химии. 2003. Т. 48. № 12. С. 2080.
Машина Е.В., Макеев Б.А., Филиппов В.Н. // Изв. Томск. политех. ун-та. 2015. Т. 326. № 1. С. 34.
Голованова О.А., Леончук С.С. // Вестник ОмГУ. 2019. Т. 24. № 2. С. 66. https://doi.org/10.25513/1812-3996.2019.24(2).66-73
Neubrand M.W., Carey M.C., Laue T.M. // Biochemistry. 2015. V. 54. № 45. P. 6783. https://doi.org/10.1021/acs.biochem.5b00874
Саблин О.А., Гриневич В.Б., Успенский Ю.П. и др. Функциональная диагностика в гастроэнтерологии. СПб: ВМедА, 2002 г.
Cheng C.-Y., Oh H., Wang T.-Y. et al. // Langmuir. 2014. V. 30. № 34. P. 10221. https://doi.org/10.1021/la502380q
Al Omari M.M.H., Rashid I.S., Qinna N.A. et al. Profiles of Drug Substances, Excipients and Related Methodology. V. 41. Burlington: Academic Press, 2016. 132 p. https://doi.org/10.1016/bs.podrm.2015.11.003
Ros E., Navarro S., Fernandez I. et al. // Gastroenterology. 1986. V. 91. № 3. P. 703. https://doi.org/10.1016/0016-5085(86)90642-6
Yu J.-K., Pan H., Huang S.-M. et al. // Asian J. Surgery. 2013. V. 36. № 1. P. 26. https://doi.org/10.1016/j.asjsur.2012.06.001
Poudel L., Tamerler C., Misra A. et al. // J. Phys. Chem. C. 2017. V. 121. № 51. P. 28354. https://doi.org/10.1021/acs.jpcc.7b10004
Климович И.И., Дорошенко Е.М., Страпко В.П. и др. // Журн. ГрГМУ. 2008. № 1. С. 14.
Evans D., Webb P. B., Penkman K. et al. // Cryst. Growth Des. 2019. V. 19. № 8. P. 4300. https://doi.org/10.1021/acs.cgd.9b00003
Lee S.W., Choi C.S. // Cryst. Growth Des. 2007. V. 7. № 8. P. 1463. https://doi.org/10.1021/cg0700420
Trubitsyn M.A., Hung H.V., Furda L.V. et al. // Russ. J. Inorg. Chem. 2021. V. 66. № 5. P. 654. https://doi.org/10.1134/S0036023621050211
Zakharov N.A., Koval E.M., Aliev A.D. et al. // Russ. J. Inorg. Chem. 2021. V. 66. № 3. P. 305. https://doi.org/10.1134/S0036023621030219
Golovanova O.A. // Russ. J. Inorg. Chem. 2021. V. 65. № 3. P. 305. https://doi.org/10.1134/S0036023620030043
Fakhrullin R.F., Bikmullin A.G., Nurgaliev D.K. // ACS Appl. Mater. Interfaces. 2009. V. 1. № 9. P. 1847. https://doi.org/10.1021/am9003864
Serov N., Darmoroz D., Lokteva A. et al. // Chem. Commun. 2020. V. 56. P. 11969. https://doi.org/10.1039/D0CC05502F
Hou W.-T., Feng Q.-L. // Cryst. Growth Des. 2006. V. 6. № 5. P. 1086. https://doi.org/10.1021/cg0504861
Lauth V., Loretz B., Lehr C.-M. et al. // Chem. Mater. 2016. V. 28. № 11. P. 3796. https://doi.org/10.1021/acs.chemmater.6b00769
Березов Т.Т., Коровкин Б.Ф. Биологическая химия. М.: Медицина, 1998. 704 с.
Hood M.A., Landfester K., Munoz-Espi R. // Cryst. Growth Des. 2014. V. 14. № 3. P. 1077. https://doi.org/10.1021/cg401580y
Марри Р., Греннер Д., Мейес П. и др. Биохимия человека. Пер. с англ. М.: Мир; Бином, 2009. 797 с.
Nakamoto K. Infrared and Raman Spectra of Inorganic and Coordination Compounds. Wiley Online Library, 2008. 419 p. https://doi.org/10.1002/9780470405840
Егоров Н.Б., Шагалов В.В. Инфракрасная спектроскопия редких и рассеянных элементов. Томск: Изд-во ТПУ, 2012. 20 с.
Silverstein R.M., Webster F.X., David J.K. et al. Spectrometric Identification of Organic Compounds. Wiley, 2014. 464 p.
Куражковская В.С., Боровикова Е.Ю. Инфракрасная и мессбауэровская спектроскопия кристаллов. М.: Геологический факультет МГУ, 2008. 98 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии