Журнал неорганической химии, 2022, T. 67, № 4, стр. 502-507
Изучение диаграммы растворимости в системе гипохлорит натрия–хлорид натрия–вода
Ф. Э. Умиров a, *, Г. Р. Номозова a, Ж. М. Шодикулов a
a Навоийский государственный горный институт
210100 Навои, ул. Галаба шох, 127, Узбекистан
* E-mail: Umirov3@yandex.ru
Поступила в редакцию 25.07.2021
После доработки 21.10.2021
Принята к публикации 22.10.2021
- EDN: JBVWGA
- DOI: 10.31857/S0044457X22040201
Аннотация
Показаны результаты изучения процесса растворимости в системе гипохлорит натрия–хлорид натрия–вода. На основании экспериментальных данных о бинарных системах и восьми внутренних разрезах построена диаграмма растворимости системы NаClО–NаCl–H2О в интервале температур от –38.0 до 65.4°С. Из них разрезы I–IV проведены со стороны NаClО–H2O к полюсу NаCl–H2О, а разрезы V–VIII – со стороны NаCl–H2О к вершине NаClО–H2O, на которой разграничены поля кристаллизации льда, NаCl · 2H2О, NаCl, NаClО · 5H2О, NаClО · 2.5H2О и кристаллы безводного NаClО. Установлено, что в этой системе с участием водных растворов NаClО и NаCl образуется новое соединение NаClO3, идентифицированное с помощью рентгенофазового анализа и ИК-спектроскопии.
ВВЕДЕНИЕ
Дефолиация хлопчатника является агротехническим приемом для подготовки хлопчатника к своевременной уборке накопленного урожая хлопка-сырца. Дефолиация – это искусственное удаление листьев, которое обычно производится с помощью химических веществ, вызывающих в растениях процессы, аналогичные происходящим при естественном старении и опадении листьев [1–6].
В настоящее время в Узбекистане и других республиках в хлопководстве в качестве дефолиантов применяются хлораты натрия, магния и трикарбамидохлорат натрия [7–9]. Поэтому получение такого рода дефолиантов с привлечением соединений хлора на основе местного сырья или отходов производства химической промышленности является важнейшей задачей, определенной стратегией развития Республики Узбекистан [10–13].
Известно, что при производстве каустической соды в АО “Навоиазот” образуется до 6500–7000 т/год гипохлорита натрия и более 20 000 т/год хлора. На сегодняшний день это вторичное сырье используется не в полном объеме. Если его переработать до хлората натрия, то можно одновременно решить две проблемы: экологическую и получить дешевую продукцию на основе отходов производства каустической соды [14–17].
Хлораты натрия, магния и кальция – основные хлоратсодержащие дефолианты. Существуют различные способы их получения.
В лабораторных условиях хлорат натрия получают хлорированием растворов соды, едкого натрия и диспропорционированием гипохлорита натрия:
В основе промышленного производства хлората натрия ранее лежало хлорирование известкового молока с частичным выделением избытка хлорида кальция в процессе охлаждения с последующей обработкой хлораткальциевого раствора сульфатом натрия [18–21]:
Описанным способом в промышленном масштабе хлорат натрия был впервые получен во Франции [11].
В настоящее время в промышленности хлорат натрия получают преимущественно электрохимическим окислением хлорида натрия. Известны варианты получения целевого продукта указанным способом как в кристаллическом виде, так и в виде водного раствора [11].
В основе промышленного производства хлората натрия лежит электрохимическое окисление поваренной соли (АО “ФерганаАзот”, Узбекистан). Однако этот процесс является дорогостоящим, так как требует высоких затрат электроэнергии. Поэтому представляет интерес получение гипохлорита натрия из вторичного сырья при производстве каустической соды и изучение диаграммы растворимости системы гипохлорит натрия–хлорид натрия–вода визуально-политермическим методом. На основании результатов изучения системы будет рекомендован процесс получения хлората натрия.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Рассмотрена растворимость в системе гипохлорит натрия–хлорид натрия–вода визуально-политермическим методом в широком интервале температур и концентраций. ИК-спектры регистрировали на спектрометре Irtracer 100 (Shimadzu, Япония) в области частот 400–4000 см–1. Образцы готовили прессованием с КВr [22]. Рентгенофазовый анализ образцов проводили на рентгеновском дифрактометре ДРОН-УМ1 с двумя щелями Соллера (фильтрованное СоKα-излучение, скорость съемки 1 град./мин). Натрий определяли пламенно-фотометрическим методом [23]. Объемный метод определения хлоридов (метод Мора) состоял в осаждении хлора азотнокислым серебром в присутствии индикатора хромовокислого калия [24, 25]. Хлорат-ионы определяли потенциометрическим методом, основанным на их взаимодействии с восстановителями [26].
Для выяснения поведения хлорида натрия с гипохлоритом натрия при их совместном присутствии в водном растворе, а также для обоснования процесса получения эффективных дефолиантов на их основе впервые растворимость в системе NаClО–NаCl–H2О изучена визуально-политермическим методом в интервале температур от –38.0 до 65.4°С. Измерение температуры проводили термометром ТЛ-15 с ценой деления 0.1°С.
На политермической диаграмме растворимости системы NаClО–H2О, изученной в интервале температур от –16.5 до 60°С, установлены ветви кристаллизации льда, NаClО · 5H2О, NаClО · ⋅ 2.5H2О и безводного NаClО, пересекающиеся в эвтектической точке с координатами: 19.2% гипохлорита натрия, температура –16.5°С.
Система гипохлорит натрия–хлорид натрия–вода изучена в диапазоне температур от –38.0 до 65.4°С с помощью восьми внутренних разрезов. Из них разрезы I–IV проведены со стороны NаClО‒H2O к полюсу NаCl–H2О, а разрезы V–VIII – со стороны NаCl–H2О к вершине NаClО–H2O. На основании политерм боковых бинарных систем и внутренних разрезов построена политермическая диаграмма растворимости системы гипохлорит натрия–хлорид натрия–вода, на которой разграничены поля кристаллизации льда, NаCl · 2H2О, NаCl, NаClО · 5H2О, NаClО · 2.5H2О, а также новое соединение NаClO3 (рис. 1).
Указанные поля сходятся в пяти тройных нонвариантных точках совместного существования трех твердых фаз. Для этих точек определены составы равновесного раствора и соответствующие им температуры кристаллизации (табл. 1).
Таблица 1.
Двойные и тройные точки системы хлорид натрия–гипохлорит натрия–вода
| № | Состав жидкой фазы, % | Температура кристал-лизации, °С | Твердая фаза | ||
|---|---|---|---|---|---|
| NаClО | NаCl | H2O | |||
| 1 | 19.2 | – | 80.8 | –16.5 | Лед + NаClО · 5H2О |
| 2 | 18.4 | 8.4 | 73.2 | –18.0 | Лед + NаClО · 5H2О + NаClO3 |
| 3 | 16.0 | 8.3 | 75.7 | –19.5 | Лед + NаClO3 |
| 4 | 9.2 | 13.1 | 77.7 | –21.4 | Лед + NаClO3 |
| 5 | 6.0 | 18.8 | 75.2 | –22.5 | Лед + NаClO3 |
| 6 | 5.1 | 21.5 | 73.4 | –26.0 | Лед + NаCl · 2H2О + NаClO3 |
| 7 | – | 23.5 | 77.1 | –22.2 | Лед + NаCl · 2H2О |
| 8 | 5.8 | 25.1 | 70.1 | –3.2 | NаCl · 2H2О + NаClO3 + NаCl |
| 9 | – | 28.4 | 71.6 | 1.0 | NаCl · 2H2О + NаCl |
| 10 | 5.0 | 28.5 | 66.5 | 40.1 | NаCl + NаClO3 |
| 11 | 6.2 | 37.5 | 56.3 | 63.8 | NаCl + NаClO3 |
| 12 | 6.5 | 39.6 | 53.9 | 65.4 | NаCl + NаClO3 |
| 13 | 18.8 | 7.2 | 74.0 | –15.2 | NаClО · 5H2О + NаClO3 |
| 14 | 39.0 | 3.8 | 57.2 | 11.6 | NаClО · 5H2О + NаClO3 |
| 15 | 50.1 | 3.2 | 46.7 | 18.0 | NаClО · 5H2О + NаClО · 2.5H2О + NаClO3 |
| 16 | 46.0 | – | 54.0 | 23.7 | NаClО · 5H2О + NаClО · 2.5H2О |
| 17 | 55.5 | 3.3 | 41.2 | 28.0 | NаClО · 2.5H2О + NаClO3 |
При изучении системы NaClO–NaCl–H2O по причине испарения воды при высоких температурах точных результатов получить не удалось, поэтому данная система до конца не изучена. На ее диаграмме растворимости при температуре 65°С и выше границы фазовых областей показаны пунктирными линиями.
Известно, что использованное сырье (гипохлорит натрия–хлорид натрия) в растворе имеет щелочную среду, поэтому молекулярный хлор не выделяется.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На политермической диаграмме через каждые 10°С нанесены изотермы растворимости. Построена проекция политермической кривой растворимости на боковые водные стороны системы. Поле кристаллизации соединения NаClO3, образованного взаимодействием исходных компонентов, занимает значительную часть диаграммы. По занимаемой площади кристаллизации можно судить о том, что соединение NаClO3 малорастворимо в данной системе по сравнению с другими компонентами.
Таким образом, в результате исследования гетерогенного равновесия в системе гипохлорит натрия–хлорид натрия–вода установлены температурные и концентрационные пределы выделения соединения NаClO3, идентифицированного методами химического и ренгенофазового анализа, а также ИК-спектроскопии и масс-спектрометрии (рис. 2, 3, табл. 2 ).
Химический анализ твердой фазы, выделенной из предполагаемой области кристаллизации соединения NаClO3, дал следующие результаты:
| Na+ | ${\text{ClO}}_{3}^{ - }$ | Cl– | |
| Найдено, мас. %: | 22; | 76.6; | 1.4. |
| Для NаClO3 | |||
| вычислено, мас. %: | 21.60; | 78.4%. | – |
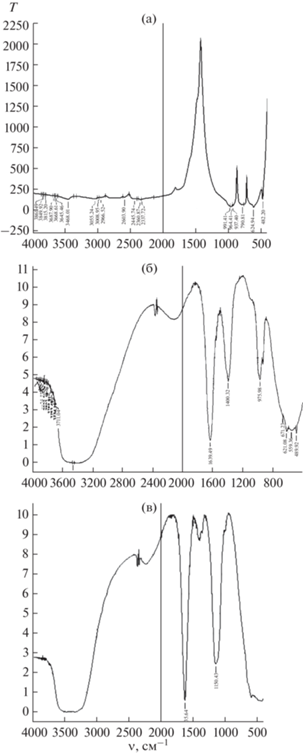
ИК-спектроскопия является одним из методов, применяемых для качественного определения структуры и идентификации новых соединений. В связи с этим для выяснения типов химической связи, места и способа координации исходных молекул NаClО и NаCl, а также выделенного в твердом виде соединения NаClO3 сняты его ИК-спектры и составляющих его компонентов (рис. 2).
В ИК-спектрах NаClО (гипохлорита натрия) присутствуют полосы поглощения в области 3200–3650 см–1, связанные с деформационными колебаниями кристаллизационной воды и гипохлорита натрия (3626 см–1). Деформационные колебания воды наблюдаются в области 1633 см–1. Характерные для NaClO полосы фиксируются при 3630 см–1, симметричные и асимметричные валентные колебания ионов ClO– – при 671–700 см–1 (рис. 2б).
Полосы поглощения ионов ${\text{ClO}}_{3}^{ - }$ наблюдаются в спектрах при 991.4, 964.4, 937, 790.8, 624.9 и 482.2 см–1. Полосы при 991.4, 964.4 и 937 см–1 отвечают симметричным валентным (рис. 2а), при 482.2 см–1 – деформационному, а при 624.9 см–1 – асимметричному деформационному колебаниям ионов ${\text{ClO}}_{3}^{ - },$ что согласуется с данными [22, 23].
На основании данных ИК-спектров можно предположить, что в системе гипохлорит натрия–хлорид натрия–вода образуется соединение NаClO3.
Таким образом, в системе с участием водных растворов NаClО и NаCl образуется новое соединение – NаClO3, идентифицированное методами химического анализа и ИК-спектроскопии. Соединение NаClO3 представляет собой белое кристаллическое вещество, хорошо растворимое в воде при температуре 20–36.5°С, его удельная масса составляет 1.970 г/см3.
Для подтверждения состава полученного соединения выполнен рентгенофазовый анализ. Дифрактограмма представлена на рис. 3. Все рефлексы на дифрактограмме характеризуются собственными углами отражения и набором межплоскостных расстояний, что свидетельствует об индивидуальности полученного хлората натрия и его кристаллической решетки. Идентификация фазового состава проведена в соответствии с картотекой ASTM.
ЗАКЛЮЧЕНИЕ
Полученная в растворе система гипохлорит натрия–хлорид натрия–вода впервые изучена визуально-политермическим методом, разграничены поля кристаллизации льда, NаCl · 2H2О, NаCl, NаClО · 5H2О, NаClО · 2.5H2О, а также соединения NаClO3.
В системе NaClO–NaCl–H2O обнаружено новое соединение NаClO3, которое удалось выделить в кристаллическом виде и идентифицировать с помощью химического, ренгенофазового анализа и ИК-спектроскопии.
Полученные результаты в будущем могут способствовать созданию новой технологической схемы получения дефолиантов из отходов химического производства.
Список литературы
Ажиметова Г.Н. // Современные проблемы науки и образования. 2017. № 1. С. 53.
Умиров Ф.Э. Получение дефолианта на основе хлоратов и органических соединений. Бухара, 2019. 139 с.
Тешаев Ш. // Ўзбекистон қишлоқ хўжалиги журнали. 2006. № 1. С. 14.
Girenko D.V., Gyrenko A.A., Nikolenko N.V. // Int. J. Analyt. Chem. 2019. Art. 2360420. https://doi.org/10.1155/2019/2360420
Тогашаров А.С., Шукуров Ж.С., Тухтаев С. Новые дефолианты на основе хлоратов и техногенных отходов хлопкоочистительных заводов. Навруз, 2019. 156 с.
Raghavendra T., Rama ReddyY. // Ind. J. Agrico. Res. 2020. V. 54. P. 404. https://doi.org//10.18805/IJARe.A-5288
Умиров Ф.Э., Закиров Б.С., Номозова Г.Р., Худойбердиев Ф.И. // Наманган давлат университети илмий ахборотномаси. 2019. № 3. С. 46.
Шукуров Ж.С., Тогашаров А.С., Аскарова М.К. и др. Комплексно действующие дефолианты, обладающие физиологически активными и инсектицидными свойствами. Навруз, 2019. 136 с.
El-Sherbeni A.EH.ED., Khaleid M.S., AbdAllah S.A.E.A. et al. // Bull. Natl. Res. Cent. 2019. V. 63. P. 57. https://doi.org/10.1186/s42269-019-0103-0
Boyd C.E. // Solubility Chem. Equilibrium. 2020. V. 1. P. 66. https://doi.org/10.1007/978-3-030-23335-8_4
Адилов З.Х., Эргашев Д.А., Тожиев Р.Р., Хамдамова Ш.Ш. Получение хлоратсодержащих дефолиантов, обладающих инсектицидными свойствами. Фергана, 2021. 133 с. https://doi.org/10.36074/ad-er-to-kha.monograph
Kossev K., Tsvetanova L., Dimowa L. et al. // Bulgarian Chem. Commun. 2013. № 4. P. 543.
Хамдамова Ш.Ш. // Universum: технические науки. 2019. № 67. С. 10.
Якименко Л.Н., Пасманник М.И. Справочник по производству хлора, каустической соды и основных хлорпродуктов. М.: Химия, 1976. 440 с.
Умиров Ф.Э., Номозова Г.Р. // Наманган давлат университети илмий ахборотномаси. 2021. № 5. С. 88.
Umirov F.E., Namazova G.R., Majidov H. // J. Critical Rev. 2020. V. 7. P. 2577.
Хамдамова Ш., Аскарова М., Тухтаев С. // Int. Scientific Rev. 2017. V. 35. № 4. P. 14.
Набиев М.Н., Шаммасов Р., Тухтаев С. и др. // Пат. СССР № 1143691. 1985. № 9. С. 84.
Шукуров Ж.С., Хусанов Э.С., Мухитдинова М.Ш., Тогашаров А.С. // Журн. неорган. химии. 2021. Т. 66. № 6. С. 807. https://doi.org/10.31857/S0044457X21060179
Sidikov A.A., Toghasharov A.S., Shukurov J.S. et al. // Int. J. Adv. Res. Sci. Eng. Tech. 2020. V. 7. № 5. P. 13619.
Умиров Ф.Э., Шодикулов Ж.М., Умиров У.Ф. // Путь науки. 2020. № 10(80). С. 19. https://doi.org/10.13140/RG.2.2.11645.90082
Накамото К. ИК-спектры и спектры КР неорганических и координационных соединений. М.: Мир, 1991. 536 с.
Недома И. Расшифровка рентгенограмм порошков. М.: Металлургия, 1975. 424 с.
Кочеров В.И., Сараева С.Ю., Алямовская И.С. и др. Химические и физико-химические методы анализа. Челябинск: Изд-во Уральского ун-та, 2016. 104 с.
Харитонов Ю.Я. Физико-химические методы анализа. М.: Высшая школа, 2001. 252 с.
Serikov U.A., Serkova N.V. // J. Siberian Federal University. 2018. V. 3. P. 361.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии