Журнал неорганической химии, 2022, T. 67, № 6, стр. 770-781
Гидротермальный синтез гидросиликатных наносвитков состава (Mg1 – xCox)3Si2O5(OH)4 в растворе Na2SO3
Е. К. Храпова a, *, Д. А. Козлов b, c, А. А. Красилин a
a Физико-технический институт им. А.Ф. Иоффе РАН
194021 Санкт-Петербург, ул. Политехническая, 26, Россия
b Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
c Московский государственный университет им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
* E-mail: e.k.khrapova@mail.ioffe.ru
Поступила в редакцию 21.10.2021
После доработки 03.12.2021
Принята к публикации 16.12.2021
- EDN: FVPEJN
- DOI: 10.31857/S0044457X22060125
Аннотация
Гидротермальным методом при 200°С получены однофазные нанотубулярные гидросиликаты состава (Mg1 –xCox)3Si2O5(OH)4 (x = 0.2, 0.4…1) со структурой хризотила. Материалы на основе кобальтсодержащих гидросиликатов могут применяться в качестве катализаторов, сорбентов, сенсоров, в составе устройств для накопления и хранения энергии. Сложность получения нанотубулярных кобальтсодержащих гидросиликатов связана с присутствием в системе кислорода и, как следствие, окислением кобальта до Co3+. Для стабилизации Co2+ на стадии гидротермальной обработки использовали раствор сульфита натрия для химического удаления кислорода из системы. Полученные образцы представляют собой наносвитки различной морфологии. Увеличение содержания кобальта в системе приводит к формированию многостенных и двустенных цилиндров, конусов, наносвитков типа трубка-в-трубке, а также наносвитков с полностью или частично замкнутыми торцами, изогнутых наносвитков и сфероподобных частиц.
ВВЕДЕНИЕ
Одним из самых распространенных в природе и простым для получения в лабораторных условиях слоистым нанотубулярным гидросиликатом является хризотил – минерал с общей химической формулой Mg3Si2O5(OH)4 [1]. Слои хризотила обладают способностью к самопроизвольному сворачиванию из-за размерного несоответствия между двумя его подслоями: металл-кислородным, состоящим из октаэдров MgO6, и кремний-кислородным, состоящим из тетраэдров SiO4 [2–4].
Одним из путей придания хризотилу новых свойств является изоморфное замещение в катионной подрешетке. В октаэдрической позиции замещение ионов магния возможно на ионы таких металлов, как никель [3, 5–7], кобальт [7–9], железо [10–12], алюминий [13]. В тетраэдрической позиции кремний может быть замещен на германий [7, 14] или титан [15, 16]. Таким образом, происходит изменение механических, каталитических, магнитных и сорбционных свойств. Это позволяет применять гидросиликатные наносвитки со структурой хризотила в качестве наполнителей композиционных материалов [17–19], катализаторов [20–23], сорбентов [23–26], в составе устройств для накопления и хранения энергии [27, 28]. Изоморфное замещение приводит к изменению морфологии: помимо частиц цилиндрической формы [28–31] могут наблюдаться конусы [30–33], частицы типа конус-в-конусе, трубка-в-трубке [30, 33, 34], а также пластины [14, 34–36]. В работе [37] был получен пластинчатый гидросиликат кобальта из наночастиц CoO–SiO2, представляющих собой систему ядро–оболочка. На его основе был изготовлен катализатор для реакции Фишера–Тропша, который продемонстрировал высокую активность. Катализаторы типа металл-носитель являются одними из самых используемых и перспективных. Существует возможность создания таких катализаторов на основе d-элементов, в частности, кобальта.
Получение хризотила с изоморфным замещением магния на металлы с переменными степенями окисления, такие как кобальт и железо, вызывает затруднения ввиду сложности стабилизации катиона в степени окисления +2. В гидротермальных условиях парциальное давление кислорода возрастает в соответствии с общим давлением в автоклаве. Одним из методов предотвращения окисления кобальта является его структурная стабилизация в виде CoSiO3 перед гидротермальной обработкой. Такая попытка была предпринята в работе [8], в которой сообщается о получении нанотубулярного кобальтсодержащего гидросиликата. Помимо основной нанотубулярной фазы в образцах также присутствовал ряд других фаз: оксиды и гидроксид кобальта, талькоподобная фаза Co3Si4O10(OH)2, Co2SiO4, пластинчатый Co3Si2O5(OH)4. Кроме того, синтез проводили при высоких температурах и высоких концентрациях щелочи. В работе [38] показано, что создание химического сопряжения между компонентами исходной композиции позволяет снизить температуру гидротермальной обработки, необходимую для формирования нанотубулярных гидросиликатов. Но для проведения синтеза данным методом и получения нанотубулярной структуры необходимо создать условия, которые бы препятствовали окислению Co2+.
В настоящей работе мы предприняли попытку получения однофазного кобальтсодержащего хризотила состава (Mg1 –xCox)3Si2O5(OH)4 путем использования сульфита натрия для удаления кислорода из системы на этапе гидротермальной обработки. Исследование возможности получения однофазных образцов в такой системе простым методом позволит создать физико-химические основы синтеза хризотила с полностью или частично замещенным ионом магния на ионы d-элементов с переменными степенями окисления.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез гидросиликатов состава (Mg1 – xCox)3Si2O5(OH)4
Для получения гидросиликатов состава (Mg1 ‒ xCox)3Si2O5(OH)4, где x = 0.2, 0.4, 0.6, 0.8, 1 (x – номинальное (расчетное) мольное содержание кобальта по отношению к сумме катионов магния и кобальта), использовали метод обратного соосаждения. Для этого в 1 М водный раствор NaOH (х. ч.) объемом 0.5 л добавляли 10 г аморфного SiO2 (Аэросил А-300) и перемешивали в течение 24 ч до полного растворения SiO2. Затем отмеряли необходимый (исходя из заданного соотношения (Mg + Co)/Si = 1.5) объем полученного раствора и в него по каплям при постоянном перемешивании на воздухе добавляли водный раствор, содержащий 0.5 · (1 – x) М MgCl2 (ч. д. а.) и 0.5 · x М CoCl2 (ч.) объемом 0.5 л. Раствор солей объемом 0.5 л готовили при комнатной температуре непосредственно перед началом реакции осаждения путем смешения навесок кристаллогидратов солей и их последующего растворения в дистиллированной воде при постоянном перемешивании. Затем полученный осадок отмывали от хлорид-ионов дистиллированной водой с помощью центрифугирования, степень отмывки проверяли качественной реакцией с AgNO3. После отмывки осадок высушивали при температуре 80°C под вакуумом и измельчали в агатовой ступке.
Гидротермальную обработку проводили в сосудах высокого давления, выполненных из нержавеющей стали с тефлоновыми вкладышами объемом 25 мл. Гидротермальную обработку проводили при температуре 200°C и давлении 2.5 МПа в течение 168 ч. В качестве гидротермальной среды использовали дистиллированную воду или 0.1 М водный раствор Na2SO3.
После проведения гидротермальной обработки с использованием сульфита натрия полученные образцы отмывали декантацией в перчаточном боксе в атмосфере аргона с помощью дегазированной дистиллированной воды. Воду готовили перегонкой 5 мас. %-ного водного раствора Na2SO3 в токе аргона с последующей дегазацией вакуумированием. Далее образцы высушивали под вакуумом при температуре 80°C и помещали на хранение в эксикатор перчаточного бокса. Образцы, полученные с использованием дистиллированной воды в качестве гидротермальной среды, сушили под вакуумом при температуре 80°C и хранили на воздухе.
Исследование образцов
Исследование образцов проводили непосредственно после их высушивания методом порошковой рентгеновской дифрактометрии на рентгеновском дифрактометре Rigaku SmartLab 3 (Япония, CoKα-излучение, λ = 1.789 Å). Съемку осуществляли в геометрии Брэгга–Брентано в режиме θ–2θ-сканирования с шагом 0.01° по шкале 2θ и скоростью съемки 2 град/мин в интервале углов 5°–60°. Ускоряющее напряжение 40 кВ, ток накала катода 35 мА. Для обработки полученных дифрактограмм использовали программу Rigaku SmartLab Studio II. Рентгенофазовый анализ проводили с помощью базы данных COD [39–41]. Для расчета параметров элементарной ячейки (ПЭЯ) использовали метод Поли и Ле Бейла [42], для аппроксимации полученного профиля – сплит-функцию псевдо-Фойгта.
Исследование химического состава полученных образцов выполняли методом рентгеноспектрального микроанализа на базе сканирующего электронного микроскопа FEI Quanta 200 со встроенным рентгеновским Si(Li)-микроанализатором EDAX.
Исследование морфологии частиц и их распределения по размерам проводили на просвечивающем электронном микроскопе Zeiss Libra 200 MC (Zeiss, Германия) при ускоряющем напряжении 200 кВ и на электронном микроскопе Leo 912 AB Omega (Zeiss, Германия) при ускоряющем напряжении 100 кВ. Для получения статистических данных по каждому образцу было проанализировано 200–230 частиц.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Порошковая рентгеновская дифрактометрия
По данным порошковой рентгеновской дифрактометрии, представленным на рис. 1а, образцы, полученные с использованием дистиллированной воды в качестве гидротермальной среды (ГТО-H2O), представляют собой многофазные системы. Во всех образцах присутствует фаза Co3O4, которая, по-видимому, образовалась в результате частичного окисления кобальта до Co3+. В зависимости от содержания кобальта наблюдаются также и другие фазы: пластинчатая талькоподобная фаза предположительного состава (Mg,Co)3Si4O10(OH)2, а при малом содержании кобальта (x = 0.2–0.6) – нанотубулярная хризотилоподобная фаза предположительного состава (Mg,Co)3Si2O5(OH)4. Формированию талькоподобной фазы способствовало частичное окисление кобальта с образованием Co3O4 и связанное с этим уменьшение стехиометрического соотношения (Mg + Co)/Si в фазе гидросиликата.
Рис. 1.
Дифрактограммы продуктов гидротермальной обработки: а – в водной среде (ГТО-H2O), б – в сульфитной среде (ГТО-Na2SO3). В скобках указаны номера карточек в базе данных Crystallography Open Database (COD).
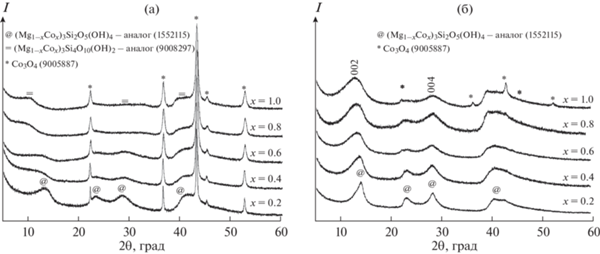
Порошковые рентгеновские дифрактограммы образцов, полученных при использовании сульфита натрия в качестве гидротермальной среды (образцы ГТО-Na2SO3), представлены на рис. 1б. Все образцы являются однофазными и представляют собой нанотубулярную хризотилоподобную фазу состава (Mg,Co)3Si2O5(OH)4, за исключением образца с x = 1. В данном образце присутствует незначительное количество Co3O4, что может быть связано как с частичным окислением кобальта, так и с изначальным избытком в системе ионов кобальта. Дифракционные максимумы, соответствующие хризотилоподобной фазе, становятся менее узкими и интенсивными. Смещение и уширение пика (002) свидетельствуют о существенном увеличении параметра с и уменьшении среднего размера кристаллита в данном направлении, связанном с толщиной стенки наносвитков.
На рис. 2 представлены ПЭЯ фаз, содержащихся в образцах серии ГТО-Н2O. ПЭЯ талькоподобной фазы (рис. 2а) изменяются несистематично, в то время как объем элементарной ячейки растет. Значения ПЭЯ талька взяты из работы [43]. ПЭЯ и объем ячейки Co3O4, представленные на рис. 2б, уменьшаются при увеличении содержания кобальта в системе. Значения ПЭЯ Co3O4 полученных образцов находятся между значениями Co3O4 [44] и MgCo2O4 [45]. Общая тенденция к уменьшению объема элементарной ячейки при увеличении содержания кобальта в системе может быть связана с уменьшением количества магния в оксиде и приближением объема к значениям, характерным для Co3O4. Значения ПЭЯ хризотилоподобной фазы для образцов серии ГТО-H2O представлены на рис. 3. Согласно [2], элементарная ячейка включает в себя два слоя, смещенных друг относительно друга. Значение параметра a возрастает при увеличении содержания кобальта в системе, но при x = 0.4 оно резко снижается. Параметр b уменьшается с увеличением содержания кобальта в системе, параметры c и β, как и параметр a, возрастают. Объем элементарной ячейки изменяется аналогично параметру a.
Рис. 2.
Параметры элементарных ячеек образцов серии ГТО-H2O: а – для талькоподобной фазы, б – для Co3O4. В скобках указаны номера карточек в базе данных COD.
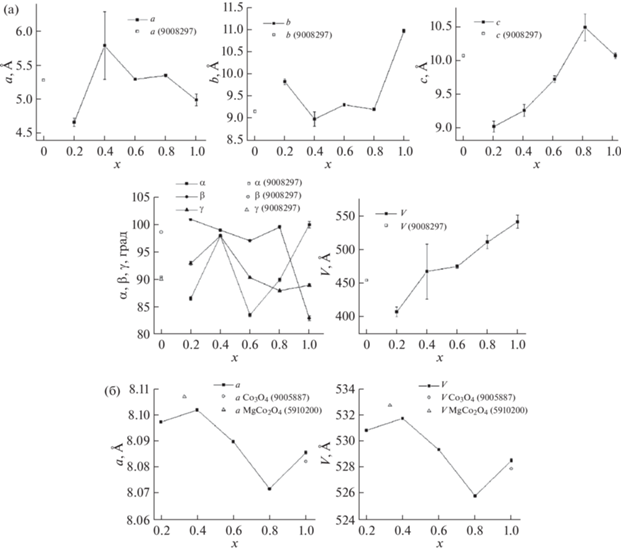
Рис. 3.
Параметры элементарных ячеек образцов серии ГТО-H2O для хризотилоподобной фазы. В скобках указан номер карточки в базе данных COD.
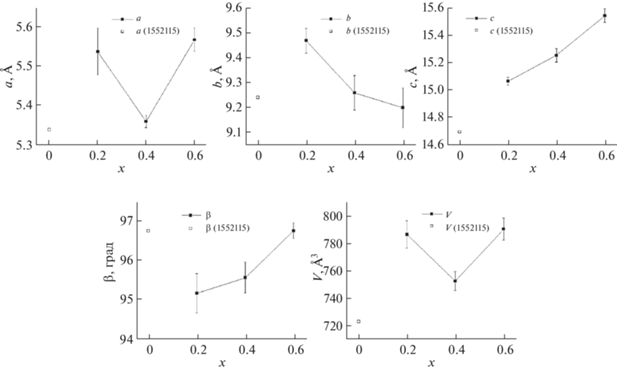
Значения ПЭЯ хризотилоподобной фазы в образцах серии ГТО-Na2SO3 представлены на рис. 4. Параметр a возрастает при увеличении содержания кобальта в системе, лишь при x = 0.4 наблюдается минимум, после чего происходит резкое возрастание данного параметра, как и в хризотилоподобной фазе в серии ГТО-Н2O. Параметр b постепенно уменьшается при увеличении содержания кобальта, за исключением случая с x = 1. В целом изменение данного параметра (0.15 Å) является минимальным по сравнению с другими линейными размерами элементарной ячейки. Параметр c возрастает при увеличении содержания кобальта в системе, что может быть связано с увеличением как толщины гидросиликатного слоя, так и размера межслоевого пространства. Параметр β приблизительно одинаковый для всех образцов, лишь при x = 1 наблюдается уменьшение его величины. Объем элементарной ячейки увеличивается при росте содержания кобальта в системе за счет увеличения параметров a и c.
Рентгеноспектральный микроанализ
Элементный состав образцов серии ГТО-H2O представлен в табл. 1. Соотношение (Mg + Co)/Si должно составлять 1.5, однако такое значение получено только для образца с x = 0.2. Далее соотношение возрастает, что может быть связано с ростом фазовой неоднородности и морфологическими особенностями присутствующих в образцах фаз. Активный рост кристаллов Co3O4 и увеличение их количества в системе по сравнению с другими фазами могли приводить к их агломерации. Сосуществующая талькоподобная фаза является слабоокристаллизованной, а ее частицы представляют собой тонкие пластины с относительно низкой плотностью. Более плотные частицы Co3O4 и их агломераты – основные области потерь энергии электронами и, как следствие, генерации характеристического излучения. Таким образом, происходит увеличение интенсивности линий характеристического излучения кобальта, приводящее к наблюдаемому росту соотношения (Mg + Co)/Si. Вторым предполагаемым объяснением может быть образование в гидротермальных условиях водорастворимого силиката и его удаление из системы при отмывке полученного осадка. Однако в этом случае маловероятно образование талькоподобной фазы (рис. 1а), обычно характеризующейся отношением М/Si = = 3 : 4 (M – катион металла). Вместо этого должно было наблюдаться формирование хризотилоподобной фазы с М/Si = 3 : 2 и фазы гидроксида, оксигидроксида или оксида металла.
Таблица 1.
Элементный состав образцов серии ГТО-H2O
| х | x по анализу | O | Mg | Si | Co | (Co + Mg)/Si* |
|---|---|---|---|---|---|---|
| ат. % | ||||||
| 0.2 | 0.25 ± 0.01 | 57.6 ± 0.1 | 18.71 ± 0.01 | 16.92 ± 0.07 | 6.71 ± 0.05 | 1.50 ± 0.01 |
| 0.4 | 0.46 ± 0.01 | 55.3 ± 0.5 | 15.22 ± 0.03 | 16.91 ± 0.04 | 12.80 ± 0.50 | 1.66 ± 0.03 |
| 0.6 | 0.67 ± 0.01 | 53.7 ± 0.2 | 10.21 ± 0.01 | 15.40 ± 0.02 | 20.70 ± 0.62 | 2.01 ± 0.04 |
| 0.8 | 0.83 ± 0.02 | 52.5 ± 0.2 | 5.50 ± 0.10 | 15.41 ± 0.10 | 26.50 ± 0.50 | 2.01 ± 0.06 |
| 1 | 1 | 50.7 ± 1.4 | 0 | 13.91 ± 0.40 | 35.50 ± 0.81 | 2.55 ± 0.11 |
Результаты рентгеноспектрального микроанализа для образцов серии ГТО-Na2SO3 представлены в табл. 2. В данном случае соотношение (Mg + + Co)/Si в пределах погрешности близко к 1.5 при любом x, это может быть связано с высокой морфологической и фазовой однородностью по сравнению с образцами серии ГТО-H2O. Во всех образцах наблюдается содержание небольшого количества серы, которое возрастает при увеличении содержания кобальта в системе. Поскольку, согласно результатам рентгенофазового анализа, дополнительные кристаллические фазы не выявлены, можно предположить, что серосодержащие побочные продукты синтеза могут быть сорбированы или инкапсулированы во внутреннем канале или межслоевом пространстве.
Таблица 2.
Элементный состав образцов серии ГТО-Na2SO3
| х | x по анализу | O | Mg | Si | Co | S | (Co + Mg)/Si |
|---|---|---|---|---|---|---|---|
| ат. % | |||||||
| 0.2 | 0.21 ± 0.01 | 62.91 ± 0.70 | 17.30 ± 0.03 | 15.21 ± 0.10 | 4.70 ± 0.10 | 0.20 ± 0.01 | 1.44 ± 0.02 |
| 0.4 | 0.41 ± 0.01 | 62.20 ± 0.31 | 13.61 ± 0.02 | 14.41 ± 0.01 | 9.41 ± 0.20 | 0.31 ± 0.01 | 1.60 ± 0.01 |
| 0.6 | 0.60 ± 0.05 | 60.05 ± 1.09 | 9.60 ± 0.10 | 15.22 ± 0.12 | 14.60 ± 1.10 | 0.42 ± 0.01 | 1.59 ± 0.09 |
| 0.8 | 0.80 ± 0.13 | 60.05 ± 1.92 | 4.70 ± 0.02 | 15.23 ± 0.05 | 19.21 ± 2.40 | 0.52 ± 0.01 | 1.57 ± 0.16 |
| 1 | 1 | 60.65 ± 3.61 | 0 | 15.21 ± 0.07 | 23.52 ± 4.31 | 0.61 ± 0.01 | 1.55 ± 0.16 |
Просвечивающая электронная микроскопия
Микрофотографии образцов серии ГТО-H2O представлены на рис. 5. Частицы с морфологией, близкой к кубической, отнесены к фазе Co3O4. Помимо них на микрофотографиях можно выделить тонкие пластины талькоподобной фазы состава (Mg,Co)3Si4O10(OH)2. Хризотилоподобная нанотубулярная фаза наблюдается в существенных количествах только при x = 0.2. Окисление кобальта до Co3+ могло приводить к активному формированию Co3O4, что не позволяло образовывать наносвитки со структурой и стехиометрией хризотила. Допуская возможность окисления кобальта в структуре уже сформировавшегося гидросиликата, следует отметить, что одним из вероятных результатов этого процесса будет изменение обусловливающей сворачивание величины размерного несоответствия между октаэдрическим и тетраэдрическим подслоями.
На рис. 6 представлены микрофотографии образцов серии ГТО-Na2SO3, содержащие основные морфологические вариации сворачивания кобальтсодержащих гидросиликатных слоев. Предотвращение окисления кобальта за счет химического удаления кислорода из системы позволило получить наносвитки с хризотилоподобной структурой во всем диапазоне значений x. Наносвитки цилиндрической морфологии можно разделить на две категории: тонкие двухстенные цилиндры (рис. 6г), появляющиеся в значительном количестве при x = 0.6, и многостенные цилиндры (рис. 6а). Помимо них наблюдаются частицы с морфологией, отличающейся от полой цилиндрической: конусы (рис. 6б), сфероподобные частицы (рис. 6в), изогнутые частицы (рис. 6д), цилиндры с замкнутыми торцами (рис. 6е), цилиндры с частично замкнутыми торцами (рис. 6ж), трубки-в-трубке (рис. 6з). Процентное содержание различных форм частиц в зависимости от содержания кобальта в системе представлено на рис. 6и.
Рис. 6.
Морфологические типы образцов серии ГТО-Na2SO3: а – цилиндры (x = 0.4); б – конусы (x = 0.2); в – сфероподобные частицы (x = 0.6); г – тонкие цилиндры (x = 1); д – изогнутые частицы (x = 0.8); е – частицы с замкнутыми торцами (x = 0.8); ж – цилиндры с частично замкнутыми торцами (x = 0.6); з – трубка-в-трубке (x = 0.4); и – относительное содержание частиц с различной морфологией: 1 – цилиндры, 2 – конусы, 3 – тонкие цилиндры, 4 – сфероподобные частицы, 5 – частицы с полностью или частично замкнутыми торцами и прочие типы частиц. Дополнительные ПЭМ-микрофотографии сфероподобных частиц приведены в файле с дополнительной информацией.

Возникновение такого морфологического многообразия частиц может быть связано с увеличением по сравнению с гидросиликатом магния размерного несоответствия между двумя подслоями при замещении магния на кобальт. Известно, что родственные нанотубулярные гидросиликаты, такие как имоголит Al2SiO3(OH)4 и галлуазит Al2Si2O5(OH)4, могут образовывать частицы сферической и сфероподобной формы – аллофан [46, 47] и сфероидальный галлуазит [48, 49] соответственно. Размерное несоответствие между подслоями, выраженное в виде радиуса механически ненапряженного бислоя r0, согласно данным работы [50], увеличивается (а радиус, соответственно, уменьшается) в ряду: Mg3Si2O5(OH)4 (8.8 нм), Co3Si2O5(OH)4 (~6 нм), Al2Si2O5(OH)4 (~3 нм), Al2SiO3(OH)4 (~1 нм). Поскольку размерное несоответствие между подслоями, скорее всего, существует не только вдоль направления сворачивания, но и по другим кристаллографическим направлениям, для его компенсации вдоль этих направлений могут быть использованы другие возможности, в том числе искажение сетки полиэдров [51]. Вероятно, если размерное несоответствие оказывается большим, то данного варианта компенсации недостаточно, и формирующийся на торцах свитка слой стремится изогнуться в другом направлении с образованием замкнутых торцов или сфероподобных частиц. Следует отметить, что для слоев со структурой имоголита сферическую морфологию могут иметь до 100% всех наблюдаемых частиц (минерал аллофан) [46]. Наличие сфероподобных частиц отмечалось авторами [52] для случая синтетического аналога галлуазита, занимающего промежуточное значение по величине r0 между имоголитом и исследуемым случаем. В полученных образцах гидросиликатов состава (Mg1 –xCox)3Si2O5(OH)4 сфероподобные частицы наблюдались лишь при x ≥ 0.6 и их содержание не превышало 15% от общего количества частиц (рис. 6и). Наблюдались также нанотубулярные частицы с частично или полностью замкнутыми торцами, их количество возрастало при увеличении содержания кобальта в системе.
При увеличении содержания кобальта в системе наблюдалось уменьшение размеров частиц. На рис. 7 представлено распределение частиц по длине, а также средние взвешенные значения длины наносвитков. В случае x = 0.2 на распределении можно выделить два диапазона, соответствующих коротким (с длиной 100–300 нм) и длинным (с длиной от 350 нм до 1.2 мкм) наносвиткам. При x = 0.4 длина наносвитков составляет 50–450 нм, причем большинство наносвитков имеет длину от 100 до 250 нм. Образование частиц с различной морфологией при x = 0.6 приводит к еще большему уменьшению длины (длина большинства частиц составляет 100–150 нм), а само распределение находится в диапазоне от 50 до 350 нм, что характерно также для образцов с x = = 0.8 и 1.
Рис. 7.
Распределения нанотубулярных частиц серии ГТО-Na2SO3 по длине, а также средние значения длины. На вставках приведены ПЭМ-микрофотографии частиц соответствующего состава.

Распределения по толщине стенок наносвитков, а также средние взвешенные значения представлены на рис. 8. При x = 0.8 и 1 на распределениях присутствуют две области: с толщиной стенок 1–2 нм (характерна для двустенных наносвитков) и 3–10 нм. Именно при этих значениях x наблюдается наибольшее количество двустенных наносвитков. У образцов с x = 0.2–0.6 отсутствует ярко выраженная область толщины стенок, соответствующая двустенным наносвиткам. Уменьшение средней толщины стенки коррелирует с экспериментально наблюдаемым увеличением уширения дифракционных максимумов 00l (рис. 1), а также с уменьшением расчетного радиуса r0 при замещении магния на кобальт с 8.8 до ~5 нм, вследствие чего гидросиликаты кобальта должны формировать частицы с более тонкой стенкой (меньшим числом витков).
Рис. 8.
Распределения нанотубулярных частиц серии ГТО-Na2SO3 по толщине стенки, а также средние значения толщины стенки. ПЭМ-микрофотографии частиц с различной толщиной стенки приведены в файле с дополнительной информацией.
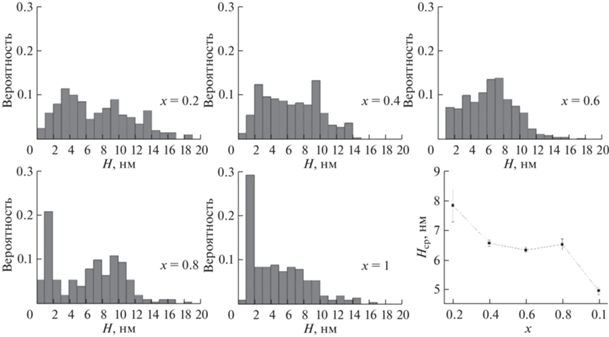
Помимо уменьшения толщины стенки наблюдается увеличение межслоевого периода в зависимости от числа слоев в стенке. Для двустенных наносвитков величина межслоевого периода составляет ~1 нм, в то время как для наносвитков с большим количеством слоев величина периода составляет ~0.74 нм, что согласуется с литературными данными для наносвитков со структурой хризотила [2, 53]. Увеличение периода от 0.75 до 0.85 нм для наносвитков состава Ni3Si2O5(OH)4 при уменьшении количества слоев в стенке наносвитка было отмечено в работе [4]. Данная особенность наряду с уменьшением толщины стенки может вносить вклад в уширение дифракционных максимумов 00l за счет наличия частиц в системе с различным параметром ячейки c. Следует также отметить, что изменение соотношения размеров слоя и межслоевого пространства может быть причиной изменения соотношения интенсивностей рентгеновских максимумов 002 и 004 (рис. 1).
ЗАКЛЮЧЕНИЕ
Проведен гидротермальный синтез слоистых нанотубулярных гидросиликатов состава (Mg1 –x,Cox)3Si2O5(OH)4 (x = 0.2, 0.4, 0.6, 0.8, 1). Показано, что использование раствора сульфита натрия в качестве гидротермальной среды для химического удаления кислорода из системы с целью предотвращения окисления кобальта является эффективным способом получения гидросиликатных кобальт(II)содержащих наносвитков со структурой хризотила без примесей других фаз. При отсутствии сульфита натрия в гидротермальном флюиде хризотилоподобная фаза формируется лишь при низком содержании кобальта (x = = 0.2, 0.4). По мере увеличения содержания кобальта в системе формируется талькоподобная кобальтсодержащая фаза и Co3O4 без образования нанотубулярных частиц. Увеличение содержания кобальта в системе приводит к росту размерного несоответствия между подслоями и появлению качественно новых морфологических особенностей, не характерных для гидросиликатов магния, – образованию нанотубулярных частиц с замкнутыми торцами и сфероподобных частиц. Данные особенности перспективны при использовании гидросиликатов для капсулирования различных веществ во внутреннем канале наносвитков.
Список литературы
Корыткова Э.Н., Маслов А.В., Пивоварова Л.Н. и др. // Физика и химия стекла. 2004. Т. 30. № 1. С. 72. [Korytkova E.N., Maslov A.V., Pivovarova L.N. et al. // Glass. Phys. Chem. 2004. V. 30. № 1. P. 51.]
Falini G., Foresti E., Gazzano M. et al. // Chem. Eur. J. 2004. V. 10. № 12. P. 3043. https://doi.org/10.1002/chem.200305685
Krasilin A.A., Nevedomsky V.N., Gusarov V.V. // J. Phys. Chem. C. 2017. V. 121. № 22. P. 12495. https://doi.org/10.1021/acs.jpcc.7b03785
Чивилихин С.А., Попов И.Ю., Гусаров В.В. // Докл. АН. 2007. Т. 412. № 2. С. 201. [Chivilikhin S.A., Popov I.Y., Gusarov V.V. // Dokl. Phys. 2007. V. 52. № 1. P. 60.] https://doi.org/10.1134/S1028335807010156
Alvarez–Ramírez F., Toledo-Antonio J.A., Angeles-Chavez C. et al. // J. Phys. Chem. C. 2011. V. 115. № 23. P. 11442. https://doi.org/10.1021/jp201941x
Корыткова Э.Н., Маслов А.В., Пивоварова Л.Н. и др. // Неорган. материалы. 2005. Т. 41. № 7. С. 849. [Korytkova E.N., Maslov A.V., Pivovarova L.N. et al. // Inorg. Mater. 2005. V. 41. № 7. P. 743.] https://doi.org/10.1007/s10789-005-0202-1
Yang B., Zhang N., Chen G. et al. // Appl. Catal., B. 2020. V. 260. P. 118184. https://doi.org/10.1016/j.apcatb.2019.118184
Корыткова Э.Н., Пивоварова Л.Н., Дроздова И.А. и др. // Журн. общ. химии. 2007. Т. 77. № 10. С. 1600. [Korytkova E.N., Pivovarova L.N., Drosdova I.A. et al. // Russ. J. Gen. Chem. 2007. V. 77. № 10. P. 1669.]https://doi.org/10.1134/S1070363207100039
Nitta Y., Ueno K., Imanaka T. // Appl. Catal. 1989. V. 56. № 1. P. 9.
Piperno S., Kaplan-Ashiri I., Cohen S.R. et al. // Adv. Funct. Mater. 2007. V. 17. № 16. P. 3332. https://doi.org/10.1002/adfm.200700278
Lesci I.G., Balducci G., Pierini F. et al. // Microporous Mesoporous Mater. 2014. V. 197. P. 8. https://doi.org/10.1016/j.micromeso.2014.06.002
Огородова Л.П., Киселева И.А., Корыткова Э.Н. и др. // Журн. физ. химии. 2010. Т. 84. № 1. С. 49. [Ogorodova L.P., Kiseleva I.A., Korytkova E.N. et al. // Russ. J. Phys. Chem. A. 2010. V. 84. № 1. P. 44.] https://doi.org/10.1134/S0036024410010097
Красилин А.А., Гусаров В.В. // Журн. прикл. химии. 2015. Т. 88. № 12. С. 1681. [Krasilin A.A., Gusarov V.V. // Russ. J. Appl. Chem. 2015. V. 88. № 12. P. 1928.] https://doi.org/10.1134/S10704272150120046
Красилин А.А., Храпова Е.К. // Журн. прикл. химии. 2017. Т. 90. № 1. С. 25. [Krasilin A.A., Khrapova E.K. // Russ. J. Appl. Chem. 2017. V. 90. № 1. P. 22.] https://doi.org/10.1134/S1070427217010049
Bloise A.B. // Neues Jahrb. Mineral., Abh. 2009. V. 185. № 3. P. 297. https://doi.org/10.1127/0077-7757/2009/0130
Масленникова Т.П., Корыткова Э.Н., Гатина Э.Н. и др. // Физика и химия стекла. 2016. Т. 42. № 6. С. 815. [Maslennikova T.P., Korytkova E.N., Gatina E.N. et al. // Glass. Phys. Chem. 2016. V. 42. № 6. P. 627.] https://doi.org/10.1134/S1087659616060146
Гофман И.В., Светличный В.М., Юдин В.Е. и др. // Журн. общ. химии. 2007. Т. 77. № 7. С. 1075. [Gofman I.V., Svetlichnyi V.M., Yudin V.E. et al. // Russ. J. Gen. Chem. 2007. V. 77. № 7. P. 1158.] https://doi.org/10.1134/S1070363207070043
Teixeira A.P.C., Purceno A.D., Barros A.S. et al. // Catal. Today. 2012. V. 190. № 1. P. 133. https://doi.org/10.1016/j.cattod.2012.01.042
Luo J., Zhang C., Li L. et al. // Sensors. 2018. V. 18. № 9. P. 2999. https://doi.org/10.3390/s18092999
Perbost R., Amouric M., Olives J. // Clays Clay Miner. 2003. V. 51. № 4. P. 430. https://doi.org/10.1346/CCMN.2003.0510409
Khrapova E.K., Ugolkov V.L., Straumal E.A. et al. // ChemNanoMat. 2021. V. 7. № 3. P. 257. https://doi.org/10.1002/cnma.202000573
Bian Z., Li Z., Ashok J. et al. // Chem. Commun. 2015. V. 51. № 91. P. 16324. https://doi.org/10.1039/C5CC05226B
Sivaiah M.V., Petit S., Beaufort M.F. et al. // Microporous Mesoporous Mater. 2011. V. 140. № 1–3. P. 69. https://doi.org/10.1016/j.micromeso.2010.09.015
Krasilin A.A., Bodalyov I.S., Malkov A.A. et al. // Nanosyst: Phys, Chem, Math. 2018. V. 9. № 3. P. 410. https://doi.org/10.17586/2220-8054-2018-9-3-410-416
Yu S., Zhai L., Wang Y. et al. // J. Environ. Chem. Eng. 2015. V. 3. № 2. P. 752. https://doi.org/10.1016/j.jece.2015.03.023
Liu K., Zhu B., Feng Q. et al. // Appl. Clay Sci. 2013. V. 80. P. 38. https://doi.org/10.1016/j.jece.2015.03.023
Krasilin A.A., Danilovich D.P., Yudina E.B. et al. // Appl. Clay Sci. 2019. V. 173. P. 1. https://doi.org/10.1016/j.clay.2019.03.007
Yang Y., Liang Q., Li J. et al. // Nano Res. 2011. V. 4. № 9. P. 882. https://doi.org/10.1007/s12274-011-0144-7
Храпова Е.К., Ежов И.С., Румянцев А.М. и др. // Неорган. материалы. 2020. Т. 56. № 12. С. 1317. [Khrapova E.K., Ezhov I.S., Rumyantsev A.M. et al. // Inorg. Mater. 2020. V. 56. № 12. P. 1248.] https://doi.org/10.1134/S0020168520120092
Yada K., Iishi K. // Am. Mineral. 1977. V. 62. № 9–10. P. 958.
Корыткова Э.Н., Пивоварова Л.Н., Дроздова И.А. и др. // Журн. неорган. химии. 2007. Т. 52. № 3. С. 338. https://doi.org/10.1134/S0036023607030084 [Korytkova E.N., Pivovarova L.N., Semenova O.E. et al. // Russ. J. Inorg. Chem. 2007. V. 52. № 3. P. 338.] 10.1134/S0036023607030084
Войтылов В.В., Войтылов А.В., Корыткова Э.H. и др. // Журн. прикл. химии. 2008. Т. 81. № 2. С. 218. [Voitylov V.V., Voitylov A.V., Korytkova E.N. et al. // Russ. J. Appl. Chem. 2008. V. 81. № 2. P. 207.] https://doi.org/10.1134/S1070427208020092
Красилин А.А., Супрун А.М., Неведомский В.Н. и др. // Докл. АН. 2015. Т. 460. № 5. С. 558. [Krasilin A.A., Suprun A.M., Nevedomsky V.N. et al. // Dokl. Phys. Chem. 2015. V. 460. № 2. P. 42.] https://doi.org/10.1134/S0012501615020049
Bloise A., Belluso E., Fornero E. et al. //Microporous Mesoporous Mater. 2010. V. 132. № 1–2. P. 239. https://doi.org/10.1016/j.micromeso.2010.03.003
Falini G., Foresti E., Lesci G. et al. // Chem. Commun. 2002. № 14. P. 1512. https://doi.org/10.1039/B203430A
Foresti E., Hochella Jr. M.F., Kornishi H. et al. // Adv. Funct. Mater. 2005. V. 15. № 6. P. 1009. https://doi.org/10.1002/adfm.200400355
Park J.C., Kang S.W., Kim J.C. et al. // Nano Res. 2017. V. 10. № 3. P. 1044. https://doi.org/10.1007/s12274-016-1364-7
Красилин А.А., Альмяшева О.В., Гусаров В.В. // Неорган. материалы. 2011. Т. 47. № 10. С. 1222. [Krasilin A.A., Almjasheva O.V., Gusarov V.V. // Inorg. Mater. 2011. V. 47. № 10. P. 1111.] https://doi.org/10.1134/S002016851110013X
Downs R.T., Hall-Wallace M. // Am. Mineral. 2003. V. 88. № 1. P. 247.
Gražulis S., Daškevič A., Merkys A. et al. // Nucleic Acids Res. 2012. V. 40. № D1. P. D420. https://doi.org/10.1093/nar/gkr900
Gražulis S., Chateigner D., Downs R.T. et al. // J. Appl. Crystallogr. 2009. V. 42. № 4. P. 726. https://doi.org/10.1107/S0021889809016690
Le Bail A. // Powder Diffr. 2005. V. 20. № 4. P. 316. https://doi.org/10.1154/1.2135315
Perdikatsis B., Burzlaff H. // Z. Kristallogr. - Cryst. Mater. 1981. V. 156. № 3–4. P. 177. https://doi.org/10.1524/zkri.1981.156.3-4.177
Liu X., Prewitt C.T. // Phys. Chem. Miner. 1990. V. 17. № 2. P. 168. https://doi.org/10.1007/BF00199669
Wyckoff R.W.G. // The Structure of Crystals. V. 3. N.Y.: Interscience Publ, 1951. P. 76.
Parfitt R.L. // Clay Miner. 2009. V. 44. № 1. P. 135. https://doi.org/10.1007/BF00199669
Thill A., Picot P., Belloni L. // Appl. Clay Sci. 2017. V. 141. P. 308. https://doi.org/10.1007/BF00199669
Berthonneau J., Grauby O., Jeannin C. et al. // Clays Clay Miner. 2015. V. 63. № 5. P. 368. https://doi.org/10.1346/CCMN.2015.0630503
Cravero F., Fernández L., Marfil S. et al. // Appl. Clay Sci. 2016. V. 131. P. 48. https://doi.org/10.1016/j.clay.2016.01.011
Krasilin A.A., Khrapova E.K., Maslennikova T.P. // Crystals. 2020. V. 10. № 8. P. 654. https://doi.org/10.3390/cryst10080654
Singh B. // Clays Clay Miner. 1996. V. 44. № 2. P. 191. https://doi.org/10.1346/CCMN.1996.0440204
White R.D., Bavykin D.V., Walsh F.C. // J. Phys. Chem. C. 2012. V. 116. № 5. P. 8824. https://doi.org/10.1021/jp300068t
Yada K. // Acta Crystallogr., Sect. A: Found. Crystallogr. 1971. V. 27. № 6. P. 659. https://doi.org/10.1107/S0567739471001402
Дополнительные материалы
- скачать ESM.docx
- Рисунок S1 - Рисунок S6
Инструменты
Журнал неорганической химии




