Журнал неорганической химии, 2022, T. 67, № 7, стр. 1014-1021
Изучение состава и свойств оксидов железа в продуктах гидротермальной обработки красных шламов и бокситов
Л. А. Пасечник a, *, В. М. Скачков a, С. А. Бибанаева a, И. С. Медянкина a, В. Г. Бамбуров a
a Институт химии твердого тела УрО РАН
620990 Екатеринбург, ул. Первомайская, 91, Россия
* E-mail: pasechnik@ihim.uran.ru
Поступила в редакцию 14.10.2021
После доработки 07.12.2021
Принята к публикации 10.01.2022
- EDN: VYSFXQ
- DOI: 10.31857/S0044457X22060198
Аннотация
Бокситы и красный шлам глиноземного производства характеризуются высоким содержанием соединений железа и могут рассматриваться в качестве перспективного сырья для получения магнетита. Гидротермальная обработка в щелочной среде боксита Североуральского бокситового рудника, красного шлама и гематита в присутствии FeSO4 или порошков металлов (Al, Fe, Ca, Mg, смеси 0.25Mg–0.25Al–0.5Fe) привела к образованию магнетита в продуктах. Условия обработки определялись параметрами выщелачивания бокситов на производстве, обеспечивая высокое извлечение алюминия. Методами рентгенофазового анализа, сканирующей микроскопии и измерения магнитных характеристик показано, что в присутствии FeSO4 и металлического Al из красных шламов получены высокодисперсные продукты с содержанием магнетита 32.4 и 23.7% Fe3O4 соответственно. Введение порошков Fe или смеси 0.25Mg–0.25Al–0.5Fe при выщелачивании бокситов способствовало формированию соответственно 40.8 и 67.9% Fe3O4 в виде кристаллических частиц размером до 5 мкм. Высокие магнитные свойства полученных продуктов благодаря образованию магнитных фаз могут позволить провести их эффективное отделение для практического использования.
ВВЕДЕНИЕ
Промышленные предприятия ежегодно складируют в отвалах сотни тысяч тонн твердых отходов, содержащих от 15 до 90% оксидов железа (FeO, α-Fe2O3, γ-Fe2O3 или Fe3O4). Из-за отсутствия эффективных технологических решений различающиеся по химическому и фазовому составу в широких пределах шлаки, шламы и пыли практически не используются повторно для замены традиционного сырья. В то же время в мировой практике наблюдается положительная тенденция к рециклингу отходов, которые создают экологические и экономические проблемы [1–3]. Успешное использование отходов и низкосортных железных руд, а также направленное извлечение оксидов железа магнитным обогащением предполагают их предварительную намагничивающую обработку восстановлением [4–6], окислением [7, 8] или термическим разложением [9]. Не менее распространенными являются гидрохимические подходы к синтезу магнитных фаз [10–12], которые являются компонентами коллоидов [12], ферромагнитных газовых датчиков и сенсоров [13, 14], сорбентов, пигментов [15, 16] и др. материалов, в том числе биомедицинских [17]. Области использования железосодержащих слабо- и сильномагнитных материалов обусловлены их химическим и фазовым составом, структурными и физическими свойствами [12, 18], которые, в свою очередь, определяются способом получения. Одним из эффективных методов синтеза и модификации оксидов является автоклавная обработка в жидкой среде, которая приводит к образованию оксидных, неоксидных или металлических частиц с контролируемыми формой и размером [19, 20].
Перспективным источником железа является красный шлам (КШ) – остаток после извлечения алюминия из бокситов методом Байера, представляющий собой многофазную смесь и содержащий 35–65% гематита Fe2O3 и до 3% магнетита Fe3O4 [21, 22]. Являясь основными спутниками в бокситах и структурными аналогами минералов бемита α-AlOOH и гиббсита Аl2O3 · nH2O, железосодержащие гетит α-FeOOH и лимонит (гидрогематит) Fe2O3 · nH2O в высокощелочных растворах при температурах выше 200°C переходят в оксид железа Fe2O3, обладающий различной способностью к гидратации. Если для гидрогематита этот процесс необратим, то гетит при сгущении обводняется с образованием коллоидно-растворенной гидроокиси железа, что все вместе ухудшает отделение высокодисперсных частиц красного шлама от алюминатного раствора [23].
Близость ионных радиусов Al3+ (0.57 Å) и Fe3+ (0.67 Å) объясняет существование твердых растворов алюмогетита, алюмогематита и др., в которых содержание Al2O3 достигает 15–35%. Присутствие в разбавленных растворах алюминия и кремния снижает скорость кристаллизации Fe2O3, а их избыточное количество приводит к образованию алюмосиликатов и гидрогранатов натрия и кальция в КШ, в которых до 30% ионов Al3+ могут замещать ионы Fe3+. Содержащиеся в КШ Al2O3, СаО, SiO2 и др. предлагают удалять гидрохимическими [24, 25] или физическими методами [26], что позволит повысить содержание железа в остатке. Растворение и полное удаление алюминия из сложных минералов бокситов и КШ в щелочной среде достигается путем обменного взаимодействия извести с алюмосиликатами с образованием более устойчивых соединений, например Ca2SiO4, считая соотношение CaO : SiO2 основным параметром процесса по реакции (1) [23, 27]:
(1)
$\begin{gathered} {\text{2Ca}}{{{\text{O}}}_{{{\text{react}}}}} + {\text{Si}}{{{\text{O}}}_{{\text{2}}}}{\text{(в}}\,\,{\text{силикатах}}\,\,{\text{сырья)}} \to \\ \to \,\,{\text{C}}{{{\text{a}}}_{{\text{2}}}}{\text{Si}}{{{\text{O}}}_{{\text{4}}}}\left( {\text{s}} \right){\text{.}} \\ \end{gathered} $Выщелачивание алюминия из КШ в присутствии извести одновременно приводит к образованию магнетита в обесщелоченном остатке вследствие наличия собственных восстановителей, например S2–-ионов и органических флокулянтов, а также других ионов, которые непосредственно не участвуют в восстановлении железа(III), но оказывают положительное влияние на этот процесс [28, 29]. Таким образом, синтез магнетита Fe3O4 при взаимодействии анионов ${\text{Fe}}\left( {{\text{OH}}} \right)_{4}^{ - },$ продуктов гидратации гематита [23], и феррит-анионов ${\text{Fe(OH)}}_{3}^{ - },$ дополнительно вводимых в пульпу КШ [29, 30] или образующихся в восстановительной атмосфере, описывается реакциями (2)–(4).
(2)
$\begin{gathered} {\text{F}}{{{\text{e}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}} + {\text{2O}}{{{\text{H}}}^{ - }} + {\text{3}}{{{\text{H}}}_{{\text{2}}}}{\text{O}} \to \\ \to \,\,{\text{2FeO}}_{2}^{ - } + {\text{4}}{{{\text{H}}}_{{\text{2}}}}{\text{O}} \leftrightarrow {\text{2Fe(OH)}}_{4}^{ - }{\text{,}} \\ \end{gathered} $(3)
${\text{F}}{{{\text{e}}}^{{{\text{2 + }}}}}{\text{ + 3O}}{{{\text{H}}}^{ - }} \to {\text{HFeO}}_{2}^{ - } + {{{\text{H}}}_{{\text{2}}}}{\text{O}} \leftrightarrow {\text{Fe}}\left( {{\text{OH}}} \right)_{3}^{ - }{\text{,}}$(4)
$\begin{gathered} {\text{Fe}}\left( {{\text{OH}}} \right)_{3}^{ - } + {\text{2Fe}}\left( {{\text{OH}}} \right)_{4}^{ - } \to \\ \to \,\,{\text{F}}{{{\text{e}}}_{{\text{3}}}}{{{\text{O}}}_{{\text{4}}}} + {\text{3O}}{{{\text{H}}}^{ - }} + {\text{4}}{{{\text{H}}}_{{\text{2}}}}{\text{O}}{\text{.}} \\ \end{gathered} $Рассматриваемые процессы перспективны в отношении железосодержащих отходов (КШ) и природного сырья (боксита) для получения в составе низкощелочных остатков магнетита. Этот подход позволит повысить комплексность переработки минерального сырья не только благодаря извлечению алюминия в раствор, но и получению полезного магнетитсодержащего продукта. Таким образом, в настоящей работе предложен синтез магнетита в составе продуктов гидротермальной обработки техногенного красного шлама и природного боксита, исследованы морфология и фазовый состав оксидов железа, получаемых в присутствии FeSO4 или металлов-восстановителей, с сохранением высокого извлечения алюминия.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали NaOH, Са(ОН)2, α-Fe2O3 (гематит), FeSO4 · 7H2O и алюминий гранулированный (все реактивы марки “ч. д. а.”), магниевую стружку (МГС-99, ГОСТ 804-93) и железо карбонильное (ос. ч., ТУ 6-09-3000-78). Образцы красного шлама и боксита Североуральского бокситового рудника (СУБР) были получены с Богословского алюминиевого завода (Свердловская область) с влажностью 20–30 мас. %, высушены при 125°C и растерты.
Состав сырья и условия гидротермальной обработки (выщелачивания) приведены в табл. 1 и 2. Эксперименты проводили в автоклаве Parr 4560 объемом 450 мл при температуре 220–250°C и давлении 15–25 атм. при перемешивании со скоростью 100 об/мин в течение 1–2 ч. Для получения щелочной пульпы использовали 30%-ный раствор NaOH при соотношении жидкой фазы к твердому сырью 10 : 1. В пульпу вводили соответствующее количество Са(ОН)2, FeSO4 или порошков металлов. По окончании обработки автоклав самопроизвольно охлаждали до 80–85°C, затем из разгерметизированного реактора выгружали пульпу и отфильтровывали щелочной алюминатный раствор, а твердый остаток промывали горячей дистиллированной водой, высушивали при 125°С до постоянного веса и растирали для получения порошкообразных образцов.
Таблица 1.
Химический состав КШ и боксита СУБР, мас. %
| Сырье | Fe2O3 | Al2O3 | CaO | SiO2 | TiO2 | Na2O |
|---|---|---|---|---|---|---|
| КШ | 43.4 | 14.1 | 9.86 | 7.12 | 4.01 | 3.35 |
| Боксит | 21.3 | 52.4 | 4.49 | 3.45 | 1.98 | 0.51 |
Таблица 2.
Сырье железа и условия гидротермальной обработки
| Сырье | Продукт | Са(ОН)2, мас. % | Магнетизирующая добавка, мас. % | Время, ч | t, °C | р, МПа |
|---|---|---|---|---|---|---|
| КШ | МКШ1 | 0.3 | 10 FeSO4 | 2.0 | 250 | 19.5 |
| МКШ2 | 0 | 5 Al | 1.0 | 250 | 25.0 | |
| Боксит | МБ1 | 0 | 10 Са | 1.0 | 220 | 25 |
| МБ2 | 0 | 5 Mg | 1.0 | 220 | 15.5 | |
| МБ3 | 10 | 5 Fe | 1 | 220 | 25 | |
| МБ4 | 0 | 10 смеси 0.25Mg–0.25Al–0.5Fe | 1.0 | 220 | 20.0 | |
| α-Fe2O3 | МГем | 0 | 10 FeSO4 | 2.0 | 250 | 15.5 |
Химический состав твердых фаз определяли методом масс-спектрометрии с индуктивно связанной плазмой (Spectromass 2000). Рентгенофазовый анализ (РФА) порошковых продуктов проводили в Центре коллективного пользования “Рентгеноструктурный анализ” ИХТТ УрО РАН на дифрактометре Shimadzu XRD700 с использованием CuKα-излучения (5° < 2θ < 70°, шаг 0.03°). Идентификацию фаз осуществляли по базе рентгенографических порошковых стандартов JCDD PDF2 (USA, Release 2016). Морфологию и химический состав образцов изучали с помощью сканирующего электронного микроскопа JEOL JSM-6390LA, снабженного рентгеновским спектрометром EDS Inca Energy 250. Магнитную восприимчивость измеряли с помощью вибрационного магнетометра VSM-5T (Cryogenic Ltd) при комнатной температуре в магнитных полях до 10 кЭ.
Степень извлечения алюминия ω(Al2O3) (%) рассчитывали на основе содержания алюминия в исходном сырье $m{{\left( {{\text{A}}{{{\text{l}}}_{2}}{{{\text{O}}}_{3}}} \right)}_{{{\text{исх}}}}}~$ (г) и конечных продуктах $m{{\left( {{\text{A}}{{{\text{l}}}_{2}}{{{\text{O}}}_{3}}} \right)}_{{{\text{кон}}}}}$ (г) по формуле (5):
(5)
$\begin{gathered} {{\omega }}\left( {{\text{A}}{{{\text{l}}}_{2}}{{{\text{O}}}_{3}}} \right),\,{\text{\% }} = \\ = \,\,100\% \times \left( {1 - {{m{{{\left( {{\text{A}}{{{\text{l}}}_{2}}{{{\text{O}}}_{3}}} \right)}}_{{{\text{кон}}}}}} \mathord{\left/ {\vphantom {{m{{{\left( {{\text{A}}{{{\text{l}}}_{2}}{{{\text{O}}}_{3}}} \right)}}_{{{\text{кон}}}}}} {m{{{\left( {{\text{A}}{{{\text{l}}}_{2}}{{{\text{O}}}_{3}}} \right)}}_{{{\text{исх}}}}}}}} \right. \kern-0em} {m{{{\left( {{\text{A}}{{{\text{l}}}_{2}}{{{\text{O}}}_{3}}} \right)}}_{{{\text{исх}}}}}}}} \right). \\ \end{gathered} $С учетом полного перехода дополнительно вводимого железа в магнетит рассчитывали степень конверсии гематита в магнетит ωmagn(Fe2O3) (%) исходя из количества непрореагировавшего гематита в остатке $m{{\left( {{\text{F}}{{{\text{e}}}_{2}}{{{\text{O}}}_{3}}} \right)}_{{{\text{кон}}}}}$ (г) по отношению к исходному содержанию в сырье $m{{\left( {{\text{F}}{{{\text{e}}}_{2}}{{{\text{O}}}_{3}}} \right)}_{{{\text{исх}}}}}$ (г) по формуле (6):
(6)
$\begin{gathered} {{{{\omega }}}_{{{\text{magn}}}}}\left( {{\text{F}}{{{\text{e}}}_{2}}{{{\text{O}}}_{3}}} \right),\,{\text{\% }} = \\ = \,\,100\% \times \left( {1 - {{m{{{\left( {{\text{F}}{{{\text{e}}}_{2}}{{{\text{O}}}_{3}}} \right)}}_{{{\text{кон}}}}}} \mathord{\left/ {\vphantom {{m{{{\left( {{\text{F}}{{{\text{e}}}_{2}}{{{\text{O}}}_{3}}} \right)}}_{{{\text{кон}}}}}} {m{{{\left( {{\text{F}}{{{\text{e}}}_{2}}{{{\text{O}}}_{3}}} \right)}}_{{{\text{исх}}}}}}}} \right. \kern-0em} {m{{{\left( {{\text{F}}{{{\text{e}}}_{2}}{{{\text{O}}}_{3}}} \right)}}_{{{\text{исх}}}}}}}} \right). \\ \end{gathered} $РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В результате экспериментов были получены магнетитсодержащие (магнетизированные) шламы (МКШ) и бокситы (МБ), дифрактограммы которых приведены на рис. 1. Данные РФА и химического анализа (табл. 3) свидетельствуют о существенном снижении алюминийсодержащих фаз в продуктах по сравнению с сырьем, а также об изменении количественного соотношения фаз оксидов железа. При обработке КШ в присутствии FeSO4 и появлении восстановителя в пульпе, как и ожидалось, часть гематита переходит в магнетит Fe3O4. Общее содержание железа в продуктах увеличивается за счет растворения алюминия с соответствующим извлечением ω(Al2O3), а также в результате введения железосодержащих добавок.
Рис. 1.
Дифрактограммы исходного КШ (1) и продуктов обработки: МКШ1 (2), МКШ2 (3), МГем (4), МБ1 (5), МБ2 (6), МБ3 (7), МБ4 (8).
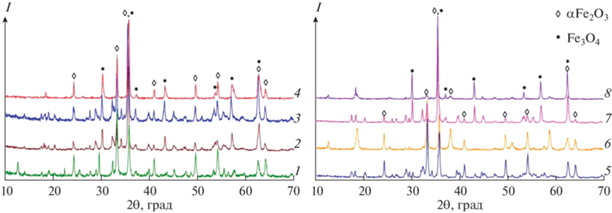
Таблица 3.
Результаты гидротермальной обработки
| Продукт | Содержание в продукте, мас. % | ω(Al2O3), % | ωmagn(Fe2O3), % | ||
|---|---|---|---|---|---|
| Al2O3 | Fe2O3 | Fe3O4 | |||
| МКШ1 | 3.50 | 20.1 | 32.4 | 75.9 | 61.7 |
| МКШ2 | 7.50 | 22.5 | 23.7 | 89.0 | 51.3 |
| МБ1 | 10.0 | 49.5 | 11.4 | 78.1 | 18.7 |
| МБ2 | 17.5 | 34.9 | 0.93 | 77.2 | 2.6 |
| МБ3 | 9.80 | 15.5 | 40.8 | 94.4 | 72.5 |
| МБ4 | 4.80 | 4.0 | 67.9 | 97.5 | 94.4 |
| МГем | – | 36.5α-/29.6γ- | 33.9 | – | 35.1 |
В образце МКШ1 при выщелачивании в присутствии Са(ОН)2 и FeSO4 содержание магнетита Fe3O4 (32.4%) соответствует степени конверсии гематита (51.9%) от исходного его количества в КШ. Обработка синтетического α-Fe2O3 в этих же условиях в присутствии FeSO4 приводит к синтезу в магнетизированном образце МГем практически такого же количества (33.9%) магнетита Fe3O4 и появлению 29.6% маггемита γ-Fe2O3. Таким образом, суммарное количество образовавшегося Fe3O4 обеспечивается взаимодействием частично гидратированного гематита с вводимыми ионами Fe(II), а в КШ дополнительно конверсией в присутствии собственных восстановителей при обработке в течение 2 ч. В работе [31] продолжительность полного фазового перехода гематита в магнетит в присутствии этилендиамина достигает 9 ч. Общее время синтеза наностержней Fe3O4 в присутствии мочевины через формирование композита Fe(OH)2–FeOOH, в котором гидроксид железа Fe(OH)2 осаждается на поверхности гетита FeOOH, составляет 24 ч [32]. Тем не менее высокая эффективность конверсии гематита из КШ (96.4%) может быть достигнута путем увеличения до 25% дозировки FeSO4 также при обработке в течение 2 ч [29].
Растворение в щелочной среде металлического Al приводит к появлению газообразного водорода, который является восстановителем. Несмотря на достаточное количество водорода, образующегося при обработке КШ в присутствии выбранной дозы металла, полного фазового перехода в образце МКШ2 не происходит. Количество Fe2O3 в остатке сокращается до 22.5 мас. %, и появляется 23.7 мас. % Fe3O4. Этот результат показывает наличие динамического равновесия между оксидами железа в щелочной среде, а также подтверждает преимущественный механизм синтеза магнетита через взаимодействие гематита с образовавшимися анионами ${\text{HFeO}}_{2}^{ - },$ а не с водородом [33].
Обработка боксита в щелочной среде в присутствии порошков металлов Fe, Ca, Mg или смеси 0.25Mg–0.25Al–0.5Fe не только приводит к растворению алюминия, но одновременно, как и в КШ, позволяет осуществить фазовое превращение гематита в магнетит. Присутствие алюминия в боксите в фазе бемита AlO(OH) позволяет понизить температуру обработки до 220°С. Выбор металлов в работе обусловлен и ограничен реакциями, протекающими при гидрохимическом выщелачивании бокситов. Использование щелочноземельных металлов Ca и Mg взамен извести для разрушения алюмосиликатов сырья обеспечило растворение алюминия и получение магнетизированных продуктов МБ1 и МБ2. Данные табл. 3 свидетельствуют о том, что замена Са на Mg оказалась менее эффективной как для извлечения глинозема (содержание Al2O3 остается высоким – 17.5 мас. %), так и для синтеза магнетита с величиной конверсии всего 2.6%. Ведение порошков Fe или смеси 0.25Mg–0.25Al–0.5Fe показывает лучшие результаты по снижению Al2O3 и Fe2O3 в остатке, при этом степень конверсии гематита в магнетит во втором случае выше и составляет 94.4%.
СЭМ-изображения на рис. 2 свидетельствуют, что морфология и размер частиц продуктов зависят от состава сырья и магнетизирующей добавки. Видно, что в магнетизированном образце МКШ1 (изображение 1 на рис. 2) сохраняется структура высокодисперсных частиц оксидов железа и алюмосиликатов исходного КШ. Во всех магнетизированных остатках от обработки бокситов вследствие растворения железосодержащих фаз, например гетита, формируются кубические и октаэдрические микрочастицы магнетита. При этом более крупные (до 5 мкм) полиэдры Fe3O4 обволакиваются большим количеством мелких частиц неопределенной формы. В порошках МКШ2 и МГем также обнаруживаются полиэдры Fe3O4, но их размер значительно меньше или достигает 1 мкм.
Рис. 2.
СЭМ-изображения продуктов гидротермальной обработки: МКШ1 (1) МКШ2 (2), МБ1 (3), МБ3 (4), МБ4 (5), МГем (6).

Для образцов, различающихся исходным сырьем, размером частиц и содержанием оксидов железа, были получены полевые зависимости при комнатной температуре. Изотермические петли гистерезиса М(Н), приведенные на рис. 3, свидетельствуют об усилении ферромагнитного поведения продуктов обработки по сравнению с исходным КШ (рис. 3, кривая 1), который характеризуется коэрцитивной силой HС = 200 Э, намагниченностью насыщения Мs = 2.90 эме/г в полях до 5 кЭ и остаточной намагниченностью Мr = 0.34 эме/г в нулевом поле. Слабый ферромагнетизм исходного КШ обусловлен присутствием незначительного количества магнитных примесей на фоне основного количества немагнитных алюмосиликатов, карбонатов и гематита Fe2O3.
Рис. 3.
Кривые намагничивания при комнатной температуре исходного КШ (1) и продуктов гидротермальной обработки: МКШ2 (2), МКШ1 (3), МБ3 (4), МГем (5). На вставке приведена увеличенная центральная часть графика для иллюстрации величины гистерезиса.
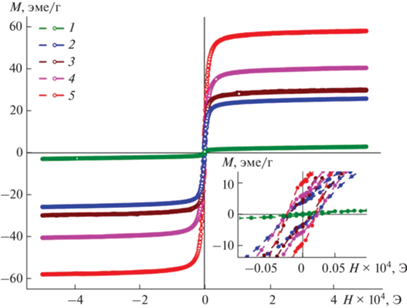
Для магнетизированных продуктов намагниченность Мs возрастает от 25 и практически до 60 эме/г в соответствии с содержанием Fe3O4 на фоне непрореагировавшего Fe2O3 и других немагнитных фаз. Для образцов МГем и МБ4, характеризующихся различным составом оксидов железа, кривые намагничивания полностью совпадают. Поэтому на рис. 3 приведена только одна кривая 1 для МГем, в котором достаточно высокая величина Мs = 57.5 эме/г обусловлена суммарным присутствием магнетита и маггемита γ-Fe2O3 на фоне 36.5% непрореагировавшего гематита. Это же значение Мs установлено для магнетизированного боксита МБ4, содержащего 67.9% Fe3O4 и соизмеримое с МГем количество немагнитных компонентов. Остаточная намагниченность Мr полученных образцов возрастает в том же порядке (вставка на рис. 3).
Магнитные свойства полученных продуктов сравнимы со значениями Мs = 43.8 эме/г и HС = = 104 Э при 300 K для маггемита γ-Fe2O3, синтезированного термолизом Fe(OH)(HCOO)2 на воздухе при 350°C [34]. В то же время максимальная намагниченность насыщения существенно ниже величины Мs = 97.4 эме/г для наночастиц магнетита, полученных в гидротермальных условиях [34]. Для магнитного концентрата, содержащего 34.2% Fe3O4 и 24.8% α-Fe2O3, эта величина составляет 65.5 эме/г [29]. Снижение Мs является не только следствием условий получения, определяющих состав железосодержащих фаз (Fe3O4, α-Fe2O3, γ-Fe2O3), но в большей степени присутствием немагнитных примесей, влияющих на общую намагниченность насыщения всего образца. Однако присутствие магнетита частично в виде монокристаллов также может приводить к увеличению намагниченности насыщения, как это наблюдается в порошках магнетизированных бокситов МБ3 и МБ4. В целом синтезированные магнетитсодержащие порошковые материалы состоят из частиц и агрегатов микронных размеров, обладающих многодоменной структурой, для которой наблюдаются достаточно высокие значения коэрцитивной силы HС = 200 Э. Причиной высокой коэрцитивности HС является наличие магнитокристаллической анизотропии, обусловленной формированием различных структурных полиэдров железа в двух степенях окисления.
ЗАКЛЮЧЕНИЕ
Гидротермальной обработкой природных бокситов и отходов от их переработки – КШ – в присутствии сульфата Fe(II) и металлов Al, Mg, Са, Fe были получены магнетитсодержащие материалы, обладающие свойствами, необходимыми для применения метода магнитной сепарации. Достаточно высокие значения намагниченности насыщения при комнатной температуре и кристалличность продуктов, в частности после выщелачивания бокситов, позволяют с большей эффективностью отделить магнитные оксиды железа от немагнитных фаз. Установлено высокое извлечение алюминия при выщелачивании боксита в присутствии восстановителей, которое достигает 97.5% в случае добавки смеси 0.25Mg–0.25Al–0.5Fe, при этом формирование крупнокристаллических частиц магнетита улучшает седиментационные качества магнетизированного остатка в щелочной пульпе по сравнению с высокодисперсным исходным КШ. В технологическом плане этот положительный эффект приводит к снижению потерь щелочей (соединений алюминия и натрия) с твердым остатком от гидротермального выщелачивания при разделении автоклавной пульпы.
Следует отметить, что растворение устойчивого гематита (как синтетического, так и сформировавшегося ранее при выщелачивании бокситов в составе КШ), последующее восстановление ионов железа(III), последующее зарождение и рост полиэдрических частиц Fe3O4 требуют большего времени, чем растворение природных минералов железа в бокситах. Полученные результаты подтверждают возможность создания нового подхода к получению востребованных магнитных материалов непосредственно из природного сырья, что позволит модифицировать технологию и повысить экономическую эффективность производства [35]. Перспективным будет применение в качестве магнетизирующих добавок металлических отходов, стружки, пыли и др. материалов, содержащих исследованные в работе металлы. Поэтому для эффективного внедрения более чистой технологии дальнейшие исследования будут направлены на оптимизацию условий синтеза магнитных оксидов железа с целью снижения количества промышленных отходов и повышения комплексности использования минерального сырья.
Список литературы
Ahamed A.M., Pons M.N., Ricoux Q. et al. // Miner. Eng. 2021. V. 170. Atr. 107030. https://doi.org/10.1016/j.mineng.2021
Gao L., Liu Z., Pan Y. et al. // Adv. Powder Technol. 2020. V. 31. P. 51. https://doi.org/10.1016/j.apt.2019.09.036
Long H., Chun T., Di Z. et al. // Metals. 2016. V. 6. № 4. Art. 88(9). https://doi.org/10.3390/met6040088
Grudinsky P., Zinoveev D., Yurtaeva A. et al. // J. Sustain. Metall. 2021. V. 7. P. 858.
Jang K.O., Nunna V.R.M., Hapugoda S. et al. // Miner. Eng. 2014. V. 60 P. 14. https://doi.org/10.1016/j.mineng.2014.01.021
Yuan S., Zhang Q., Yin H., Li Y. // J. Hazard. Mater. 2021. V. 404. Part B. Art. 124067. https://doi.org/10.1016/j.jhazmat.2020.124067
Pan Y., Zhu R., Banerjee S.K. et al. // J. Geophys. Res. 2000. V. 105. P. Is. B1. 783. https://doi.org/10.1029/1999JB900358
Sakthivel R., Vasumathi N., Sahu D., Mishra B.K. // Powder Technol. 2010. V. 201. № 2. P. 187. https://doi.org/10.1016/j.powtec.2010.03.005
Dhupe A., Gokarn A.N. // Int. J. Miner. Process. 1990. V. 28. № 3–4. P. 209. https://doi.org/10.1016/0301-7516(90)90043-X
Shahrashoub M., Bakhtiari S., Afroosheh F., Googheri M.S. // Colloids Surf., A. 2021. V. 622. Art. 126675. https://doi.org/10.1016/j.colsurfa.2021.126675
Shilova O.A., Nikolaev A.M., Kovalenko A.S. et al. // Russ. J. Inorg. Chem. 2020. V. 65. № 3. P. 426. [Шилова О.А., Николаев А.М., Коваленко А.С. и др. // Журн. неорган. химии. 2020. Т. 65. № 3. С. 398.] https://doi.org/10.1134/S0036023620030134
Gubin S.P., Yurkov G.Yu., Koksharov Yu.A., Khomutov G.B. // Russ. Chem. Rev. 2005. V. 74. № 6. P. 489. [Губин С.П., Кокшаров Ю.А., Хомутов Г.Б., Юрков Г.Ю. // Успехи химии. 2005. Т. 74. № 6. С. 539.] https://doi.org/10.1070/RC2005v074n06ABEH000897
Shkerin S.N., Kyz’min A.V., Gyrdasova O.I. et al. // Russ. J. Electrochem. 2017. V. 52. № 2. P. 154. [Шкерин С.Н., Кузьмин А.В., Гырдасова О.И. и др. // Электрохимия. 2017. Т. 53. № 2. С. 172.] https://doi.org/10.1134/S1023193517020124
Bazuev G.V., Gyrdasova O.I., Novikov S.I. et al. // Inorg. Mater. 2016. V. 52. № 9. P. 932. [Базуев Г.В., Гырдасова О.И., Новиков С.И., Кузнецов А.Ю. // Неорган. материалы. 2016. Т. 52. № 9. С. 997.]https://doi.org/10.1134/S0020168516090028
Yavuz E., Tokalıoğlu Ş., Patat Ş. // Food Chem. 2018. V. 263. P. 232. https://doi.org/10.1016/j.foodchem.2018.04.134
Рухлядева М.С., Никоненко Е.А., Исмагилова Г.В. и др. // Хим. технология. 2017. Т. 18. № 5. С. 218.
Huang G., Lu C.-H., Yang H.-H. // Novel nanomaterials for biomedical, environmental and energy applications. 2019. P. 89.
Roca A.G., Marco J.F., Serna C.J. et al. // J. Phys. Chem. C. 2007. V. 111. P. 18577. https://doi.org/10.1021/jp075133m
Vladimirova E.V., Dmitriev A.V., Kandaurov M.V. // Russ. J. Inorg. Chem. 2019. V. 64. № 6. P. 689. [Владимирова Е.В., Дмитриев А.В., Кондауров М.В. // Журн. неорган. химии. 2016. Т. 64. № 6. С. 565.]https://doi.org/10.1134/S0036023619060160
Pan Z., Wang Y., Huang H. et al. // Ceram. Int. 2015. V. 41. № 10. P. 12515. https://doi.org/10.1016/j.ceramint.2015.06.124
Agrawal S., Dhawan N. // Miner. Eng. 2021. V. 171. P. 107084. https://doi.org/10.1016/j.mineng.2021.107084
Archambo M.S., Kawatra S.K. // Miner. Process. Extr. Metall. Rev. 2021. V. 42. № 4. P. 222. https://doi.org/10.1080/08827508.2020.1720982
Ни Л.П., Гольдман М.М., Соленко Т.А. и др. Окислы железа в производстве глинозема. Алма-Ата: Наука, 1971. 127 с.
Zinoveev D., Pasechnik L.A., Fedotov M. et al. // Recycling. 2021. V. 6. № 2. P. 38. https://doi.org/10.3390/recycling6020038
Liu Y., Naidu R. // Waste Manage. 2014. V. 34. № 12. P. 2662. https://doi.org/10.1016/j.wasman.2014.09.003
Trushko V.L., Utkov V.A., Bazhin V.Y. // Metall. Min. Proc. 2017. V. 227. P. 547. https://doi.org/10.25515/PMI.2017.5.547
Smith P. // Hydromet. 2017. V. 170. P. 16. https://doi.org/10.1016/j.hydromet.2016.02.011
Li. X.B., Wang Y.L., Zhou Q.S. et al. // Hydromet. 2018. V. 175. P. 257. https://doi.org/10.1016/j.hydromet.2017.12.004
Pasechnik L.A., Skachkov V.M., Bogdanova E.A. et al. // Hydromet. 2020. V. 196. Art. 105438. https://doi.org/10.1016/j.hydromet.2020.105438
Lu J.F., Tsai C.J. // Nanoscale Res. Lett. 2014. V. 9. Art. 230. https://doi.org/10.1186/1556-276X-9-230
Lian S., Wang E., Kang Z. et al. // Solid State Commun. 2004. V. 129. Is. 8. P. 485. https://doi.org/10.1016/j.ssc.2003.11.043
Wang Y., Li X., Zhou Q. et al. // Hydrometallurgy. 2019. V. 189. Art. 105126. https://doi.org/10.1016/j.hydromet.2019.105126
Krasil'nikov V.N., Gyrdasova O.I., Tyutyunnik A.P. et al. // Dokl. Chem. 2018. V. 481. № 4. P. 161. [Красильников В.Н., Гырдсова О.А., Тютюнник А.П. и др. // Докл. АН. 2018. Т. 481. № 4. С. 386.]https://doi.org/10.1134/S0012500818080013
Ge S., Shi X., Sun K. et al. // J. Phys. Chem. C. 2009. V.113. № 31. P. 13593. https://doi.org/10.1021/jp902953t
Demortière A., Panissod P., Pichon B.P. et al. // Nanoscale. 2011. V. 3. P. 225. https://doi.org/10.1039/C0NR00521E
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии


