Журнал неорганической химии, 2023, T. 68, № 12, стр. 1731-1739
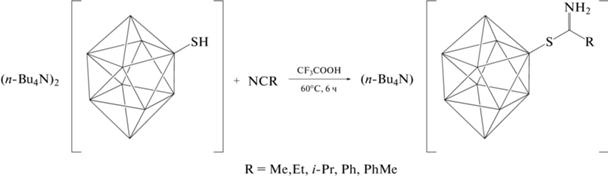
Синтез новых иминиевых производных сульфонио-клозо-декаборатного аниона (Bu4N)[2-B10H9SC(NH2)R] (R = –CH3, –CH2CH3, –CH(CH3)2, –Ph, –PhCH3)
А. В. Голубев a, *, А. С. Кубасов a, А. А. Лукошкова a, Н. А. Саркисов a, b, И. В. Новиков a, b, П. А. Стародубец a, c, А. Ю. Быков a, А. П. Жданов a, К. Ю. Жижин a, Н. Т. Кузнецов a
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва,
Ленинский пр-т, 31, Россия
b МИРЭА – Российский технологический университет (Институт тонких
химических технологий им. М.В. Ломоносова)
119571 Москва, пр-т Вернадского, 86, Россия
c Российский химико-технологический университет им. Д.И. Менделеева
125047 Москва,
Миусская пл., 9, Россия
* E-mail: golalekseival@mail.ru
Поступила в редакцию 14.07.2023
После доработки 04.08.2023
Принята к публикации 27.08.2023
- EDN: XEXONU
- DOI: 10.31857/S0044457X23601487
Аннотация
Получены новые иминиевые производные сульфонио-клозо-декаборатного аниона в виде тетрабутиламмониевых солей (Bu4N)[2-B10H9SC(NH2)R] (R = –CH3, –CH2CH3, –CH(CH3)2, –Ph, ‒PhCH3), в которых иминиевая группа выступает в качестве защитной и позволяет проводить дальнейшую модификацию кластерного аниона без вреда для сульфониевой группы. Соединения изучены методами элементного анализа, ИК- и 11B, 1H, 13C ЯМР-спектроскопии. Строение соединений (Bu4N)[2-B10H9SC(NH2)CH3] и (Bu4N)[2-B10H9SC(NH2)Ph] подтверждено данными рентгеноструктурного анализа. Выход целевых соединений составляет >80%.
ВВЕДЕНИЕ
На данный момент кластерные анионы бора и их производные находят все большее применение [1–3]. Они могут использоваться для создания термостойких [4] или координационных полимеров [5], в качестве функциональных групп в нанокомпозитах [6]. На основе кластерных анионов бора и их производных могут быть созданы ионные жидкие кристаллы [7, 8]. Лекарственные средства с включением кластеров бора могут применяться в медицине [9, 10]. Расширение разнообразия соединений, используемых в этих областях, может быть достигнуто введением нескольких одинаковых или различных функциональных групп в клозо-боратный кластер. На данный момент разработано большое число способов модификации кластерных анионов бора [11–13], которые позволяют ввести как один заместитель и имеют региоселективный характер по полиэдру [14–17], так и полностью заместить атомы водорода в борном остове [18–20]. Основной методикой получения производных кластерных анионов бора с двумя различными функциональными группами является поочередное введение иод-фенильной группы по апикальным позициям борного остова (1, 10) в клозо-декаборатном анионе с последующей их заменой [21–23].
Получение производных клозо-боратов с несколькими различными функциональными группами почти всегда базируется на проведении многостадийных синтезов. Однако очень часто реагенты, используемые для введения заместителей, могут вступать в нежелательные реакции с уже введенными функциональными группами. Одним из методов предотвращения таких взаимодействий является использование защитных групп для введенных ранее заместителей. Известно большое число различных защитных групп для –OH, –NH3 и –SH [24]. Например, для защиты спиртов применяются кремнийорганические защитные группы, которые легко разрушаются в кислой среде [25, 26]. Для защиты аминогрупп [27] может быть использована фталимидная защита [28]. Для проведения реакций Сузуки тиольные группы могут быть защищены с помощью 2-метоксиизобутирильной группы [29]. Другим способом защиты свободной SH-группы является перевод ее в тиоэфирную или окисление до симметричного дисульфида [30]. Однако условия проведения большинства таких реакций приводят и к одновременному замещению по борному остову.
В настоящей работе представлен метод получения новых иминиевых производных сульфонио-клозо-декаборатного аниона в виде тетрабутиламмониевых солей (Bu4N)[2-B10H9SC(NH2)R] (R = –CH3, –CH2CH3, –CH(CH3)2, –Ph, –PhCH3) путем взаимодействия исходного SH-производного (Bu4N)2[2-B10H9SH] с различными нитрилами (CH3CN, CH3CH2CN, (CH3)2CHCN, PhCN, CH3PhCN) в присутствии трифторуксусной кислоты. Иминиевая группа в подобных соединениях может рассматриваться как защитная для сульфониевой группы, и ее введение позволит проводить дальнейшую модификацию кластера, не затрагивая данную позицию борного остова. При этом иминиевая группа может быть легко снята в присутствии основания.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы. Соль (Bu4N)2[2-B10H9SH] получали по известной методике [31] путем взаимодействия ундекагидро-клозо-декаборатного аниона с тетраметилтиомочевиной с последующим их гидразинолизом. Ацетонитрил (CH3CN, 99%), пропионитрил (CH3CH2CN, 99%), изобутиронитрил ((CH3)2CHCN, 98%), бензонитрил (PhCN, 99%), п-толунитрил (CH3PhCN, 99%) и трифторуксусная кислота (CF3COOH, 99.8%) были коммерчески доступны и не требовали дополнительной очистки.
Элементный анализ на углерод, водород, азот и серу проводили на автоматическом анализаторе CHNS-3 FA 1108 Elemental Analyser (Carlo Erba).
ИК-спектры соединений записывали на ИК-фурье-спектрофотометре Инфралюм ФТ-08 (НПФ ФП “Люмекс”) в области 4000–400 см–1 с разрешением 1 см–1. Образцы готовили в виде спрессованных с KBr таблеток.
11В, 1Н, 13С ЯМР-спектры растворов исследуемых веществ в CD3CN записывали на импульсном фурье-спектрометре Bruker MSL-300 (ФРГ) на частотах 96.32, 300.3 и 75.49 МГц соответственно с внутренней стабилизацией по дейтерию. В качестве внешних стандартов использовали тетраметилсилан и эфират трифторида бора.
Рентгеноструктурные исследования. Набор дифракционных отражений для кристаллов соединений 1 и 4 получен в Центре коллективного пользования ИОНХ РАН на автоматическом дифрактометре Bruker D8 Venture (λMoKα, графитовый монохроматор, ω–ϕ-сканирование). Данные проиндексированы и интегрированы с помощью программы SAINT, была применена поправка на поглощение, основанная на измерениях эквивалентных отражений (SADABS) [32]. Структуры расшифрованы прямым методом с последующим расчетом разностных синтезов Фурье. Все неводородные атомы уточнены в анизотропном приближении. Все атомы водорода CH- и BH-групп уточнены по модели “наездника” с тепловыми параметрами Uизо = 1.2Uэкв (Uизо) соответствующего неводородного атома (1.5Uизо для СН3-групп).
Все расчеты проводили с использованием программы SHELXTL [33, 34]. Структура расшифрована и уточнена с помощью программного комплекса OLEX2 [35].
Основные кристаллографические данные, параметры эксперимента и характеристики уточнения структуры приведены в табл. 1. Кристаллографические данные депонированы в Кембриджском банке структурных данных (CCDС № 2279168 (1) и 2279169 (4)).
Таблица 1.
Основные кристаллографические данные для структур 1 и 4
| Соединение | 1 | 4 |
|---|---|---|
| Брутто-формула | C18H50B10N2S | C23H52B10N2S |
| М | 434.76 | 496.82 |
| Т, K | 150 | 150 |
| Сингония | Орторомбическая | Моноклинная |
| Пр. гр. | Pna21 | Cc |
| a, Å | 20.821(6) | 11.0055(18) |
| b, Å | 13.485(3) | 17.003(4) |
| c, Å | 9.9001(17) | 16.5707(19) |
| β, град | 90 | 95.105(4) |
| V, Å3 | 2779.7(11) | 3088.4(10) |
| Z | 4 | 4 |
| ρрасч, г/см3 | 1.039 | 1.068 |
| μ, мм–1 | 0.126 | 0.121 |
| F(000) | 952.0 | 1080.0 |
| Излучение (λ, нм) | MoKα (λ = 0.71073) | MoKα (λ = 0.71073) |
| Отражений всего | 17 138 | 13 932 |
| Независимых отражений | 6183 [Rint = 0.0432, Rsigma = 0.0539] | 6726 [Rint = 0.0212, Rsigma = 0.0336] |
| GOF по F2 | 1.031 | 1.071 |
| R1, wR2 по N0 | 0.0787, 0.2041 | 0.0407, 0.1054 |
| R1, wR2 по N | 0.1002, 0.2227 | 0.0430, 0.1071 |
Анализ поверхности Хиршфельда был выполнен с использованием программного обеспечения Crystal Explorer 17.5 [36]. Донорно-акцепторные пары визуализировали с использованием стандартного (высокого) разрешения поверхности и dnorm: поверхности отображаются в фиксированной цветовой шкале от –0.640 (красный) до 0.986 (голубой) а.е.
Стабильность иминиевых солей сульфонио-клозо-декаборатного аниона (Bu4N)[2-B10H9SC(NH2)R] (R = –CH3, –CH2CH3, –CH(CH3)2, –Ph, –PhCH3) изучали, растворяя соответствующие соли (20 мг) в смеси ацетонитрил/вода (2/1). Исследуемые растворы доводили до pH 2, 3.5, 5, 6.5, 7, 7.5, 9, 10.5, 12 с помощью уксусной CH3COOH и трифторуксусной CF3COOH кислот и гидроксидов калия KOH и аммония NH4OH. За процессом гидролиза следили с помощью 11В ЯМР-спектроскопии, сравнивая сигналы исходного и конечного продуктов в спектрах. Спектры для анализа были получены спустя 2, 5, 10, 30 мин, 1, 2, 4, 12, 24 ч.
Методика синтеза (Bu4N)[2-B10H9SC(NH2)R] (R = –CH3, –CH2CH3, –CH(CH3)2, –Ph, –PhCH3). В колбе на 25 мл растворяли соль (Bu4N)2[2-B10H9SH] (100 мг, 0.16 ммоль) в 10 мл смеси соответствующего нитрила (RCN) и трифторуксусной кислоты в соотношении 1 : 1. Полученный реакционный раствор нагревали до 60°С и оставляли при постоянном перемешивании в течение 6 ч в атмосфере аргона, после чего раствор упаривали на роторном испарителе до полного удаления жидкости. К полученному остатку добавляли 10 мл воды и обрабатывали на ультразвуковой ванне в течение 10 мин до образования осадка. Полученный осадок отфильтровывали и промывали последовательно дистиллированной водой (2 × 10 мл) и диэтиловым эфиром (2 × 10 мл). Окончательную очистку проводили с помощью флэш-хроматографии на силикагеле SiO2 с использованием элюента дихлорметан|дихлорметан/ацетонитрил (1/1). Полученную вторую органическую фракцию упаривали на роторном испарителе и высушивали в глубоком вакууме с помощью пластинчато-роторного насоса.
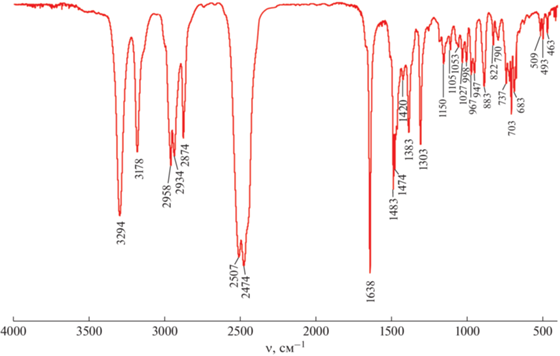
(Bu4N)[2-B10H9SC(NH2)CH3] (1). Из (Bu4N)2[2-B10H9SH] (100 мг, 0.16 ммоль) и ацетонитрила (CH3CN) получено соединение (Bu4N)[2-B10H9SC(NH2)CH3] (60.9 мг, 0.14 ммоль). Выход составил 89%. Ниже приведены данные элементного анализа для C18H50B10N2S. Найдено, %: С 49.63; Н 11.61; N 6.29; S 7.21. Вычислено, %: С 49.72; Н 11.59; N 6.44; S 7.37. 11B ЯМР-спектр (CD3CN, δ, м.д.): 2.8 (d, 2B, B(10)), –5.0 (d, 2B, B(1)), –20.5 (s, 1B, B(2)), –26.6 (d, 5B, B(3–5, 6, 9)), –28.5 (d, 2B, B(7, 8)). 1H ЯМР-спектр (CD3CN, δ, м.д.): 10.14 (bs, 1H, NH2), 9.11 (bs, 1H, NH2), 3.09 (m, 8H, Bu4N), 2.38 (s, 3H, CH3), 1.60 (m, 8H, Bu4N), 1.34 (m, 8H, Bu4N), 0.97 (t, 12H, Bu4N). 13C ЯМР-спектр (CD3CN): 199.0 (SC), 59.3 (Bu4N), 26.8 (CH3), 24.3 (Bu4N), 20.3 (Bu4N), 13.8 (Bu4N). ИК-спектр (KBr, ν, см–1): 3294, 3178, 2958, 2934, 2874, 2507, 2474, 1638, 1483, 1474, 1420, 1383, 1303, 1150, 1105, 1053, 1027, 998, 967, 947, 883, 822, 790, 737, 703, 683, 509, 493, 463.
(Bu4N)[2-B10H9SC(NH2)CH2CH3] (2). Из (Bu4N)2[2-B10H9SH] (100 мг, 0.16 ммоль) и пропионитрила (CH3CH2CN) получено соединение (Bu4N)[2-B10H9SC(NH2)CH2CH3] (62.8 мг, 0.14 ммоль). Выход 87%. Ниже приведены данные элементного анализа для C19H52B10N2S. Найдено, %: С 50.72; Н 11.59; N 6.13; S 7.02. Вычислено, %: С 50.85; Н 11.68; N 6.24; S 7.14. 11B ЯМР-спектр (CD3CN, δ, м.д.): 2.8 (d, 2B, B(10)), –4.9 (d, 2B, B(1)), –20.5 (s, 1B, B(2)), –26.6 (d, 5B, B(3–5, 6, 9)), –28.4 (d, 2B, B(7, 8)). 1H ЯМР-спектр (CD3CN, δ, м.д.): 10.13 (bs, 1H, NH2), 9.04 (bs, 1H, NH2), 3.09 (m, 8H, Bu4N), 2.62 (m, 2H, CH2CH3), 1.60 (m, 8H, Bu4N), 1.34 (m, 8H, Bu4N), 1.18 (t, 3H, CH2CH3), 0.97 (t, 12H, Bu4N). 13C ЯМР-спектр (CD3CN): 204.4 (SC), 59.3 (Bu4N), 34.0 (CH2CH3), 24.3 (Bu4N), 20.3 (Bu4N), 13.8 (Bu4N), 12.6 (CH2CH3). ИК-спектр (KBr, ν, см–1): 3292, 3175, 2953, 2936, 2875, 2502, 2474, 1640, 1479, 1471, 1423, 1385, 1305, 1145, 1102, 1049, 1031, 1001, 966, 943, 886, 823, 791, 736, 702, 681, 511, 491, 460.
(Bu4N)[2-B10H9SC(NH2)CH(CH3)2] (3). Из (Bu4N)2[2-B10H9SH] (100 мг, 0.16 ммоль) и изобутиронитрила ((CH3)2CHCN) получено соединение (Bu4N)[2-B10H9SC(NH2)CH(CH3)2] (64.1 мг, 0.14 ммоль). Выход 88%. Согласно результатам элементного анализа, для C20H54B10N2S найдено, %: С 51.75; Н 11.70; N 5.97; S 6.83; вычислено, %: С 51.90; Н 11.76; N 6.05; S 6.93. 11B ЯМР-спектр (CD3CN, δ, м.д.): 2.7 (d, 2B, B(10)), –5.0 (d, 2B, B(1)), –20.6 (s, 1B, B(2)), –26.6 (d, 5B, B(3–5, 6, 9)), –28.4 (d, 2B, B(7, 8)). 1H ЯМР-спектр (CD3CN, δ, м.д.): 10.15 (bs, 1H, NH2), 9.01 (bs, 1H, NH2), 3.09 (m, 8H, Bu4N), 2.91 (m, 1H, CH(CH3)2), 1.61 (m, 8H, Bu4N), 1.35 (m, 8H, Bu4N), 1.18 (d, 6H, CH(CH3)2), 0.97 (t, 12H, Bu4N). 13C ЯМР-спектр (CD3CN): 208.6 (SC), 59.3 (Bu4N), 39.9 (CH(CH3)2), 24.3 (Bu4N), 21.5 (CH(CH3)2), 20.3 (Bu4N), 13.8 (Bu4N). ИК-спектр (KBr, ν, см–1): 3292, 3179, 2953, 2936, 2872, 2504, 2476, 1636, 1483, 1473, 1419, 1386, 1303, 1149, 1101, 1043, 1031, 966, 943, 880, 825, 786, 741, 702, 679, 511, 489, 460.
(Bu4N)[2-B10H9SC(NH2)Ph] (4). Из (Bu4N)2[2-B10H9SH] (100 мг, 0.16 ммоль) и бензонитрила (PhCN) получено соединение (Bu4N)[2-B10H9SC(NH2)Ph] (66.5 мг, 0.13 ммоль). Выход 85%. Ниже представлены данные элементного анализа для C23H52B10N2S. Найдено, %: С 55.51; Н 10.51; N 5.57; S 6.32. Вычислено, %: С 55.60; Н 10.55; N 5.64; S 6.45. 11B ЯМР-спектр (CD3CN, δ, м.д.): 2.7 (d, 2B, B(10)), –5.1 (d, 2B, B(1)), –20.6 (s, 1B, B(2)), –26.6 (d, 5B, B(3–5, 6, 9)), –28.6 (d, 2B, B(7, 8)). 1H ЯМР-спектр (CD3CN, δ, м.д.): 10.35 (bs, 1H, NH2), 9.91 (bs, 1H, NH2), 7.78 (m, 2H, Ph), 7.66 (m, 1H, Ph), 7.50 (m, 2H, Ph), 3.09 (m, 8H, Bu4N), 1.60 (m, 8H, Bu4N), 1.34 (m, 8H, Bu4N), 0.97 (t, 12H, Bu4N). 13C ЯМР-спектр (CD3CN): 194.9 (SC), 135.0 (Ph), 134.6 (Ph), 130.0 (Ph), 128.3 (Ph), 59.3 (Bu4N), 24.3 (Bu4N), 20.3 (Bu4N), 13.8 (Bu4N). ИК-спектр (KBr, ν, см–1): 3323, 3177, 2961, 2934, 2874, 2510, 2477, 1624, 1472, 1419, 1388, 1324, 1306, 1272, 1191, 1131, 1067, 1031, 995, 943, 877, 824, 790, 737, 719, 660, 637.
(Bu4N)[2-B10H9SC(NH2)PhCH3] (5). Из (Bu4N)2[2-B10H9SH] (100 мг, 0.16 ммоль) и п‑толунитрила (MePhCN) получено (Bu4N)[2-B10H9SC(NH2)PhCH3] (68.5 мг, 0.13 ммоль). Выход 84%. По результатам элементного анализа для C24H55B10N2S, найдено, %: С 56.27; Н 10.80; N 5.39; S 6.18; вычислено, %: С 56.31; Н 10.83; N 5.47; S 6.26. 11B ЯМР-спектр (CD3CN, δ, м.д.): 2.7 (d, 2B, B(10)), –5.1 (d, 2B, B(1)), –20.6 (s, 1B, B(2)), –26.6 (d, 5B, B(3–5, 6, 9)), –28.6 (d, 2B, B(7, 8)). 1H ЯМР-спектр (CD3CN, δ, м.д.): 10.27 (bs, 1H, NH2), 9.88 (bs, 1H, NH2), 7.70 (m, 2H, Ph), 7.32 (m, 2H, Ph), 3.09 (m, 8H, Bu4N), 2.39 (s, 3H, PhCH3), 1.60 (m, 8H, Bu4N), 1.34 (m, 8H, Bu4N), 0.97 (t, 12H, Bu4N). 13C ЯМР-спектр (CD3CN): 194.2 (SC), 146.4 (Ph), 131.7 (Ph), 130.6 (Ph), 128.3 (Ph), 59.3 (Bu4N), 24.3 (Bu4N), 21.6 (PhCH3), 20.3 (Bu4N), 13.8 (Bu4N). ИК-спектр (KBr, ν, см–1): 3319, 3178, 2958, 2935, 2876, 2505, 2476, 1628, 1470, 1420, 1386, 1320, 1302, 1270, 1189, 1130, 1068, 1030, 1000, 939, 878, 825, 790, 741, 720, 659, 641.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Синтез. Введение защитной группы для сульфанильной группы в производном клозо-декаборатного аниона было проведено путем взаимодействия между сульфанил-клозо-декаборатным анионом в виде тетрабутиламмониевой соли с соответствующим нитрилом в присутствии трифторуксусной кислоты (схема 1 ).
Схема 1 . Схема синтеза иминиевых производных сульфонио-клозо-декаборатного аниона.
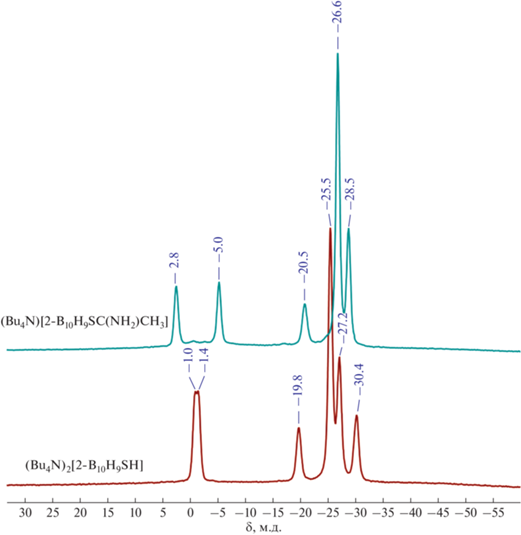
По данным 11В ЯМР-спектроскопии (рис. 1), в полученном соединении после реакции взаимодействия сульфанил-клозо-декаборатного аниона и нитрила наблюдается следующая картина. Сигналы от апикальных вершин, в отличие от исходного сульфанил-клозо-декаборатного аниона, расходятся в сильное и слабое поле на 7.8 м.д. и находятся при 2.8 и –5.0 м.д. Сигнал от ипсо-атома бора в полиэдре смещается в сильное поле на 0.7 до –20.5 м.д. Сигналы от остальных экваториальных атомов бора перераспределяются с интегральным соотношением 5 : 2 и находятся при ‒26.6 и –28.5 м.д. соответственно, тогда как в исходном сульфанил-клозо-декаборатном анионе данные сигналы находятся при –25.5, –27.2 и –30.4 м.д. с интегральным соотношением 4 : 2 : 1.
В 1Н и 13С ЯМР-спектрах наблюдаются две группы сигналов от тетрабутиламмониевого катиона и органической части в замещенной позиции борного остова (табл. 2). В области слабого поля в 1Н ЯМР-спектрах в диапазоне 10.2–9.0 м.д. присутствуют два сигнала, относящихся к протонам атома азота в иминиевой группе. При наличии ароматического кольца в остатке R сигналы от этих протонов смещаются в область слабого поля и находятся в диапазоне 10.4–9.8 м.д. Данный эффект наблюдается и в 13С ЯМР-спектрах для атома углерода в иминиевой группе.
Таблица 2.
Данные 1Н и 13С ЯМР-спектроскопии для замещенных позиций в соединениях 1–5
| Группа | Me | Et | i-Pr | Ph | MePh |
|---|---|---|---|---|---|
| 1H | |||||
| NH2 | 10.14 | 10.13 | 10.15 | 10.35 | 10.27 |
| 9.11 | 9.04 | 9.01 | 9.91 | 9.88 | |
| R | 2.38 (CH3) | 2.62 (CH2) | 2.91 (CH) | 7.78 (Ph) | 7.70 (Ph) |
| 1.18 (CH3) | 1.18 (CH3) | 7.66 (Ph) | 7.32 (Ph) | ||
| 7.50 (Ph) | 2.39 (CH3) | ||||
| 13C | |||||
| SC | 199.0 | 204.4 | 208.6 | 194.9 | 194.2 |
| R | 26.8 (CH3) | 146.4(Ph) | |||
| 135.0 (Ph) | 131.7 (Ph) | ||||
| 34.0 (CH2) | 39.9 (CH) | 134.6 (Ph) | 130.6 (Ph) | ||
| 12.6 (CH3) | 24.4 (CH3) | 130.0 (Ph) | 128.3 (Ph) | ||
| 128.3 (Ph) | 21.6 (CH3) | ||||
В ИК-спектрах (рис. 2) полученных соединений можно наблюдать полосы при 3294 и 3178 см–1, характерные для валентных колебаний N–H. Полосы в диапазоне 2958–2874 см–1 характерны для валентных колебаний C–H, полосы при 2507 и 2474 см–1 – для валентных колебаний B–H. Интенсивная узкая полоса при 1638 см–1 отвечает колебаниям связи C=N. Остальные полосы в области малых волновых чисел (<1500 см–1) соответствуют деформационным колебаниям в соединении (n-Bu4N)[2-B10H9SC(NH2)R].
Исследование стабильности полученных целевых соединений в растворе ацетонитрил/вода (2/1) проводили с помощью 11В ЯМР-спектроскопии. По данным 11В ЯМР-спектроскопии, соединения ((Bu4N)[2-B10H9SC(NH2)R] (R = –CH3, –CH2CH3, –CH(CH3)2, –Ph, –PhCH3)) устойчивы при нормальных условиях и в присутствии органических кислот (уксусная и трифторуксусная, pH < 7), тогда как добавление небольших количеств основания (KOH, NH4OH, pH >7.5) приводит к снятию имминиевой группы с обратным получением сульфанил-клозо-декаборатного аниона [B10H9SH]2–.
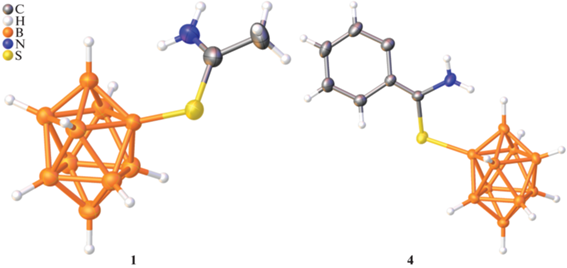
Исследование структур. Структура анионов в соединениях 1 и 4 представлена на рис. 3. Соединение 1 кристаллизуется в орторомбической элементарной ячейке (пр. гр. Pna21), а соединение 4 – в моноклинной (пр. гр. Сс). Длины связи B–S составляют 1.903(5) и 1.896(3) Å для 1 и 4 соответственно и типичны для большинства S-замещенных клозо-боратов [31, 37–39]. Длины связи S–C составляют 1.708(6) Å в анионе соединения 1 и 1.705(2) Å в анионе соединения 4, что существенно короче среднего значения для одинарных связей S–C (1.819 Å) и близко к длине связи в других иминиевых солях, доступных в Кембриджской базе структурных данных [40, 41], что говорит о сопряжении связей S–C=N. Длины связи N=C составляют 1.276(7) и 1.308(3) Å для 1 и 4 соответственно, что также соотносится со значениями, полученными для тиоимминиевых производных. Углы SCN составляют 123.2(4)° (1) и 122.5(2)° (4).
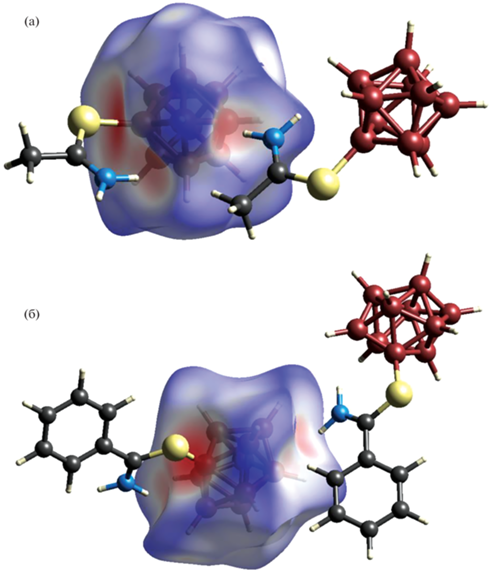
Анализ поверхности Хиршфельда борных остовов B10H9 в анионах соединений 1 и 4 показывает наличие внутри- и межмолекулярных коротких контактов NH…H(B) и NH…B, где расстояния между атомами меньше суммы их ван-дер-ваальсовых радиусов (рис. 4). Расстояния H…H и H…B приведены в табл. 3. Подобные взаимодействия с производными клозо-боратных анионов наблюдались также для катиона Et3NH+ [37]. Белые пятна на поверхности борных остовов соответствуют контактам CH…H/B.
Таблица 3.
Длины внутри- (вн.) и межмолекулярных (меж.) водородных связей NH…H/B в соединениях 1 и 4 (Å)
| Соединение | NH…H (вн.) | NH…B (вн.) | NH…H (меж.) | NH…B (меж.) |
|---|---|---|---|---|
| 1 | 2.2406(3) | 2.487(6) | 2.2031(3) | 2.589(6) |
| 4 | 2.2829(5) | 2.455(3) | 2.3461(2) | 2.723(3) |
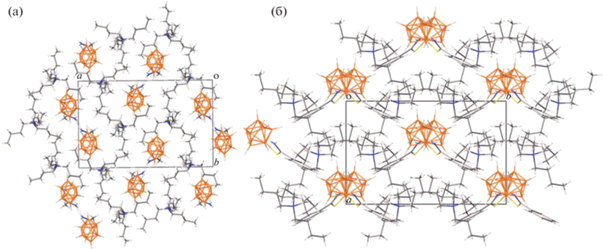
Связанные водородными связями NH…H/B в зигзагообразные цепочки анионы соединений 1 и 4 расположены в каналах, состоящих из катионов тетрабутиламмония, параллельно оси с (рис. 5). Как показывает анализ поверхности Хиршфельда анионов, катионы тетрабутиламмония связаны с борными остовами за счет большого числа слабых контактов CH…H/B, на что указывает также упорядоченная структура склонного к разупорядоченности катиона.
ЗАКЛЮЧЕНИЕ
Разработана методика введения защитной группы для сульфанильной группы в клозо-декаборатном анионе [B10H9SH]2– на основе получения иминиевых солей через взаимодействие исходного производного с различными нитрилами (CH3CN, CH3CH2CN, (CH3)2CHCN, PhCN, MePhCN) в присутствии трифторуксусной кислоты. Исследование стабильности этих соединений показало, что данная защитная группа устойчива при нормальных условиях и в присутствии таких кислот, как уксусная и трифторуксусная, но является легко уходящей в присутствии оснований с обратным получением сульфанил-клозо-декаборатного аниона [B10H9SH]2–.
Список литературы
Dash B.P., Satapathy R., Maguire J.A. et al. // New J. Chem. 2011. V. 35. № 10. P. 1955. https://doi.org/10.1039/c1nj20228f
Axtell J.C., Saleh L.M.A., Qian E.A. et al. // Inorg. Chem. 2018. V. 57. № 5. P. 2333. https://doi.org/10.1021/acs.inorgchem.7b02912
Stogniy M.Y., Bogdanova E.V., Anufriev S.A. et al. // Russ. J. Inorg. Chem. 2022. V. 67. № 10. P. 1537. https://doi.org/10.1134/S0036023622600848
Dash B.P., Satapathy R., Gaillard E.R. et al. // J. Am. Chem. Soc. 2010. V. 132. № 18. P. 6578. https://doi.org/10.1021/ja101845m
Bae Y.S., Spokoyny A.M., Farha O.K. et al. // Chem. Commun. 2010. V. 46. № 20. P. 3478. https://doi.org/10.1039/b927499e
Gao S., Zhu Y., Hosmane N. // Boron-Based Compd. Potential Emerg. Appl. Med. 2018. P. 371. https://doi.org/10.1002/9781119275602.ch3.4
Jankowiak A., Kanazawa J., Kaszynski P. et al. // J. Organomet. Chem. 2013. V. 747. P. 195. https://doi.org/10.1016/j.jorganchem.2013.05.034
Goossens K., Lava K., Bielawski C.W. et al. // Chem. Rev. 2016. V. 116. № 8. P. 4643. https://doi.org/10.1021/cr400334b
Ali F., S Hosmane N., Zhu Y. // Molecules. 2020. V. 25. № 4. P. 828. https://doi.org/10.3390/molecules25040828
Matveev E.Y., Garaev T.M., Novikov S.S. et al. // Russ. J. Inorg. Chem. 2023. V. 68. № 6. P. 670. https://doi.org/10.1134/S0036023623600533
Sivaev I.B., Prikaznov A.V., Naoufal D. // Collect. Czech. Chem. Commun. 2010. V. 75. № 11. P. 1149. https://doi.org/10.1135/cccc2010054
Nelyubin A.V., Klyukin I.N., Selivanov N.A. et al. // Russ. J. Inorg. Chem. 2023. V. 68. № 6. P. 658. https://doi.org/10.1134/S003602362360048X
Voinova V.V., Klyukin I.N., Novikov A.S. et al. // Russ. J. Inorg. Chem. 2021. V. 66. № 3. P. 295. https://doi.org/10.1134/S0036023621030190
Matveev E.Y., Retivov V.M., Razgonyaeva G.A. et al. // Russ. J. Inorg. Chem. 2011. V. 56. № 10. P. 1549. https://doi.org/10.1134/S0036023611100160
Kubasov A.S., Turishev E.S., Golubev A.V. et al. // Inorg. Chim. Acta. 2020. V. 507. № March. P. 119589. https://doi.org/10.1016/j.ica.2020.119589
Mindich A.L., Bokach N.A., Kuznetsov M.L. et al. // Chempluschem. 2012. V. 77. № 12. P. 1075. https://doi.org/10.1002/cplu.201200257
Neumolotov N.K., Selivanov N.A., Bykov A.Y. et al. // Russ. J. Inorg. Chem. 2022. V. 67. № 10. P. 1583. https://doi.org/10.1134/S0036023622600861
Ivanov S.V., Miller S.M., Anderson O.P. et al. // J. Am. Chem. Soc. 2003. V. 125. № 16. P. 4694. https://doi.org/10.1021/ja0296374
Bolli C., Derendorf J., Jenne C. et al. // Eur. J. Inorg. Chem. 2017. V. 2017. № 38. P. 4552. https://doi.org/10.1002/ejic.201700620
Warneke J., Konieczka S.Z., Hou G.L. et al. // Phys. Chem. Chem. Phys. 2019. V. 21. № 11. P. 5903. https://doi.org/10.1039/c8cp05313h
Jankowiak A., Baliński A., Harvey J.E. et al. // J. Mater. Chem. C. 2013. V. 1. № 6. P. 1144. https://doi.org/10.1039/c2tc00547f
Kaszyński P., Ringstrand B. // Angew. Chem. Int. Ed. 2015. V. 54. № 22. P. 6576. https://doi.org/10.1002/anie.201411858
Voinova V.V., Selivanov N.A., Bykov A.Y. et al. // Russ. J. Inorg. Chem. 2023. V. 68. № 6. P. 678. https://doi.org/10.1134/S003602362360017X
Schelhaas M., Waldmann H. // Angew. Chem. Int. Ed. 1996. V. 35. № 18. P. 2056. https://doi.org/10.1002/anie.199620561
Bols M., Pedersen C.M. // Beilstein J. Org. Chem. 2017. V. 13. P. 93. https://doi.org/10.3762/bjoc.13.12
Davies J.S., Higginbotham C.L., Tremeer E.J. et al. // J. Chem. Soc., Perkin Trans. 1992. № 22. P. 3043. https://doi.org/10.1039/p19920003043
Dangerfield E.M., Plunkett C.H., Win-Mason A.L. et al. // J. Org. Chem. 2010. V. 75. № 16. P. 5470. https://doi.org/10.1021/jo100004c
Reddy P.Y., Kondo S., Toru T. // J. Org. Chem. 1997. V. 62. № 8. P. 2652. https://doi.org/https://doi.org/10.1021/jo962202c
Zeysing B., Gosch C., Terfort A. // Org. Lett. 2000. V. 2. № 13. P. 1843. https://doi.org/10.1021/ol0058902
Greene T.W., Wuts P.G.M. // Protection for the Thiol Group, in: Prot. Groups Org. Synth., John Wiley, 1999: pp. 454–493. https://doi.org/10.1002/0471220574
Kubasov A.S., Turishev E.S., Polyakova I.N. et al. // J. Organomet. Chem. 2017. V. 828. P. 106. https://doi.org/10.1016/j.jorganchem.2016.11.035
Bruker, SAINT, Bruker AXS Inc.: Madison (WI), USA 2018 // n.d.
Sheldrick G.M. // Acta Crystallogr., Sect. C: Struct. Chem. 2015. V. 71. P. 3. https://doi.org/10.1107/S2053229614024218
Krause L., Herbst-Irmer R., Sheldrick G.M. et al. // J. Appl. Crystallogr. 2015. V. 48. № 1. P. 3. https://doi.org/10.1107/S1600576714022985
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Crystallogr. 2009. V. 42. № 2. P. 339. https://doi.org/10.1107/S0021889808042726
Spackman P.R., Turner M.J., McKinnon J.J. et al. // J. Appl. Crystallogr. 2021. V. 54. P. 1006. https://doi.org/10.1107/S1600576721002910
Kubasov A.S., Golubev A.V., Bykov A.Y. et al. // J. Mol. Struct. 2021. V. 1241. P. 130591. https://doi.org/10.1016/j.molstruc.2021.130591
Ali M.O., Lasseter J.C., Żurawiński R. et al. // Chem. – A Eur. J. 2019. V. 25. № 10. P. 2616. https://doi.org/10.1002/chem.201805392
Kultyshev R.G., Liu J., Meyers E.A. et al. // Inorg. Chem. 2000. V. 39. № 15. P. 3333. https://doi.org/10.1021/ic000198o
Axhausen J., Ritter C., Lux K. et al. // Z. Anorg. Allg. Chem. 2013. V. 639. № 1. P. 65. https://doi.org/10.1002/zaac.201200419
Chang H.C., Hsu Y.C., Chen C.H. et al. // Dalton Trans. 2015. V. 44. № 48. P. 20808. https://doi.org/10.1039/c5dt03316k
Дополнительные материалы
- скачать ESM_1.zip
- Приложение 1.
1 cifreport
- скачать ESM_2.zip
- Приложение 2.
4 cifreport
Инструменты
Журнал неорганической химии