Журнал неорганической химии, 2023, T. 68, № 12, стр. 1824-1830
Потенциометрический метод определения биологически неразлагаемых антимикробных веществ
Е. С. Турышев a, *, А. С. Кубасов a, А. В. Голубев a, К. Ю. Жижин a, Н. Т. Кузнецов a
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва,
Ленинский пр-т, 31, Россия
* E-mail: tyrishev@gmail.com
Поступила в редакцию 31.07.2023
После доработки 18.08.2023
Принята к публикации 19.08.2023
- EDN: RIYEOA
- DOI: 10.31857/S0044457X23601633
Аннотация
Разработаны ионоселективные электроды (ИСЭ) на основе полимерных пластифицированных мембран для определения бензалкония хлорида (алкилдиметилбензиламмония), в качестве активного компонента выступает бис-октодецил-2-сульфонио-клозо-декаборат цезия Cs[B10H9S(C18H37)2] (сенсор А), для определения норфлоксацина гидрохлорида активным компонентом служит трис-октодецил-1-аммонио-клозо-декаборат калия K[B10H9N(C18H37)3] (сенсор Б). Показано, что электроды обладают обратимым потенциометрическим откликом по отношению к анализируемым катионам в присутствии ряда других неорганических и органических катионов. Исследовано влияние концентрации электродно-активного вещества на электрохимические характеристики изготовленного сенсора. Найден оптимальный состав ион-чувствительной мембраны. Установлено, что разработанные сенсоры обеспечивают широкий диапазон определяемых концентраций (для сенсора А 2 × 10–7–1 × 10–2, для сенсора Б 1 × 10–7–1 × 10–2) и низкий предел обнаружения (для сенсора А 1 × 10–7 М, для сенсора Б 8 × 10–8 М). Новые ИСЭ могут быть рекомендованы для прямого потенциометрического детектирования свободных ионов в водоемах и водных вытяжках почв.
ВВЕДЕНИЕ
Аналитическое определение биологически неразлагаемых соединений в водоемах и почвах является актуальной, но не простой задачей. Четвертичные аммониевые соли имеют широкое применение, в частности, бензалкония хлорид (алкилдиметилбензиламмония) используется для дезинфекции материалов, стерилизации оборудования, в древесной промышленности для предотвращения деградации древесины, как бактерицид и фунгицид в ветеринарии и сельском хозяйстве, а также как компонент некоторых медикаментов. Однако бензалконий плохо разлагается и может накапливаться в окружающей среде [1, 2], поэтому важной задачей является контроль неразлагаемых соединений в водоемах и почвах. Основными методами анализа являются жидкостная хроматография [3, 4], хромато-масс-спектрометрия [5], различные спектральные методы [6]. Тем не менее вопрос об экспресс-методе определения бензалкония остается открытым.
Синтетические фторсодержащие антибиотики, например фторхинолоны, также плохо разлагаются и имеют тенденцию к накоплению, что вредит окружающей среде [7–9]. Для определения норфлоксацина, простейшего представителя фторхинолонов, применяют люминесцентные [10], хроматографические [11] и даже электрохимические методы [12]. В свою очередь, фторхинолоны применяются в медицине при лечении сепсиса, инфекций малого таза, сибирской язвы, туберкулеза, менингита. Поэтому важно контролировать количество антибиотиков в лабораторных образцах и окружающей среде.
Экспрессным и незатратным методом определения органических веществ может выступать ионометрия, тем не менее детектирование органических соединений усложняется наличием в них нескольких функциональных групп, поэтому необходимо подобрать электродно-активное вещество (ЭАВ), которое будет селективно взаимодействовать с определяемым ионом. Сложные модифицированные системы клозо-декаборатных анионов идеально выступают в роли многофункциональных центров, которые обратимо связываются с конкретными органическими ионами [13]. Область применения бороводородов в последние годы неуклонно расширяется. Разработан ряд ионоселективных сенсоров для определения различных органических веществ [14–16]. Контролируемая модификация, прежде всего серо- и азотсодержащих производных кластерных анионов бора, позволяет получать функциональные соединения [17, 18], которые могут использоваться в ионометрии при детектировании органических веществ.
Цель настоящей работы заключается в получении ионоселективных электродов (ИСЭ) для потенциометрического определения хлорида бензалкония и гидрохлорида норфлоксацина. Для этого в полимерную пластифицированную мембрану вводили активные компоненты Cs[B10H9S(C18H37)2] или K[B10H9N(C18H37)3] и изучали их потенциометрические параметры. Мембрана, содержащая аммониевое производное кластерного аниона бора, селективно определяет активность (концентрацию) ионов протонированной формы норфлоксацина, а мембрана, содержащая сульфониевое производное, – ионы бензалкония. Аналитический сигнал ИСЭ, регистрируемый в условиях, близких к нулевому току, и соответствующий измерению величины электродвижущей силы (э. д. с. = = ∆Е = ЕИСЭ – ЕЭС) электрохимической системы, позволяет обеспечить экспрессное детектирование органических ионов в широком концентрационном диапазоне и относительную простоту интерпретации полученных результатов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реагенты и растворы. В работе использовали реактивы марки “ч. д. а.” или “х. ч.”: дибутилфталат (ДБФ), 1-октодецил бромид, карбонат цезия, гидроксид калия (б/в), хлорид бензалкония (Sigma-Aldrich), гидрохлорид норфлоксацина (Sigma-Aldrich), поливинилхлорид (ПВХ, high molecular weight. Selectophore Fluka), N,N-диметилформамид (ДМФА), свежеперегнанный тетрагидрофуран (ТГФ), ацетонитрил, дистиллированную воду, гексан, дейтерированный диметилсульфоксид (ДМСО-d6). Соли сульфанил-клозо-декабората цезия Cs2[2-B10H9SH] и 1-амино-клозо-декабората калия K[1-B10H9NH3] были синтезированы и идентифицированы в лаборатории химии легких элементов и кластеров ИОНХ РАН [19, 20]. Исходные растворы бензалкония хлорида и норфлоксацина гидрохлорида (0.1 M) готовили растворением точной навески препарата в деионизированной воде. Остальные рабочие растворы (0.01–1 × 10–8 М) были приготовлены путем последовательного разбавления исходного раствора.
Получение электродно-активных веществ (ЭАВ)
А. Cs[2-B10H9S(n-C18H37)2]. Навеску Cs[2-B10H9SH] (100 мг, 354 ммоль) и карбонат цезия (34 мг, 177 ммоль) помещали в колбу объемом 25 мл и растворяли в ДМФА (5 мл), добавляли 1-октодецил бромид (236 мг, 708 ммоль) и нагревали при 90°C в течение 3 ч в атмосфере азота. Раствор отфильтровывали от осадка, ДМФА отгоняли с помощью роторного испарителя. Для очистки вещества добавляли воду (10 мл) и гексан (10 мл) и обрабатывали полученную смесь на УЗ-ванне в течение 30 мин, после чего суспензию центрифугировали в течение 20 мин, растворители сливали, процедуру проводили дважды. Затем осадок высушивали под глубоким вакуумом. Выход 85%.
Для C36H83CsB10S рассчитано, %: C 54.79; H 10.60; S 4.06. Найдено, %: C 54.59; H 10.72; S 3.96.
11B{1H} ЯМР-спектр (ДМСО‑d6, δ, ppm): 3.4 (d, 1B); −3.0 (d, 1B); −15.6 (s, 1B); −25.5 (d, 5B); −28.2 (d, 2B).
1H ЯМР-спектр (ДМСО‑d6, δ, ppm): 2.68 (dt, 4H, J1 = 7.87, J2 = 1.94, SCHAHB); 1.66 (m, 12H, SCH2CH2); 1.36 (m, 12H, C3H2, n-Bu4N+); 1.26 (m, 56H, C4H2–C17H2); 0.87 (t, 6H, J = 7.15, CH3); 0.60–2.10 (m, 9H, B10H9).
13C ЯМР-спектр (DMSO‑d6, δ, ppm): 41.4 (C1); 31.6 (C2); 28.9, 28.2, 27.8, 27.1, 25.2, 22.3 (C3–C17); 13.0 (C18).
ИК-спектр (KBr, ν, cм−1): 2955, 2915, 2870, 2475, 1461, 1419, 1379, 1340, 1223, 1101, 1000, 951, 831, 789, 742, 676.
Б. K[1-B10H9N(n-C18H37)3]. Навеску KB10H9NH3 (100 мг, 577 ммоль) помещали в колбу объемом 25 мл и растворяли в ДМФА (10 мл), после чего добавляли мелкоизмельченный гидроксид калия (323 мг, 5770 ммоль) и избыток 1-октодецил бромида (962 мг, 2885 ммоль). Реакционную смесь оставляли на 2 сут при комнатной температуре при постоянном перемешивании в атмосфере азота. Далее растворитель отгоняли на роторном испарителе и сушили вещество под глубоким вакуумом в течение 1.5 ч. Полученную смесь обрабатывали на УЗ-ванне в течение 30 мин с ацетонитрилом (10 мл), органическую фракцию упаривали на роторном испарителе и пропускали через хроматографическую колонку с последовательным добавлением элюентов: петролейного эфира (20 мл), смеси петролейного эфира и дихлорметана в соотношении 1 : 1 (20 мл), ацетонитрила. Ацетонитрильную фракцию упаривали на роторном испарителе и сушили вещество под глубоким вакуумом в течение 1 ч. Выход 65%.
Для C54H120KB10N рассчитано, %: C 69.68; H 12.99; N 1.50. Найдено, %: C 69.47; H 12.84; N 1.47.
11B{1H} ЯМР-спектр (ДМСО‑d6, δ, ppm): –2.1 (d, 1B); –5.6 (m, 2B); –26.0 (d, 4B); –31.4 (d, 3B);
1H ЯМР-спектр (ДМСО‑d6, δ, ppm): 2.91 (m, 6H, NCH2); 1.46 (m, 6H, NCH2CH2); 1.26 (m, 90H, C3H2–C17H2); 0.88 (t, 9H, J = 7.25, CH3); 0.60–2.10 (m, 9H, B10H9).
13C ЯМР-спектр (DMSO‑d6, δ, ppm): 62.0 (C1); 32.5 (C2); 30.3, 30.2, 29.9, 29.7, 27.7, 24.6, 23.8 (C3–C17); 14.5 (C18).
ИК-спектр (KBr, ν, см−1): 2985, 2906, 2844, 2465, 1502, 1486, 1396, 1344, 1285, 1152, 995, 923, 874, 763, 723, 686.
Изготовление ИСЭ с пластифицированными ПВХ-мембранами. Для получения пластифицированных ПВХ-мембран использовали ранее разработанную методику [21]. Точную навеску ЭАВ сначала растворяли в пластификаторе – дибутилфталате, а затем смешивали с заранее приготовленным раствором ПВХ в ТГФ. Полученную смесь тщательно перемешивали и переносили в стеклянное кольцо с внутренним диаметром 28 мм, расположенное на гладкой стеклянной поверхности. Сверху кольцо накрывали слоем 5 мм фильтровальной бумаги, которую придавливали свинцовым грузом (для равномерного испарения ТГФ с поверхности). После испарения ТГФ в термостате при 32°С в течение 48 ч мембрану выдерживали под вакуумом в течение 60 мин. В итоге получали прозрачную полимерную пленку со средней толщиной ~0.3 мм. Далее из нее вырезали диски диаметром 9.5 мм, которые помещали в стандартный корпус электрода фирмы Philips IS 561. Перед работой изготовленный сенсор выдерживали в 1 × 10–4 M растворе измеряемого вещества в течение 15–30 мин.
Методы анализа и аппаратура. Потенциометрические измерения проводили с помощью рН/ион-анализатора Radelkis ОР-300, используя гальваническую цепь следующего вида:
В качестве внутреннего раствора сравнения использовали 1 × 10–4 М раствор бромида тетрабутиламмония, выбранный с учетом достаточно низкой энергии гидратации катиона тетрабутиламмония. Внешним электродом сравнения служил хлорсеребряный электрод Radelkis ОР-0820. Электродную функцию регистрировали в диапазоне 1 × 10–8–1 × 10–1 M с использованием свежеприготовленных растворов, начиная с растворов с меньшей концентрацией аниона. Электродный потенциал фиксировали как среднеарифметическое из трех значений, различающихся не более чем на 0.5 мВ. Исследуемые растворы перемешивали при помощи магнитной мешалки. Температура в процессе измерений составляла 25 ± 1°С.
Элементный анализ ЭАВ на содержание углерода и водорода выполняли на автоматическом газоанализаторе CHNS_3 FA 1108 Elemental Analyser (Carlo Erba). ИК-спектры получали на ИК-фурье-спектрометре ИНФРАЛЮМ ФТ-02 в диапазоне 400–4000 см–1. Образцы готовили диспергированием исследуемого вещества в вазелиновом или фторированном масле Fluorolube. Спектры ЯМР 1Н, 11B, 13C растворов ЭАВ в ДМСО записывали на импульсном фурье-спектрометре Bruker MSL-300 (ФРГ) на частотах 300.3, 96.32 и 75.49 МГц соответственно с внутренней стабилизацией по дейтерию. В качестве внешних стандартов использовали тетраметилсилан.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
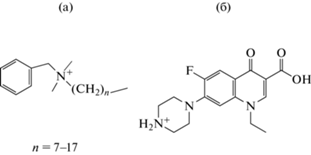
Применение антимикробных препаратов является необходимостью не только в медицине, но и в ветеринарии, промышленности, сельском хозяйстве, при уборке помещений и так далее. Однако не все используемые на сегодняшний день соединения являются биоразлагаемыми, поэтому актуальным остается вопрос контроля накопления веществ в почве и воде. Одни из самых распространенных неразлагаемых соединений – четвертичные аммониевые соли, например бензалкония хлорид и синтетические антибиотики, такие как фторхинолоны (рис. 1).
Исследования прошлых лет показали, что липофильные ионные ассоциаты являются перспективыми электродно-активными веществами при создании ИСЭ для детектирования биологически активных ионов. В связи с этим нами были синтезированы производные клозо-декаборатного аниона, которые использовали как ЭАВ для ПВХ-мембран. Сенсор, содержащий Cs[2-B10H9S(n-C18H37)2] (сенсор А), селективно определяет бензалконий хлорид, а сенсор с K[1-B10H9N(n-C18H37)3] в качестве ЭАВ (сенсор Б) – протонированную форму норфлоксацина – антибиотика класса фторхинилонов.
Классическая полимерная мембрана ИСЭ представляет собой трехкомпонентную композицию ЭАВ–пластификатор–полимерная матрица, свойства которой в значительной степени зависят от природы и соотношения мембранообразующих компонентов. При этом электроаналитические параметры сенсоров на основе ионных ассоциатов существенно зависят как от содержания ЭАВ, так и от природы пластификатора в фазе мембраны. Ранее было показано, что применение пластификаторов с более низкой диэлектрической проницаемостью повышает чувствительность сенсора, поэтому в данной работе в качестве пластификатора мы использовали дибутилфталат (εγ = 6.4) [22]. Селективность потенциометрического отклика сенсоров, как правило, определяется энергией гидратации (сольватации) определяемого аниона и специфичностью его взаимодействия с центром связывания [23]. Поэтому основное внимание при разработке нового ИСЭ нами было уделено вопросу оптимизации состава ион-чувствительной ПВХ-мембраны.
Выбор концентрации ЭАВ
В результате изучения зависимости потенциометрического отклика изготовленных ИСЭ на основе ПВХ-мембраны, пластифицированной ДБФ и содержащей разные количества ЭАВ, было установлено, что сенсор А, содержащий в фазе мембраны 1.2 мас. % ЭАВ, показывает наилучшие результаты по отношению к иону бензалкония. Сенсор Б, в свою очередь, демонстрирует наилучшие характеристики по отношению к протонированной форме норфлоксацина при 1.4 мас. % (табл. 1).
Таблица 1.
Зависимость потенциометрических характеристик ИСЭ от концентрационного содержания ЭАВ в фазе мембраны
| Состав мембраны, мас. % | cмин, М |
s, мВ/декада |
Линейный концентрационный диапазон отклика, М | Дрейф потенциала, мВ/ч | ||
|---|---|---|---|---|---|---|
| ЭАВ | ПВХ | ДБФ | ||||
| ЭАВ Cs[2-B10H9S(n-C18H37)2] (Сенсор А) | ||||||
| 1.0 | 29.0 | 70.0 | ⁓1 × 10–8 | 56.4 | 3 × 10–7–1 × 10–2 | ±2–4 |
| 1.2 | 29.0 | 69.8 | 1 × 10–7 | 55.0 | 2 × 10–7–1 × 10–2 | ±0.2 |
| 1.5 | 29.0 | 69.5 | 3 × 10–7 | 54.3 | 5 × 10–7–1 × 10–2 | ±0.1 |
| ЭАВ K[1-B10H9N(n-C18H37)3] (Сенсор Б) | ||||||
| 1.2 | 29.0 | 69.8 | ⁓6 × 10–8 | 57.8 | 1 × 10–7–1 × 10–2 | ±2–4 |
| 1.4 | 29.0 | 69.6 | 8 × 10–8 | 56.3 | 1 × 10–7–1 × 10–2 | ±0.2 |
| 1.6 | 29.0 | 69.4 | 3 × 10–7 | 55.2 | 5 × 10–7–1 × 10–2 | ±0.1 |
При увеличении содержания ЭАВ в полимерной композиции наблюдается ухудшение нижнего предела обнаружения (смин), это можно объяснить ростом активности потенциалопределяющего аниона в поверхностном мембранном слое относительно водного раствора. При уменьшении содержания ЭАВ в полимерной композиции наблюдается нестабильность регистрируемого потенциала. Последнее, вероятно, связано с уменьшением ионообменных центров в фазе мембраны.
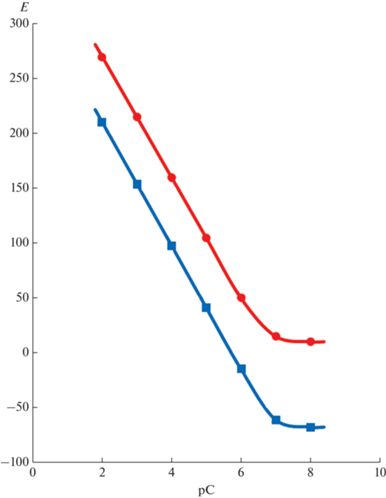
Оптимизированные мембраны сенсоров А и Б имеют нерстовский отклик и сопоставимые угловые коэффициенты (крутизна s), рис. 2. Нижний предел обнаружения составляет 2 × 10–7 М для сенсора А и 1 × 10–7 М для сенсора Б, что вполне соответствует чувствительности прочих методов измерения при анализе загрязнений водоемов и почв. Широкий линейный концентрационный диапазон отклика и низкий дрейф потенциала позволяют проводить экспресс-тестирование в полевых условиях, что снижает трудоемкость при проведении мониторинга окружающей среды.
Рис. 2.
Электродные функции ИСЭ на основе ПВХ-мембран: красная линия – для сенсора А при определении ионов бензалкония, синяя – для сенсора Б при определении ионов протонированной формы норфлоксацина.
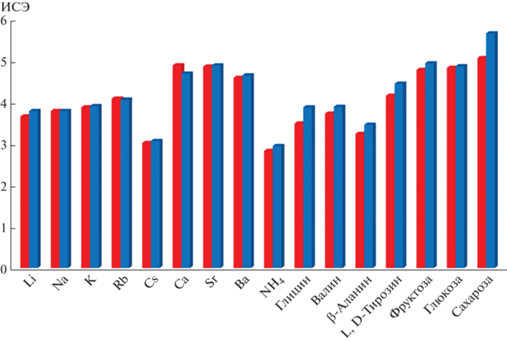
На рис. 3 представлена диаграмма, характеризующая коэффициенты потенциометрической селективности, рассчитанные для изученных мембранных систем с наилучшими электродными характеристиками методом смешанных растворов [24]. Видно, что исследуемые электроды проявляют избирательность по отношению к анализируемому веществу. При этом ${\text{lg}}K_{{i,j}}^{{{\text{пот}}}}$ не имеет критических отклонений вне зависимости от применяемого ЭАВ для неорганических ионов, для органических соединений сенсор с K[1-B10H9N(n-C18H37)3] в составе является более селективным, что может быть связано с большей липофильностью аммониевого производного за счет трех октодецильных групп.
Зависимость потенциометрического отклика от рН исследуемого водного раствора
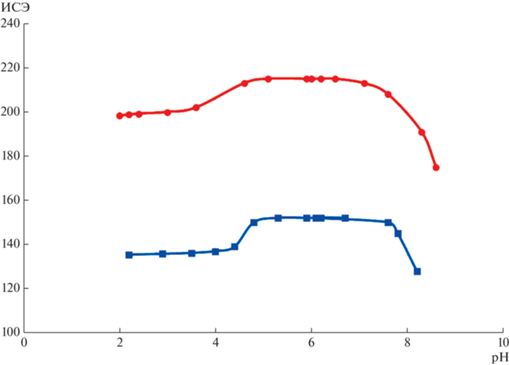
Для оценки рабочего рН-диапазона изготовленных сенсоров с оптимальным составом мембраны были получены зависимости электродного потенциала в 1 × 10–3 М растворах измеряемых веществ в интервале рH от 2 до 9. Из рис. 4 видно, что потенциометрический отклик для сенсора А практически не зависит от рН исследуемого раствора в интервале рН 4.2–7.8. Для сенсора Б диапазон измерений немного сокращается – рН 4.8–7.7.
Рис. 4.
Зависимость потенциометрического отклика ИСЭ от рН водного раствора, содержащего 1 × 10–3 М определяемого вещества, красный – сенсор А, синий – сенсор Б.
Водные растворы бензалкония хлорида и норфлоксацина гидрохлорида имеют pH от 6 до 8. Полученные значения позволяют проводить измерения без предварительной пробоподготовки. Тем не менее для повышения точности измерений рекомендуется проводить измерения в фосфатном буфере при pH 6, что соответствует наибольшей активности ионов измеряемых веществ.
ЗАКЛЮЧЕНИЕ
На основании совокупности полученных данных можно заключить, что разработанные ИСЭ, содержащие Cs[2-B10H9S(n-C18H37)2] и K[1-B10H9N(n-C18H37)3] в качестве ЭАВ и селективные по отношению к бензалконию и протонированной форме норфлоксацина соответственно, характеризуются высокой чувствительностью в присутствии ряда как неорганических, так и органических катионов в широком интервале рН водного раствора. Разработанные электроды могут быть рекомендованы для экспресс-анализа водоемов и водных вытяжек почв.
Список литературы
Zhang C., Tezel U., Li K. et al. // Water Res. 2011. V. 45. № 3. P. 1238. https://doi.org/10.1016/j.watres.2010.09.037
Barber O.W., Hartmann E.M. // Crit. Rev. Environ. Sci. Technol. 2022. V. 52. № 15. P. 2691. https://doi.org/10.1080/10643389.2021.1889284
Domnina Yu.M., Suslov V.V., Kedik S.A. et al. // Drug development & registration. 2020. V. 9. № 4. P. 121. https://doi.org/10.33380/2305-2066-2020-9-4-121-127
Kümmerer K., Eitel A., Braun U. et al. // J. Chromatogr. A. 1997. V. 774. № 1–2. P. 281. https://doi.org/10.1016/S0021-9673(97)00242-2
Ul’yanovskii N., Kosyakov D.S., Shavrina I. // Macc-cпeктpoмeтpия. 2022. T. 16. № 1. https://doi.org/10.25703/MS.2021.59.36.002
Ly N.H., Nguyen P., Son S.J. et al. // Bull. Korean. Chem. Soc. 2022. V. 43. № 2. P. 246. https://doi.org/10.1002/bkcs.12441
Schubert S. // Prävention und Gesundheitsförderung. 2014. V. 9. № 3. P. 171. https://doi.org/10.1007/s11553-014-0457-y
Von Ah S., Stephan R., Zurfluh K. et al. // Schweiz Arch Tierheilkd. 2019. V. 161. № 6. P. 387. https://doi.org/10.17236/sat00211
Bloem E., Albihn A., Elving J. et al. // Sci. Total Environ. 2017. V. 607–608. P. 225. https://doi.org/10.1016/j.scitotenv.2017.06.274
Domes C., Domes R., Popp J. et al. // Anal. Chem. 2017. V. 89. № 18. P. 9997. https://doi.org/10.1021/acs.analchem.7b02422
Ratsak C., Guhl B., Zühlke S. et al. // Environ. Sci. Eur. 2013. V. 25. № 1. P. 7. https://doi.org/10.1186/2190-4715-25-7
Abdullina S.G., Serebriannikova E.A. // Medical Pharmaceutical J. “Pulse”. 2022. P. 17. https://doi.org/10.26787/nydha-2686-6838-2022-24-6-17-22
Kubasov A.S., Turishev E.S., Kopytin A.V. et al. // Inorg. Chim. Acta. 2021. V. 514. P. 119992. https://doi.org/10.1016/j.ica.2020.119992
Zdrachek E., Bakker E. // Anal. Chem. 2019. V. 91. № 1. P. 2. https://doi.org/10.1021/acs.analchem.8b04681
Turyshev E.S., Shpigun L.K., Kopytin A.V. et al. // Austin. J. Anal. Pharm. Chem. 2023. V. 10. № 1. P. 1154. https://doi.org/10.26420/austinjanalpharmchem.2023. 1154
Zhizhin K.Yu., Turyshev E.S., Kopytin A.V. et al. // Nanosystems: Phys. Chem. Mathem. 2022. V. 13. № 6. P. 688. https://doi.org/10.17586/2220-8054-2022-13-6-688-697
Kubasov A.S., Turishev E.S., Golubev A.V. et al. // Inorg. Chim. Acta. 2020. V. 507. P. 119589. https://doi.org/10.1016/j.ica.2020.119589
Nelyubin A.V., Klyukin I.N., Novikov A.S. et al. // Inorganics (Basel). 2022. V. 10. № 11. P. 196. https://doi.org/10.3390/inorganics10110196
Kubasov A.S., Turishev E.S., Golubev A.V. et al. // Inorg. Chim. Acta. 2020. V. 507. P. 119589. https://doi.org/10.1016/j.ica.2020.119589
Nelyubin A.V., Selivanov N.A., Bykov A.Yu. et al. // Russ. J. Inorg. Chem. 2022. V. 67. № 11. P. 1776. https://doi.org/10.1134/S0036023622601106
Turyshev E.S., Kopytin A.V., Zhizhin K.Y. et al. // Talanta. 2022. V. 241. P. 123239. https://doi.org/10.1016/j.talanta.2022.123239
Kopytin A., Turyshev E., Madraimov M. et al. // Russ. J. Inorg. Chem. 2023. V. 68. № 1. P. 10.
Schaller U., Bakker E., Pretsch E. // Anal. Chem. 1995. V. 67. № 18. P. 3123. https://doi.org/10.1021/ac00114a005
Buck R.P., Lindner E. // Pure Appl. Chem. 1994. V. 66. № 12. P. 2527. https://doi.org/10.1351/pac199466122527
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии