Журнал неорганической химии, 2023, T. 68, № 2, стр. 283-288
Роль SiO2 в образовании гидратных фаз в присутствии СН4/CO2
Ю. Ю. Божко a, b, *, Р. К. Жданов a, b, К. В. Гец a, b, О. С. Субботин a, b, В. Р. Белослудов a, b
a Новосибирский государственный университет
630090 Новосибирск, ул. Пирогова, 1, Россия
b Институт неорганической химии им. А.В. Николаева СО РАН
630090 Новосибирск, пр-т Академика Лаврентьева, 3, Россия
* E-mail: bozhko@niic.nsc.ru
Поступила в редакцию 29.08.2022
После доработки 14.10.2022
Принята к публикации 17.10.2022
- EDN: LQYEIO
- DOI: 10.31857/S0044457X22601572
Аннотация
Изучено влияние наночастиц диоксида кремния на формирование гидратных фаз в присутствии СН4/CO2. Теоретический эксперимент проводили методами молекулярной динамики при начальных давлениях в системе 2.4 и 1.2 МПа и температуре 271 K для метановых и диоксид углеродных систем. Полученные результаты показали, что в присутствии наночастиц диоксида кремния время индукции образования гидрата метана уменьшилось на 79%, а количество метана, захваченного в полость гидрата, увеличилось на 55.8% при давлении 2.4 МПа. В присутствии наночастиц диоксида кремния время индукции образования гидрата диоксида кремния уменьшилось на 62%, а количество диоксида углерода, захваченного в полость гидрата, увеличилось на 27.8% при давлении 1.2 МПа.
ВВЕДЕНИЕ
В последнее время все большее число исследователей рассматривают задачи, касающиеся разработки научных основ для технологий транспортировки и хранения парниковых газов газгидратным методом, а также технологии разделения газов. Но существует несколько научных проблем для внедрения этого метода. Известно, что время индукции гидратов (время образования) диоксида углерода и метана слишком велико для применения газогидратных технологий в промышленных масштабах. Актуальные проблемы зарождения и роста стабильных и метастабильных фаз в различных системах рассмотрены в работах [1–3]. Исследования влияния различных наночастиц (SiO2, CuO, Al2O3 и др.) и ПАВ (SDS, CTAB и др.) на скорость формирования гидратных фаз в настоящее время активно ведутся как теоретическими, так и экспериментальными методами [4–13].
В работе [4] с использованием технологии магнитно-резонансной томографии исследована кинетика образования гидратов в наножидкостях, содержащих наночастицы SiO2 и пористые среды. В работе [5] показано, что водный раствор SDS с концентрацией 500 ppm является эффективным катализатором, способным повышать среднюю кажущуюся константу скорости образования гидратов СО2 и СН4 на 350 и 200% соответственно. Проведена серия экспериментов по образованию гидрата СО2 в присутствии диоксида титана (TiO2), диоксида кремния (SiO2), многослойных углеродных нанотрубок [7]. Эксперименты показали, что при температуре 274.15 K и начальном давлении 5.0 МПа время индукции образования гидрата CO2 значительно сократилось при добавлении 0.005 мас. % наночастиц многослойных углеродных нанотрубок. Возможность замедления образования газовых гидратов при помощи ингибиторов изучали в работе [14]. Исследования кинетики образования газовых гидратов как однокомпонентных, так и бинарных приведены в работах [15–26].
В теоретических работах [14, 27–30] изучали скорость образования гидратов метана. В работе [31] исследовали возможность образования гидратных структур без молекул гостей. Методами молекулярной динамики проведено моделирование взаимодействующей поверхности кварца SiO2 с объемной жидкой водой (фазой воды) [32].
В настоящей работе изучали систему, содержащую гидрат метана/диоксида углерода с добавлением наночастицы диоксида кремния диаметром 10 Å, которую в последнее время активно исследуют для определения механизма ускорения образования клатратных гидратов, так как наночастицы SiO2 применяют в качестве добавки, значительно увеличивающей скорость образования гидратов [9–14, 27–33], в других газогидратных системах. Таким образом, можно получать гидраты метана/диоксида углерода с малым временем индукции. Изучение скорости и структурных свойств необходимо для понимания механизма образования гидратов. Расчет термодинамических параметров образования гидратов метана/CO2 в присутствии наночастицы SiO2 необходим для разработки технологий утилизации и хранения парниковых газов в газогидратной форме.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Методами молекулярной динамики с использованием молекулярно-динамического пакета Gromacs [34] смоделирован процесс образования гидратов в системах, содержащих молекулы CH4/CO2, воды и SiO2. Релаксацию рассматриваемых систем проводили с использованием термостата v-rescale и баростата с-rescale для быстрого и эффективного приведения систем к заданным значениям температуры и давления в NPT-ансамбле. Для основного моделирования применяли термостат Nose-Hoover’a и баростат Parrinello-Rahman’а. Рассматривали системы при температуре 271 K и давлении 1.2 и 2.4 MПа для диоксид углеродных и метановых систем соответственно. Известно, что в области низкого давления чистый гидрат СН4/CO2 образует структуру КС-I, которая состоит из двух полостей 512 (S-полость), шести полостей 51262 (L-полость) и 46 молекул H2O в элементарной ячейке. Молекулы СН4/CO2 способны заполнить как L-полость, так и S-полость. В работе моделировали наночастицы SiO2 размером 10 Å. Межмолекулярные взаимодействия описывали потенциалами Леннард–Джонса для этих частиц. Для молекул воды межмолекулярные взаимодействия описывали потенциалами Леннард–Джонса и Кулона. Для описания взаимодействия молекул H2O–H2O использовали одну из наиболее распространенных моделей воды TIP4P/Ice [35]. Молекулы метана и диоксида углерода моделировали со следующими параметрами: ε = 1.23012 кДж/моль, σ = 3.73000 Å [36] и ε = 1.86680 кДж/моль, σ = 3.94000 Å [37] соответственно как одноцентровые частицы Леннард–Джонса. Молекулы SiO2 моделировали с параметрами, указанными в работе [32]. Молекулярно-динамические расчеты проводили для объемной системы, которая представляла собой жидкую фазу воды с включениями наночастицы SiO2 и молекул метана/диоксида углерода. Система представляла собой объемную фазу, трехмерные периодические граничные условия накладывали на 368 молекул метана/диокида углерода и 2116 молекул воды. Температуру поддерживали методом масштабирования скорости. Шаг интегрирования 1 фс. На начальном этапе моделирования проводили долговременное уравновешивание системы. После уравновешивания температуру постепенно повышали до 271 K, т.е. до области температур, при которых газогидрат формируется при давлениях 1.2 и 2.4 MПа.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
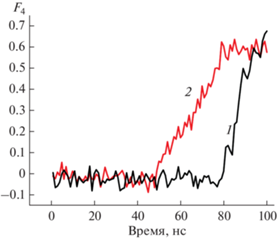
На рис. 1 показана зависимость величины параметра структурного порядка (F4) от времени моделирования в различных системах, снимки траектории движения при молекулярном моделировании сделаны на разных этапах моделирования.
Рис. 1.
Зависимость величины параметра структурного порядка (F4) в различных системах (1 – метан–вода; 2 – метан–вода–SiO2) от времени моделирования, снимки траектории движения при молекулярном моделировании сделаны на разных этапах моделирования.

Параметр порядка F4 является функцией торсионного угла между атомами кислорода в пределах 0.3 нм и атомами водорода в паре вода–вода [11]. Средние значения F4 для фазы льда, жидкой фазы (вода) и фазы гидрата равны –0.4, 0.0 и 0.7 (значения для гидратных фаз КС-I и КС-II одинаковы) соответственно. Поэтому параметр F4 является эффективной величиной, при помощи которой можно выявить наличие различных фаз [11]. Из полученных данных видно, что время индукции образования гидрата уменьшается в случае, если в систему вода–газ добавляют наночастицу SiO2. Величина изменения составляет ~79%.
На рис. 2 показана зависимость величины параметра структурного порядка (F4) в различных системах от времени моделирования. Видно, что время индукции образования гидрата уменьшается в случае, если в систему вода–газ добавляют наночастицу SiO2. Величина изменения составляет ~62%.
Рис. 2.
Зависимость величины параметра структурного порядка (F4) в различных системах (1 – диоксид углерода–вода; 2 – диоксид углерода–вода–SiO2) от времени моделирования, снимки траектории движения сделаны на разных этапах моделирования.
На рис. 3 показана зависимость числа полостей разного типа в системах метан–вода и метан–вода–SiO2 от времени моделирования. Видно, что числo больших и малых полостей KC-I начинает значительно расти, если в систему вода–газ добавляют наночастицу SiO2. Величина изменения составляет 55.8%.
Рис. 3.
Зависимость числа полостей разного типа в системах метан–вода (a) и метан–вода–SiO2 (б) от времени моделирования. Снимки траектории движения сделаны на разных этапах моделирования: 1 – число малых полостей 512 КС-I; 2 – число больших полостей 51262 КС-I; 3 – число больших полостей 51263 КС-I; 4 – число больших полостей 51264 КС-II.

На рис. 4 показана зависимость числа полостей разного типа в системах диоксид углерода–вода и диоксид углерода–вода–SiO2 от времени моделирования. Видно, что числo больших и малых полостей KC-I начинает значительно расти, если в систему вода–газ добавляют наночастицу SiO2. Величина изменения составляет 27.8%.
Рис. 4.
Зависимость числа полостей разного типа в системах диоксид углерода–вода (a); диоксид углерода–вода–SiO2 (б) от времени моделирования. Снимки траектории движения сделаны на разных этапах моделирования (1 – число малых полостей 512 КС-I; 2 – число больших полостей 51262 КС-I; 3 – число больших полостей 51263 КС-I; 4 – число больших полостей 51264 КС-II).

Надо отметить, что структуры в конце моделирования содержат большие полости, которые можно отнести как к KC-I, так и к KC-II.
ЗАКЛЮЧЕНИЕ
Методами молекулярной динамики проведены исследования влияния наночастиц SiO2 диаметром 10 Å, известных как катализаторы при зарождении и последующем росте гидратов метана/диоксида углерода. Наночастицы SiO2 уменьшают время индукции формирования гидратов и более эффективны в зародышеобразовании гидратов метана, чем гидратов диоксида углерода, что хорошо согласуется с экспериментальными данными [4].
Получена зависимость величины параметра структурного порядка (F4) в системах метан (диоксид углерода)–вода, метан (диоксид углерода)–вода–SiO2 от времени моделирования.
Теоретический эксперимент проведен методами молекулярной динамики при начальных давлениях в системе 2.4 и 1.2 МПа и температуре 271 K. Полученные результаты показали, что в присутствии наночастиц диоксида кремния время индукции образования гидрата метана уменьшилось на 79%, а количество метана, захваченного в полость гидрата, увеличилось на 55.8% при давлении 2.4 МПа. Показано, что в присутствии наночастиц диоксида кремния время индукции гидрата диоксида кремния уменьшилось на 62%, а количество диоксида углерода, захваченного в полость гидрата, увеличилось на 27.8% при давлении 1.2 МПа.
Список литературы
Baidakov V.G. // Russ. J. Gen. Chem. 2022. V. 92. № 4. P. 611. https://doi.org/10.1134/S107036322204003X
Nagornov I.A., Mokrushin A.S., Simonenko E.P. et al. // Russ. J. Inorg. Chem. 2022. V. 67. № 4. P. 539. https://doi.org/10.1134/S0036023622040143
Sycheva G.A. // Glass Phys. Chem. 2021. V. 47. № 1. P. S41. https://doi.org/10.1134/S1087659621070105
Cheng Z., Zhao Y., Liu W. et al. // J. Natural Gas Sci. Engineer. 2020. V. 79. P. 103375. https://doi.org/10.1016/j.jngse.2020.103375
Pahlavanzadeh H., Khanlarkhani M., Rezaei S. et al. // Fuel. 2019. V. 253. P. 1392. https://doi.org/10.1016/j.fuel.2019.05.010
Maiti M., Ranjan R., Chaturvedi E. et al. // J. Dispersion Sci. Technol. 2021. V. 42. № 3. P. 338. https://doi.org/10.1080/01932691.2019.1680380
Li A., Luo D., Jiang L. et al. // Sep. Sci. Technol. 2019. V. 54. № 15. P. 2498. https://doi.org/10.1080/01496395.2018.1548481
Adibi N., Mohammadi M., Ehsani M.R. et al. // J. Natural Gas Sci. Engineer. 2020. V. 84. P. 103690. https://doi.org/10.1016/j.jngse.2020.103690
Liang S., Rozmanov D., Kusalik P.G. // Phys. Chem. Chem. Phys. 2011. V. 13. № 44. P. 19856. https://doi.org/10.1039/C1CP21810G
Bagherzadeh S.A., Englezos P., Alavi S. et al. // J. Phys. Chem. B. 2012. V. 116. № 10. P. 3188. https://doi.org/10.1021/jp2086544
Moon C., Hawtin R.W., Rodger P.M. // Faraday Discussions. 2007. V. 136. P. 367. https://doi.org/10.1039/B618194P
Prasad P.S.R., Chari V.D., Sharma D.V. et al. // Fluid Phase Equilibria. 2012. V. 318. P. 110. https://doi.org/10.1016/j.fluid.2012.01.012
Moon C., Taylor P.C., Rodger P.M. // Can. J. Phys. 2003. V. 81. № 1–2. P. 451. https://doi.org/10.1139/P03-035
Moon C., Taylor P.C., Rodger P.M. // J. Am. Chem. Soc. 2003. V. 125. № 16. P. 4706. https://doi.org/10.1021/ja028537v
Antonov D.V., Donskoy I.G., Gaidukova O.S. et al. // Environ. Res. 2022. P. 113990. https://doi.org/10.1016/j.envres.2022.113990
Antonov D.V., Donskoy I.G., Gaidukova O.S. et al. // Fuel. 2022. V. 325. P. 124771. https://doi.org/10.1016/j.fuel.2022.124771
Gaidukova O., Misyura S., Razumov D. et al. // Appl. Sci. 2022. V. 12. № 12. P. 5953. https://doi.org/10.3390/app12125953
Misyura S.Y., Donskoy I.G., Manakov A.Y. et al. // Flow, Turbulence and Combustion. 2022. V. 109. № 1. P. 175. https://link.springer.com/article/10.1007/ s10494-022-00325-x
Semenov A.P., Mendgaziev R.I., Stoporev A.S. et al. // Chem. Eng. Sci. 2022. V. 255. P. 117670. https://doi.org/10.1016/j.ces.2022.117670
Semenov A.P., Mendgaziev R.I., Stoporev A.S. et al. // Data in Brief. 2022. P. 108289. https://doi.org/10.1016/j.dib.2022.108289
Semenov M.E., Pavelyev R.S., Stoporev A.S. et al. // Petroleum Chem. 2022. V. 62. № 2. P. 127. https://link.springer.com/article/10.1134/S0965544122060019
Meleshkin A.V., Bartashevich M.V., Glezer V.V. // Appl. Surf. Sci. 2019. V. 493. P. 847. https://doi.org/10.1016/j.apsusc.2019.06.276
Meleshkin A.V., Marasanov N.V. // J. Engineer. Thermophys. 2021. V. 30. № 4. P. 699. https://link.springer.com/article/10.1134/S1810232821040135
Meleshkin A.V., Shkoldina A.A. // J. Eng. Thermophys. 2021. V. 30. № 4. P. 693. https://link.springer.com/article/10.1134/S1810232821040123
Meleshkin A.V., Bartashevich M.V., Glezer V.V. et al. // J. Eng. Thermophys. 2020. V. 29. № 2. P. 264. https://link.springer.com/article/10.1134/S18102328200-20083
Meleshkin A.V., Bartashevich M.V., Glezer V.V. // J. Eng. Thermophys. 2020. V. 29. № 2. P. 279. https://link.springer.com/article/10.1134/S181023282-0020101
Walsh M.R., Koh C.A., Sloan E.D. et al. // Science. 2009. V. 326. № 5956. P. 1095. https://doi.org/10.1126/science.1174010
Walsh M.R., Rainey J.D., Lafond P.G. et al. // Phys. Chem. Chem. Phys. 2011. V. 13. № 44. P. 19951. https://doi.org/10.1039/C1CP21899A
Walsh M.R., Beckham G.T., Koh C.A. // J. Phys. Chem. C. 2011. V. 115. № 43. P. 21241. https://doi.org/10.1021/jp206483q
Jacobson L.C., Molinero V.A. // J. Phys. Chem. B. 2010. V. 114. № 21. P. 7302. https://doi.org/10.1021/jp1013576
Jacobson L.C., Hujo W., Molinero V. // J. Phys. Chem. B. 2009. V. 113. № 30. P. 10298. https://doi.org/10.1021/jp903439a
Skelton A.A., Fenter P., Kubicki J.D. et al. // J. Phys. Chem. C. 2011. V. 115. № 5. P. 2076. https://doi.org/10.1021/jp109446d
Rodger P.M., Smith W., Forester T.R. // Fluid Phase Equilib. 1996. V. 116. P. 326. https://doi.org/10.1016/0378-3812(95)02903-6
Berendsen H.J.C., van der Spoel D., van Drunen R. // Computer Phys. Commun. 1995. V. 91. № 1–3. P. 43. https://doi.org/10.1016/0010-4655(95)00042-E
Abascal J.L.F., Sanz E., Fernandez R.G. et al. // J. Chem. Phys. 2005. V. 122. P. 234511. https://doi.org/10.1063/1.1931662
Goodbody S.J., Watanabe K., MacGowan D. et al. // J. Chem. Soc., Faraday Trans. 1991. V. 87. № 13. P. 1951. https://doi.org/10.1039/FT9918701951
Ferdows M., Ota M. // Chem. Eng. Technol.: Industrial Chemistry-Plant Equipment-Process Engineering-Biotechnology. 2005. V. 28. № 2. P. 168. https://doi.org/10.1002/ceat.200407056
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии


