Журнал неорганической химии, 2023, T. 68, № 9, стр. 1287-1292
Синтез, структура и электрохимические свойства комплекса кобальта на основе N-(2,5-бис(метоксикарбонил)фенил)-α-дифенилфосфорилглицината
И. Ф. Сахапов a, *, А. А. Кагилев a, b, А. О. Кантюков a, b, И. К. Михайлов a, b, О. С. Софьичева a, Д. Р. Исламов c, З. Н. Гафуров a, Д. Г. Яхваров a, b, **
a Институт органической и физической химии им. А.Е. Арбузова
ФИЦ Казанский научный центр РАН
420088 Казань, Россия
b Химический институт им. А.М. Бутлерова, Казанский (Приволжский)
федеральный университет
420008 Казань, Россия
c Лаборатория структурного анализа биомакромолекул ФИЦ Казанский
научный центр РАН
420011 Казань, Россия
* E-mail: ilyas.sakhapov@iopc.ru
** E-mail: yakhvar@iopc.ru
Поступила в редакцию 11.05.2023
После доработки 30.05.2023
Принята к публикации 06.06.2023
- EDN: WOIXFC
- DOI: 10.31857/S0044457X23601098
Аннотация
Получен и охарактеризован новый бисхелатный комплекс кобальта (II) [Co(DPG)2(DMF)2] (1), где DPG – N-(2,5-бис(метоксикарбонил)фенил)-α-дифенилфосфорилглицинат, являющийся первым примером комплекса кобальта, содержащего в своей структуре фосфорилированное производное α-аминокислоты. Методом рентгеновской дифракции определена октаэдрическая координационная геометрия комплекса кобальта 1. Установлено, что электрохимическое восстановление полученного комплекса кобальта является необратимым двухэлектронным процессом (Epred = –1.70 В отн. Ag/AgNO3, 1 × 10–2 М в CH3CN), приводящим к образованию металлического кобальта, адсорбированного на поверхности рабочего электрода.
ВВЕДЕНИЕ
Аминокислоты, как природные, так и синтетические, являются одним из важнейших классов соединений за счет разнообразия их функций. Благодаря этому они находят широкое применение в различных областях синтетической химии, биохимии, медицины и каталитической химии, выполняя роль синтетических строительных блоков, органических катализаторов, и лигандов металлокомплексных катализаторов для получения практически значимых соединений [1–7]. Стоит отметить, что последние 10 лет активно растет интерес к синтетической модификации природных аминокислот путем введения в структуру α-аминокислоты фосфорорганических групп, [8–12] которые не только расширяют разнообразие природных α-аминокислот, но и оказывают значительное влияние на свойства α-аминокислот, придавая модифицированным производным повышенную стабильность и настраивая их каталитические характеристики [13, 14].
N-замещенные α-фосфино-α-аминокислоты получают по реакции трехкомпонентной конденсации при комнатной температуре путем смешивания растворов соответствующего амина, вторичного фосфина и глиоксиловой кислоты в диэтиловом эфире или метаноле [15]. Данный метод является наиболее простым и селективным способом получения фосфорилированных в α-положение производных природных α-аминокислот, которые нашли применение в качестве лигандов высокоэффективных каталитических систем на основе переходных металлов для процессов олиго- и полимеризации этилена благодаря наличию гибридного PCCO-фрагмента [16]. В зависимости от выбора используемых заместителей при NH-группе в α-фосфино-α-аминокислотах, продуктами реакции могут являться как короткие α-олефины (бутен-1, гексен-1), так и мономодальные полиэтилены [17–20]. В настоящее время известно большое количество комплексов переходных металлов, образованных α-фосфино-α-аминокислотами. В качестве комплексообразователя в этих системах выступают ионы таких металлов как никель, хром, марганец, молибден, вольфрам и др. [10, 21, 22]. Однако, на сегодняшний день, в мировой литературе отсутствуют данные о комплексах кобальта, образованных α-фосфино-α-аминокислотами, хотя кобальт является одним из эссенциальных микроэлементов, и выполняет функцию кофактора ферментов кобаламинов, в том числе цианокобаламина (витамина В12). Таким образом, сочетание модифицированной природной аминокислоты с эссенциальным микроэлементом – кобальтом, представляется интересной и важной задачей для получения биологически активных соединений.
Целью настоящей работы является синтез и исследование структуры и свойств комплекса кобальта (II), образованного двумя эквивалентами N-(2,5-бис(метоксикарбонил)фенил)-α-дифенилфосфорилглицината.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Эксперименты, связанные с подготовкой исходных реагентов и проведением электрохимических исследований, были выполнены в инертной атмосфере (азот, 99.6%) с использованием стандартной аппаратуры Шленка. Получение комплекса 1 проводили в отсутствии атмосферы инертного газа. N,N-Диметилформамид (ДМФА) очищали трехкратной перегонкой над гидридом кальция в инертной атмосфере. Коммерческий CoBr2 (Sigma–Aldrich) использовался без дополнительной очистки. Лиганд N-(2,5-бис(метоксикарбонил)фенил)-α-дифенилфосфорилглицинат был образован in situ вследствие окисления N-(2,5-бис(метоксикарбонил)фенил)-α-дифенилфосфиноглицина, полученного по ранее разработанной нами методике [23].
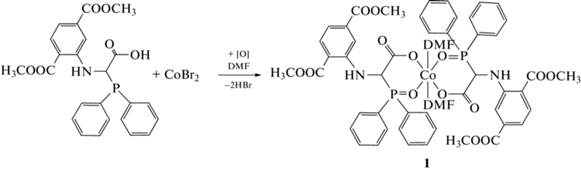
Синтез комплекса [Co(DPG)2(DMF)2] (1). Навеску лиганда N-(2,5-бис(метоксикарбонил)фенил)-α-дифенилфосфиноглицина (1.99 г, 4.4 ммоль) растворили в абсолютированном ДМФА (5 мл) и добавили полученный желтый раствор к темно-синему раствору дибромида кобальта (0.48 г, 2.2 ммоль) в 5 мл абсолютированного ДМФА. Полученный темно-зеленый раствор перемешивали 24 часа при комнатной температуре. Через 36 часов наблюдалось медленное образование осадка красно-оранжевого цвета и кристаллов бисхелатного комплекса кобальта 1, содержащего две молекулы N-(2,5-бис(метоксикарбонил)фенил)-α-дифенилфосфорилглицината и две молекулы ДМФА на один атом кобальта. Выход комплекса составил 1.68 г (67%).
Элементный анализ выполнен на CHNS высокотемпературном анализаторе Elementar vario MACRO cube:
В исследованиях методом циклической вольтамперометрии (ЦВА) концентрация исследуемого комплекса 1 составляла 5 × 10–3 M в ДМФА, концентрация фонового электролита n-Bu4NBF4 составляла 1 × 10–1 M. Объем рабочего раствора составлял 5 мл. Все эксперименты проводили в атмосфере инертного газа (азота) в трехэлектродной электрохимической ячейке, оснащенной рабочим электродом, вспомогательным электродом и электродом сравнения (ЭС). В качестве рабочего электрода использовался стеклоуглеродный электрод (СУ, рабочая поверхность 3.14 мм2). В качестве вспомогательного электрода использовалась платиновая проволока диаметром 1 мм. В качестве ЭС использовали систему Ag/AgNO3, 1 × 10–2 М в CH3CN (Е0(Fc/Fc+) = +0.20 B; относительно нас. к. э. +0.17 B). ЦВА-кривые записывали при постоянной скорости развертки потенциала рабочего электрода 50 мВ/с при помощи потенциостата E2P фирмы BASi Epsilon (США) с программным обеспечением Epsilon-EC-USB-V200.
Рентгеноструктурный анализ кристаллов комплекса 1 был проведен на четырехкружном дифрактометре Rigaku XtaLAB Synergy S с детектором HyPix и микрофокусной рентгеновской трубкой PhotonJet с использованием излучения CuKα (1.54184 Å) при температуре 100 K. Полученные данные были проиндексированы и интегрированы с помощью пакета программ CrysAlisPro. Учет поглощения проведен с использованием модуля ABSPACK: численная коррекция поглощения на основе гауссовского интегрирования по многогранной кристаллической модели и эмпирическая коррекция поглощения на основе сферических гармоник в соответствии с симметрией кристалла. Модуль GRAL использовался для анализа систематических затуханий и определения пространственной группы симметрии. Структура была решена прямым методом с использованием SHELXT [24] и уточнена методом наименьших квадратов с использованием SHELXL [25]. Все не водородные атомы были уточнены анизотропно. Атомы водорода помещены в расчетные положения и уточнены в модели наездника. Изображения сгенерированы с помощью программы Mercury 4.1 [26]. Кристаллы были получены методом медленного испарения. Структурные данные депонированы в Кембриджском центре кристаллографических данных (deposit@ccdc.cam.ac.uk; www: http://www.ccdc.cam.ac.uk), CCDC: 2259215.
Кристаллографические данные кобальтового комплекса C54H56CoN4O16P2 (M = 1137.89 г/моль): моноклинная сингония, пр. гр. P21/c (№ 14), a = = 9.57910(10) Å, b = 34.0996(3) Å, c = 8.21580(10) Å, β = 103.0330(10)°, V = 2614.51(5) Å3, Z = 2, T = = 101(1) K, μ(CuKα) = 3.795 мм–1, Dcalc = 1.445 г/см3, 35 914 измерено отражений (5.184° ≤ 2θ ≤ 154.398°), из них уникальных: 5382 (Rint = 0.0406, Rsigma = = 0.0233), которые использовались во всех расчетах. R1 = 0.0337 (I > 2σ(I)) и wR2 = 0.0845.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В настоящей работе представлен синтез первого примера комплекса кобальта на основе α-фосфино-α-аминокислоты N-(2,5-бис(метоксикарбонил)фенил)-α-дифенилфосфорилглицината (схема 1 , комплекс 1), структура которого была подтверждена методом рентгеновской дифракции.
Схема 1 . Синтез комплекса 1.
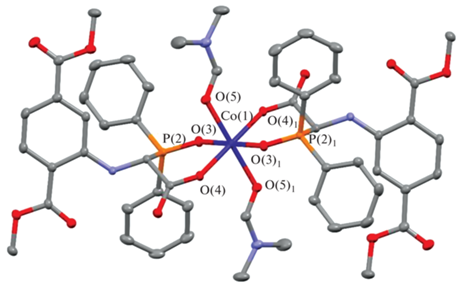
Согласно рентгенодифракционным данным, комплекс кристаллизуется в моноклинной пространственной группе P21. В элементарной ячейке наблюдали одну молекулу комплекса с двумя скоординированными к металлическому центру молекулами ДМФА и двумя молекулами N-(2,5-бис(метоксикарбонил)фенил)-α-дифенилфосфорилглицината. Геометрия металлического центра в пространстве представлена в виде октаэдра (рис. 1).
В табл. 1 представлены длины связей и валентные углы атомов, связанных с металлическим центром в комплексе 1. Методом циклической вольтамперометрии были исследованы электрохимические свойства комплекса 1.
Таблица 1.
Длины связей и валентные углы между атомами для комплекса 1
| Длина связей, Å | |
|---|---|
| Co(1)–O(3) | 2.077(1) |
| Co(1)–O(4) | 2.052(1) |
| Co(1)–O(3)1 | 2.077(1) |
| Co(1)–O(4)1 | 2.052(1) |
| Co(1)–O(5) | 2.184(1) |
| Co(1)–O(5)1 P(2)=O(3) P(2)1=O(3)1 |
2.184(1) 1.498(1) 1.498(1) |
| Валентный угол, град | |
| O(3)–Co(1)–O(4) | 91.44(4) |
| O(3)1–Co(1)–O(4)1 | 91.44(4) |
| O(4)–Co(1)–O(5)1 | 88.12(4) |
| O(3)1–Co(1)–O(5)1 | 88.58(4) |
| O(3)1–Co(1)–O(5) O(4)1–Co(1)–O(5) |
88.58(4) 88.12(4) |
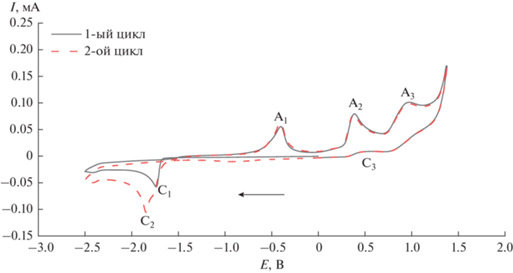
На рис. 2 изображены ЦВА-кривые комплекса 1 с различным направлением сканирования потенциала рабочего электрода. Значения потенциалов пиков, фиксируемых на ЦВА-кривой, приведены в табл. 2. На ЦВА-кривой, изображенной сплошной линией, развертка потенциала рабочего электрода проводилась сначала в сторону катодных значений до потенциала –2.50 В. В катодной области потенциалов в этом случае наблюдается необратимый пик восстановления С1, который соответствует электрохимическому двухэлектронному процессу восстановления Co(II) в Co(0) с образованием металлического кобальта, имеющего пик реокисления при потенциалах пика А1, как и в случае ранее описанного процесса электрохимического восстановления дибромида кобальта [27]. Стоит отметить, что при сканировании ЦВА-кривой сначала в сторону анодных значений (пунктирная линия на рис. 2) пик восстановления комплекса смещается в более отрицательную область потенциалов (С2), что может свидетельствовать об образовании новых частиц в растворе в результате электроокислительных процессов (пики А2 и А3). При нескольких циклах сканирования потенциала рабочего электрода только в катодную область (от 0.00 до ‒2.50 В, два цикла) происходит небольшое смещение пика С1 (рис. 3), что, вероятно, связано с модификацией поверхности рабочего электрода металлическим кобальтом. Стоит отметить, что при достижении пика А2 с последующим сканированием потенциала рабочего электрода в область катодных значений, появления пика С2 не наблюдается. Следовательно, для образования новой комплексной формы комплекса кобальта, восстанавливающейся при потенциале пика С2 (рис. 2), необходимо предварительное более глубокое окисление исследуемого комплекса 1 при потенциалах пика А3.
Рис. 2.
ЦВА-кривые комплекса 1. Развертка потенциала рабочего электрода от 0.00 до ‒2.50 В, обратно до 1.40 В и далее до 0.00 В (сплошная линия); от 0.00 до 1.40 В, далее до ‒2.50 В и обратно до 0.00 В (пунктир).
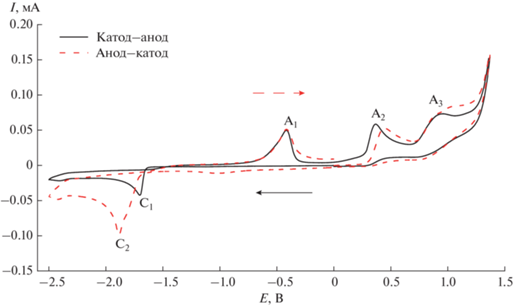
Таблица 2.
Потенциалы пиков (±0.01 В)* на ЦВА-кривых комплекса 1, концентрация субстрата (5 × 10–3 М) в ДМФА в присутствии n-Bu4NBF4 (1 × 10–1 M) (стеклоуглеродный электрод, скорость развертки – 50 мВ/с)
| Соединение | Катодные пики | $E_{p}^{{{\text{red}}}}$, В | Анодные пики | $E_{p}^{{{\text{ox}}}}$, В |
|---|---|---|---|---|
| 1 | С1 | ‒1.70 | А1 | ‒0.40 |
| С2 | ‒1.88 | А2 | 0.36 | |
| А3 | 0.95 |
Рис. 3.
ЦВА-кривые комплекса 1. Развертка потенциала рабочего электрода от 0.00 до –2.50 В, обратно до 0.00 В (сплошная линия); второй цикл от 0.00 до –2.50 В, обратно до 0.00 В (пунктир).
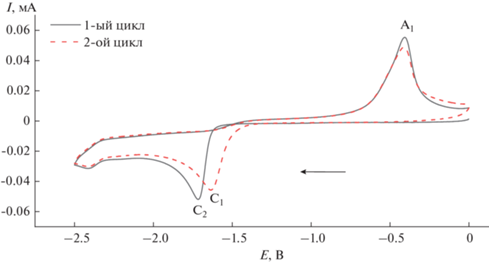
Более того, образование пика С2 можно также заметить при двукратном сканировании ЦВА-кривой от 0.00 до –2.50 В и далее до 1.40 В (два цикла, рис. 4).
ЗАКЛЮЧЕНИЕ
В результате проведенных исследований был получен новый комплекс кобальта(II) на основе N-(2,5-бис(метоксикарбонил)фенил)-α-дифенилфосфорилглицината (1). Структура комплекса 1 установлена методом рентгеновской дифракции. Определено, что ион кобальта в комплексе имеет октаэдрическую координационную геометрию. Электрохимические свойства комплекса 1 были исследованы методом циклической вольтамперометрии. Установлено, что при потенциале первого пика восстановления ($E_{{\text{p}}}^{{{\text{red}}}}$ = –1.70 В отн. Ag/AgNO3, 1 × 10–2 М в CH3CN) происходит электрохимическое двухэлектронное восстановление металлического центра комплекса 1 с образованием металлического кобальта.
Список литературы
Kotha S., Goyal D., Chavan A.S. // J. Org. Chem. 2013. V. 78. № 24. P. 12288. https://doi.org/10.1021/jo4020722
Noisier A.F.M., Brimble M.A. // Chem. Rev. 2014. V. 114. № 18. P. 8775. https://doi.org/10.1021/cr500200x
Mondal S., Chowdhury S. // Adv. Synth. Catal. 2018. V. 360. № 10. P. 1884. https://doi.org/10.1002/adsc.201800011
Lewis J.C. // Curr. Opin. Chem. Biol. 2015. V. 25. P. 27. https://doi.org/10.1016/j.cbpa.2014.12.016
Heravi M.M., Vavsari V.F. // Adv. Heterocycl. Chem. 2015. V. 114. P. 77. https://doi.org/10.1016/bs.aihch.2015.02.002
Roy S.G., De P. // J. Appl. Polym. Sci. 2014. V. 131. № 20. P. 41084. https://doi.org/10.1002/app.41084
Зарезин Д.П., Ненайденко В.Г. // Успехи химии. 2019. Т. 88. № 3. С. 248.
Софьичева О.С., Кислицын Ю.А., Нестерова А.А., Добрынин А.Б., Яхваров Д.Г. // Электрохимия. 2020. Т. 56. № 5. С. 456.
Soficheva O.S., Nesterova A.A., Dobrynin A.B. et al. // Mendeleev Commun. 2020. V. 30. № 4. P. 516. https://doi.org/10.1016/j.mencom.2020.07.038
Lach J., Peulecke N., Kindermann M.K. et al. // Tetrahedron 2015. V. 71. № 30. P. 4933. https://doi.org/10.1016/j.tet.2015.05.101
Wardle N., Annie Bligh S., Hudson H. // Curr. Org. Chem. 2007. V. 11. № 18. P. 1635. https://doi.org/10.2174/138527207783221200
Ferreira P.M.T., Monteiro L.S. // N,N-diprotected dehydroamino acid derivatives: Versatile substrates for the synthesis of novel amino acids, in: Targets Heterocycl. Syst., 2006: pp. 152–174
Marsh R.E., Donohue J. // Adv. Protein Chem. 1967. V. 22C. P. 235. https://doi.org/10.1016/S0065-3233(08)60042-X
Peulecke N., Kindermann M.K., Köckerling M. et al. // Polyhedron. 2012. V. 41. № 1. P. 61. https://doi.org/10.1016/j.poly.2012.04.019
Peulecke N., Yakhvarov D.G., Heinicke J.W. // Eur. J. Inorg. Chem. 2019. V. 2019. № 11. P. 1507. https://doi.org/10.1002/ejic.201801130
Kagileva A.A., Kagilev A.A., Kantyukov A.O. et al. // New J. Chem. 2022. V. 46. № 36. P. 17303. https://doi.org/10.1039/d2nj02578g
Dutta A., Du Bois D.L., Roberts J.A.S. et al. // Proc. Natl. Acad. Sci. USA. 2014. V. 111. № 46. P. 16286. https://doi.org/10.1073/pnas.1416381111
Oughli A.A., Ruff A., Boralugodage N.P. et al. // Nat. Commun. 2018. V. 9. № 1. P. 1. https://doi.org/10.1038/s41467-018-03011-7
Galan B.R., Reback M.L., Jain A. et al. // Eur. J. Inorg. Chem. 2013. V. 2013. № 30. P. 5366. https://doi.org/10.1002/ejic.201300751
Priyadarshani N., Ginovska B., Bays J.T. et al. // Dalt. Trans. 2015. V. 44. № 33. P. 14854. https://doi.org/10.1039/c5dt01649e
Buhaibeh R., Filippov O.A., Bruneau-Voisine A. et al. // Angew. Chem. Int. Ed. 2019. V. 58. № 20. P. 6727. https://doi.org/10.1002/anie.201901169
Lach J., Guo C.Y., Kindermann M.K. et al. // Eur. J. Org. Chem. 2010. V. 2010. № 6. P. 1176. https://doi.org/10.1002/ejoc.200901251
Фомина О., Яхваров Д.Г., Хайнике И. et al. // Ученые записки Казанского университета 2012. Т. 154. № 3.
Sheldrick G.M. // Acta Crystallogr., Sect. A: Found. Crystallogr. 2015. V. 71. № 1. P. 3. https://doi.org/10.1107/S2053273314026370
Sheldrick G.M. // Acta Crystallogr., Sect. A: Found. Crystallogr. 2008. V. 64. № 1. P. 112. https://doi.org/10.1107/S0108767307043930
Macrae C.F., Edgington P.R., McCabe P. et al. // J. Appl. Crystallogr. 2006. V. 39. № 3. P. 453. https://doi.org/10.1107/S002188980600731X
Khusnuriyalova A.F., Petr A., Gubaidullin A.T. et al. // Electrochim. Acta 2018. V. 260. P. 324. https://doi.org/10.1016/j.electacta.2017.12.050
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии