Журнал общей биологии, 2019, T. 80, № 2, стр. 83-94
Cвязь магнитного компаса и фоторецепции у птиц: гипотезы и нерешенные вопросы
Л. А. Астахова 1, *, А. Ю. Ротов 1, К. В. Кавокин 1, 2, Н. С. Чернецов 1, 2, 3, М. Л. Фирсов 1
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
194223 С.-Петербург, просп. Тореза, 44, Россия
2 С.-Петербургский государственный университет
199034 С.-Петербург, Университетская наб., 7–9, Россия
3 Зоологический институт РАН
199034 С.-Петербург, Университетская наб., 1, Россия
* E-mail: lubkins@yandex.ru
Поступила в редакцию 12.07.2018
После доработки 18.10.2018
Принята к публикации 01.11.2018
Аннотация
Существование магнитной компасной системы, позволяющей животным поддерживать направление миграционных перемещений, было впервые показано у птиц около пятидесяти лет назад. За прошедшие полвека был получен большой объем косвенных, главным образом поведенческих, данных об особенностях работы магнитного компаса птиц и его взаимосвязи с восприятием световой информации. На основании этих данных сложилось доминирующее на сегодняшний день представление о том, что первичный магниторецептор у птиц расположен в сетчатке глаза, и наиболее популярной гипотезой, описывающей работу такого магниторецептора, является модель радикальных пар. Согласно этой модели первичными рецепторными молекулами, воспринимающими магнитное поле, являются белки криптохромы, присутствующие в нейронах сетчатки птиц. Предполагается, что молекулы криптохромов, локализованные в фоторецепторных клетках, могут иметь упорядоченную ориентацию относительно поверхности сетчатки. При поглощении фотонов коротковолновой области спектра эти молекулы давали бы зависящий от направления внешнего магнитного поля химический отклик. Чувствительность фотохимических реакций с участием радикальных пар в криптохромах к магнитному полю подтверждается как теоретическими расчетами, так и экспериментами. Однако к настоящему времени не получено никаких экспериментальных данных о молекулярных механизмах дальнейшей трансдукции сигнала, индуцированного магнитным полем. Существующие гипотезы о возможной природе этих механизмов имеют ряд проблем с точки зрения их совместимости с современными представлениями о работе фоторецепторной сенсорной системы. Эти гипотезы предполагают наличие у участников зрительного процесса особых свойств (как на молекулярном, так и на клеточном уровне), к настоящему времени не подтвержденных экспериментально. Таким образом, в настоящее время перед наукой о магниторецепции ставится задача последовательной проверки имеющихся гипотез о молекулярной природе магнитного компаса птиц.
Магнитное поле Земли является источником информации о сторонах света и о положении в пространстве для многих животных. История изучения принципов работы механизмов, стоящих за этими процессами у представителей разных таксонов, насчитывает значительный срок. За это время были сделаны принципиально важные открытия, позволившие экспериментально подтвердить факт наличия магнитосенсорного чувства как еще одной сенсорной модальности, в дополнение к гораздо лучше изученным фото-, хемо- и механорецепции и менее изученной электрорецепции.
Существование магнитной компасной системы, которая предоставляет возможность выбирать и поддерживать соответствующее сезону направление миграционных перемещений, было впервые показано для птиц (Wiltschko, 1968; Wiltschko W., Wiltschko R., 1972). В дальнейшем разные авторы сообщали о наличии магнитного компаса у многих животных, в частности у грызунов (Deutschlander et al., 2003; Phillips et al., 2013; Malewski et al., 2018) и рукокрылых (Holland et al., 2006) из млекопитающих, бесхвостых амфибий (Diego-Rasilla et al., 2013; Shakhparonov, Ogurtsov, 2017), костных рыб (Quinn, 1980; Bottesch et al., 2016), у десятиногих ракообразных (Lohmann et al., 1995), бабочек (Guerra et al., 2014; Dreyer et al., 2018), двукрылых (Gegear et al., 2008), муравьев (Fleischmann et al., 2018). Следует, однако, подчеркнуть, что сведения об использовании магнитного компаса птицами являются наиболее надежными. Они были многократно независимо подтверждены разными группами исследователей, в том числе теми, кто первоначально относился к сообщениям о наличии у птиц магнитного компаса со скепсисом, но были переубеждены имеющимися экспериментальными данными (Emlen et al., 1976). Данные по другим группам животных, как позвоночных, так и беспозвоночных, на настоящий момент должны рассматриваться как многообещающие и предварительные. Поэтому в области изучения магниторецепции модельной группой организмов до сих пор являются мигрирующие птицы.
Помимо информации о сторонах света (компасной), магнитное поле Земли может предоставлять информацию о положении животного по отношению к цели, т.е. исполнять роль физической основы ментальной карты. Достаточно надежные данные о том, что магнитная карта используется животными при перемещениях на местности, имеются для костных рыб (Putman et al., 2014; Naisbett-Jones et al., 2017), морских черепах (Lohmann et al., 1999; Putman et al., 2011, 2015) и птиц (Kishkinev et al., 2015; Chernetsov et al., 2017). Сенсорная основа магнитной карты рыб и черепах в настоящее время неизвестна, а для птиц есть основания полагать, что магнитная навигационная информация поступает в мозг от неустановленного рецептора, иннервируемого глазничной ветвью тройничного нерва (Kishkinev et al., 2013; Pakhomov et al., 2018). Принято считать, что физические основы сенсорных систем, обеспечивающих работу магнитного компаса и карты птиц, различны. Экспериментально показано, что в отличие от магнитной карты, работа магнитного компаса у зарянок (Erithacus rubecula) не зависит от информации, поступающей по тройничному нерву: птицы с пересеченным тройничным нервом продолжают успешно выбирать сезонное направление миграции по магнитному полю (Zapka et al., 2009). Это говорит о том, что работу магнитной компасной системы птиц обеспечивает другой рецептор.
В настоящее время наиболее разработанной концепцией биофизического механизма работы сенсорной системы, лежащей в основе магнитного компасного чувства птиц, является так называемая модель радикальных пар, предполагающая наличие химического магниторецептора на основе обратимых бирадикальных реакций (Hore, Mouritsen, 2016). Целый ряд известных из поведенческих экспериментов свойств магнитного компаса птиц указывают на эту возможность – в частности, инклинационность и светозависимость компаса (Wiltschko W., Wiltschko R., 1972, 1995, 1999, 2001). Важными вопросами для построения адекватной модели магниторецепции являются идентификация молекулы-рецептора, а также типа или типов магниточувствительных клеток, участвующих в формировании сигнала. В рамках модели радикальных пар предлагаются лишь гипотетические кандидаты на эти роли, пока не получившие экспериментального подтверждения.
В настоящем обзоре рассмотрены основные гипотезы, составляющие систему представлений о работе магнитного компаса на основе бирадикальных реакций у позвоночных, в частности, у птиц. Несмотря на достаточно долгую историю изучения этой проблемы, в системе представлений о механизмах восприятия магнитного поля до сих пор имеются значительные и даже критические пробелы, не позволяющие к настоящему времени сформулировать обоснованную, общепринятую и непротиворечивую концепцию магниторецепции, как это было сделано, например, в области изучения фото- или хеморецепции. Однако достижения самых последних лет позволяют надеяться на возможность скорого успеха в этом направлении.
СВЯЗЬ МАГНИТОРЕЦЕПЦИИ И ФОТОРЕЦЕПЦИИ. СПЕКТРАЛЬНАЯ ЗАВИСИМОСТЬ МАГНИТОРЕЦЕПТОРНОЙ ФУНКЦИИ
Первые сведения о взаимосвязи систем магнитного компаса и фоторецепции у птиц появились почти одновременно с открытием самого факта их чувствительности к магнитному полю, и за последние десятилетия накоплено уже немало данных, свидетельствующих о том, что для работы магнитного компаса требуется свет, причем с определенными спектральными характеристиками. Все имеющиеся к настоящему времени данные о спектральной зависимости магниточувствительности получены в поведенческих экспериментах по ориентации птиц. Ввиду этого следует признать, что аргументация для утверждения о связи между магниторецепцией и фоторецепцией является скорее косвенной, чем прямой, поскольку нет возможности поставить поведенческий эксперимент в полной темноте и однозначно разделить два сенсорных стимула – свет и направление магнитного поля.
Подавляющее большинство работ по зависимости ориентации птиц в магнитном поле от спектральных характеристик освещения выполнены исследовательской группой под руководством супругов Вольфганга и Розиты Вильчко (Wolfgang Wiltschko, Roswitha Wiltschko) из Франкфуртского университета (Германия). Так, ими было показано, что у домашних голубей (Columba livia) на способность ориентироваться влияет длина волны света, при которой их транспортировали к месту выпуска – они успешно ориентировались, если использовался свет полного спектра или зеленый, но не ориентировались, если их транспортировали при красном свете (Wiltschko R., Wiltschko W., 1998). Также данной группой были проведены множественные поведенческие эксперименты на перелетных птицах – зарянках, австралийских белоглазках (Zosterops lateralis) и садовых славках (Sylvia borin) в круговых аренах при свете разной длины волны. Было показано, что при освещении желтым (λmax = 590 нм) и красным (λmax = 617–645) монохроматическим светом птицы были дезориентированы, либо направление их миграционного поведения было смещено на 90° от ожидаемого направления, тогда как при освещении ультрафиолетовым (λmax = 373 нм), синим (λmax = 424 и 443 нм), сине-зеленым (λmax = 502 и 510 нм) и зеленым светом (λmax = 565–568 нм) птицы успешно ориентировались в магнитном поле (Wiltschko et al., 1993, 2003, 2008; Munro et al., 1997; Rappl et al., 2000; Wiltschko W., Wiltschko R., 2001; Stapput et al., 2008; Muheim et al., 2002, и ряд других работ, обзор Wiltschko et al., 2010). В совокупности перечисленные исследования показывают, что “переломной” для ориентации птиц в магнитном поле является желто-зеленая область спектра, т.е. длина волны приблизительно 570 нм, и освещение с длиной волны менее этого значения позволяет птицам ориентироваться, а более – не позволяет. Похожие результаты, но в другой поведенческой модели с применением социального стимула были получены на цыплятах (Gallus gallus): они были способны ориентироваться при освещении синим (465 нм), но не красным (645 нм) светом (Wiltschko et al., 2007). Совсем недавно похожие результаты по зависимости ориентации в магнитном поле от длины волны освещения были получены группой из Швеции на лабораторных птицах – зебровых амадинах (Taeniopygia guttata). Поведенческие эксперименты на зебровых амадинах также проводили в круговых аренах, предварительно птиц обучали находить пищевое подкрепление в рамках пространственной ориентационной задачи. Амадины демонстрировали правильную ориентацию, когда обучение и сам эксперимент проводили при зеленом (521 нм), синем (460 нм) и фиолетовом (430 нм) свете, тогда как при обучении и испытаниях в красном свете (638 нм) ориентация имела тенденцию к отклонению от правильной на 45° (Pinzon-Rodriguez, Muheim, 2017). В целом приведенные данные о зависимости ориентации птиц в магнитном поле от спектральных характеристик предъявляемого света являются серьезным основанием, чтобы предполагать связь структур, обеспечивающих работу магнитного компаса со светочувствительными клетками – фоторецепторами.
Фоторецепторные клетки позвоночных – палочки и колбочки – находятся в сетчатке глаза. У некоторых животных, в том числе у птиц, существует и другой тип фоторецепторов, локализованных в пинеальном органе – пинеалоциты, содержащие зрительный пигмент и обладающие типичной для фоторецепторов сетчатки морфологией (Collin, Oksche, 1981; Okano et al., 1994; Bailey, Cassone, 2005). Эксперименты, проведенные на мухоловках-пеструшках (Ficedula hypoleuca), показали, что хирургическое удаление пинеального органа (при ежедневных инъекциях мелатонина) не вызывает нарушений ориентации (Schneider et al., 1994). Предполагается, что обработка магниторецепторного сигнала у птиц происходит в так называемом кластере N, являющимся частью зрительного гиперпаллиума – структуры, аналогичной зрительной коре млекопитающих, получающей сигнал непосредственно от сетчатки (Mouritsen et al., 2005; Heyers et al., 2007). Так, показано, что разрушение кластера N у зарянок приводит к потере способности к компасной ориентации по магнитному полю (Zapka et al., 2009). Эти результаты позволяют считать сетчатку наиболее вероятным органом локализации магниторецепторной функции у птиц.
ФИЗИЧЕСКИЕ ПРИНЦИПЫ РАБОТЫ МАГНИТОРЕЦЕПТОРА НА РАДИКАЛЬНЫХ ПАРАХ. КРИПТОХРОМЫ
Модель радикальных пар основана на хорошо установленном факте зависимости кинетики специфического класса химических реакций от магнитного поля. В ходе таких реакций происходит либо распад исходной молекулы на два радикала, либо перенос электрона внутри сложной молекулы с образованием двух радикальных групп. Как правило, образование пары радикалов происходит за счет энергии поглощенного фотона. Поэтому такие реакции (называемые бирадикальными) обычно идут при облучении вещества светом определенного спектрального диапазона. Чувствительность бирадикальных реакций к магнитному полю обусловлена спиновой корреляцией электронов в образующихся радикалах. Эти два электрона, которые исходно образовывали ковалентную связь, после ее разрыва оказываются в состоянии с антипараллельными спинами (синглетном). Пока их спиновая корреляция сохраняется, остается высокой вероятность рекомбинации радикалов с восстановлением ковалентной связи. Переход пары электронов в квантовое состояние с параллельными спинами (триплетное) блокирует процесс рекомбинации. В этом случае повышается вероятность вступления радикалов в независимую цепь реакций, приводящих к формированию так называемых триплетных продуктов. Переходы из синглетного в триплетное состояние и обратно индуцируются градиентом магнитного поля, который создается обычно магнитными моментами атомных ядер в самих радикалах. Внешнее магнитное поле само по себе не приводит к таким переходам, но может влиять на их скорость, тем самым меняя выход триплетных продуктов. Это влияние зависит от характера взаимодействия между электронными и ядерными спинами в радикалах. В частности, если это взаимодействие анизотропно, эффект магнитного поля на скорость реакции может зависеть от его ориентации по отношению к оси молекулы, что может служить основой для работы “химического компаса”. Принципиальная возможность реализации химического компаса на бирадикальных реакциях продемонстрирована в модельном эксперименте П. Хора с сотрудниками (Maeda et al., 2008).
Идея биологического компаса на бирадикальных реакциях, впервые высказанная Шультеном в 1978 г. (Schulten et al., 1978), приобрела реальное звучание в 2000 г. после того, как Шультен и Ритц предложили в качестве молекулярной основы такого компаса светочувствительный белок криптохром (Ritz et al., 2000). Криптохромы относятся к группе флавопротеинов и способны поглощать свет в области 350–500 нм благодаря наличию хромофорных групп: 5,10-метенилтетрагидрофолата и флавинадениндинуклеотида (ФАД). Криптохромы близки по строению к фотолиазам – ферментам, обеспечивающим светозависимую репарацию ДНК, однако сами не имеют репарирующей функции, вместо этого они участвуют в регуляции циркадных ритмов, образуя петлю транскрипционно-трансляционной обратной связи совместно с белками PER, CLOCK и BMAL1 (Sancar, 2000; Chaves et al., 2011). В сетчатке птиц было обнаружено четыре различных белка, относящихся к этой группе: криптохром 1 в двух сплайс-вариантах (CRY1a и CRY1b), криптохром 2 (CRY2) и криптохром 4 (CRY4) (Möller et al., 2004; Mouritsen et al., 2004; Nießner et al., 2011; Bolte et al., 2016; Günther et al., 2018). Для криптохрома 1a, обнаруженного в сетчатке садовой славки, была показана возможность формирования долгоживущих радикальных пар (Liedvogel et al., 2007). Образование радикалов под действием света также продемонстрировано для криптохрома 4 курицы (Mitsui et al., 2015). При этом происходит последовательный трансфер электрона между тремя аминокислотными остатками триптофана с последующим образованием радикальной пары из ФАД, перешедшего в семихинонную форму, и ближайшего к нему триптофанового остатка (Dodson et al., 2013; Hore, Mouritsen, 2016). Следует отметить недавнюю работу Нилсена с соавт. (Nielsen et al., 2018), в которой с помощью квантово-механических расчетов было показано, что ФАД, будучи связанным с каким-либо из 6 различных криптохромов, в том числе CRY1a и CRY4 зарянки, не способен поглощать свет с длиной волны более 550 нм. Аналогичный результат был получен при прямой записи спектра CRY1a садовой славки, экспрессированного в культуре клеток Sf9 (Liedvogel et al., 2007). Поведенческие эксперименты, в свою очередь, говорят о том, что птицы успешно ориентируются при освещении зеленым светом (λmax = = 565–568 нм, см. раздел “Связь магниторецепции и фоторецепции. Спектральная зависимость магниторецепторной функции”), что приводит авторов к гипотезе о том, что магниторецепция использует в качестве хромофорной группы не только ФАД.
К настоящему моменту основным кандидатом на роль молекулярного магниторецептора считается криптохром 4. В его пользу говорят результаты недавних исследований, показавшие, что экспрессия гена Cry4 в сетчатке зарянок и цыплят не претерпевает значимых изменений в течение цикла день–ночь (что говорит об отсутствии функциональных связей с циркадными ритмами), но усиливается у зарянок во время миграционного сезона весной и осенью (Günther et al., 2018). Отсутствие циркадной ритмики экспрессии в сетчатке генов Cry4, но не Cry1 и Cry2, также было показано для зебровых амадин (Pinzon-Rodriguez et al., 2018).
За последние годы были достигнуты значительные успехи в теоретическом описании и моделировании бирадикальных реакций в криптохроме. В частности, рассчитаны времена спиновой релаксации электронов, образующих радикальные пары (Kattnig et al., 2016), исследована кинетика основных стадий цикла реакции (Solov’yov et al., 2012), предложены и исследованы различные механизмы повышения чувствительности бирадикальной реакции к величине и направлению магнитного поля (Kattnig et al., 2016a, b; Hiscock et al., 2016).
Основные экспериментальные подтверждения модели радикальных пар на сегодняшний день получены в поведенческих экспериментах по ориентации птиц в круглых аренах и включают в себя нечувствительность компаса к полярности магнитного поля (инклинационность) и нарушение работы компаса слабыми радиочастотными магнитными полями. Последний факт вызывает в последнее время большие дискуссии, так как модель радикальных пар оказывается неспособна количественно объяснить экспериментально наблюдаемую высокую чувствительность компаса птиц к переменным полям мегагерцового диапазона (Hiscock et al., 2017). В качестве одного из вариантов решения этой проблемы была выдвинута гипотеза о наличии в клетках сетчатки кластеров магнитных нанокристаллов, ко-локализованных с молекулами криптохрома (Kavokin, 2017). Такая структура предположительно усиливала бы внешнее магнитное поле, обеспечивая чувствительность магнитосенсорной функции, соответствующую данным поведенческих экспериментов. Однако возможность ее существования пока не подвергалась экспериментальной проверке.
ЛОКАЛИЗАЦИЯ КРИПТОХРОМОВ В СЕТЧАТКЕ. ВЕРОЯТНЫЙ КЛЕТОЧНЫЙ СУБСТРАТ МАГНИТОРЕЦЕПЦИИ
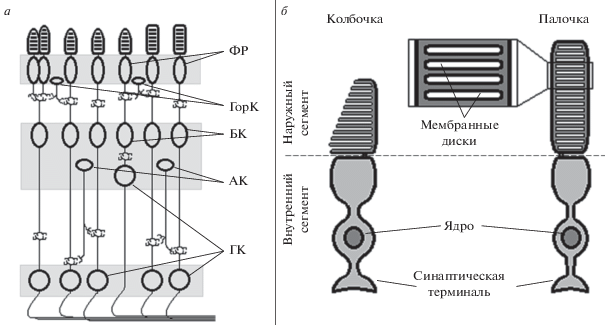
Поскольку нейронов, не участвующих в зрительном процессе, в сетчатке не обнаружено, следует предположить, что криптохромы или другие молекулярные рецепторы, чувствительные к направлению магнитного поля, локализованы в тех же самых клетках, в которых происходит генерация и первичная обработка зрительного сигнала. Нейроны сетчатки образуют слоистую структуру и включают в себя светочувствительные клетки – фоторецепторы, обеспечивающие преобразование светового стимула в электрический ответ (фототрансдукцию), биполярные и ганглиозные клетки, проводящие сигнал от рецепторов в центральную нервную систему, и горизонтальные и амакриновые клетки, модулирующие зрительный сигнал, но не имеющие прямого выхода к мозгу (рис. 1а). Фоторецепторы в свою очередь подразделяются на палочки и колбочки – рецепторы сумеречного и дневного зрения, причем колбочки различаются за счет экспрессии разных зрительных пигментов (с различными максимумами спектров поглощения): существуют ультрафиолет-, сине-, зелено- и красночувствительные. Фоторецепторы имеют высокоспециализированный компартмент клетки – так называемый наружный сегмент, содержащий множество плотно уложенных мембранных дисков, в которых локализованы молекулы зрительного пигмента и других участников биохимического каскада фототрансдукции (рис. 1б). Такая специфическая морфология гипотетически могла бы обеспечить полную или хотя бы частичную пространственную иммобилизацию молекул криптохрома (Ritz et al., 2000), что предположительно могло бы обеспечить преимущественную чувствительность всех молекул криптохрома в одной клетке к магнитному полю определенного направления и не допустить усреднения и взаимного обнуления сигналов магниторецепции в случае хаотической ориентации осей молекул.
Рис. 1.
Схема строения сетчатки и фоторецепторов. а – Сетчатка включает несколько типов нейронов: фоторецепторы (ФР), горизонтальные (ГорК), биполярные (БК), амакриновые (АК) и ганглиозные клетки (ГК), образующих слоистую структуру. б – Палочки и колбочки позвоночных подразделяются на два компартмента: внутренний сегмент, содержащий ядро, аппарат синтеза белка и другие органеллы и оканчивающийся синаптической терминалью; наружный сегмент, в котором локализованы белки–участники каскада фототрансдукции, составленный из множества плотно уложенных мембранных дисков. У палочек диски расположены внутри наружного сегмента, у колбочек – представляют собой выросты плазматической мембраны.
В последние два десятилетия появились работы по экспериментальному определению локализации криптохромов в сетчатке птиц. Мёллер с соавт. показали, что в сетчатке зарянок экспрессируются по меньшей мере CRY1a, CRY1b и CRY2 (Möller et al., 2004). В работе Моуритсена с соавт. (Mouritsen et al., 2004) исследовалась экспрессия криптохромов 1 и 2 в сетчатке садовых славок в миграционном состоянии. Криптохром 1 был локализован в цитозоле ганглиозных клеток и больших смещенных ганглиозных клеток (чьи тела расположены в более глубоких слоях сетчатки, чем у типичных ганглиозных). Криптохром 2 оказался локализован в ядрах клеток, что, по мнению авторов, говорит о его вовлеченности в регуляцию циркадных ритмов, но не магниторецепцию. Нисснер с соавт. (Nießner et al., 2011) исследовали локализацию криптохрома CRY1a в сетчатке двух видов птиц – зарянки и домашней курицы – иммуногистохимическим методом. У обоих видов CRY1a присутствует исключительно в наружных сегментах ультрафиолет-чувствительных колбочек. На основе данных иммуногистохимии и электронной микроскопии авторы показали, что CRY1a выстраивается в тяжи вдоль мембранных дисков наружных сегментов, а фракционирование клеток показало, что CRY1a присутствует в мембранной фракции.
На сегодняшний день большой вклад в решение данной проблемы внесла группа Хенрика Моуритсена из Ольденбургского университета (Германия). Методом иммуногистохимии ими исследовалась локализация криптохрома 1b (CRY1b) в сетчатке птиц (Bolte et al., 2016). Авторы использовали в своем исследовании поликлональное антитело, обеспечивающее высокую селективность окрашивания на CRY1b, но не CRY1a. Было показано, что у трех видов птиц – зарянки, обыкновенной каменки (Oenanthe oenanthe) и голубя – CRY1b обнаруживается в цитозоле ганглиозных клеток, смещенных ганглиозных клетках и внутренних сегментах фоторецепторов. По мнению авторов, цитозольная локализация CRY1b в сетчатке свидетельствует против участия CRY1b в циркадных ритмах, а значит, он мог бы работать в механизме магнитного компаса. Одновременно с упомянутым исследованием была опубликована другая работа (Nießner et al., 2016), в которой иммуногистохимический анализ также выявил локализацию CRY1b в ганглиозных клетках, но не в фоторецепторах зарянки.
В недавней работе Гюнтер с соавт. (Günther et al., 2018) исследовали локализацию CRY4 в том или ином типе фоторецепторов в сетчатке зарянок и цыплят при помощи двойного иммунного окрашивания поликлональным антителом, специфичным к CRY4, и антителами к различным зрительным пигментам. Было показано, что белок CRY4 специфически экспрессируется в наружных сегментах двойных колбочек (см. следующий раздел) и красночувствительных (длинноволновых) одиночных колбочек (у обоих исследованных видов птиц). На рис. 2 приведена сводная информация по локализации различных криптохромов в сетчатке.
Рис. 2.
Локализация криптохромов в сетчатке мигрирующих птиц (зарянок). а – Локализация криптохрома 1a наблюдается в наружных сегментах колбочек, чувствительных к ультрафиолетовой области спектра (по: Nießner et al., 2011). УФК – ультрафиолет-чувствительные колбочки. б – Криптохром 1b обнаруживается во внутренних сегментах фоторецепторов (ВС), и ганглиозных клетках (ГК), а также в смещенных ганглиозных клетках (СГК), чьи тела расположены в более глубоких слоях сетчатки (по: Bolte et al., 2016). в – Криптохром 4 локализован в наружных сегментах колбочек, содержащих зрительный пигмент, чувствительный к длинноволновой области видимого спектра – двойных колбочках (ДК) и одиночных красночувствительных колбочках (КК) (по: Günther et al., 2018). Криптохром 2, не представленный на рисунке, локализован в ядрах различных типов нейронов сетчатки, поэтому предполагается, что его функция связана с циркадной ритмикой (регуляцией экспрессии генов), но не с магниторецепцией (Mouritsen et al., 2004).
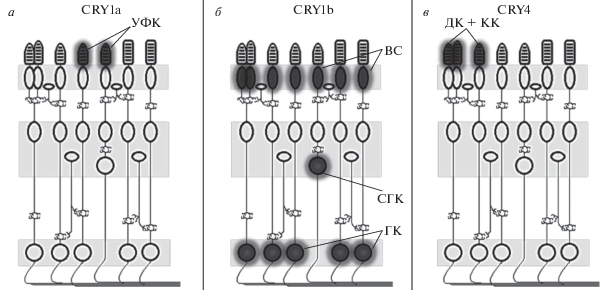
Таким образом, по современным представлениям все наиболее вероятные кандидаты на роль молекулярного субстрата магниторецепции локализуются в фоторецепторах сетчатки, в том числе в колбочках. Это позволяет предположить, что они под воздействием магнитного поля Земли могли бы модулировать работу каскада фототрансдукции или запускать отдельный каскад передачи сигнала на ионные каналы плазматической мембраны. Другая возможность, которую пока нельзя исключить, – это модулирующее влияние криптохромов на работу ганглиозных клеток, о возможных молекулярных механизмах которого к настоящему времени ничего не известно.
МАГНИТОРЕЦЕПЦИЯ В ФОТОРЕЦЕПТОРАХ. ДВОЙНЫЕ КОЛБОЧКИ
Хотя реальные молекулярные механизмы магниторецепции до сих пор не известны, существует определенный набор теоретических представлений о том, как мог бы быть устроен анализатор направления магнитного поля, находись он в сетчатке и используй он криптохромы как первичные молекулярные сенсоры направления магнитного поля (Ritz et al., 2000, 2009, 2010; Hore, Mouritsen, 2016; Worster et al., 2017). Вкратце эти представления состоят в следующем.
1. Магниторецепция осуществляется молекулами криптохрома, в которых вероятность перехода в сигнальное состояние после поглощения фотона определяется ориентацией самой молекулы по отношению к направлению магнитного поля (см. раздел “Физические принципы работы магниторецептора на радикальных парах. Криптохромы”).
2. Хаотически расположенные молекулы криптохрома не смогли бы создавать сигнал, уровень которого зависел бы от ориентации клетки по отношению к магнитному полю, поэтому предполагается, что, хотя молекулы криптохрома не являются транс- или при-мембранными белками, они тем не менее могут образовывать комплексы с другими при-мембранными белками и таким образом выстраивать ориентированные структуры внутри клетки. Если развивать это предположение, становится очевидно, что чем более упорядочена матрица, служащая основой для выстраивания молекул криптохрома, тем лучше такая клетка будет различать направление магнитного поля. Наиболее упорядоченной структурой в сетчатке являются наружные сегменты фоторецепторов – палочек и колбочек, содержащие стопки многочисленные мембранных дисков, поэтому вполне естественно предположить, что криптохромы могут образовывать комплексы с молекулами зрительного пигмента и таким образом формировать упорядоченные структуры.
3. Присутствие в фоторецепторной клетке криптохромов и обусловленная этим ее чувствительность к направлению магнитного поля означают наличие в одной сенсорной клетке двух сенсорных модальностей. Подобные примеры, хотя и редки, но все же существуют. Так, в окончаниях термочувствительных нейронов проводимостью одних и тех же TRP (Transient Receptor Potential) каналов управляют и температура, и химический лиганд (Dhaka et al., 2006; Baez et al., 2014). Теоретически возможен и другой вариант, когда одна сенсорная модальность (например, магниторецепция) не влияет непосредственно на проводимость наружной мембраны, но модулирует работу второй сенсорной модальности (например, фоторецепции). Таким образом, в случае фоторецепторной клетки предполагается гипотетическая схема, при которой криптохромы через неизвестный молекулярный механизм модулируют работу каскада фототрансдукции.
Считается, что все многочисленные основные и регуляторные компоненты каскада фототрансдукции определены и связи между ними хорошо известны. Поглотив квант света, молекула зрительного пигмента изменяет свою конформацию и переходит в активное состояние, запуская каскад фототрансдукции – многостадийный процесс, в результате работы которого в палочках активация только одной молекулы пигмента приводит к закрытию нескольких сотен катионных каналов на наружной плазматической мембране фоторецептора. В случае колбочек эффективность каскада существенно меньше, и активация одной молекулы колбочкового зрительного пигмента генерирует сигнал, неразличимый на уровне шума. Для молекулы криптохрома, при всей привлекательности гипотезы о ее роли первичного магниторецептора, неизвестны никакие механизмы взаимодействий ни с участниками каскада фототрансдукции, ни с любыми другими сигнальными процессами в фоторецепторах.
Поскольку магниторецепция, основанная на фотохимических реакциях в криптохроме, не может работать в полной темноте, возникает также вопрос о возможной конкуренции за свет между криптохромами и зрительными пигментами.
Необходимость конкуренции за кванты света с молекулами зрительного пигмента делает палочки маловероятным местом возможной локализации криптохромов, в то время как в колбочках, которые не функционируют при сумеречных уровнях освещенности, криптохромы могли бы запускать механизмы, обеспечивающие вечернее миграционное поведение, характерное для перелетных воробьинообразных птиц (Hore, Mouritsen, 2016). Это предположение согласуется с результатами иммуногистохимического анализа, показывающего ко-локализацию некоторых криптохромов с колбочковыми зрительными пигментами (см. раздел “Локализация криптохромов в сетчатке. Вероятный клеточный субстрат магниторецепции”).
Кроме того, такая модель делает принципиально неразличимыми модулирующее воздействие магнитного поля и изменения интенсивности света, падающего на фоторецептор. Удачным решением этой проблемы, по мнению ряда авторов (Hore, Mouritsen, 2016; Worster et al., 2017), было бы наличие двух рядом расположенных детекторов, у которых реакция на свет была бы одинаковой, а реакция на магнитное поле – разной из-за взаимно перпендикулярного расположения криптохромов в одном рецепторе относительно другого. На роль такого детектора был предложен реально существующий тип фоторецептора – двойная колбочка.
Двойные колбочки не встречаются у млекопитающих, но широко распространены в сетчатках рыб, амфибий, рептилий и птиц (Hart, 2001; Hunt et al., 2009). Двойная колбочка состоит из двух неодинаковых по размеру и форме частично сросшихся колбочек – основной и дополнительной. Основная колбочка, как правило, более длинная и узкая, дополнительная – короткая и широкая. Наружные сегменты основного и дополнительного компонента двойной колбочки из-за близкого расположения оптически тесно связаны. Обе колбочки соединены на уровне внутреннего сегмента таким образом, что мембраны прилегающих областей образуют, по некоторым данным, щелевые контакты (Smith et al., 1985). С другой стороны, в сетчатке рептилий показано отсутствие функциональной связи между основной и дополнительной составляющими двойных колбочек (Firsov, Green, 1998). Наружные сегменты обоих компонентов двойных колбочек у всех до сих пор исследованных видов птиц содержат одинаковый длинноволновый пигмент. Единственным известным исключением является мигрирующий рисовый трупиал (Dolichonyx oryzivorus), у которого в основном наружном сегменте экспрессируется длинноволновый пигмент (565 нм), а в дополнительном – коротковолновый (403 нм) (Beason, Loew, 2008). Считается, что основной функцией двойных колбочек в сетчатке является не цветоразличение, а различение интенсивностей в пределах поля зрения и выделение контрастов. Два компонента двойной колбочки не являются спектрально идентичными детекторами света, так как основной компонент, в отличие от дополнительного, содержит во внутреннем сегменте так называемую масляную каплю – светофильтр, отсекающий коротковолновую часть света, достигающего наружного сегмента (Hunt et al., 2009).
У основного и дополнительного элемента двойной колбочки диски наружных сегментов располагаются в параллельных плоскостях. Равным образом и во внутренних сегментах нет структур, которые ориентировали бы молекулы криптохрома под углом друг к другу, обеспечивая разную реакцию на магнитное поле. Тем не менее упорядоченная и расположенная под углом ориентация криптохромов в двух соседних клетках могла бы быть достигнута их сцеплением с тяжами родопсинов в мембранных дисках двух составляющих двойной колбочки (Hore, Mouritsen, 2016). Некоторые из имеющихся к настоящему времени данных действительно свидетельствуют о возможности существования различных олигомерных аггрегаций родопсина в мембранных дисках фоторецепторов рептилий (Govardovskii et al., 2009) и мышей (Gunkel et al., 2015), хотя только у последних показано наличие линейных олигомерных структур родопсина, ориентированных в одном направлении.
Неизвестен специальный механизм, который, сравнивая выходные сигналы двух компонентов двойной колбочки, позволял бы вычленять модулирующий магниторецепторный сигнал. Таким образом, двойная колбочка, по крайней мере на уровне современных знаний, не предоставляет преимущества для осуществления магниторецепции по сравнению с двумя одиночными близкорасположенными колбочками – и в том, и в другом случае предписанных гипотетических свойств больше, чем реально существующих.
ЗАКЛЮЧЕНИЕ
В 2018 г. исполнилось 50 лет со времени начала публикации Вольфгангом и Розитой Вильчко с соавторами серии статей, в которых на основании данных поведенческих экспериментов было объективно подтверждено ранее высказанное предположение о том, что птицы ориентируются в своем миграционном перемещении по магнитному полю. Удивительно, но за прошедшие полвека это положение так и остается почти единственным фактическим составляющим науки о магниторецепции позвоночных. Прогресс, достигнутый за это же время в изучении фото- , хемо- и в меньшей степени механорецепции, определил желательный уровень комплексного подхода к описанию механизмов рецепции. Сегодня описание работы какой-либо сенсорной системы должно содержать информацию о молекулярном механизме рецепции сенсорного стимула, о внутриклеточных механизмах трансдукции сенсорного стимула в электрический ответ клетки-рецептора, об основных нейрональных путях первичной обработки сенсорного сигнала и о путях передачи сенсорной информации в мозг, а также представление о центральных механизмах обработки сенсорного сигнала и о воздействии соответствующей сенсорной информации на поведение животного. Очевидно, что для магниторецепции у птиц пока только последнее из вышеперечисленных положений может считаться в значительной степени изученным.
В то же время, за последние 20 лет было выдвинуто много интересных гипотетических концепций и о природе молекулярных сенсоров магнитного поля, и о клеточных механизмах рецепции. Были предложены конкретные кандидаты на роль клеточных субстратов магниторецепции – двойные колбочки сетчатки птиц. В настоящем обзоре мы постарались показать, что хотя некоторые положения выдвинутых гипотез плохо совместимы с современными представлениями о работе фоторецепторной сенсорной системы или даже прямо им противоречат, предложенные варианты работы магниторецепторной сенсорной системы следует тем не менее считать вероятными и в общих чертах теоретически реализуемыми. Очевидно, что современное состояние науки о магниторецепции характеризуется достаточным количеством вполне приемлемых рабочих гипотез, которые требуют экспериментальной проверки. Мы полагаем, что первоочередной задачей является проведение комплексного электрофизиологического исследования сетчатки на уровне целой ткани и отдельных клеток для определения источника первичного магниторецепторного сигнала. Необходимо также однозначно идентифицировать молекулярный рецептор магнитного поля и определить молекулярные механизмы, при помощи которых сигнал рецептора транслируется на следующие нейроны. Можно надеяться, что в случае успешного решения этих базовых вопросов наука о магниторецепции получит мощный стимул к дальнейшему развитию.
Исследование выполнено при поддержке гранта РНФ 16-14-10159.
Список литературы
Baez D., Raddatz N., Ferreira G., Gonzalez C., Latorre R., 2014. Gating of thermally activated channels // Curr. Top. Membr. V. 74. P. 51–87.
Bailey M.J., Cassone V.M., 2005. Melanopsin expression in the chick retina and pineal gland // Molecular Brain Res. V. 134. № 2. P. 345–348.
Beason R.C., Loew E.R., 2008. Visual pigment and oil droplet characteristics of the bobolink (Dolichonyx oryzivorus), a new world migratory bird // Vision Res. V. 48. № 1. P. 1–8.
Bolte P., Bleibaum F., Einwich A., Günther A., Liedvogel M., Heyers D., Depping A., Wöhlbrand L., Rabus R., Janssen-Bienhold U., Mouritsen H., 2016. Localisation of the putative magnetoreceptive protein cryptochrome 1b in the retinae of migratory birds and homing pigeons // PLoS One. V. 11. № 3. P. e0147819.
Bottesch M., Gerlach G., Halbach M., Bally A., Kingsford M.J., Mouritsen M., 2016. A magnetic compass that might help coral reef fish larvae return to their natal reef // Curr. Biol. V. 26. P. R1266–R1267.
Chaves I., Pokorny R., Byrdin M., Hoang N., Ritz T., Brettel K., Essen L.-O., Horst G.T.J., van der, Batschauer A., Ahmad M., 2011. The cryptochromes: blue light photoreceptors in plants and animals // Annu. Rev. Plant Biol. V. 62. P. 335–364.
Chernetsov N., Pakhomov A., Kobylkov D., Kishkinev D., Holland R.A., Mouritsen H., 2017. Migratory Eurasian reed warblers can use magnetic declination to solve the longitude problem // Curr. Biol. V. 27. № 17. P. 2647–2651.
Collin J.P., Oksche A., 1981. Structural and functional relationships in the nonmammalian pineal gland // The Pineal Gland. V. 1. P. 27–67.
Deutschlander M.E., Freake M.J., Borland S.C., Phillips J.B., Madden R.C., Anderson L.E., Wilson B.W., 2003. Learned magnetic compass orientation by the Siberian hamster, Phodopus sungorus // Anim. Behav. V. 65. № 4. P. 779–786.
Dhaka A., Viswanath V., Patapoutian A., 2006. Trp ion channels and temperature sensation // Annu. Rev. Neurosci. V. 29. P. 135–161.
Diego-Rasilla F.J., Luengo R.M., Phillips J.B., 2013. Use of a light-dependent magnetic compass for y-axis orientation in European common frog (Rana temporaria) tadpoles // J. Comp. Physiol. A. V. 199. P. 619–628.
Dodson C.A., Hore P.J., Wallace M.I., 2013. A radical sense of direction: signalling and mechanism in cryptochrome magnetoreception // Trends Biochem. Sci. V. 38 № 9. P. 435–446.
Dreyer D., Frost B., Mouritsen H., Günther A., Green K., Whitehouse M., Johnsen S., Heinze S., Warrant E., 2018. The Earth’s magnetic field and visual landmarks steer migratory flight behaviour in the nocturnal Australian Bogong moth // Curr. Biol. V. 28. doi 10.1016/j.cub.2018.05.030
Emlen S.T., Wiltschko W., Demong N.J., Wiltschko R., Bergman S., 1976. Magnetic direction finding: evidence for its use in migratory indigo buntings // Science. V. 193. P. 505–508.
Firsov M.L., Green, D.G., 1998. Photoreceptor coupling in turtle retina // Visual Neuroscience. V. 15. № 4. P. 755–764.
Fleischmann P.N., Grob R., Müller V.L., Wehner R., Rössler W., 2018. The geomagnetic field is a compass cue in Cataglyphis ant navigation // Curr. Biol. V. 28. № 9. P. 1440–1444.
Gegear R.J., Casselman A., Waddell S., Reppert S.M., 2008. Cryptochrome mediates light-dependent magnetosensitivity in Drosophila // Nature. V. 454. P. 1014–1018.
Govardovskii V.I., Korenyak D.A., Shukolyukov S.A., Zueva L.V., 2009. Lateral diffusion of rhodopsin in photoreceptor membrane: a reappraisal // Mol. Vis. V. 15. P. 1717–1729.
Guerra P.A., Gegear R.J., Reppert S.M., 2014. A magnetic compass aids monarch butterfly migration // Nature Comm. V. 5. P. 4164.
Gunkel M., Schoneberg J., Alkhaldi W., Irsen S., Noe F., Kaupp U.B., Al-Amoudi A., 2015. Higher-order architecture of rhodopsin in intact photoreceptors and its implication for phototransduction kinetics // Structure. V. 23. № 4. P. 628–638.
Günther A., Einwich A., Sjulstok E., Feederle R., Bolte P., Koch K.-W., Solov’yov I.A., Mouritsen H., 2018. Double-cone localization and seasonal expression pattern suggest a role in magnetoreception for European robin cryptochrome 4 // Curr. Biol. V. 28. № 2. P. 211–223.
Hart N.S., 2001. The visual ecology of avian photoreceptors // Prog. Retin. Eye Res. V. 20. № 5. P. 675–703.
Heyers D., Manns M., Luksch H., Güntürkün O., Mouritsen H., 2007. A visual pathway links brain structures active during magnetic compass orientation in migratory birds // PLoS One. V. 2. № 9. P. e937.
Hiscock H.G., Mouritsen H., Manolopoulos D., Hore P.J., 2017. Disruption of magnetic compass orientation in migratory birds by radiofrequency electromagnetic fields // Biophys. J. V. 113. № 7. P. 1475–1484.
Hiscock H.G., Worster S., Kattnig D.R., Steers C., Jin Y., Manolopoulos D.E., Mouritsen H., Hore P.J., 2016. The quantum needle of the avian magnetic compass // Proc. Natl. Acad. Sci. USA. V. 113. P. 4634–4639.
Holland R., Thorup K., Vonhof M.J., Cochran W.W., Wikelski M., 2006. Bat orientation using Earth’s magnetic field // Nature. V. 444. P. 702.
Hore P.J., Mouritsen H., 2016. The radical-pair mechanism of magnetoreception // Annu. Rev. Biophys. V. 45. P. 299–344.
Hunt D.M., Carvalho L.S., Cowing J.A., Davies W.L., 2009. Evolution and spectral tuning of visual pigments in birds and mammals // Philos. Trans. R. Soc. London B. V. 364. № 1531. P. 2941–2955.
Kattnig D.R., Solovy’ov I.A., Hore P.J., 2016. Electron spin relaxation in cryptochrome-based magnetoreception // Phys. Chem. Chem. Phys. V. 18. P. 12443–12456.
Kattnig D.R., Evans E.W., Déjean V., Dodson C.A., Wallace M.I., Mackenzie S.R., Timmel C.R., Hore P.J., 2016a. Chemical amplification of magnetic field effects relevant to avian magnetoreception // Nature Chemistry. V. 8. P. 384–391.
Kattnig D.R., Sowa J.K., Solov’yov I.A., Hore P.J., 2016b. Electron spin relaxation can enhance the performance of a cryptochrome-based magnetic compass sensor // New J. Physics. V 18. P. 063007
Kavokin K., 2017. Can a hybrid chemical-ferromagnetic model of the avian compass explain its outstanding sensitivity to magnetic noise? // PloS ONE. V. 12. № 3. P. e0173887.
Kishkinev D., Chernetsov N., Heyers D., Mouritsen H., 2013. Migratory reed warblers need intact trigeminal nerves to correct for a 1.000 km eastward displacement // PLoS ONE. V. 8. № 6. P. e65847.
Kishkinev D., Chernetsov N., Pakhomov A., Heyers D., Mouritsen H., 2015. Eurasian reed warblers compensate for virtual magnetic displacement // Curr. Biol. V. 25. № 19. P. R822–R824.
Liedvogel M., Maeda K., Henbest K., Schleicher E., Simon T., Timmel C.R., Hore P.J., Mouritsen H., 2007. Chemical magnetoreception: bird cryptochrome 1a is excited by blue light and forms long-lived radical-pairs // PloS ONE. V. 2. № 10. e1106.
Lohmann K.J., Hester J.T., Lohmann C.M.F., 1999. Long-distance navigation in sea turtles // Ethol. Ecol. Evol. V. 11. № 1. P. 1–23.
Lohmann K.J., Pentcheff N.D., Nevitt G.A., Stetten G.D., Zimmer-Faust R.K., Jarrard H.E., Boles L.S., 1995. Magnetic orientation of spiny lobsters in the ocean: experiments with undersea coil systems // J. Exp. Biol. V. 198. P. 2041–2048.
Maeda K., Henbest K.B., Cintolesi F., Kuprov I., Rodgers C.T., Liddell P.A., Gust D., Timmel C.R., Hore P.J., 2008. Chemical compass model of avian magnetoreception // Nature. V. 453. № 7183. P. 387–390.
Malewski S., Begall S., Burda H., 2018. Learned and spontaneous magnetosensitive behaviour in the Roborovski hamster (Phodopus roborovskii) // Ethology. V. 28. doi 10.1111/eth.12744
Mitsui H., Maeda T., Yamaguchi C., Tsuji Y., Watari R., Kubo Y., Okano K., Okano T., 2015. Overexpression in yeast, photocycle, and in vitro structural change of an avian putative magnetoreceptor cryptochrome4 // Biochemistry. V. 54. № 10. P. 1908-1917.
Möller A., Sagasser S., Wiltschko W., Schierwater B., 2004. Retinal cryptochrome in a migratory passerine bird: a possible transducer for the avian magnetic compass // Naturwissenschaften. V. 91. P. 585–588.
Mouritsen H., Feenders G., Liedvogel M., Wada K., Jarvis E.D., 2005. Night-vision brain area in migratory songbirds // Proc. Natl. Acad. Sci. U.S.A. V. 102. № 23. P. 8339–8344.
Mouritsen H., Janssen-Bienhold U., Liedvogel M., Feenders G., Stalleicken J., Dirks P., Weiler R., 2004. Cryptochromes and neuronal-activity markers colocalize in the retina of migratory birds during magnetic orientation // PNAS. V. 101. P. 14294–14299.
Muheim R., Bäckman J., Åkesson S., 2002. Magnetic compass orientation in European robins is dependent on both wavelength and intensity of light // J. Exp. Biol. V. 205. P. 3845–3856.
Munro U.H., Munro J.A., Phillips J.B., Wiltschko W., 1997. Effect of wavelength of light and pulse magnetisation on different magnetoreception systems in a migratory bird // Aust. J. Zool. V. 45. P. 189–198.
Naisbett-Jones L.C., Putman N.F., Stephenson J.F., Ladak S., Young K.A., 2017. A magnetic map leans juvenile European eels to the Gulf Stream // Curr. Biol. V. 27. P. 1236–1240.
Nielsen C., Nørby M. S., Kongsted J., Solov’yov I. A., 2018. Absorption spectra of FAD embedded in cryptochromes // J. Phys. Chem. Lett. V. 9. № 13. P. 3618–3623.
Nießner C., Denzau S., Gross J.C., Peichl L., Bischof H.-J., Fleissner G., Wiltschko W., Wiltschko R., 2011. Avian ultraviolet/violet cones identified as probable magnetoreceptors // PLoS One. V. 6. № 5. P. e20091.
Nießner C., Gross J. C. Denzau, S., Peichl L., Fleissner G., Wiltschko W., Wiltschko R., 2016. Seasonally changing cryptochrome 1b expression in the retinal ganglion cells of a migrating passerine bird // PloS one. V. 11. № 3. P. e0150377.
Okano T., Yoshizawa T., Fukada Y., 1994. Pinopsin is a chicken pineal photoreceptive molecule // Nature. V. 372. № 6501. P. 94.
Pakhomov A., Anashina A., Heyers D., Kobylkov D., Mouritsen H., Chernetsov N., 2018. Magnetic map navigation in a migratory songbird requires trigeminal input // Sci. Rep. V. 8. P. 11975.
Phillips J.B., Youmans P.W., Muheim R., Sloan K.A., Landler L., Painter M.S., Anderson C.R., 2013. Rapid learning of magnetic compass direction by C57BL/6 mice in a 4-armed ‘plus’ water maze // PLoS ONE. V. 8. № 8. P. e73112.
Pinzon-Rodriguez A., Muheim R., 2017. Zebra finches have a light-dependent magnetic compass similar to migratory birds // J. Exp. Biol. V. 220. P. 1202–1209.
Pinzon-Rodriguez A., Bensch S., Muheim R., 2018. Expression patterns of cryptochrome genes in avian retina suggest involvement of Cry4 in light-dependent magnetoreception // J. R. Soc. Interface. V. 15. № 140. P. 20 180 058.
Putman N.F., Endres C.S., Lohmann C.M.F., Lohmann K.J., 2011. Longitude perception and bicoordinate magnetic maps in sea turtles // Curr. Biol. V. 21. P. 463–466.
Putman N.F., Scanlan M.M., Billman E.J., O’Neil J.P., Couture R.B., Quinn T.P., Lohmann K.J., Noakes D.L.G., 2014. An inherited magnetic map guides ocean navigation in juvenile Pacific salmon // Curr. Biol. V. 24. P. 446–450.
Putman N.F., Verley P., Endres C.S., Lohmann K.J., 2015. Magnetic navigation behaviour and the oceanic ecology of young loggerhead sea turtles // J. Exp. Biol. V. 218. P. 1044–1050.
Quinn T.P., 1980. Evidence for celestial and magnetic compass orientation in lake migrating sockeye salmon fry // J. Comp. Physiol. V. 137. P. 243–248.
Rappl R., Wiltschko R., Weindler P., Berthold P., Wiltschko W., 2000. Orientation behavior of Garden Warblers (Sylvia borin) under monochromatic light of various wavelengths // Auk. V. 117. P. 256–260.
Ritz T., Adem S., Schulten K., 2000. A model for photoreceptor-based magnetoreception in birds // Biophys. J. V. 78. № 2. P. 707–718.
Ritz T., Ahmad M., Mouritsen H., Wiltschko R., Wiltschko W., 2010. Photoreceptor-based magnetoreception: optimal design of receptor molecules, cells, and neuronal processing // J. R. Soc. Interface. doi 10.1098/rsif.2009.0456.focus
Ritz T., Wiltschko R., Hore P.J., Rodgers C.T., Stapput K., Thalau P., Timmel C.R., Wiltschko W., 2009. Magnetic compass of birds is based on a molecule with optimal directional sensitivity // Biophys. J. V. 96. № 8. P. 3451–3457.
Sancar A., 2000. Cryptochrome: the second photoactive pigment in the eye and its role in circadian photoreception // Annu. Rev. Biochem. V. 69. № 1. P. 31–67.
Shakhparonov V.V., Ogurtsov S.V., 2017. Marsh frogs, Pelophylax ridibundus, determine migratory direction by magnetic field // J. Comp. Physiol. A. V. 203. № 1. P. 35–43.
Schneider T., Thalau H.P., Semm P., Wiltschko W., 1994. Melatonin is crucial for the migratory orientation of pied flycatchers (Ficedula hypoleuca Pallas) // J. Exp. Biol. V. 194. № 1. P. 255–262.
Schulten K., Swenberg C.E., Weller A., 1978. A biomagnetic sensory mechanism based on magnetic field modulated coherent electron spin motion // Z. Phys. Chem. (NF). V. 111. № 1. P. 1–5.
Smith R.L., Nishimura Y., Raviola G., 1985. Interreceptor junction in the double cone of the chicken retina // J. Submicroscopic Cytology. V. 17. № 2. P. 183–186.
Solov’yov I.A., Schulten K., 2012. Reaction kinetics and mechanism of magnetic field effects in cryptochrome // J. Phys. Chem. B. V. 116. № 3. P. 1089–1099.
Stapput K., Thalau P., Wiltschko R., Wiltschko W., 2008. Orientation of birds in total darkness // Curr. Biol. V. 18. P. 602–606.
Wiltschko R., Wiltschko W., 1998. Pigeon homing: effect of various wavelengths of light during displacement // Naturwissenschaften. V. 85. P. 164–167.
Wiltschko R., Munro U., Ford H., Stapput K., Wiltschko W., 2008. Light-dependent magnetoreception: orientation behaviour of migratory birds under dim red light // J. Exp. Biol. V. 211. №. 20. P. 3344–3350.
Wiltschko R., Stapput K., Thalau P., Wiltschko W., 2010. Directional orientation of birds by the magnetic field under different light conditions // J. R. Soc. Interface. doi 10.1098/rsif.2009.0367.focus
Wiltschko W., 1968. Über den Einfluβ statischer Magnetfelder auf die Zugorientierung der Rotkehlchen (Erithacus rubecula) // Z. Tierpsychol. V. 25. P. 537–558.
Wiltschko W., Wiltschko R., 1972. Magnetic compass of European robins // Science. V. 176. № 4030. P. 62–64.
Wiltschko W., Wiltschko R., 1995. Migratory orientation of European Robins is affected by the wavelength of light as well as by a magnetic pulse // J. Comp. Physiol. A. V. 177. № 3. P. 363–369.
Wiltschko W., Wiltschko R., 1999. The effect of yellow and blue light on magnetic compass orientation in European Robins, Erithacus rubecula // J. Comp. Physiol. A. V. 184. № 3. P. 295–299.
Wiltschko W., Wiltschko R., 2001. Light-dependent magnetoreception in birds: the behaviour of European robins, Erithacus rubecula, under monochromatic light of various wavelengths and intensities // J. Exp. Biol. V. 204. № 19. P. 3295–3302.
Wiltschko W., Munro U.H., Ford H., Wiltschko R., 1993. Red light disrupts magnetic orientation of migratory birds // Nature. V. 364. P. 525–527.
Wiltschko W., Munro U., Ford H., Wiltschko R., 2003. Magnetic orientation in birds: non-compass responses under monochromatic light of increased intensity // Proc. R. Soc. London B. V. 270. №. 1529. P. 2133–2140.
Wiltschko W., Freire R., Munro U., Ritz T., Rogers L., Thalau P., Wiltschko R., 2007. The magnetic compass of domestic chickens // J. Exp. Biol. V. 210. P. 2300–2310.
Worster S., Mouritsen H., Hore P.J., 2017. A light-dependent magnetoreception mechanism insensitive to light intensity and polarization // J. R. Soc. Interface. V. 14. №. 134. P. 20170405.
Zapka M., Heyers D., Hein C.M., Engels S., Schneider N.-L., Hans J., Weiler S., Dreyer D., Kishkinev D., Wild M., Mouritsen H., 2009. Visual, but not trigeminal, mediation of magnetic compass information in a migratory bird // Nature. V. 461. № 7268. P. 1274–1277.
Дополнительные материалы отсутствуют.
Инструменты
Журнал общей биологии


