Журнал общей биологии, 2019, T. 80, № 2, стр. 124-134
Биоиндикационный потенциал биофизических и гидробиологических показателей фитопланктона в экспериментах с лабораторными альгоценозами
П. В. Фурсова 1, *, П. А. Бобырев 1, Д. В. Рисник 1, Е. Н. Воронова 1, С. И. Погосян 1
1 Московский государственный университет им. М.В. Ломоносова, биологический факультет, кафедра биофизики
119234 Москва, Ленинские горы, Россия
* E-mail: fursova@biophys.msu.ru
Поступила в редакцию 11.09.2018
После доработки 29.11.2018
Принята к публикации 14.12.2018
Аннотация
Для оценки воздействия на экосистему тех или иных факторов широко используют биоиндикацию – метод оценки качества природной среды по состоянию ее биоты. При этом актуальными остаются две проблемы: с одной стороны, это проблема адекватного выбора биологических показателей состояния экосистемы, имеющих наибольший биоиндикационный потенциал, с другой – проблема установления численных границ нормы для индикаторов. Для исследования биоиндикационного потенциала гидробиологических и биофизических показателей был создан лабораторный альгоценоз, состоящий из представителей различных классов микроводорослей и цианобактерий: Anabaena variabilis, Pleurochloris magna, Ankistrodesmus falcatus и Stichococcus bacillaris. В качестве действующих токсикантов использовали соли меди, цинка и диурон. Анализ полученных экспериментальных данных проводили методом локальных экологических норм. Метод основан на компьютерном анализе взаимного распределения биологических и физико-химических характеристик, а именно на поиске таких границ норм фактора и индикатора, при которых благополучные значения индикатора соответствуют допустимым значениям фактора, а недопустимые значения фактора – неблагополучным значениям индикатора. В работе проанализированы данные по 27 биоиндикаторам: различные показатели флуоресценции, спектральные характеристики; численности и средние объемы клеток каждого вида; параметры ранговых распределений численностей видов в пробе; индексы выравненности; непараметрические индексы видового разнообразия; индекс сапробности фитопланктона. Для каждого индикатора рассчитали границу нормы, определили существенно влияющие на него факторы и их границу нормы; оценили полноту вклада фактора в степень неблагополучия индикатора; провели сравнение биоиндикаторов по средней силе связи с факторами, количеству найденных существенных факторов и их среднегеометрическому значению.
Биоиндикацию – метод оценки качества природной среды по состоянию ее биоты – широко используют для оценки воздействия на экосистему тех или иных факторов. Традиционными показателями, играющими индикационную роль в исследованиях водоемов, являются видовой состав, численность, биомасса, сапробность видов-индикаторов, а также трофический состав, различные отношения вышеприведенных показателей и многие другие. Методы, основанные на таких показателях, объединены под названием общих экологических, или гидробиологических. Гидробиологические методы имеют ряд недостатков, к которым можно отнести высокую трудоемкость и длительность обработки проб, необходимость квалифицированного определения видов организмов, ошибки в подсчете их численностей и др. В связи с этим предприняты попытки поиска альтернативных подходов, лишенных подобных недостатков. Одним из таких подходов можно считать комплекс биофизических методов. Прежде всего это биоиндикация, основанная на измерении показателей флуоресценции хлорофилла, отражающих состояние фотосинтетического аппарата зеленых растений. Биофизические методы обладают некоторыми преимуществами перед стандартными гидробиологическими подходами: высокой точностью инструментальных измерений, возможностью компьютерного анализа данных в режиме реального времени и в полевых условиях, малыми временными затратами, применимостью практически в любых экосистемах как наземных, так и водных.
Несмотря на успешное применение биоиндикации во многих странах (EU Water Framework Directive, 2000), существуют две важные проблемы. С одной стороны, это проблема адекватного выбора биологических показателей состояния экосистемы, имеющих наибольший биоиндикационный потенциал, с другой – проблема установления численных границ нормы (разделяющих норму и отклонение от нормы) для индикаторов.
В настоящей работе проведена апробация метода локальных экологических норм (метода ЛЭН) на данных экспериментов с поликультурами водорослей и цианобактерий в контролируемых условиях воздействия трех химических агентов в диапазоне качества среды от нормы до очевидного неблагополучия. Также сопоставлены и проранжированы по биоиндикационному потенциалу наборы биофизических и гидробиологических показателей.
ОБЪЕКТЫ И МЕТОДЫ
Для экспериментов были выбраны альгологически чистые культуры микроводорослей A. variabilis, P. magna, A. falcatus и S. bacillaris (цианобактерия, охрофитовая и два вида зеленых водорослей, соответственно). Клетки этих видов обладают схожими условиями оптимального роста (свет, температура, потребности в элементах питания) и в то же время характеризуются морфологическими различиями, достаточными для высокой точности подсчета численности при микроскопировании (Fursova et al., 2017).
Культивирование монокультур водорослей
В качестве базовой среды для подготовки инокулята использовали модифицированную для работы с пресноводными видами среду BG11 с добавками микроэлементов (Allen, 1968). Финальное значение pH приготовленной среды – 7.4. Культивирование происходило в люминостате при температуре 21°С в режиме непрерывного освещения при интенсивности света 80 мкмоль квантов/(м2 с). При культивировании поддерживали бактериологическую и альгологическую чистоту культур. Стадии роста и достижение стационарной фазы контролировали по содержанию хлорофилла спектрофотометрическим методом. Колбы с культурами располагали на качалках для равномерного перемешивания суспензии.
Культивирование смешанной культуры под воздействием токсикантов
Для составления смешанной культуры суспензии микроводорослей на линейной стадии роста брали в пропорциях 2 : 1 : 1 : 1 (A. falcatus : P. magna : A. variabilis : S. bacillaris). Суспензию каждого вида водорослей разводили до достижения показателя абсорбции на длине волны 678 нм, равного 0.02. Перед инокуляцией клетки отмывали от среды культивирования троекратным центрифугированием в безазотной среде. Затем их пересаживали на безазотную среду BG11, из состава которой исключали соединение Na2EDTA, способное сорбировать соли тяжелых металлов. Выращивание на обедненной среде приводило к краткому (в сравнении с необедненной средой) сроку достижения стационарной стадии (Fursova et al., 2017). Световые и температурные условия культивирования по сравнению с выращиванием монокультур не изменяли.
В качестве действующих токсикантов использовали соли меди, цинка и диурон. Вариации токсикантов и их концентрации были сгенерированы случайным образом (равномерное распределение) в пределах от 1 до 100 ПДК для цинка и меди и от 1 до 10 ПДК для диурона (табл. 1). Суммарно было исследовано влияние 30 сочетаний концентраций токсических веществ.
Таблица 1.
Сочетания концентраций токсикантов (сгенерированные на основе равномерно распределенной случайной величины концентраций от 1 до 10 для диурона и от 1 до 100 ПДК ‒ для меди и цинка), воздействующих на смешанную культуру микроводорослей
| № | Диурон | Zn | Сu | № | Диурон | Zn | Сu | № | Диурон | Zn | Сu |
|---|---|---|---|---|---|---|---|---|---|---|---|
| мг/л | мг/л | мг/л | |||||||||
| 1 | 8.5 | 2.1 | 76.8 | 11 | 3.9 | 70.4 | 55.9 | 21 | 4.4 | 85.6 | 11.8 |
| 2 | 3.5 | 28.8 | 69.2 | 12 | 0.9 | 83.9 | 66.6 | 22 | 4.9 | 15.8 | 33.3 |
| 3 | 10.0 | 46.3 | 51.8 | 13 | 6.2 | 90.6 | 90.0 | 23 | 7.1 | 59.7 | 42.1 |
| 4 | 5.6 | 19.5 | 96.6 | 14 | 5.6 | 59.9 | 78.9 | 24 | 6.1 | 72.3 | 61.2 |
| 5 | 1.3 | 86.6 | 95.3 | 15 | 1.9 | 53.7 | 35.0 | 25 | 8.7 | 60.0 | 57.6 |
| 6 | 1.3 | 13.8 | 87.3 | 16 | 9.2 | 14.7 | 12.5 | 26 | 7.8 | 57.8 | 20.4 |
| 7 | 2.7 | 77.5 | 87.9 | 17 | 7.3 | 46.0 | 98.7 | 27 | 1.2 | 63.5 | 23.0 |
| 8 | 4.9 | 97.9 | 34.4 | 18 | 1.9 | 2.5 | 65.4 | 28 | 9.2 | 97.1 | 57.3 |
| 9 | 0.9 | 88.5 | 83.4 | 19 | 1.9 | 47.1 | 15.1 | 29 | 8.3 | 42.0 | 77.1 |
| 10 | 1.3 | 45.7 | 58.1 | 20 | 5.4 | 67.3 | 57.6 | 30 | 3.7 | 60.9 | 33.7 |
Измерения параметров флуоресценции и оптических показателей, а также микрофотографирование проводили сразу после добавления токсикантов в поликультуры водорослей, через 24 и 48 ч инкубации с токсическими веществами.
Эксперимент проводили в трех повторностях.
Параметры флуоресценции хлорофилла
Параметры флуоресценции хлорофилла в суспензии водорослей измеряли на флуориметре с амплитудной модуляцией возбуждающего света “Мега 25", созданном на кафедре биофизики биологического факультета МГУ им. М.В. Ломоносова (Погосян и др., 2009). Измерения проводили после предварительной 15-минутной темновой адаптации водорослей. Интенсивность флуоресценции измеряли при помощи электронного фотоумножителя через фильтр КС-18, пропускающий излучение с длиной волны более 680 нм. Возбуждение флуоресценции проводили с помощью светодиодов, имеющих максимум излучения на длине волны 455 нм. Интенсивность флуоресценции хлорофилла в условиях открытых реакционных центров фотосистемы 2 (F0) и максимальную интенсивность флуоресценции хлорофилла в условиях полностью закрытых реакционных центров фотосистемы 2 (Fm) измеряли при интенсивности возбуждающего света с плотностью 0.8 и 6000 мкмоль квантов/(м2 с) соответственно. Измерения проведены согласно “Методике измерений обилия и индикации состояния фитопланктона флуоресцентным методом” (Маторин и др., 2010; Konyukhov et al., 2012). Методика аттестована: аттестат № 01.0025/205-66-11, ФР.1.39.2011.11246.
Потенциальную эффективность первичных процессов фотосинтеза Fv/Fm (максимальный фотохимический квантовый выход фотосистемы 2) вычисляли по формуле: Fv/Fm = (Fm – F0)/Fm, где Fv = Fm – F0 ‒ переменная флуоресценция.
Значения флуоресценции представлены в относительных единицах.
Спектральные характеристики
Измерение спектров поглощения суспензий водорослей в диапазоне от 350 нм до 850 нм проводили на однолучевом спектрофотометре с интегрирующей сферой на базе спектрометра USB4000 (Ocean Optics, США). Спектр поглощения вычисляли на основании двух спектров оптической плотности, полученных при установке кюветы с образцом на разных расстояниях от интегрирующей сферы, что позволяло определить рассеяние света на образце (Merzlyak, Naqvi, 2000). Допустимая погрешность измерения оптической плотности не превышает 0.005 при оптической плотности 1 во всем спектральном диапазоне.
Численность, биомасса и средние размеры клеток
Численность и средние размеры клеток определяли по микрофотографиям. Содержимое камеры Горяева фотографировали при помощи микроскопа Люмам (ЛОМО, РФ) с камерой DCM310 Microscope CMOS Camera (Китай). Фотографированию предшествовал период оседания клеток в камере (10 мин), чтобы фокусировка микроскопа охватила слой, в который попали клетки из всего объема камеры. Для каждой пробы было сделано от 20 (на этапах, когда численность была высока) до 30 (на этапах, когда численность была мала) фотографий различных полей зрения.
Автоматический подсчет клеток осуществляли при помощи программы Fiji (Schindelin, 2012), базирующейся на программном обеспечении ImageJ 1.49f. Фотоснимки поля зрения камеры микроскопа передавались на монитор компьютера. Зеленый канал полученных цветных снимков, как наименее зашумленный и наиболее контрастный, преобразовывался в черно-белые изображения. Анализируя их, программа определяла численность и средние размеры клеток каждого вида в поликультуре. Предварительное “обучение” распознаванию образов клеток различных видов было проведено по снимкам монокультур (Fursova et al., 2017).
Биомассу клеток рассчитывали, исходя из средних размеров клеток, их геометрических приближений форм и численности в пробе. Плотность клеток принимали равной единице.
Показатели таксономической структуры сообщества
Показатели таксономической структуры сообщества рассчитывали по данным о численностях клеток каждого вида.
В качестве параметрических индексов разнообразия использовали параметры экспоненциальной (z) и гиперболической (β) моделей рангового распределения численностей (Левич, 1980). Для расчетов виды в пробе упорядочивали по убыванию численности. Виду с максимальной численностью присваивали 1-й ранг, следующему по численности виду 2-й ранг и т.д., виду с минимальной численностью присваивали ранг w, где w – количество видов в пробе. Полученную зависимость численности от ранга аппроксимировали экспоненциальной или гиперболической моделью.
Экспоненциальная модель рангового распределения численностей видов (Motomura, 1932) описывает численности функцией: ${{n}_{i}} = {{n}_{1}}{{z}^{{i\, - \,1}}},$ где ni – численность клеток вида ранга i, z – параметр модели.
Гиперболическая модель (Левич, 1980) описывает значения численностей функцией ${{n}_{i}} = {{{{n}_{1}}} \mathord{\left/ {\vphantom {{{{n}_{1}}} {{{i}^{\beta }}}}} \right. \kern-0em} {{{i}^{\beta }}}},$ где β – параметр модели.
Индексы выравненности (Левич и др., 2009) определяли по формуле: ${{e}_{k}} = 1 - \left( {\sum\nolimits_{i\, = \,1}^k {{{{{n}_{i}}} \mathord{\left/ {\vphantom {{{{n}_{i}}} N}} \right. \kern-0em} N}} } \right)$ где N – общее число клеток в пробе, k – число доминирующих видов, используемых в анализе. В настоящей работе были использованы показатели: e1, e2, e3.
Непараметрические индексы видового разнообразия представлены в работе индексами Шеннона и Симпсона. Индекс видового разнообразия Шеннона рассчитывали по формуле (MacArthur, 1955): $H = - \sum\nolimits_{i\, = \,1}^w {\frac{{{{n}_{i}}}}{N}{{{\lg }}_{2}}\frac{{{{n}_{i}}}}{N}} ,$ где w – общее число видов в пробе, ni – численность i-го вида в пробе, N ‒ численность всей пробы.
Индекс видового разнообразия Симпсона определяли по формуле (Simpson, 1949): $M = \sqrt {\sum\nolimits_{i\, = \,1}^w {{{{\left( {\frac{{{{n}_{i}}}}{N}} \right)}}^{2}}} } .$
Индекс сапробности фитопланктона рассчитывали по формуле (Руководство…, 1992): ${\text{И С }} = {{\sum\nolimits_{i\, = \,1}^w {{{s}_{i}}{{n}_{i}}} } \mathord{\left/ {\vphantom {{\sum\nolimits_{i\, = \,1}^w {{{s}_{i}}{{n}_{i}}} } {\sum\nolimits_{i\, = \,1}^w {{{n}_{i}}} }}} \right. \kern-0em} {\sum\nolimits_{i\, = \,1}^w {{{n}_{i}}} }},$ где si – индивидуальная сапробность i-го вида, ni – численность i-го вида, w – число выбранных видов-индикаторов.
Метод локальных экологических норм
Метод локальных экологических норм (метод ЛЭН) основан на компьютерном анализе взаимного распределения биологических и физико-химических характеристик, а именно на поиске таких границ норм фактора (ГНФ) и индикатора (ГНИ), чтобы благополучные значения индикатора соответствовали допустимым значениям фактора, а недопустимые значения фактора – неблагополучным значениям индикатора (рис. 1) (Рисник и др., 2016). Метод ЛЭН позволяет получать границы нормы факторов в случаях, когда недопустимы слишком высокие значения фактора (например, для содержания ксенобиотиков), слишком низкие его значения (например, для содержания растворенного кислорода в водоемах) или слишком высокие и слишком низкие его значения одновременно (например, содержание биогенных элементов в водах). Метод позволяет вести поиск границ нормы индикаторов, когда неблагополучны слишком высокие его значения (например, смертность организмов), слишком низкие (например, рождаемость в популяции), а также высокие и низкие значения одновременно (например, видовое разнообразие сообщества).
Рис. 1.
Классы значений индикатора и фактора при одновременном воздействии нескольких факторов среды. Области а, b, c, d обозначают качественные классы на диаграмме: а – благополучие индикатора при допустимых значениях фактора, b1, 2 – благополучные значения индикатора при недопустимых значениях фактора (слишком высоких и слишком низких соответственно), с – неблагополучие индикатора при допустимых значениях фактора, d1, 2 – неблагополучие индикатора при недопустимых значениях фактора (слишком высоких и слишком низких соответственно).
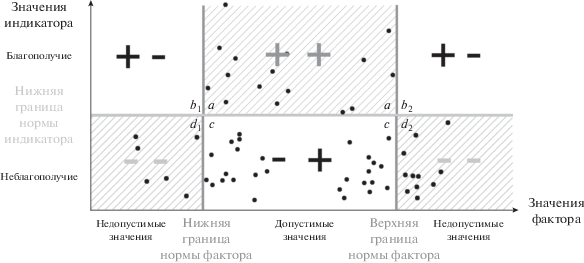
Если выбранная биологическая характеристика действительно является индикатором, то области b1, 2 на диаграмме (рис. 1) должны быть пустыми, поскольку “благополучие” индикатора при “недопустимых” значениях фактора невозможно. При рассмотрении воздействия одного фактора область с также должна быть пустой, однако в реальной ситуации к неблагополучию индикатора может приводить совокупное действие других факторов среды, что приводит к появлению точек в области с.
Совокупное влияние факторов составляет принципиальное отличие природных экосистем от лабораторных объектов, на которых проводят токсикологические эксперименты по определению нормативов ПДК.
Алгоритм метода ЛЭН состоит в переборе различных ГНИ и ГНФ на диаграммах зависимости индикатора от фактора и выборе таких границ, при которых выполнены условия (Рисник и др., 2016):
область b оказывается достаточно “пустой” (пустота ограничивается заданной минимальной точностью);
общее число наблюдений и количества наблюдений в областях a и d ограничиваются заданной минимальной представительностью (другими словами, должны быть достаточно представительными для достоверности анализа);
результаты анализа должны быть значимы с заданной доверительной вероятностью. Значимость (доверительную вероятность) полученных результатов оценивают как вероятность того, что при независимости распределений двух характеристик, между которыми проводится поиск связи, не будут найдены границы норм при заданных параметрах минимальной точности и представительности.
В рамках настоящей работы расчеты проводили при помощи программы по установлению границ качественных классов (Гончаров и др., 2012), реализующей алгоритмы метода ЛЭН при следующих значениях параметров поиска: минимальная точность – 0.85; минимальная представительность – 0.10; минимальная доверительная вероятность результатов – 95%.
Помимо ГНИ и ГНФ метод локальных экологических норм позволяет (Левич и др., 2011, 2012, 2013; Рисник и др., 2016) выявить существенные для экологического неблагополучия факторы среды, ранжировать их по вкладу в частоту случаев неблагополучия, рассчитать силу связи между индикаторами и факторами, оценить достаточность программ наблюдения за потенциально опасными факторами среды, сопоставить индикационный потенциал различных биологических характеристик.
Полноту вклада (ПВ) фактора в неблагополучие рассчитывают как долю наблюдений “недопустимых” по фактору и “неблагополучных” по индикатору среди всех “неблагополучных” значений по индикатору.
Достаточность программы наблюдений определяют как долю наблюдений индикатора, неблагополучие которых обусловлено действием факторов, входящих в программу наблюдений.
Важно отметить, что метод ЛЭН не вносит в анализ данных никаких модельных предпосылок или гипотез и состоит исключительно в подсчете встречаемости высоких и низких, допустимых и недопустимых значений характеристик в предыстории, т.е. работает только с первичными данными наблюдений. Метод не требует, чтобы распределения исходных данных удовлетворяли каким-либо статистическим критериям, не использует априорные представления о приемлемости и допустимости соответствующих границ.
Всего в работе проанализировали воздействие трех факторов (диурон, цинк, медь) на 27 биоиндикаторов:
F0 – фоновый уровень переменной флуоресценции; Fm – максимальный уровень переменной флуоресценции; Fv/Fm – эффективность фотосинтеза фитопланктона; D678 – коэффициент поглощения на длине волны 678 нм, пропорциональный содержанию хлорофилла “а” в культуре; D628 – коэффициент поглощения на длине волны 628 нм, пропорциональный содержанию фикобилинов в культуре; D480 – коэффициент поглощения на длине волны 480 нм, пропорциональный содержанию каротиноидов в культуре; D678/D628 (хлорофилл/фикобилины); D678/D480 (хлорофилл/каротиноиды); численности и биомассы клеток каждого вида (NAnabaena, NAnkistrodesmus, NPleurochloris, NStichococcus, ВAnabaena, ВAnkistrodesmus, ВPleurochloris, ВStichococcus); общая численность клеток и биомасса (Nобщ, Вобщ); средний объем клетки; параметры ранговых распределений численностей видов в пробе (z, β); индексы выравненности (e1, e2, e3); непараметрические индексы видового разнообразия (индекс Шеннона, индекс Симпсона); индекс сапробности фитопланктона (ИС).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Методом локальных экологических норм (ЛЭН) для каждого индикатора рассчитали границу нормы (ГНИ), определили существенные факторы и их границу нормы (ГНФ). Существенными считали факторы, для которых при заданных параметрах поиска методом ЛЭН найдены границы нормы.
Была проведена оценка полноты вклада фактора в степень неблагополучия индикатора, проведено сравнение биоиндикаторов по средней силе связи с факторами (СС), количеству найденных существенных факторов и их среднегеометрическому значению (СГ).
Для большинства индикаторов, как характеристик состояния популяции фитопланктона или состояния его отдельных видов, благополучными можно считать их высокие значения (они характеризуют высокую биомассу и численность, высокое разнообразие, оптическую плотность, флуоресценцию и т.п.), в связи с чем для этих индикаторов был проведен поиск нижних границ нормы. Исключениями являются только индекс сапробности и параметр β, высокие значения которых связаны с неблагополучием тестовой популяции; для этих показателей проводили поиск верхних границ нормы. Все испытанные факторы в изучаемом диапазоне действия выступают в роли токсикантов, в связи с этим для них проводили поиск верхних границ нормы. Значения рассчитанных границ норм индикаторов, факторов и их полноты представлены в табл. 2.
Таблица 2.
Значения границ норм индикатора (ГНИ), верхней границы норм фактора (ГНФ) и полноты вклада фактора (ПВ)
| Фактор | Верхняя ГНФ | ПВ | Верхняя ГНФ | ПВ | Верхняя ГНФ | ПВ |
|---|---|---|---|---|---|---|
| ГНИ | D480 > 0.13 | D628 > 0.05 | D678 > 0.12 | |||
| Диурон | 8.5 | 0.18 | ‒ | ‒ | 8.5 | 0.16 |
| Zn | ‒ | ‒ | 88.5 | 0.17 | 28.8 | 0.92 |
| Сu | 87.9 | 0.18 | ‒ | ‒ | 87.3 | 0.20 |
| ГНИ | D678/D480 > 0.92 | D678/D628 > 2.45 | F0 > 582 | |||
| Диурон | ‒ | ‒ | 4.9 | 0.65 | ‒ | ‒ |
| Zn | ‒ | ‒ | 63.5 | 0.5 | 46.3 | 0.79 |
| Сu | 65.4 | 0.65 | 69.2 | 0.45 | ‒ | ‒ |
| ГНИ | Fm > 1449.5 | Fv/Fm > 0.61 | e1 > 0.7 | |||
| Диурон | 8.5 | 0.15 | 1.9 | 0.95 | 4.9 | 0.54 |
| Zn | 28.8 | 0.88 | 88.5 | 0.14 | 53.7 | 0.65 |
| Сu | 76.8 | 0.35 | 87.3 | 0.23 | 87.3 | 0.19 |
| ГНИ | e2 >0.4 | e3 > 0.19 | Индекс Шеннона > 1.96 | |||
| Диурон | 4.9 | 0.58 | 8.3 | 0.20 | 6.2 | 0.42 |
| Zn | 63.5 | 0.46 | ‒ | ‒ | ‒ | ‒ |
| Сu | 87.3 | 0.21 | 90 | 0.12 | 90 | 0.16 |
| ГНИ | Индекс Симпсона > 0.53 | Nобщ > 8.5 × 109 кл./л | NAnabaena > 2.7 × 109 кл./л | |||
| Диурон | ‒ | ‒ | 4.9 | 0.62 | 4.9 | 0.62 |
| Zn | ‒ | ‒ | 63.5 | 0.48 | 63.5 | 0.48 |
| Сu | 51.8 | 0.73 | 69.2 | 0.43 | 69.2 | 0.43 |
| ГНИ | NAnkistrodesmus > 1.7 × 109 кл./л | NPleurochloris > 1.8 × 109. кл./л | NStichococcus > 2.4 × 109. кл./л | |||
| Диурон | 6.1 | 0.43 | 4.9 | 0.58 | 4.9 | 0.68 |
| Zn | 72.3 | 0.35 | ‒ | ‒ | ‒ | ‒ |
| Сu | 87.3 | 0.22 | 87.3 | 0.21 | 87.9 | 0.21 |
| ГНИ | Средний объем клетки > 87.7 мкм3 | zобщ > 0.87 | Индекс сапробности < 1.68 | |||
| Диурон | 1.3 | 0.89 | 4.9 | 0.54 | 8.3 | 0.19 |
| Zn | 88.5 | 0.11 | 53.7 | 0.65 | ‒ | ‒ |
| Сu | ‒ | ‒ | 87.3 | 0.19 | 90 | 0.11 |
| ГНИ | βобщ < 0.27 | BAnabaena > 0.017 г/л | BAnkistrodesmus > 0.02 г/л | |||
| Диурон | 7.8 | 0.22 | 4.9 | 0.58 | 7.8 | 0.22 |
| Zn | 88.5 | 0.11 | ‒ | ‒ | 88.5 | 0.11 |
| Сu | 83.4 | 0.22 | 87.3 | 0.21 | 87.9 | 0.15 |
| ГНИ | BPleurochloris > 0.02 г/л | BStichococcus > 0.02 г/л | Βобщ > 0.083 г/л | |||
| Диурон | 7.8 | 0.24 | 1.3 | 0.89 | 4.9 | 0.54 |
| Zn | 88.5 | 0.12 | 88.5 | 0.11 | 53.7 | 0.65 |
| Сu | 87.9 | 0.16 | 87.3 | 0.19 | 87.3 | 0.19 |
Полученные данные показали, что в лабораторных условиях факторы воздействовали на приблизительно равное количество биоиндикаторов. При этом все три рассматриваемых фактора действовали хотя бы на один из представленных показателей флуоресценции.
Диурон оказался существенным для 23 индикаторов, медь – для 24, цинк – для 18. При этом для 15 индикаторов существенными оказались все 3 фактора, для 8 индикаторов – пара факторов и для 4 индикаторов – по одному фактору.
Стоит отметить, что отсутствие установленной связи не говорит об отсутствии воздействия как такового – вполне вероятно, что связь не выявлена по причине недостаточного числа наблюдений.
Границы норм индикаторов
Методом ЛЭН были найдены границы нормы всех индикаторов (табл. 2). Для показателя потенциальной эффективности первичных процессов фотосинтеза расчет дал значение 0.61. Согласно имеющимся экспертным оценкам, для фитопланктона благополучными можно считать показатели выше 0.5 (для высших растений – выше 0.74, а диапазон 0.6–0.74 – “пограничным”, плохо поддающимся прогнозированию и требующим дополнительного исследования) (Маторин, Алексеев, 2013).
Границы норм и полнота факторов
Для всех трех действующих загрязнителей были найдены значения верхних границ (табл. 2). Это означает, что согласно расчетам все рассмотренные биоиндикаторы будут принимать благополучные значения при концентрациях токсиканта ниже найденных граничных значений. Так, например, при концентрациях диурона ниже 8.5 мг/л показатель D480 будет принимать благополучные значения.
Экологическое неблагополучие (или, по крайней мере, неблагополучие отдельных организмов) было зафиксировано при воздействии диурона в концентрациях свыше 1.3 мг/л, что близко к минимальной из исследованных концентраций и лишь незначительно превышает ПДК. Наиболее чувствительным индикатором к действию диурона оказалась биомасса S. bacillaris.
Согласно проведенным расчетам концентрации диурона, приводящие к экологическому неблагополучию, на порядок ниже таковых для цинка и меди. Переход лабораторного альгоценоза в состояние “неблагополучия” был зарегистрирован при превышении концентрации цинка 28.8 мг/л. При этом первым ответом клеток было изменение содержания хлорофилла “а” (D678) и значения максимальной флуоресценции (Fm). Известно, что ионы цинка не только приводят к снижению уровня хлорофилла в хлоропластах, но и способны конкурировать с ионами железа при формировании железосерных комплексов фотосинтетического аппарата; включение цинка в их состав приводит к появлению неактивных комплексов (Пигулевская, 1984).
Первое проявление негативного влияния меди было зафиксировано при концентрации выше 51.8 мг/л. При этом показателем, для которого была установлена такая ГНФ, оказался индекс Симпсона.
Несмотря на выбор концентраций токсикантов от 1 до 10 (100) ПДК, не все ГНФ соответствовали минимальным исследованным концентрациям, наиболее приближенным к 1 ПДК. По-видимому, исследованные виды не относятся к самым чувствительным звеньям пищевой цепи, по реакции которых в лабораторных условиях установлены ПДК для цинка и меди.
Важной характеристикой является полнота вклада (ПВ) фактора в неблагополучие индикатора (табл. 2).
Наибольшие значения полноты вклада действия диурона в неблагополучие индикаторов зафиксированы для эффективности фотосинтеза фитопланктона (Fv/Fm) (ПВ = 0.95), среднего объема клетки (ПВ = 0.89) и биомассы S. bacillaris (ПВ = 0.89).
Неблагополучие величин F0 и Fm преимущественно сопряжено с негативным действием ионов цинка (ПВ = 0.79 и 0.88), аналогичная сопряженность установлена для показателя D678 (ПВ = 0.92).
Полнота вклада воздействия меди на все индикаторы оказалась значительно меньше ПВ других токсикантов. Для индекса Симпсона этот показатель равен 0.73, а для индикатора D678/D480 – 0.65, причем медь для этого оптического показателя стала единственным существенным фактором.
Выбор наиболее эффективных биоиндикаторов
Понятие биоиндикационного потенциала может меняться в зависимости от целей и задач исследования. Так, если задача состоит в описании связей, целесообразнее выбрать биоиндикаторы с максимальной средней силой связи между значениями индикатора и факторов. При необходимости описать вклад всех факторов, учтенных в мониторинге, актуальнее выбрать биоиндикаторы с максимальной достаточностью программы наблюдений для описания причин неблагополучия при максимальном числе существенных факторов (напомним, что достаточность определяют как долю неблагополучных наблюдений, обусловленных недопустимостью значений хотя бы одного фактора среди всех неблагополучных наблюдений). При необходимости описать конкретные факторы целесообразно выбрать индикатор с высокой средней силой связи и полнотой для этих факторов, игнорируя все остальные характеристики.
В рамках настоящей работы задача оценить достаточность программы наблюдений не стояла – при строго контролируемом небольшом наборе факторов достаточность программы наблюдений определяется лишь количеством найденных существенных факторов для каждого индикатора. Очевидно, что при наличии значимой связи со всеми тремя факторами индикатор будет демонстрировать достаточность, близкую к единице. Таким образом, сопоставление биоиндикаторов проводили по двум параметрам – количеству найденных существенных факторов и средней силе связи между индикатором и фактором. Оба этих показателя были сведены в единый критерий путем вычисления среднегеометрического их нормированных величин (табл. 3). Нормировку производили следующим образом: среднюю силу связи делили на 0.33 (максимально возможная величина коэффициента существенности), количество найденных существенных факторов делили на 3 (максимально возможное количество существенных факторов).
Таблица 3.
Сравнение биоиндикаторов по средней силе связи с факторами (СС), количеству найденных существенных факторов и их нормированному среднегеометрическому значению (СГ). Индикаторы ранжированы в порядке убывания СГ
| Индикатор | СС | Число факторов | СГ | Индикатор | СС | Число факторов | СГ |
|---|---|---|---|---|---|---|---|
| D678/D628 | 0.17 | 3 | 0.72 | BPleurochloris | 0.08 | 3 | 0.50 |
| N | 0.15 | 3 | 0.67 | Индекс Шеннона | 0.12 | 2 | 0.49 |
| NAnabaena | 0.15 | 3 | 0.67 | D678/D480 | 0.22 | 1 | 0.47 |
| e2 | 0.14 | 3 | 0.65 | BStichococcus | 0.07 | 3 | 0.47 |
| Fv/Fm | 0.14 | 3 | 0.65 | D480 | 0.10 | 2 | 0.44 |
| NAnkistrodesmus | 0.14 | 3 | 0.65 | Bобщ | 0.07 | 3 | 0.44 |
| βобщ | 0.11 | 3 | 0.58 | BAnkistrodesmus | 0.06 | 3 | 0.43 |
| D678 | 0.11 | 3 | 0.58 | F0 | 0.18 | 1 | 0.43 |
| e1 | 0.11 | 3 | 0.58 | e3 | 0.08 | 2 | 0.40 |
| zобщ | 0.11 | 3 | 0.58 | Средний объем клетки | 0.08 | 2 | 0.39 |
| NStichicoccus | 0.16 | 2 | 0.57 | Индекс Симпсона | 0.12 | 1 | 0.35 |
| Fm | 0.10 | 3 | 0.55 | ИС | 0.06 | 2 | 0.35 |
| BAnabaena | 0.13 | 2 | 0.51 | D628 | 0.09 | 1 | 0.30 |
| NPleurochloris | 0.13 | 2 | 0.51 |
Индикаторы с наибольшими значениями результирующего показателя (СГ > 0.6) могут рассматриваться как наиболее перспективные для изучения влияния исследуемых солей тяжелых металлов и диурона.
Обращает на себя внимание рекордно высокая сила связи значений индикатора D678/D480 (отношение хлорофилл “а”/каротиноиды) с единственным найденным для него существенным фактором – концентрацией меди. Таким образом, индикатор D678/D480, вероятно, является хорошим сенсором загрязнения медью.
Индикатором с наибольшим значением СГ стал показатель D678/D628, характеризующий отношение содержания хлорофилл/фикобилины. Учитывая, что количество цианобактерий (Anabaena) также значительно изменялось при действии факторов (показатель NAnabaena на третьем месте по величине СГ), изменения в спектральном составе вполне закономерны. Вместе с тем на основании полученных данных можно предположить, что спектральное определение цианобактериального развития является более чувствительным методом диагностики воздействия химических факторов, представленных в настоящей работе, нежели гидробиологическое.
ЗАКЛЮЧЕНИЕ
Существующая проблема нормирования неблагоприятных воздействий на природные водные экосистемы находит решение при помощи различных подходов: биоиндикация, биотестирование, лабораторные эксперименты и др. Каждый из перечисленных подходов может использовать широкий спектр индикационных показателей, большинство из которых можно отнести к гидробиологическим. С появлением биофизических методов измерений все более доступными индикаторами становятся параметры флуоресценции хлорофилла растительных организмов. В большинстве случаев подобные показатели отражают состояние организмов значительно быстрее, точнее и проще, чем гидробиологические, а современная приборная база с высокой степенью вовлеченности компьютерных технологий дает возможность оперативной обработки получаемой информации.
На сегодняшний день гидробиологические показатели качества среды изучены довольно полно, о чем свидетельствует их включение в нормативные акты многих стран (US Clean Water Act, 1972; EU Water Framework Directive, 2000). Проанализированы степень чувствительности тех или иных индикаторов к различным факторам среды и границы применимости индикаторов (Шитиков и др., 2003).
Параметры флуоресценции хлорофилла в качестве биоиндикаторов изучены менее полно, при этом имеющиеся данные подтверждают их высокий биоиндикационный потенциал (Young, Beardall, 2003; Маторин и др., 2013). В данной работе впервые проведено объективное сравнение биофизических и гидробиологических индикаторов. Границы нормы для параметров флуоресценции хлорофилла введены в ряде работ (Маторин и др., 2013), но приведенные границы обоснованы экспертными (т.е. в большой степени субъективными) соображениями. В работе А.П. Левича и соавторов (2013) границы для некоторых параметров флуоресценции рассчитаны и соотнесены с гидробиологическими индикаторами. Однако в указанной работе исследование проводили на основе природных данных, полученных под влиянием большого количества факторов. В настоящей работе был проведен лабораторный эксперимент в строго контролируемых условиях влияния трех факторов в максимально широком диапазоне, при этом большинство биофизических и гидробиологических показателей было вовлечено в анализ впервые.
По биоиндикационному потенциалу ни одна из рассмотренных групп индикаторов не обладает явным преимуществом, однако объективность, точность и быстрота биофизических тестов делает их более предпочтительными.
Рассчитанные в лабораторном эксперименте границы норм не могут быть перенесены на природные объекты. Однако продемонстрированная адекватность работы метода ЛЭН для выбранных индикаторов позволяет сделать вывод о перспективности его применения для оценки состояния водной среды.
Работа выполнена при поддержке Министерства образования и науки России (соглашение № 14.616.21.0080).
Список литературы
Гончаров И.А., Левич А.П., Рисник Д.В., 2012. Программа установления границ качественных классов для количественных характеристик систем и установления взаимосвязи между характеристиками (Программа установления ГКК). Роспатент № 2 012 616 523.
Левич А.П., 1980. Структура экологических сообществ. М.: Изд-во МГУ. 181 с.
Левич А.П., Забурдаева Е.А., Максимов В.Н., Булгаков Н.Г., Мамихин С.В., 2009. Поиск целевых показателей качества для биоиндикаторов экологического состояния и факторов окружающей среды (на примере водных объектов р. Дон) // Водные ресурсы. Т. 36. № 6. С. 730–742.
Левич А.П., Булгаков Н.Г., Максимов В.Н., Рисник Д.В., 2011. “In situ”-технология установления локальных экологических норм // Вопросы экологического нормирования и разработка системы оценки состояния водоемов. М.: Т-во науч. изд. КМК. С. 32–57.
Левич А.П., Булгаков Н.Г., Максимов В.Н., Фурсова П.В., 2012. In situ-методология оценки качества среды обитания: основные положения // Использование и охрана природных ресурсов в России. № 6. С. 35−37.
Левич А.П., Булгаков Н.Г., Рисник Д.В. и др., 2013. Поиск связей между биологическими и физико-химическими характеристиками экосистемы Рыбинского водохранилища. Ч. 3. Расчет границ классов качества вод // Компьютерные исследования и моделирование. Т. 5. № 3. С. 451−471.
Маторин Д.Н., Алексеев А.А., 2013. Флуоресценция хлорофилла для биодиагностики растений. М.: ООО “ПКЦ Альтекс”. 364 с.
Маторин Д.Н., Осипов В.А., Яковлева О. В., Погосян С.И., 2010. Определение состояния растений и водорослей по флуоресценции хлорофилла. М.: Макс-Пресс. 116 с.
Пигулевская Т.К., 1984. Изучение механизма токсического действия цинка на фотосинтетические реакции растений. Дис. … канд. биол. наук. М.: МГУ. 184 с.
Погосян С.И., Гальчук С.В., Казимирко Ю.В., Конюхов И.В., Рубин А.Б., 2009. Применение флуориметра “МЕГА-25” для определения количества фитопланктона и оценки состояния его фотосинтетического аппарата // Вода: химия и экология. № 6. С. 34‒40.
Рисник Д.В., Левич А.П., Фурсова П.В., Гончаров И.А., 2016. Алгоритм метода по расчету границ качественных классов для количественных характеристик систем и по установлению взаимосвязей между характеристиками. Ч. 1. Расчеты для двух качественных классов // Компьютерные исследования и моделирование. Т. 8. № 1. С. 19–36.
Руководство по гидробиологическому мониторингу пресноводных экосистем, 1992 / Под ред. Абакумова В.А. СПб: Гидрометеоиздат. 318 с.
Шитиков В.К., Розенберг Г.С., Зинченко Т.Д., 2003. Количественная гидроэкология: методы системной идентификации. Тольятти: ИЭВБ РАН. 463 с.
Allen M.M., 1968. Simple conditions for growth of unicellular blue-green algae on plates // J. Phycol. V. 4. № 1. P. 1‒4.
Fursova P.V., Voronova E.N., Levich A.P. et al., 2017. Selection of species for the laboratory-reared algal community by their hydrobiological and biophysical features // Moscow Univ. Biol. Sci. Bull. V. 72. № 4. P. 184–189.
Konyukhov I.V., Selina M.S., Morozova T.V., Pogosyan S.I., 2012. Experience of continuous fluorimetric monitoring of phytoplankton at a mooring station // Oceanology. V. 52. № 1. P. 130–140.
MacArthur R.H., 1955. Fluctuations of animal populations, and measure of community stability // Ecology. V. 36. № 7. P. 353–356.
Merzlyak M.N., Naqvi K.R., 2000. On recording the true absorption and scattering spectrum of a turbid sample: application to cell suspensions of the cyanobacterium Anabaena variabilis // J. Photochem. Photobiol. B Biol. V. 58. № 2. P. 123–129.
Motomura I., 1932. Statistical treatment of association // Japan J. Zool. V. 44. P. 379–383.
Schindelin J., Arganda-Carreras I., Frise E. et al., 2012. Fiji: an open-source platform for biological-image analysis // Nature Methods. V. 9. № 7. P. 676‒682.
Simpson E.H., 1949. Measurement of diversity // Nature (London). V. 163. № 4148. P. 668.
The EU Water Framework Directive, 2000. http://ec.europa.eu/environment/water/water-framework/index_en.html.
The US Clean Water Act, 1972. https://en.wikipedia.org/wiki/Clean_Water_Act.
Young E.B., Beardall J., 2003. Transient perturbations in chlorophyll a fluorescence elicited by nitrogen re-supply to nitrogen-stressed microalgae: distinct responses to NO3 – versus ${\text{NH}}_{4}^{ + }$ // J. Phycol. V. 39. P. 332–343.
Дополнительные материалы отсутствуют.
Инструменты
Журнал общей биологии


