Журнал общей биологии, 2019, T. 80, № 4, стр. 260-273
Морфо-функциональные преобразования челюстной мускулатуры в эволюции грызунов
Е. Г. Потапова *
Институт проблем экологии и эволюции им. А.Н. Северцова РАН
119701 Москва, Ленинский просп., 33, Россия
* E-mail: lena-potapova@yandex.ru
Поступила в редакцию 19.02.2019
После доработки 10.03.2019
Принята к публикации 21.04.2019
Аннотация
Обобщены данные, полученные автором в результате многолетних исследований челюстного аппарата современных грызунов. Материал включает оригинальные сведения по 22 семействам отряда Rodentia. На основе представлений о специфике челюстного аппарата грызунов как целостной системы рассмотрены строение челюстной мускулатуры, направления ее преобразований в эволюции отряда, а также функциональный и филогенетический аспекты ее разнообразия в этой группе. Детально изучено строение челюстных мышц. Показано, что при всем их внешнем разнообразии строение их апоневротического каркаса однотипно и может служить надежной основой для идентификации и гомологизации элементов внутренней дифференцировки мышц. Обсуждается морфо-функциональная специализация челюстной мускулатуры. Выделены ее морфотипы, отражающие приспособленность челюстного аппарата к работе в разном режиме: раздавливании и вертикальном разрезании. Особое внимание уделено описанию вариантов специализации в характерном только для грызунов режиме продольного перетирания. Один вариант связан с гипертрофией передних частей массетера при упрощении дифференцировки и пологой ориентации его боковой и медиальной порций, на фоне ослабления височного мускула. Другой вариант, наоборот, связан с усилением внутренней дифференцировки челюстных мышц, благодаря особому преобразованию нижней челюсти: увеличению ее высоты, смещению углового отростка вверх до уровня зубного ряда и значительному подъему сочленовного отростка. Выявлено соответствие типов челюстного аппарата базальным ветвям филогенетического древа Rodentia. Предполагается, что структура типологического разнообразия данной системы сложилась на ранних этапах адаптивной радиации грызунов, а единообразие этих типов внутри филетических линий обусловлено родством входящих в их состав видов. Функциональная специализация челюстного аппарата внутри базальных групп осуществлялась уже в рамках характерного для каждой группы типа его строения. Она происходила в основном за счет изменений нижней челюсти и скуловой дуги и выразилась в сходных спектрах его морфо-функциональных преобразований в разных таксонах грызунов.
Работа основана на результатах многолетних оригинальных исследований автора, посвященных изучению факторов и закономерностей эволюционных преобразований сложных морфо-функциональных систем (Потапова, 1979, 1993, 2014, 2015, 2017; Гамбарян и др., 1980; Павлинов и др., 1990; Россолимо и др., 2001; Pavlinov, Potapova, 2003; Потапова, Воронцов, 2004; Жеребцова, Потапова, 2018), с учетом обширных литературных данных по челюстному аппарату современных грызунов (Tullberg, 1899; Rinker, 1954; Klingener, 1964; Reppening, 1968; Woods, 1972; Woods, Howland, 1979; Kesner, 1980; Offermans, Vree, 1989; Satoh, Iwaku, 2006; Hautier, Saksiri, 2009; Cox, Jeffery, 2011; Cox et al., 2012; Baverstock et al., 2013; Casanovas-Vilar, Dam, 2013; Cox, Baverstock, 2016). Материал включает оригинальные сведения по 22 современным семействам отряда Rodentia. Половина из них на уровне родов изучены в объеме мировой фауны. Цель работы – охарактеризовать строение челюстной мускулатуры, направления ее преобразований в эволюции отряда, а также функциональный и филогенетический аспекты ее разнообразия в этой группе. Анализ челюстной мускулатуры осуществляется на основе представлений о челюстном аппарате как целостной системе, частью которой она является.
ЧЕЛЮСТНОЙ АППАРАТ МЛЕКОПИТАЮЩИХ И ЕГО МОРФО-ФУНКЦИОНАЛЬНЫЕ ТИПЫ
Челюстной аппарат – важнейшее звено в развитии пищевой специализации. Он обеспечивает захват и расчленение пищевого объекта в ротовой полости. У млекопитающих он включает две относительно автономные подсистемы: зубную и костно-мышечную, которые в эволюции таксонов меняются скоординировано. Первая образует комплекс давящих (или режущих) элементов, вторая определяет направление и величину прилагаемых к ним усилий.
У млекопитающих верхняя челюсть неподвижно связана с осевым черепом. Жевание осуществляется только за счет движений нижней челюсти. Их обеспечивают пять парных мышц и одна непарная. Опускает (отводит) челюсть абдуктор – двубрюшный мускул (musculus digastricus). Поднимают (приводят) ее три аддуктора: височный (m. temporalis), жевательный (m. masseter) и внутренний крыловидный (m. pterygoideus internus) мускулы. Из них височный мускул является ретрактором, а массетер и крыловидный мускул – протракторами: при подъеме челюсти первый смещает ее назад, а два других – вперед. Наружный крыловидный мускул (m. pterygoideus externus) действует как протрактор (сдвигает челюсть вперед), но аддуктором не является. Непарный поперечный мускул (m. transversus mandibulae) сводит ветви челюсти и раздвигает резцы.
Млекопитающие используют разные способы жевания, которые можно разделить на два типа, в зависимости от того, по какой траектории движется челюсть при жевании, и под каким углом механические усилия прилагаются к объекту (Никольский, 1997). К первому типу относятся вертикальное раздавливание и разрезание, ко второму – разные варианты перетирания. В первом случае жевание осуществляется при движении челюсти в вертикальной плоскости, а усилия направлены перпендикулярно по отношению к окклюзионной поверхности зубов; при разрезании давление создается в ограниченной зоне кромки зуба, при раздавливании – на всей его поверхности. Во втором случае механические усилия ориентированы косо, а челюсть движется в горизонтальной плоскости. Перетирающие движения могут быть преимущественно круговыми, поперечными или продольными.
Каждому из типов жевания соответствует особый план организации челюстного аппарата (Turnbull, 1970), который характеризуется определенным набором черт (рис. 1). Ярко выраженная специализация в вертикальном разрезании реализована у хищных Carnivora (“carnivore-share”), в поперечном перетирании – у копытных из отрядов Artiodactyla и Perissodactyla (“ungulate-grinding”). У хищных основную роль в сжимании челюстей играет ретрактор (рис. 1а), у копытных – протракторы (рис. 1б). В первом типе (рис. 1в) венечный отросток крупный, сочленовная головка расположена низко; во втором (рис. 1г) венечный отросток небольшой, сочленовная головка высоко поднята, что считается благоприятным при перетирающем типе жевания (Mose, 1968; Greaves, 1980). В обоих типах сустав (сочленовная ямка и головка) ориентирован поперечно (рис. 1з), а зубы расположены впереди массетера (рис. 2а, б).
Рис. 1.
Типы жевания млекопитающих: вертикальное разрезание у хищных (а, в, з), перетирание у жвачных (б, г), грызение у грызунов (д–ж, и). а–ж – вид сбоку; з, и – вид суставной ямки снизу; а, б – по: Turnbull, 1970, c изменениями; в – по: Druzinsky, 2010, с изменениями. fa – сочленовная ямка (fossa articularis); M – жевательный мускул (m. masseter); pc – венечный отросток (processus coronoideus); pg – сочленовный отросток (pr. condiloideus (= glenoideus)); T – височный мускул (m. temporalis); te – зубы.
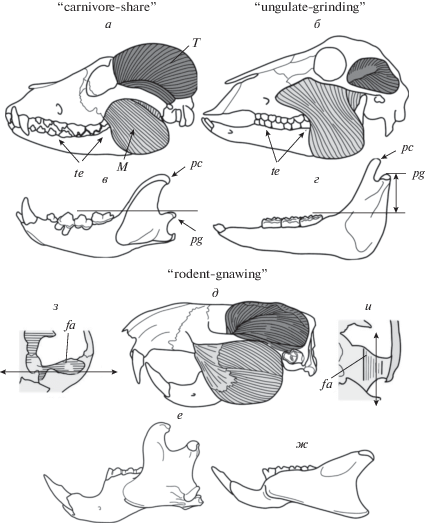
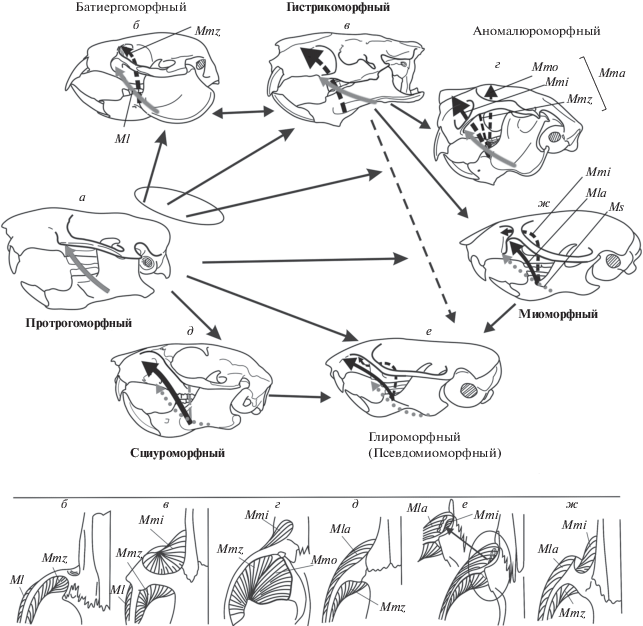
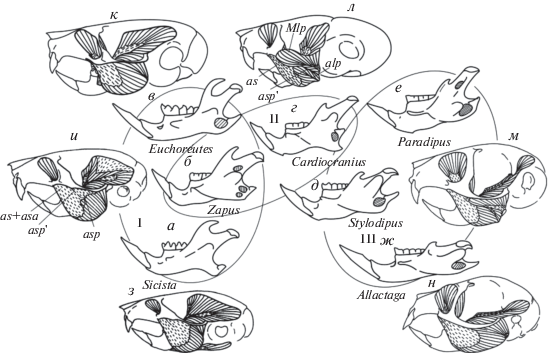
Рис. 2.
Типы зиго-массетерной структуры (а–ж), расширенная схема; названия “классических” типов (а, в, д, ж) выделены полужирным. Типы различаются характером разрастания массетера на корень скуловой дуги (прерывистая линия – медиальный массетер, сплошная линия – латеральный). Стрелки между типами показывают их возможные трансформации. Верхняя часть рисунка – вид сбоку, нижняя – вид сверху. По: Потапова, 2015а, с дополнениями и изменениями. Ml – латеральный массетер (m. masseter lateralis), в котором боковая (Mla) и поверхностная (Ms) порции четко не разделены (типы б–г, серая сплошная стрелка); Mla – передняя часть боковой порции (m. mass. lateralis anterior) (черная сплошная стрелка); Mma – передняя чаcть медиального массетера (m. mass. medialis anterior) и ее головки (черные прерывистые стрелки): Mmi – подглазничная, pars infraorbitalis, Mmo – орбитальная, pars orbitalis, Mmz – скуловая, pars zygomaticus; Ms – поверхностная порция (m. mass. superficialis) (серая точечная стрелка).
Третий тип челюстного аппарата (“rodent-gnawing”) характерен для грызунов Rodentia (рис. 1д). Его становление было обусловлено развитием способности к грызению, которая является ключевой адаптацией данной группы. Для челюстного аппарата этого типа характерны: а) увеличенные долотовидные резцы, утратившие корни и растущие на протяжении всей жизни, б) длинная диастема, в) продольная ориентация сочленовной ямки (рис. 1и), г) перераспределение мышечной массы в пользу протракторов, д) расположение коренных зубов позади переднего края массетера (рис. 1д). Эти морфологические особенности позволяют создавать значительные усилия на резцах, максимально удаленных от оси вращения челюсти. Подъем сочленовной головки и размеры венечного отростка, которые определяют ключевые различия двух других типов, у грызунов варьируют (рис. 1е, ж) и внутри отряда встречаются в обоих сочетаниях.
ТИПОЛОГИЯ ЗИГО-МАССЕТЕРНОЙ СТРУКТУРЫ ГРЫЗУНОВ
Уже на ранних этапах адаптивной радиации грызунов специализация их челюстного аппарата была связана не только с повышением эффективности грызения, но и с усовершенствованием и расширением спектра способов жевания (Wood, 1959, 1965). Наряду с раздавливанием и перемалыванием, у них развивалась способность к особому типу перетирания, основанному на продольных движениях нижней челюсти и связанному с переходом на питание более обильными, хотя и менее калорийными, зелеными кормами. Структурные преобразования происходили во всех звеньях челюстного аппарата. В строении челюстной мускулатуры они выражались в разрастании массетера на передний корень скуловой дуги и в его выходе на боковую поверхность черепа. Такое расширение мускула механически выгодно по сравнению с исходным (протрогоморфным) вариантом его крепления на нижней поверхности скуловой дуги. У современных грызунов оно свойственно всем видам, кроме одного – Aplodontia rufa (Aplodontia, Sciuromorpha) (рис. 1д, 2а).
Все разнообразие вариантов разрастания массетера, которое отражается в структурном разнообразии корня скуловой дуги (= зиго-массетерной конструкции), было сведено к трем продвинутым типам (Brandt, 1855). Единственным критерием для определения типа было положение мускула относительно скулового корня. Если мускул расположен только изнутри корня и выходит на рострум через подглазничное отверстие, его относят к гистрикоморфному типу (рис. 2в), только снаружи – к сциуроморфному (рис. 2д), с обеих сторон одновременно – к миоморфному (рис. 2ж). При таком упрощенном подходе даже существенно разные по строению и по происхождению конструкции могут быть признаны однотипными. Например, своеобразная зиго-массетерная структура у соневых Glirinae формально считалась миоморфной, а у батиергид Bathyergidae – протрогоморфной, и только потому, что массетер у батиергид не выходит на рострум, хотя и мигрирует на скуловой корень изнутри. Впоследствии тип массетера у сонь был признан псевдомиоморфным (Vianey-Liaud, 1989), а у батиергид – первично гистрикоморфным (Maier, Schrenk, 1987).
Расширенная типизация массетера (рис. 2) отражает не только его положение относительно скуловой дуги, но и способ его продвижения наверх (Потапова, 2015а). В ней учтены два варианта миграции мускула снаружи скулового корня и три – изнутри него. При разрастании снаружи корня мускул либо сразу же выходит на рострум, как у белок (рис. 2д, е), либо расширяется по его поверхности (“массетерной” площадке) и на рострум не выходит, как у мышей (рис. 2ж). Варианты миграции массетера изнутри корня различаются местом его крепления на стенке черепа. В одном случае мускул расширяется только по задней стенке скулового корня и остается в пределах глазницы (рис. 2б), как у некоторых батиергид (Cox, Faulkes, 2014); в другом – выходит через подглазничное отверстие на рострум (рис. 2в, ж), как у типичных гистрикоморф; в третьем, помимо прочего, перекидывается через дорсальный край челюсти и крепится еще и на внутренней стенке глазницы (рис. 2г), как у аномалюрид (Потапова, 2017).
Типы зиго-массетерной структуры определяются по сочетанию способов миграции массетера с обеих сторон корня скуловой дуги (Wahlert et al., 1993). При таком подходе кроме четырех классических выделяются три дополнительных типа (рис. 2б, г, е). В глироморфном типе (рис. 2е), в отличие от миоморфного, наличие инфраорбитального пучка сочетается с таким же, как у белок (сциуроморфным), продвижением массетера снаружи корня. Батиергоморфный и аномалюроморфный типы (рис. 2б, г) в принципе можно рассматривать как варианты упрощения и усложнения гистрикоморфного типа соответственно. Однако на схеме (рис. 2) они обозначены как отдельные типы, поскольку каждый из них отражает особый путь миграции массетера и гипотетически может формироваться без стадии гистрикоморфии непосредственно из протрогоморфного типа.
ВНУТРЕННЯЯ ДИФФЕРЕНЦИРОВКА ЧЕЛЮСТНЫХ МЫШЦ И ИХ НОМЕНКЛАТУРА
По сравнению с исходным протрогоморфным типом все продвинутые варианты массетера имеют функциональные преимущества. Но сравнивать их между собой по функциональной значимости вне конкретной группы некорректно. Функциональная специализация мышечной системы определяется направлением и величиной усилий, которые мышцы передают на режущие элементы зуба при сжимании челюстей. Это зависит от взаимоотношения мышц и их внутренней дифференцировки. Характер дифференцировки не связан однозначно с типом миграции массетера. Он в большей степени определяется строением нижней челюсти и положением скуловой дуги. Тип зиго-массетерной структуры влияет на число слоев массетера, но не на их наклон и более тонкие детали дифференцировки. Поэтому в рамках одного типа может быть представлен широкий спектр структурных вариаций, и, наоборот, дифференцировка массетера с разным типом зиго-массетерной структуры бывает сходной (см. рис. 3–6).
Рис. 3.
Дифференцировка челюстных мышц (а–г, к–н) и схема строения их апоневротического каркаса (д–и). а–г – жевательный и височный мускулы, последовательные углубления, вид сбоку. к–н – внутренний крыловидный мускул, вид снизу. д–ж – апоневрозы массетера: срез (д), вид сбоку (е), взаимоотношение конечных апоневрозов его латеральной (ala) и медиальной (ama) порций у Rhombomys (ж). з – апоневрозы внутреннего крыловидного мускула. и – апоневрозы височного мускула. Мускулы и их порции: Dg – m. digastricus, Mla – m. masseter lateralis anterior, Mlpp – m. mass. lateralis posterior pars profundus, Mlps – m. mass. lateralis posterior pars superficialis, Mma – m. mass. medialis anterior, Mmp – m. mass. medialis posterior, Ms – m. mass. superficialis, Pti – m. pterygoideus internus, Ptid – m. pter. internus pars dorsalis, Ptii – m. pter. internus pars intermedius, Ptiv – m. pter. internus pars ventralis, Tc – m. temporalis pars caudalis, To – m. temp. pars orbitalis, Tp – m. temp. profundus, Ts – m. temp. superficialis. Апоневрозы: ado – aponeurosis dorsalis originalis, aio – ap. intermedius originalis, ala – ap. lateralis anterior, alp – ap. lateralis posterior, ama – ap. medialis anterior, apa – ap. profunda anterior, app – ap. profunda posterior, as – ap. superficialis, asa – ap. superficialis anterior, asp – ap. superficialis posterior, asp' – гребень, соединяющий поверхностный и глубокий апоневрозы, at – ap. temporalis, atc– ap. temp. caudalis, ato – ap. temp. orbitalis, ats– ap. temp. superficialis, avo – ap. ventralis originalis, avp – ap. ventralis profunda, avs – ap. ventralis superficialis.
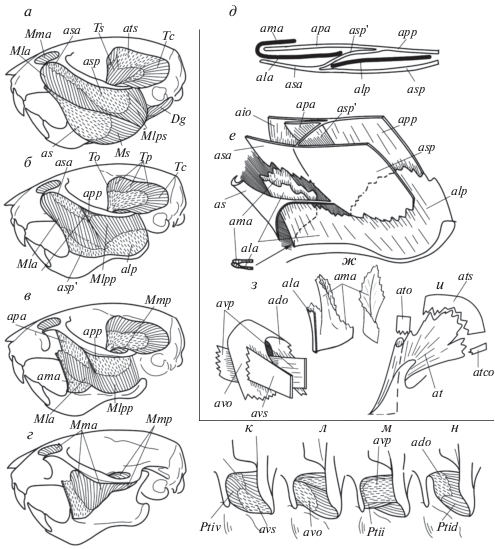
Рис. 4.
Строение челюстной мускулатуры у грызунов со сциуроморфным (а, б, ж–и) и глироморфным (в–е) типами строения массетера. а – Tamias, б – Sciurus, в – Mesocricetus, г – Graphiurus, д – Dryomys, е – Selevinia, ж – Heteromys, з – Perognathus, и – Dipodomys. Обозначения мускулов и апоневрозов как на рис. 3.
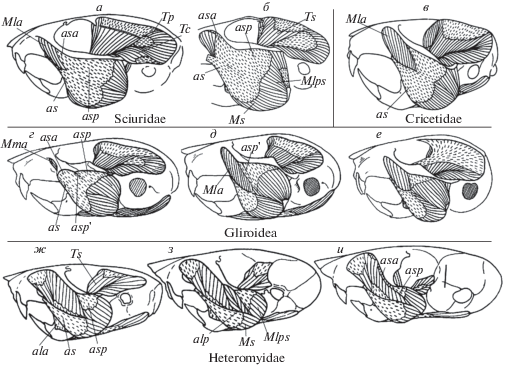
Рис. 5.
Два варианта специализации в перетирании: а, в – “как у Ctenohystrica”, Ctenodactylus (по: Потапова, 2015а); б, г – “как у полевок”, Ondatra (по: Потапова, 2010). Стрелками показано направление сил сокращения передних (Mv) и задних (Mg) частей жевательного, крыловидного (Pt) и височного (T) мускулов.
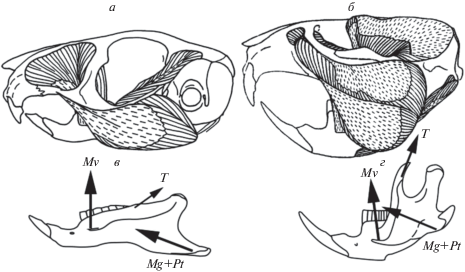
Рис. 6.
Строение нижней челюсти (а–ж) и челюстной мускулатуры (з–н) у Dipodoidea при специализации: I (а, б, в) – в вертикальном раздавливании с элементами перемалывания, II (б, г) – в перетирании круговыми движениями малой амплитуды в сочетании с раздавливанием, III (д, е, ж) – в перетирании преимущественно продольными движениями. Обозначения мускулов и апоневрозов как на рис. 3.
Структурные элементы челюстных мышц, как правило, строго не разделены и постепенно переходят один в другой, что порождает значительную долю субъективизма в их идентификации. Было даже высказано мнение о принципиальной невозможности достоверного сравнения элементов мышцы в разных группах грызунов (Klingener, 1964). При описании мышц применяются разные схемы их дифференцировки, используется разная номенклатура, по-разному определяются границы элементов и т.п. (Druzinsky et al., 2011; Rinker, 1954; Wood, 1965; Woods, 1972; Offermans, Vree, 1989; Hautier, Saksiri, 2009; Druzinsky, 2010; Cox, Jeffery, 2011; Cox, Faulkes, 2014; Потапова, 2015а; Álvarez et al., 2015). Идентификация структурных элементов челюстных мышц становится более легкой, если она основана на анализе строения их сухожильного каркаса. Челюстные мышцы имеют перистую структуру. Основу перистости составляет система плоских сухожилий – апоневрозов. Единицы дифференцировки мышц, которые обозначаются как их порции или части, представляют собой элементы этой структуры: разнонаправленные полуперья или перья (Heinse, 1961), способ объединения и степень обособленности которых различаются у разных групп. Исследование показало, что при всем внешнем разнообразии дифференцировки мышц план строения их апоневротического каркаса однотипный. Это позволяет достаточно надежно гомологизировать элементы структуры мышц даже при существенных внешних различиях в их строении.
Массетер (musculus masseter) идет от скуловой дуги к боковой поверхности нижней челюсти. Наклон его волокон меняется по мере продвижения вглубь мускула и в направлении спереди назад. В базовой схеме дифференциации (Tullberg, 1899; Rinker, 1954) в его составе различают две единицы: латеральный массетер (m. masseter lateralis) и медиальный (m. masseter medialis). Один начинается снаружи скуловой дуги, другой – изнутри нее. Первый, в свою очередь, делится на порции: поверхностную латеральную (m. mass. lateralis superficialis) и глубокую латеральную (m. mass. lateralis profundus). В упрощенной классической схеме (Wood, 1965; Woods, 1972; Павлинов и др., 1990; Hautier, Saksiri, 2009), которая принята и в данной работе (рис. 3), эти три элемента обозначаются как равноценные порции: поверхностная (m. mass. superficialis, Ms), латеральная (m. mass. lateralis, Ml) и медиальная (m. mass. medialis, Mm) – или просто как поверхностный, латеральный и медиальный массетер. В свою очередь, каждый элемент может подразделяться на переднюю и заднюю части. У некоторых грызунов (из Muroidea и Anomaluridae) между латеральным и медиальным массетером выделяется промежуточный слой вертикальных мускульных волокон (m. mass. intermedius) с крупным начальным апоневрозом aio (aponeurosis intermedius originalis), отслоившимся от глубокого апоневроза ap (ap. profunda) (рис. 3e). У большинства грызунов задняя часть латеральной порции крепится на боковой поверхности углового отростка и не заходит выше задней вырезки челюсти. В некоторых группах, например у Histricognathi, она может довольно высоко подниматься вверх по сочленовному отростку и у отдельных видов даже образует отдельный горизонтальный пучок, который идет к основанию сочленовной головки челюсти практически параллельно наружному крыловидному мускулу, но с другой стороны челюсти.
У грызунов с развитым гистрикоморфным массетером медиальная порция, как правило, полностью обособлена от латеральной. В этом случае для описания его строения используется схема, в которой поверхностную и латеральную порции называют поверхностным и глубоким массетером соответственно, а медиальную – зигоматико-мандибулярным мускулом (m. zygomatico-mandibularis) (Cox, Jeffery, 2011; Cox et al., 2012; Ginot et al., 2018). Иногда инфраорбитальную часть последнего рассматривают как максилло-мандибулярный мускул (m. maxillo-mandibularis) (Offerman, Vree, 1989).
Зачастую трудно провести границу не только между структурными элементами массетера, но даже между массетером и височным мускулом. Сзади, в зоне контакта, они имеют одинаковый наклон и разделены корнем скуловой дуги. Если волокна массетера выходят на этот корень сверху или частично оканчиваются на апоневрозе at (ap. temporalis) височного мускула, грань между мускулами становится плохо различимой.
В наиболее полном виде апоневротический каркас массетера состоит из системы перемежающихся друг с другом широких начальных и конечных апоневрозов (рис. 3д, е). Начальные апоневрозы боковой порции: поверхностный as (ap. superficialis) и глубокий ap (ap. profunda) – соединены поперечным гребнем (asp'). Он делит порцию на переднюю и заднюю части: m. mass. lateralis anterior (Mla) с апоневрозами asa (ap. superficialis anterior) и apa (ap. profunda anterior) и m. mass. lat. posterior (Mlp) c апоневрозами asp (ap. superficialis posterior) и app (ap. profunda posterior), соответственно. Положение и размер этого гребня (asp') является существенным элементом дифференцировки латерального массетера. Между начальными апоневрозами as и ap снизу вклинивается конечный апоневроз al (ap. lateralis). Он крепится вдоль нижнего массетерного гребня челюсти и состоит из двух связанных между собой или полностью обособленных частей: ala (ap. lateralis anterior) и alp (ap. lateralis posterior). Он выполняет роль стержня, который собирает мускульные волокна от поверхностных (asа, asp) и глубоких (apa, app) апоневрозов. Впереди апоневроз ala загибается внутрь и переходит в конечный апоневроз медиальной порции ama (ap. medialis anterior), который крепится вдоль верхнего массетерного гребня (рис. 3е, ж). При определенных условиях связь этих апоневрозов (ala и ama) может быть утрачена (рис. 3е). Такой план строения апоневротического скелета прослеживается во всех группах Rodentia с любым типом зиго-массетерной структуры. Размеры апоневрозов и их связь друг с другом могут варьировать, они могут образовывать выросты или расслаиваться, но общий принцип строения этого скелета всегда прослеживается.
Для разных типов массетера можно отметить некоторые устойчивые особенности апоневротического каркаса. В сциуроморфном, глироморфном и миоморфном типах массетера волокна латеральной порции “разрывают” его поверхностный слой на две части (рис. 3, 4). Передняя часть всегда начинается в основании скулового отростка верхнечелюстной кости (maxillare) сухожилием as, переходящим в апоневроз. Именно эта часть считается поверхностной порцией (Ms). Спереди от апоневроза as могут отходить волокна к внутренней стороне челюсти (pars reflexa) или к ее нижнему краю (pars anterior). Задняя часть поверхностного слоя относится к латеральной порции. Она может объединять поверхностные головки ее передней (Mlа) и задней (Mlp) частей (рис. 4а, б), но чаще соответствует последней из них – Mlp (рис. 4е–и). Конечный апоневроз al бывает разделен на две части – ala и alp. Задняя часть (alp) может образовывать перо из коротких мускульных волокон, которое вклинивается между частями бокового массетера (рис. 4з).
В гистрикоморфном, батиергоморфном и аномалюроморфном типах массетера наружный слой выглядит как одно целое. Поверхностная апоневротическая пластинка, покрывающая этот слой, соответствует объединению апоневроза поверхностной порции (as) и начальных апоневрозов только передней (asa) части (рис. 6л, м) или обеих частей (asa, asp) латеральной порции (рис. 4г, 5а, 6з, и). Граница между последними проходит вдоль линии отхождения поперечного гребня asp '. Вырост этого гребня может быть стержнем мускульного пера, разделяющего переднюю и заднюю части бокового массетера (рис. 6л, м). Передняя часть боковой порции в названных типах массетера развита слабо, но, вопреки распространенному мнению об ее отсутствии в этих типах массетера, она всегда может быть идентифицирована. В продвинутом варианте гистрикоморфного массетера конечные апоневрозы латеральной и медиальной порций (ala и ama) полностью разделены, но на начальной стадии формирования этого типа связь между ними может сохраняться. Различия в дифференцировке челюстных мышц в рамках одного типа могут быть более существенными, чем аналогичные различия разных типов.
Височный мускул (m. temporalis) может быть разделен на части лишь условно (рис. 3). Он представлен двухсторонним мускульным пером со стержневым апоневрозом at (рис. 3и), на который снизу собираются волокна от височной ямки и стенки глазницы, а сверху – от поверхностного апоневроза ats (ap. temporalis superficialis). Наружный и глубокий слои мускула называют его поверхностной (или латеральной) (m. temporalis superficialis (lateralis), Ts) и глубокой (или медиальной) (m. temp. profundus (medialis), Tp) частями. Иногда выделяют плохо обособленную орбитальную головку (m. temp. pars orbitalis, To) с начальным апоневрозом ato (ap. temp. orbitalis), идущую от стенки глазницы, и каудальное перо (m. temp. pars caudalis, Tc), образованное наиболее пологими волокнами (рис. 3б).
Внутренний крыловидный мускул (m. pterygoideus internus) начинается в крыловидной ямке и оканчивается на внутренней стороне углового отростка мандибулы. Он имеет сложную внутреннюю структуру, которая в разных таксонах грызунов может существенно различаться. Как правило, в его составе можно выделить две наклонные части: вентральную (m. pter. internus pars ventralis, Ptiv) и дорсальную (m. pter. internus pars dorsalis, Ptid) – которые охватывают более круто ориентированную промежуточную часть (m. pter. internus pars intermedius, Ptii) (рис. 3к–н). Первая начинается на внутренней крыловидной пластинке, вторая – на наружной, а третья – внутри крыловидной ямки. Каждая снабжена одним или несколькими апоневрозами (рис. 3з).
Наружный крыловидный мускул (m. pterygoideus externus) начинается от латеральной крыловидной пластинки и оканчивается в основании сочленовной головки челюсти. Иногда он снабжен конечным или начальным апоневрозами. Перистой структуры не имеет.
Поперечный мускул (m. transversus mandibulae) соединяет ветви челюсти сразу же позади симфиза и состоит из параллельно расположенных волокон.
МОРФО-ФУНКЦИОНАЛЬНАЯ СПЕЦИАЛИЗАЦИЯ ГРЫЗУНОВ В ЖЕВАНИИ
Важным фактором, определяющим морфологическое разнообразие челюстного аппарата грызунов, является пищевая специализация. Среди грызунов есть генерализированные и высокоспециализированные насекомоядные, семеноядные и зеленоядные формы. При обработке корма щечными зубами они используют разные типы жевания: раздавливание, резание, перетирание. Каждому из них соответствуют определенное строение жевательной поверхности коренных (бугорчатое или плоское) и определенный тип организации костно-мышечной системы. Особенности строения нижней челюсти, связанные со специализацией в определенном типе жевания, были проанализированы нами на полевках Arvicolidae, песчанках Gerbillidae, тушканчиках Dipodoidea, сонях Gliroidea (Павлинов и др., 1990; Потапова, 1993, 2000; Потапова, Пузаченко, 2000; Потапова, Россолимо, 2008).
Базовым способом жевания грызунов можно считать раздавливание, которое в разной степени сочетается с перетиранием. Вариабельность конструкции челюстного аппарата при данном способе жевания довольно высока, но в целом ему соответствует бугорчатый тип строения коренных, дифференцированная мускулатура с хорошо развитыми аддукторами (ретрактором и протракторами), умеренно высокий сочленовный отросток и низко расположенный угловой (рис. 6а, б, з, и). Такой вариант строения челюстного аппарата часто встречается у семеноядных грызунов. Специализация в вертикальном раздавливании в максимальной степени выражена у насекомоядных форм (рис. 6в). Некоторые особенности строения их челюстного аппарата сходны с деталями челюстного аппарата хищных (рис. 1а, 6в, к). Для насекомоядных характерны: высокий венечный отросток, зубы с высокими острыми бугорками, преобладание височного мускула и более упрощенная структура массетера, связанная с удлинением мышечных волокон.
Зеленоядные грызуны используют особый способ жевания – продольное перетирание. В отличие от перетирания у жвачных и зайцеобразных, оно основано не на поперечных, а на продольных смещениях нижней челюсти. Этому типу соответствуют гипсодонтные коренные с плоской коронкой и с режущими элементами в виде наклонно или поперечно расположенных эмалевых гребней, характер расположения которых чрезвычайно многообразен и различается в разных таксонах Rodentia. Разрезание происходит в очень узкой зоне контакта гребней на зубах нижней и верхней челюсти.
В строении костно-мышечной системы у грызунов представлено два варианта специализации в перетирании: один наиболее ярко выражен у представителей Ctenohystrica, другой – у полевок Arvicolidae (рис. 5). Первый вариант характеризуется гипертрофией и смещением вперед вертикально ориентированных передних частей массетера на фоне упрощения дифференцировки, удлинения волокон и пологой ориентации его поверхностной и боковой порций (рис. 5а) при слабом развитии височного мускула. В строении нижней челюсти это проявляется в малых размерах венечного отростка, низком положении сочленовной головки и значительном удлинении назад низко расположенного углового отростка. Второй вариант связан с усилением протракторов и усложнением дифференцировки массетера, выраженной в более четком его разделении на горизонтальную и вертикальную составляющие (рис. 5б). Эти преобразования обусловлены специфической перестройкой нижней челюсти: увеличением высоты ее тела, подъемом до уровня зубного ряда углового отростка и значительным смещением вверх сочленовной головки, как у жвачных и зайцеобразных (рис. 5г). При определенных условиях такое смещение считается механически выгодным именно для перетирания (Wolf-Exalto, 1951; Moss, 1968; Kesner, 1980).
Эти два варианта специализации в продольном перетирании представлены практически во всех крупных таксонах грызунов. Они формировались в них параллельно, на базе характерного для каждой группы плана строения черепа. В некоторых таксонах реализованы оба варианта, например у миоморфных песчанок Gerbillidae и у гистрикоморфных Dipodoidea. У песчанок первый вариант, как у Ctenohystrica, реализован у Gerbilliscus; второй, как у полевок, – у Psammomys и Rhombomys. У тушканчикообразных первый вариант свойствен пятипалым тушканчикам Allactaginae (рис. 6ж, н), второй наиболее ярко выражен у Paradipus (рис. 6е).
На рис. 6 показано разнообразие нижней челюсти тушканчикообразных Dipodoidea, которое отражает специализацию их челюстного аппарата в работе в разных режимах. Сходный спектр описан для соневых Gliroidea (Потапова, Россолимо, 2008). Многие варианты из этого спектра встречаются и в других группах грызунов, в частности у песчанок (Павлинов и др., 1990). Параллелизмы в строении челюстного аппарата проявляются не только в его изменчивости как целостной системы, но и в разнообразии отдельных функционально значимых признаков. Кроме того, выявлены параллелизмы, которые напрямую не связаны с развитием трофических адаптаций, а обусловлены преобразованием конструкций, расположенных в непосредственной близости к челюстному аппарату. Например, редукция височного мускула на фоне увеличения передних частей массетера, которая наблюдается у пустынных грызунов, вполне вероятно связана с гипертрофией их слуховых барабанов (Потапова, 1979). Такого рода преобразования отмечены у кенгуровых крыс Heteromyidae (рис. 4ж–и), гундиевых Ctenodactylidae (рис. 5а), тушканчикообразных Dipodoidea (рис. 6), долгоногов Pedetidae, песчанок Gerbillidae, некоторых мышеобразных грызунов (Nesomyidae: Macrotarsomys) и др. Следует отметить, что у представителей сонеобразных, даже при значительном увеличении размеров барабанов (например, у селевинии Selevinia), редукции височного мускула не происходит (рис. 4e). Возможно, это связано с низким расположением барабанов, обусловленным характерным для группы изгибом черепа.
ФИЛОГЕНЕТИЧЕСКИЙ АСПЕКТ
Классическая типология зиго-массетерной структуры, которая первоначально была предложена для структурирования ее морфологического разнообразия, сыграла важную роль в систематике грызунов. Типы ее строения послужили основой для разделения отряда Rodentia на подотряды Sciuromorpha, Myomorpha и Hystricomorpha (Brandt, 1855). Это разделение хорошо укладывалось в рамки типологических схем и сохранялось даже в эволюционных системах отряда (Simpson, 1945), хотя и с существенными оговорками. В филогенетических системах использование данного критерия было признано несостоятельным, поскольку считалось (Wood, 1965), что сходство типа данной конструкции не отражает близкого родства таксонов, так как структуры одноименного типа в разных группах грызунов могли формироваться независимо, и даже в пределах одной группы это могло происходить неоднократно.
Типы зиго-массетерной структуры, выделенные на основе расширенной типизации, лучше, чем классические типы, отражают не только морфологическое разнообразие этой конструкции, но и ее генезис в конкретных группах (Потапова, 2014). Если оценивать морфотипическое разнообразие челюстного аппарата одновременно по двум параметрам: во-первых, по типам строения зиго-массетерной структуры, выделенным по расширенной схеме, и, во-вторых, по типам строения нижней челюсти (гистрикогнатному или сциурогнатному; Tullberg, 1899) – то у современных грызунов оно сводится к семи вариантам (1–7 на рис. 7). Выбранные параметры отражают строение челюстного аппарата как целостной системы. Выделенные варианты представляют собой разные комбинации этих параметров. Применительно к челюстной мускулатуре эти варианты можно рассматривать как интегральный показатель ее структурной организации, поскольку они отражают характер ее крепления не только на осевом черепе, но и на нижней челюсти.
Рис. 7.
Распределение типов челюстного аппарата в кладах грызунов (I–VI) второго базального уровня ветвления (а). Упрощенная схема филогении по: Blanga-Kanfi et al., 2009, с изменениями. Сплошная линия – латеральный массетер, прерывистая – медиальный массетер. Типы челюстного аппарата (1–7) заданы по комбинаторному принципу как сочетание типов зиго-массетерной структуры: A – аномалюроморфный, В – батиергоморфный, G – глироморфный, H – гистрикоморфный, M – миоморфный, S – сциуроморфный (по: Потапова, 2014); и типов нижней челюсти: h – гистрикогнатный, s – сциурогнатный (для Сtenodactyloidea трактовка по: Потапова, 2015а, 2015б).
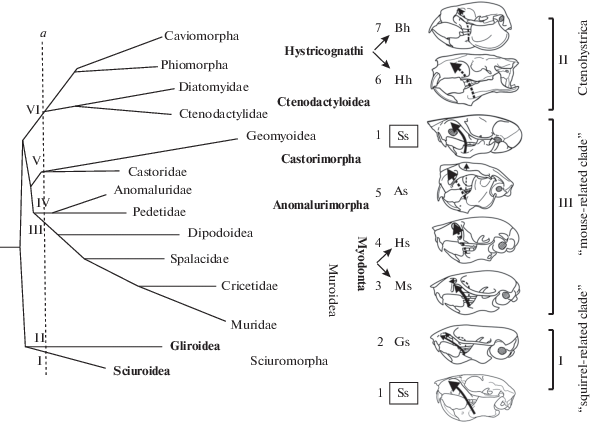
При наложении спектра этих вариантов на филогенетическое древо грызунов, построенное по независимым от рассматриваемых структур основаниям (в нашем случае по молекулярно-генетическим данным), четко прослеживается их соответствие ветвям (I–VI) базального уровня радиации отряда (рис. 7, вертикаль а). Каждый из вариантов, или их пары (7Bh, 6Hh и 3Ms, 4Hs), “привязаны” лишь к одной из этих ветвей. Только один вариант (Ss) связан с двумя независимыми ветвями – беличьими Sciuroidea (I) и бобровообразными Castorimorpha (V), относящимися к разным кладам: “squirrel-related clade” и “mouse-related clade” соответственно.
Выявленное соответствие структуры разнообразия челюстного аппарата грызунов схеме филогении Rodentia позволяет предположить, что заданные типы его строения сложились на ранних этапах адаптивной радиации отряда, а единообразие этих типов внутри филетических линий обусловлено родством входящих в их состав видов. Можно предположить, что начальная стадия развития челюстного аппарата, реализованная у предка группы, предопределяла направление дальнейших преобразований некоторых его элементов у потомков. Например, независимое становление гистрикоморфии в разных ветвях Ctenohystrica можно объяснить особенностями челюстного аппарата их общего предка, у которого преобразование нижней челюсти пошло по гистрикогнатному пути развития, что впоследствии определило развитие гистрикоморфии в разных линиях этой клады.
Дальнейшая функциональная специализация челюстного аппарата внутри базальных групп осуществлялась уже в рамках характерного для каждой группы типа его строения. Она происходила в основном за счет изменений нижней челюсти и скуловой дуги и выразилась в сходных спектрах его морфо-функциональных преобразований в разных таксонах грызунов.
Автор признателен сотрудникам Зоологического музея МГУ (Москва), Зоологического института РАН (Санкт-Петербург), Музея естественной истории (Лондон), Королевского музея Центральной Африки (г. Тервюрен, Бельгия) за возможность пользоваться коллекциями этих музеев. Автор благодарен коллегам из разных интитутов Российской Академии Наук и Московского университета за плодотворное сотрудничество при выполнении данного исследования.
Работа проводилась по теме госзадания лаборатории экологии, физиологии и функциональной морфологии высших позвоночных ИПЭЭ РАН в рамках проекта ФАНО № 0120-1356-032.
Список литературы
Гамбарян П.П., Потапова Е.Г., Фокин И.М., 1980. Морфофункциональные особенности мышечного аппарата головы тушканчиков (к обоснованию естественной системы Dipodoidea, Rodentia, Mammalia) // Функциональная морфология млекопитающих (грызуны, водные млекопитающие). Тр. Зоол. ин-та АН СССР. Т. 91. С. 3–51.
Жеребцова О.В., Потапова Е.Г., 2018. Пути и уровень морфологических адаптаций у современных Diatomyidae и Ctenodactylidae (Rodentia) // Зоол. журн. Т. 97. № 8. С. 977–997.
Никольский В.С., 1997. Общие принципы биомеханики челюстного аппарата млекопитающих // Зоол. журн. Т. 76. № 1. С. 94–103.
Павлинов И.Я., Дубровский Ю.А., Россолимо О.Л., Потапова Е.Г., 1990. Песчанки мировой фауны. М.: Наука. 368 с.
Потапова Е.Г., 1979. Параллелизм в развитии челюстной мускулатуры на примере тушканчиковидных грызунов // Эволюционные исследования (параллелизм и дивергенция). Тр. БПИ ДВНЦ. Нов. серия. Т. 52(155). С. 73–90.
Потапова Е.Г., 1993. Череп и челюстной аппарат // Ондатра. Морфология, систематика, экология. М.: Наука. С. 96–112.
Потапова Е.Г., 2000. Пути преобразования нижней челюсти тушканчикообразных (Rodentia, Dipodoidea) и роль разных адаптаций в становлении ее специфики // Зоол. журн. Т. 79. № 12. С. 1445–1456.
Потапова Е.Г., 2014. Зиго-массетерная конструкция у грызунов (типологический, адаптивный и классификационный аспекты) // Зоол. журн. Т. 93. № 7. С. 841–856.
Потапова Е.Г., 2015а. Специфика и пути эволюционных преобразований челюстной мускулатуры у Laonastes aenigmamus и Ctenodactylus gundi (Ctenodactyloidea, Rodentia) // Тр. Зоол. ин-та РАН. Т. 319. № 3. С. 401–417.
Потапова Е.Г., 2015б. Структурный и филогенетический аспект типологизации нижней челюсти грызунов // Современные проблемы палеонтологии. Мат-лы 59 сессии Палеонтол. об-ва РАН. СПб. С. 166–167.
Потапова Е.Г., 2017. Специфика и направления морфофункциональной специализации челюстного аппарата Anomaluridae (Rodentia, Mammalia) // Эволюционная и функциональная морфология позвоночных. Материалы Всерос. конф. и школы для молодых ученых памяти Ф.Я. Дзержинского. М.: Т-во науч. изд. КМК. С. 240–246.
Потапова Е.Г., Воронцов Н.Н., 2004. Таксономическое положение рода Tachyoryctes и взаимоотношения семейств ризомисовых Rhyzomyidae и слепышовых Spalacidae (Rodentia: Mammalia) // Зоол. журн. Т. 83. № 8. С. 1044–1058.
Потапова Е.Г., Пузаченко А.Ю., 2000. Анализ сходства в строении нижней челюсти тушканчикообразных (Rodentia, Dipodoidea) // Зоол. журн. Т. 79. № 9. С. 1102–1113.
Потапова Е.Г., Россолимо О.Л., 2008. Морфологическое разнообразие нижней челюсти сонеобразных Gliroidea (Rodentia) – адаптивный и филогенетический аспект // Зоологические исследования. Сб. Тр. Зоол. муз. МГУ. Т. 49. М.: Изд-во МГУ. С. 390–412.
Россолимо О.Л., Потапова Е.Г., Павлинов И.Я., Крускоп С.В., Волцит О.В., 2001. Сони (Myoxidae) мировой фауны. М.: Изд-во МГУ. 229 с.
Álvarez A., Vieytes E.C., Becerra F., Olivares A.I., Echeverría A.I. et al., 2015. Diversity of craniomandibular morphology in caviomorph rodents: An overview of macroevolutionary and functional patterns // Biology of Caviomorph Rodents: Diversity and Evolution / Eds Vassallo A.I., Antenucci D. SAREM. Series A – Mammalogical Research. V. 1. P. 199 – 228.
Baverstock H., Jeffery N.S., Cobb S.N., 2013. The morphology of the mouse masticatory musculature // J. Anat. V. 223. P. 46–60.
Blanga-Kanfi S., Miranda H., Penn O., Pupko T., DeBry R.W., Huchon D., 2009. Rodent phylogeny revised: Analysis of six nuclear genes from all major rodent clades // BMC Evol. Biol. V. 9. P. 71.
Brandt J.F., 1855. Beiträge sur näherch Kentniss der Säugetiere Rűsslands // Mem. Acad. Imp. Sci. St.-Petersbourg. Bd. 9. H. 6. S. 336.
Casanovas-Vilar I., Dam J., van, 2013. Conservatism and adaptability during squirrel radiation: What is mandible shape telling us? // PLoS One. V. 8. № 4. P. e61298. https://doi.org/10.1371/journal.pone.0061298
Cox P.G., Baverstock H., 2016. Masticatory muscle anatomy and feeding efficiency of the American beaver, Castor canadensis (Rodentia, Castoridae) // J. Mamm. Evol. V. 23. № 2. P. 191–200.
Cox P.G., Faulkes C.G., 2014. Digital dissection of the masticatory muscles of the naked mole-rat, Heterocephalus glaber (Mammalia, Rodentia) // PeerJ. V. 2. P. e448. https://doi.org/10.7717/peerj.448
Cox P.G., Jeffery N., 2011. Reviewing the morphology of the jaw-closing musculature in squirrels, rats, and guinea pigs with contrast-enhanced microCT // Anat. Rec. V. 294. № 6. P. 915–928.
Cox P.G., Rayfield E.J., Fagan M.J., Herrel A., Pataky T.C., Jeffery N.S., 2012. Functional evolution of the feeding system in rodents // PLoS One. V. 7. № 4. P. e36299. https://doi.org/10.1371/journal.pone.0036299
Druzinsky R.E., 2010. Functional anatomy of incisor biting in Aplodontia rufa and sciuromorph rodents – part 1: Masticatory muscles, skull shape and digging // Cells Tissues Organs. V. 191. № 6. P. 510–522.
Druzinsky R.E., Doherty A.H., Vree F.L., de, 2011. Mammalian masticatory muscles: Homology, nomenclature, and diversification // Integr. Comp. Biol. V. 51. № 2. P. 224–234.
Ginot S., Herrel A., Claude J., Hautier L., 2018. Skull size and biomechanics are good estimators of in vivo bite force in murid rodents // Anat. Rec. V. 301. № 2. P. 256–266.
Greaves W.S., 1980. The mammalian jaw mechanism – the high glenoid cavity // Am. Nat. V. 116. № 3. P. 432–440.
Hautier L., Saksiri S., 2009. Masticatory muscle architecture in the Laotian rock rat Laonastes aenigmamus (Mammalia, Rodentia): New insights into the evolution of hystricognathy // J. Anat. V. 215. № 4. P. 401–410.
Heinse W., 1961. Die Kaumusculatur des Scweines in anatomischer und funktioneller Hinsicht // Anat. Ans. Bd. 109. № 3. S. 269–291.
Kesner M.H., 1980. Functional morphology of the masticatory musculature of the rodent subfamily Microtinae // J. Morphol. V. 165. № 2. P. 205–222.
Klingener D.J., 1964. The comparative myology of four dipodoid rodents (genus Zapus, Napaeozapus, Sicista and Jaculus) // Misc. Publ. Mus. Zool. Univ. Michigan Press. V. 124. P. 1–100.
Maier W., Schrenk F., 1987. The hystricomorphy of the Bathyergidae, as determined from ontogenetic evidence // Ziet. Säugetierk. Bd. 52. № 3. S. 256–264.
Moss M.L., 1968. Functional cranial analysis of mammalian mandibular ramal morphology // Acta Anat. V. 71. № 3. P. 423–447.
Offermans M., Vree F., de, 1989. Morphology of the masticatory apparatus in the springhare, Pedetes capensis // J. Mammal. V. 70. № 4. P. 701–711.
Pavlinov I.Ya., Potapova E.G., 2003. Cladistic analysis of the dormice genus Graphiurus Smuts, 1832 (Rodentia, Gliridae) with comments on evolution of its zygomasseteric construction and subgeneric taxonomy // Rus. J. Theriol. V. 2. № 1. P. 49–58.
Reppening Ch.A., 1968. Musculature and origin of the subfamily Arvicolinae (Rodentia) // Acta Zool. Cracoviensia. V. 13. № 3. P. 29–72.
Rinker G.C., 1954. The comparative myology of the mammalian genera Sigmodon, Oryzomys, Neotoma, and Peromyscus (Cricetinae), with remarks of their intergeneric relationships // Misc. Publ. Mus. Zool. Univ. Mich. Press. V. 83. 124 p.
Satoh K., Iwaku F., 2006. Jaw muscle functional anatomy in northern grasshopper mouse, Onychomys leucogaster, a carnivorous murid // J. Morphol. V. 267. № 8. P. 987–999.
Simpson G.G., 1945. The principles of classification and a classification of mammals // Bull. Amer. Mus. Nat. Hist. V. 85. 350 p.
Tullberg T., 1899. Über das System der Nagethiere: eine phylogenetische Studie // Nova Acta Reg. Soc. Sci. Upsala Ser. 3. Bd. 18. Uppsala: Akadem. Buchdruckerei. 514 S.
Turnbull W.D., 1970. Mammalian masticatory apparatus // Fieldiana. Geol. V. 18. № 2. P. 149–356.
Vianey-Liaud M., 1989. Parallelism among Gliridae (Rodentia): The genus Gliravus Stehlin and Schaub // Hist. Biol. V. 2. № 3. P. 213–226.
Wahlert J.H., Sawitzke Sh.L., Holden M.E., 1993. Cranial anatomy and relationships of dormice (Rodentia, Myoxidae) // Am. Mus. Novit. № 3061. P. 1–32.
Wolf-Exalto E.A., 1951. On differences in the lower jaw of animalivorous and herbivorous mammals // Proc. Kon. Ned. Arad. Wet. Ser. C. V. 54. № 2. P. 1–52.
Wood A.E., 1959. Eocene radiation of the rodents // Evolution. V. 13. P. 354–361.
Wood A.E., 1965. Grades and clades among rodents // Evolution. V. 19. P. 115–130.
Woods C.A., 1972. Comparative myology of jaw, hyoid and pectoral appendicular regions of New and Old World hystricomorph rodents // Bull. Amer. Mus. Nat. Hist. V. 147. P. 115–198.
Woods C.A., Howland E.B., 1979. Adaptive radiation of capromyid rodents: Anatomy of the masticatory apparatus // J. Mammal. V. 60. № 1. P. 95–116.
Дополнительные материалы отсутствуют.
Инструменты
Журнал общей биологии


