Журнал общей биологии, 2019, T. 80, № 5, стр. 323-333
Эволюция утиных (Aves: Anatidae s. L.) Евразии в кайнозое
Н. В. Зеленков *
Палеонтологический институт им. А.А. Борисяка РАН
117647 Москва, ул. Профсоюзная, 123, Россия
* E-mail: nzelen@paleo.ru
Поступила в редакцию 20.07.2018
После доработки 27.02.2019
Принята к публикации 23.04.2019
Аннотация
Приведен анализ палеонтологической летописи утиных (Anatidae s. l.; включая Romainvilliinae и Dendrocygninae) Евразии в Кайнозое (поздний эоцен–неоген). Происхождение Anatidae s. l. может быть связано с появлением обширных мелководий в азиатской части Евразии в позднем эоцене (~41–34 млн лет назад) в результате глобального падения уровня моря и обмеления эпиконтинентальных морских бассейнов. В кайнозойской эволюции фаунистических сообществ утиных Евразии удается выделить четыре крупных этапа, преемственность между которыми на современном уровне знаний практически не удается проследить. Отдельные современные роды утиных (например, Tadorna) впервые появляются на границе раннего и среднего миоцена (17–15 млн лет назад), но фауны утиных современного экологического облика получают широкое распространение в умеренных широтах Евразии только во второй половине позднего миоцена (9–6 млн лет назад). Подробности смены фаунистических комплексов и детали становления современных фаун (на уровне видов) остаются неизученными.
Утиные (сем. Anatidae s. l. отряда Anseriformes) – довольно разнообразная группа птиц, включающая около 160 современных видов (Dickinson, Remsen, 2013; Hoyo, Collar, 2014). В широкой таксономической трактовке семейство включает современных Dendrocygninae и ряд ископаемых подсемейств, таких как Romainvilliinae, которые иногда выделяют в отдельные семейства (см. ниже). Утиные населяют практически всю планету за исключением Антарктиды (один вид, Anas georgica, живет на субантарктическом архипелаге Южная Георгия) и, таким образом, могут считаться одним из наиболее характерных компонентов современных экосистем (главным образом водных и околоводных). Богатая палеонтологическая летопись утиных современного морфологического типа (начиная с олигоцена; Mayr, 2017) позволяет считать их типичной группой позвоночных позднего кайнозоя, наряду с гоминидами, лошадями и оленями из млекопитающих. По этой причине понимание эволюции этой группы птиц имеет несомненное общебиологическое значение. Но, несмотря на богатую палеонтологическую летопись (одну из богатейших среди птиц), эволюционная история утиных остается плохо изученной, что отчасти объясняется отсутствием консенсуса по филогении современных представителей семейства и недостаточно разработанными представлениями о родственных связях ископаемых форм (Поповкина, Поярков, 2002; Mayr, 2017). Тем не менее в последнее десятилетие был сделан колоссальный прорыв как в молекулярной филогенетике утиных, так и в понимании филогенетического положения ключевых ископаемых форм. Было описано или ревизовано множество вымерших таксонов, в том числе с территории Евразии. Настоящая статья представляет собой попытку анализа имеющихся данных с целью реконструировать в общих чертах картину эволюции утиных Евразии в кайнозое и историю становления современных фаунистических сообществ.
ПРОИСХОЖДЕНИЕ И ПРИЧИНЫ ЭВОЛЮЦИОННОГО УСПЕХА УТИНЫХ
Утиные – единственная таксономически разнообразная группа среди современных Anseriformes. Недавно было предложено выделить филогенетически базальных свистящих уток в отдельное сем. Dendrocygnidae (Sun et al., 2017), но даже с учетом исключенных восьми видов р. Dendrocygna разнообразие утиных поразительно контрастирует с низким разнообразием остальных семейств гусеобразных, включающих или только один (Anseranatidae), или три вида (Anhimidae). Подобный эволюционный успех утиных до настоящего времени не находил объяснения (Mayr, 2008). Иногда предполагается (Olson, Feduccia, 1980), что ключевой адаптацией гусеобразных, определивших их диверсификацию, может быть способность к фильтрационному питанию, однако это не объясняет успех утиных по сравнению с полулапчатым гусем Anseranas semipalmata, для которого характерен челюстной аппарат, в целом также устроенный по типу утиного (Дзержинский, Гринцевичене, 2002).
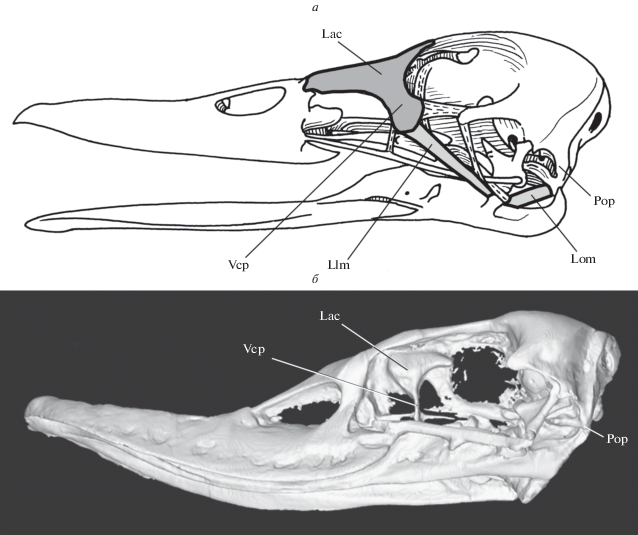
Способность к фильтрационному питанию обычно предполагается уже для древнейших мел-эоценовых гусеобразных Presbyornithidae и Anatalavis oxfordi (Zelenkov, Stidham, 2018). Однако мы попытались показать в недавней работе (Zelenkov, Stidham, 2018), что Presbyornithidae были способны фильтровать только довольно крупные объекты и, в отличие от многих современных утиных22, не обладали костно-связочным аппаратом (Дзержинский, 1982, 1993), обеспечивающим эффективную высокочастотную фильтрацию (Zweers et al., 1977) мельчайших пищевых объектов (рис. 1). Благодаря расширенному клюву с пластинками-ламеллами (зачастую называемых цедильным аппаратом, но см. Zelenkov, Stidham, 2018) пресбиорнитиды могли захватывать относительно крупные плавающие объекты и затем фильтровать их, подобно тому как современные полулапчатые гуси A. semipalmata фильтруют зерна риса (Frith, Davies, 1961). Крючок на кончике клюва, по всей видимости, использовался для извлечения пищевых объектов из субстрата – скорее всего, бентосных ракообразных (Ericson, 2000). Такой же крючок имеет A. semipalmata и использует его для вырывания клубней растений (Frith, Davies, 1961).
Рис. 1.
Сравнение профилей черепов кряквы Anas platyrhynchos (а) и вымершего Presbyornis sp. (б; с разрешения Л. Уитмера). На примере кряквы показаны основные элементы связочного аппарата, необходимого для высокочастотной фильтрации (по: Zelenkov, Stidham, 2018, с изменениями). Обозначения: Lac – слезная кость; Llm – слезно-нижнечелюстная связка; Lom – затылочно-нижнечелюстная связка; Pop – параокципитальные отростки; Vcp – вентрокаудальный отросток слезной кости.
Древнейшие известные Anatidae s. l. – позднеэоценовые Romainvillia (Mayr, 2009, 2017; Зеленков, 2018). Romainvillia сохраняют в своем скелете черты, присущие пресбиорнитидам, и по этой причине рассматриваются как переходное звено между ними и современными утиными (Mayr, 2008). Это позволяет считать пресбиорнитид вероятными предками Anatidae s. l. или, что более вероятно, предками всех Anatoidea (Anseranatidae + + Anatidae s. l.), поскольку в современных филогенетических анализах пресбиорнитиды фигурируют в качестве сестринской группы ко всем Anatoidea (Agnolin et al., 2017; Worthy et al., 2017). Если верно последнее (Presbyornithidae – предки Anatoidea), то Anseranatidae можно рассматривать как довольно рано отклонившуюся от общего ствола Anatidae и, возможно, морфологически аберрантную ветвь. Недавний новый филогенетический анализ гусеобразных показал базальное положение Presbyornithidae по отношению ко всем современным гусеобразным (Tambussi et al., 2019). Таким образом, аберрантная морфология Anhimidae также может быть вторичной для гусеобразных. В связи с этим интересно недавнее открытие новой крупной (размером с лебедя) палеоценовой птицы с территории Монголии, для которой характерна смесь признаков Anhimidae и других гусеобразных (Zelenkov, 2019).
Пресбиорнитиды имели широкое распространение и в палеоцене–раннем эоцене населяли, в том числе, и Центральную Азию, где существовали поливидовые группировки этих птиц (Kurochkin, Dyke, 2010). Похожие на пресбиорнитид утиные Romainvillia до недавнего времени были известны только из Франции (Mayr, 2008), но теперь также найдены (рис. 2) в позднем эоцене на территории Восточного Казахстана (Romainvillia kazakhstanensis; Зеленков, 2018; Stidham, Ni, 2014). Факт существования Romainvilliinae в позднем эоцене Центральной Азии позволил выдвинуть гипотезу (Зеленков, 2018) о том, что Anatidae s. l. могли произойти именно на территории Азии от пресбиорнитид или, более вероятно, от их позднеэоценовых потомков. Ранее Олсон (Olson, 1988), напротив, предполагал, что утиные должны были возникнуть на южных континентах, поскольку именно там сейчас представлено все разнообразие архаичных и аберрантных форм в этой группе птиц (см. ниже).
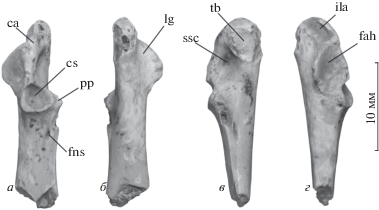
Рис. 2.
Древнейшая утка в Азии – Romainvillia kazakhstanensis (Zelenkov, 2018) из позднего эоцена Казахстана; левый коракоид с дорсальной (а), вентральной (б), медиальной (в) и латеральной (г) сторон (по: Зеленков, 2018). Обозначения: ca – crista acrocoracoidei; cs – cotyla scapularis; fah – facies articularis humeralis; fns – foramen n. supracoracoidei; pp – processus procoracoideus; ila – impressio lig. acrocoracohumeralis; lg – labrum glenoidale; ssc – углубление в дорсальной части sulcus m. supracoracoidei; tb – tuberculum brachiale.
Становление Anatidae s. l. могло быть связано (Зеленков, 2018) с глобальным падением уровня моря в позднем эоцене (Miller et al., 2005), что привело к обмелению эпиконтинентальных морских бассейнов в азиатской части Евразии и появлению обширных мелководий. Большая площадь мелководий, в частности, была характерна для Ферганского залива (Фергано-Таджикского бассейна) эоценового Туранского моря (Невесская, 1999), доходившего в середине эоцена до Таримской впадины на западе Китая (Попов и др., 2009). В позднем эоцене отмечается несколько эпизодов регрессии Ферганского залива (Попов и др., 2009; Bosboom et al., 2017), причем в приабонский век (~38–34 млн лет назад) также отмечается резкое падение температур донных вод, что классифицируется как быстротечное катастрофическое климатическое событие (Изменение климата…, 1999). Появляющиеся в палеонтологический летописи именно в конце эоцена Romainvillia могут представлять собой потомков Presbyornithidae, освоивших питание мелкими объектами на временных или постоянных мелководьях (Зеленков, 2018), где при обедненном таксономическом составе водных организмов имели место вспышки численности отдельных форм (Невесская, 1999; Попов и др., 2009).
Высказанная гипотеза происхождения утиных предполагает, что Romainvillia, в отличие от пресбиорнитид, были способны фильтровать мелкие пищевые объекты так же, как современные утиные (хотя, возможно, менее эффективно). В связи с этим стоит отметить, что, как и у современных утиных, у Romainvillia были укороченные задние конечности: известен, по крайней мере, короткий тарсометатарсус (Mayr, 2008). У Presbyornithidae, напротив, были удлиненные задние конечности ходульного типа, как у современных бродильщиков куликов. Мы предполагаем, что укорочение задних конечностей у уток может быть связано именно с освоением эффективной фильтрации мелких объектов (Zelenkov, Stidham, 2018). Пресбиорнитиды могли использовать свои удлиненные ноги для добычи корма, связанного с субстратом: в этом случае чем длиннее ноги, тем больший диапазон глубин доступен птице. При освоении фильтрационного питания очень мелкими пищевыми объектами птица может перейти к потреблению планктона или плейстона; она более не зависит от субстрата, а способность к плаванию позволяет эксплуатировать практически безграничные площади водной поверхности. Подобный сценарий, объясняющий происхождение утиных, является примером того, как драйвером макроэволюционных преобразований посткраниальной анатомии (в данном случае эволюционное развитие плавательных адаптаций) является преобразование челюстного аппарата (Зеленков, 2015а).
СТАНОВЛЕНИЕ КРОНОВОЙ ГРУППЫ ANATIDAE (ОЛИГОЦЕН–РАННИЙ МИОЦЕН)
Все молекулярно-филогенетические исследования подтверждают базальное положение свистящих уток Dendrocygna на филогенетическом дереве Anatidae s. l. (Gonzalez et al., 2009; Prum et al., 2015; Sun et al., 2017), однако оценки времени дивергенции Dendrocygna относительно остальных утиных разнятся в зависимости от анализа и выбора калибровочных точек: от эоцена–середины олигоцена (Sun et al., 2017) до позднего олигоцена (Prum et al., 2015). Время базальной дивергенции внутри Anatidae представляет собой минимальную оценку древности кроновой группы Anatidae s. l., при этом оценка в примерно 24 млн лет (поздний олигоцен; Prum et al., 2015) представляется довольно правдоподобной.
Олигоценовая палеонтологическая летопись утиных подтверждает возможное происхождение кроновых Anatidae s. l. именно в эту эпоху. Среди утиных первой половины олигоцена (~34–28 млн лет назад) удается надежно определить только мелких (размером с чирка) представителей Romainvilliinae (Mayr, 2009, 2017). Кроме того, из раннего олигоцена Бельгии описан крупный (размером с лебедя) Cygnopterus affinis, родственные связи которого остаются неясными (Louchart et al., 2005; Mayr, 2009; Mayr, Smith, 2017). В любом случае, необычная морфология этой птицы позволяет предполагать, что она, так же как и Romainvilliinae, не относится к кроновой группе Anatidae. В позднем олигоцене Европы стволовые утиные продолжают существовать и представлены, в частности, крупными (размером с гуся) представителями Romainvilliinae (Mayr, De Pietri, 2013). Однако во второй половине позднего олигоцена (~26–24 млн лет назад) в палеонтологической летописи также появляются представители кроновой группы утиных: в Австралии это стволовые представители савковых Oxyurinae (р. Pinpanetta с тремя описанными видами) и предполагаемая древнейшая пеганковая птица Australotadorna (Worthy, 2009). В терминальном олигоцене Франции (около 24 млн лет назад) появляются не-нырковые утки Mionetta (Mourer-Chauviré et al., 2004), которые по результатам филогенетического анализа также сближаются с Oxyurinae (Worthy, Lee, 2008; Worthy, 2009), но морфологически заметно отличаются от более продвинутых представителей этой клады (Зеленков, Курочкин, 2015). Представления о систематическом положении этих форм (в частности, Austra-lotadorna и Mionetta) могут измениться, однако их принадлежность к кроновой группе Anatidae выглядит несомненной.
Появление древнейших представителей кроновой группы Anatidae в Австралии не противоречит гипотезе Олсона (Olson, 1989) о происхождении утиных на южных материках в том случае, если речь идет об утиных современного морфологического типа (Anatidae s. s.). Из позднего олигоцена Южной Америки также описаны р. Teleornis и р. Aminornis, схожие с Tadorninae (Agnolin, 2004). Однако следует отметить, что разнообразие утиных второй половины палеогена (конец эоцена и олигоцен) Азии в целом остается практически не изученным. Помимо вышеупомянутой Romainvillia kazakhstanensis из позднего эоцена Казахстана, известно еще несколько фрагментарных находок, однако их систематическое положение остается неясным (Mayr, 2009; Зеленков, Курочкин, 2015). Крупный “Cygnavus” formosus описан из аксыирской свиты (ныне относящейся к верхнему эоцену) местонахождения “Жонгиз-Шоки” (неизвестному по другим источникам) в Зайсанской котловине Казахстана (Курочкин, 1968). Somateria sp. из раннего олигоцена Казахстана (Курочкин, 1968) описан по фрагменту локтевой кости, обладающему очень слабой диагностической ценностью у утиных; едва ли эта форма относится к современной кладе нырковых уток Mergini (contra Зеленков, Курочкин, 2015), но она также не может относиться к другим описанным из этих отложений Курочкиным таксонам (contra Mayr, 2009), поскольку сильно отличается по размерам. Крупные гусеобразные, отнесенные к Romainvilliinae, также описаны по крайне фрагментарным остаткам из позднего эоцена Западного Китая (Stidham, Ni, 2014).
Представители р. Mionetta хорошо представлены в серии олигоцен–раннемиоценовых местонахождений Сан-Жеран-ле-Пюи на юге Франции, откуда описано три различающихся по размерам вида (Cheneval, 1987; Mlíkovský, 2002; Зеленков, 2012а). Эти утки известны по многим тысячам экземпляров, в том числе черепам и фрагментарным скелетам, по которым не удается выявить какую-либо экологическую специализацию для этого таксона. Понятно только, что это не были специализированные ныряльщики; скорее всего, они кормились на поверхности (Worthy, Lee, 2008). В раннем миоцене Mionetta, по всей видимости, широко расселились за пределы Европы: они указаны из Намибии (Mourer-Chauviré, 2008), близкий р. Dendrochen обитал в Северной Америке (Livezey, Martin, 1988). В Азии эта группа представлена раннемиоценовой уткой “Anas” oligocaena из Приаралья (Тугаринов, 1940; Mlíkovský, Švec, 1986), которая может оказаться младшим синонимом европейского вида A. consorbina (наши данные; contra Зеленков, Курочкин, 2015). Крупные утиные позднего олигоцена–раннего миоцена Евразии представлены двумя возможно близкородственными формами, описанными из Сан-Жеран-ле-Пюи: Cygnopterus alphonsi и Paranyroca sp. (Cheneval, 1984; Mayr, Smith, 2017). Строение тарсометатарсуса обоих таксонов не позволяет относить этих птиц к кроновой группе Anatidae (Mayr, Smith, 2017). Р. Paranyroca был первоначально описан из Северной Америки (Miller, Compton, 1939); его находка в Европе подтверждает сходство фаун утиных Северной Америки и Европы в раннем миоцене (Mayr, Smith, 2017).
УТИНЫЕ МИОЦЕНОВОГО КЛИМАТИЧЕСКОГО ОПТИМУМА (РАННИЙ–СРЕДНИЙ МИОЦЕН)
Подробности эволюции фаун птиц в целом и утиных в частности в течение раннего миоцена остаются очень слабо изученными. Из отложений, близких к границе раннего и среднего миоцена (~16 млн лет) Южной Германии (местонахождение Зандельцхаузен), известен представитель р. Mionetta, морфологически отличающийся от видов из Сан-Жеран-ле-Пюи (Göhlich, 2002). Морфологическая эволюция утиных Западной Европы в это время может быть связана с глобальными климатическими изменениями: исторический интервал с 17 по 14 млн лет назад известен как миоценовый климатический оптимум неогена, характеризовавшийся наивысшими абсолютными температурами на Земле за последние 20 млн лет (Hilgen et al., 2012). Этому времени в Евразии соответствуют две репрезентативные фауны птиц, содержащие остатки утиных: хорошо изученный комплекс из местонахождения Сансан в Южной Франции (средний миоцен, ~ 14 млн лет назад) и только начинающее изучаться несколько более древнее сообщество из местонахождения Тагай на Байкале (конец раннего миоцена или начало среднего миоцена, ~17–15 млн лет назад). Примечательно, что фауна птиц Тагайского местонахождения обитала в условиях очень теплого, возможно, субтропического, климата: отсюда известен попугай и ряд форм, общих с субтропическими фаунами Западной и Центральной Европы (Зеленков, Мартынович, 2013; Тесаков и др., 2014; Зеленков, 2015б; Zelenkov, 2016a).
В Тагайском местонахождении представлено богатое разнообразие утиных (Зеленков, Мартынович, 2013), включающее девять таксонов мелких, средних и довольно крупных (размером с гуся) представителей – для всех из них это первое появление в палеонтологической летописи. Несколько видов мелких уток (размером с чирка или даже меньше) относятся к вымершему р. Mioquerquedula; систематическое положение этих утиных пока неясно, но примечательно остеологическое сходство с современными тропическими карликовыми гусями Nettapus (Зеленков, Курочкин, 2012). Довольно крупные неныряющие утки представлены вымершим р. Chenoanas, занимающим базальное положение на филогенетическом дереве Anatinae (Zelenkov et al., 2018). Кроме того, в Тагае присутствует какая-то средних размеров нырковая утка, похожая на Clangula, а также вымерший вид р. Aix и пеганковые, практически не отличимые от современных видов Tadorna и, несомненно, относящиеся к этому современному роду. Систематическое положение крупных утиных Тагая остается неясным – они могут представлять либо крупноразмерных Tadorninae, либо каких-то гусиных (Зеленков, Мартынович, 2013).
Тагайское фаунистическое сообщество утиных примечательно тем, что в нем впервые смешаны вымершие формы (такие как Chenoanas) и представители современных родов (например, Tadorna). Биогеографические корни этой фауны пока остаются неясными; не исключено, что она может представлять результат автохтонной эволюции утиных на территории Центральной Азии в раннем миоцене, поскольку в это время в Казахстане и прилегающих регионах сформировался пояс крупных и мелких озер (Изменения климата…, 1999). Удивительное таксономическое разнообразие утиных Тагая позволяет сравнивать это фаунистическое сообщество с раннемиоценовой (19–16 млн лет назад) фауной формации г. Сейнт Батанс в Новой Зеландии, откуда известно не менее восьми таксонов утиных (Worthy et al., 2007, 2008). Однако в раннем миоцене Новой Зеландии современные роды утиных еще отсутствуют, и в целом фауна выглядит более архаичной.
Фауны утиных, впервые известные по Тагаю, прослеживаются на протяжении всего среднего миоцена и, по-видимому, получили самое широкое распространение (рис. 3) на территории современного умеренного пояса Евразии (Zelenkov, 2016b; Zelenkov et al., 2018). В вышеупомянутом французском местонахождении Сансан, удаленном от Байкала на 7000 км, присутствуют те же виды утиных, что и на Тагае: Chenoanas sansaniensis и, по-видимому, Mioquerquedula minutissima (Zelenkov, 2016b; Zelenkov et al., 2018). Кроме них в Сансане присутствует довольно крупная пеганковая птица Anserobranta robusta, проявляющая сходство с современным Alopochen (Cheneval, 2000; Mlíkovský, 2002; Зеленков, Курочкин, 2015). Мелкая утка Anas velox из Сансана может быть тем же видом, что описан из Шарги как A. soporata (Зеленков, Курочкин, 2012), однако систематическое положение обоих видов (в том числе, отнесение к р. Anas s. l.) требует подтверждения.
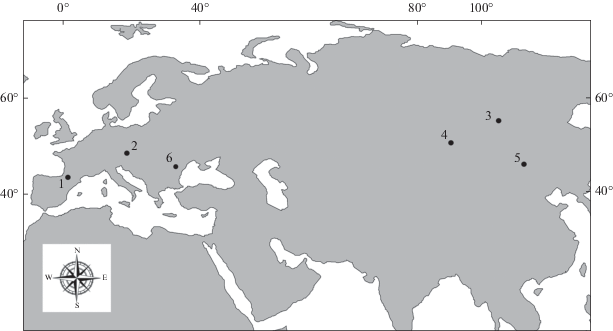
Рис. 3.
Пример широкого распространения отдельных таксонов утиных в Евразии во время миоценового климатического оптимума (по: Zelenkov et al., 2018, c дополнениями). Цифрами обозначены местонахождения с находками представителей вымершего рода Chenoanas: 1 – Сансан (Франция); 2 – Атцельсдорф (Австрия); 3 – Тагай (Россия, оз. Байкал); 4 – Шарга (Монголия); 5 – Тайрум Нор 346 (Внутренняя Монголия; Китай); 6 – Бужор (Молдова).
Начиная с середины среднего миоцена (около 15 млн лет назад) регистрируются заметные колебания климата, после которых наступает эпоха резкого похолодания, сопровождавшаяся ростом климатического градиента и возникновением аридного пояса в Центральной Азии (Flower, Kennett, 1994). Это событие отчетливо прослеживается на фаунах млекопитающих Центральной и Передней Азии, показывающих нарастающую специализацию к жизни в аридных обстановках (Liu et al., 2009; Mirzaie Attaabadi et al., 2013). Фаунистические сообщества утиных Центральной Азии отреагировали на эти климатические перестановки довольно умеренными перестройками – об этом можно судить по богатой фауне птиц из среднемиоценового (~13–11 млн лет назад) местонахождения Шарга в Западной Монголии (Zelenkov, 2016b). Здесь присутствуют все те же роды утиных (Зеленков, 2012а; Зеленков, Курочкин, 2012), что и в Тагае: Mioquerquedula, Chenoanas, Aix, Tadorna, хотя видовой состав меняется (из несомненных общих видов присутствует только M. minutissima). В то же время в Шарге становятся обычны и разнообразны нырковые утки, представленные вымершими родами Sharganetta, Protomelanitta и Nogusunna – их систематическое положение остается неясным, но Protomelanitta может оказаться членом Mergini (Зеленков, 2011), как и утка из Тагая, похожая на Clangulа. Обилие остатков нырковых уток, и в частности Mergini, в континентальных отложениях Евразии и Северной Америки при их отсутствии в морских отложениях – по-видимому, характерная черта авифаун второй половины среднего миоцена (Зеленков, 2012а).
Некоторые таксоны утиных конца среднего миоцена, представленные в местонахождении Шарга, как и более древние формы, имели широкое распространение в Евразии и даже за ее пределами. Так, Nogusunna conflictoides присутствует в одновозрастном с Шаргой местонахождении Штайнхайм в Германии (Zelenkov, 2016b), Chenoanas asiatica известна из сходных по возрасту отложений Северного Китая (Zelenkov et al., 2018), а из верхов среднего миоцена Северного Кавказа по фрагментарному черепу недавно был описан предполагаемый представитель Mioquerquedula (Зеленков, 2017). Прямое сравнение кавказской находки с типовыми материалами по Mioquerquedula невозможно, однако, как и M. minutissima, это была очень мелкая утка (меньше современного A. crecca), имеющая морфологическое сходство с Nettapus. Примечательна также находка р. Protomelanitta в одновозрастных отложениях Северной Америки (Stidham, Zelenkov, 2017).
ФАУНЫ СОВРЕМЕННОГО ТИПА (ПОЗДНИЙ МИОЦЕН–СОВРЕМЕННОСТЬ)
В позднем миоцене (11.6–5.3 млн лет назад) на всей территории Евразии отмечается прогрессивное похолодание, нарастает аридизация (Hilgen et al., 2012). Именно в это время в Евразии происходит смена архаичных среднемиоценовых фаун околоводных птиц на фауны современного типа (Zelenkov, 2016b). Начиная с позднего миоцена в фаунистических сообществах птиц полностью преобладают современные роды, а вымершие составляют абсолютное меньшинство (в качестве исключения сохраняются представители ископаемых семейств). По-видимому, именно в этом временном интервале начинается формирование многих современных клад внутри семейств или родов (Зеленков, 2014).
К сожалению, древнейшие этапы эволюции фаун утиных позднего миоцена остаются практически не изученными, что связано с плохой представленностью птиц в местонахождениях начала позднего миоцена (11–9 млн лет). К этому интервалу относятся только несколько изолированных находок в Центральной и Восточной Европе. Из низов верхнего миоцена Молдовы (Курочкин, Ганя, 1972) известны Anserobranta tarabukini (тот же род, что известен в Сансане), а также некрупная утка, похожая на Aix или Chenonetta, неопределенный гусь и более крупная форма, изначально отнесенная к Mergini (Курочкин, Ганя, 1972). Переизучение этого материала показывает, что предполагаемый Mergini в действительности сходен с Chenoanas из Сансана (наши данные). В сходном по возрасту (11–10 млн лет) местонахождении Рудабаня в Венгрии присутствуют два предполагаемых вида Mioquerquedula и возможный представитель Chenoanas (Zelenkov, 2017). Примитивный гусь, похожий на неописанного гуся из среднемиоценового местонахождения Штайнхайм в Германии, известен из местонахождения Фортепьянка на Северном Кавказе (Тарасенко и др., 2014). Эти отрывистые сведения указывают на то, что в начале позднего миоцена (биозоны MN 9–10) фауны утиных, по крайней мере в указанном регионе, принципиально не изменились по сравнению со среднемиоценовыми.
Существенная реорганизация фаун утиных умеренных широт Евразии происходит во второй половине позднего миоцена. В это время в континентальных отложениях на смену нырковым уткам из трибы Mergini приходят Aythyini; примитивные утиные Chenoanas и Mioquerquedula заменяются утками из р. Anas s. l.; исчезают из летописи или становятся очень редкими Tadornini; место крупных утиных занимают представители р. Anser и р. Branta, а также их вымершие родственники; появляются лебеди. Эти представления основаны на богатых фаунах утиных позднего миоцена и раннего плиоцена Западной Монголии (Курочкин, 1985; Зеленков, 2012б; Zelenkov, 2013), а также отдельных (пока немногочисленных) находках утиных в позднем миоцене Центральной и Восточной Европы (Jánossy, 1991; Mlíkovský, 2002; Zelenkov, Panteleyev, 2015; Зеленков, 2016; Ковальчук и др., 2017). В результате отмеченной реорганизации фауны утиных обретают, по сути, современный таксономический состав и экологический облик, отличаясь главным образом на видовом уровне (Zelenkov, 2016b).
Примечательно, что становление современного таксономического состава утиных во времени отчасти совпадает с формированием современной фауны диатомовых водорослей в континентальных водоемах, которая впервые формируется на рубеже среднего и позднего миоцена и затем диверсифицируется в течение позднего миоцена (Hayashi et al., 2018). Освоение Mergini морских местообитаний в позднем миоцене может быть связано с общим повышением продуктивности мирового океана в это время (в том числе, в связи с интенсификацией сноса с континентов за счет формирования муссонов; Filippelli, 1997; Molnar et al., 2010) одновременно с падением продуктивности внутренних водоемов в аридной зоне (Зеленков, 2012а).
Плиоцен-плейстоценовая эволюция фаун утиных Евразии остается очень плохо изученной. Климатические колебания, начавшиеся в позднем плиоцене, несомненно, оказывали существенное влияние на таксономический состав и, вероятно, диверсификацию, а также на распространение отдельных таксонов, однако находок утиных для интервала 3.5–0.02 млн лет в Евразии пока очень мало. При этом из позднего плиоцена–плейстоцена (вплоть до позднего) описано несколько ископаемых видов (Зеленков, Курочкин, 2015), что указывает на перспективность дальнейших исследований.
ЗАКЛЮЧЕНИЕ
Приведенный выше анализ палеонтологической летописи утиных в Евразии (и отчасти за ее пределами) позволяет выделить несколько этапов эволюции фаунистических сообществ, на каждом из которых в целом сходные фауны утиных имели широкое распространение в умеренных широтах Евразии. Первый этап (поздний эоцен–ранний олигоцен) представлен стволовыми представителями Anatidae, такими как Romainvilliinae. Второй этап (поздний олигоцен–ранний миоцен) остается плохо охарактеризован палеонтологически, но в целом маркируется присутствием вымершего р. Mionetta. Третий этап (конец раннего миоцена–начало позднего миоцена) характеризуется широким распространением вымерших стволовых представителей современных филогенетических линий утиных (таких как р. Chenoanas). В это время в палеонтологической летописи появляются первые представители отдельных современных родов (например, Tadorna и Aix), а в континентальных отложениях обычны остатки Mergini. На четвертом этапе (конец позднего миоцена–современность) в континентальных сообществах доминируют представители современных родов Anas и Aythya, а также гуси и лебеди. Примечательно, что на современном уровне знаний не удается проследить явную преемственность между этими этапами: смены фаунистических комплексов могли происходить довольно быстро; новые таксоны могли представлять либо результат автохтонной эволюции, либо мигрантов из других географических областей. Подробности смен фаунистических комплексов утиных представляют наибольший интерес для последующих исследований; они позволят охарактеризовать общие особенности эволюции этой широко распространенной группы птиц. Очень слабо изучена плиоцен-плейстоценовая эволюция утиных Евразии, результатом которой стало формирование современных фаунистических сообществ.
Исследование поддержано грантом РФФИ № 17-04-01162. Автор благодарен анонимному рецензенту за замечания по тексту статьи.
Список литературы
Дзержинский Ф.Я., 1982. Адаптивные черты в строении челюстного аппарата некоторых гусеобразных птиц и вероятные пути эволюции отряда // Зоол. журн. Т. 61. № 7. С. 1030–1041.
Дзержинский Ф.Я., 1993. Адаптации челюстного аппарата птиц в приложении к вопросам филогенетики класса. Дис. … докт. биол. наук. М.: МГУ. 533 с.
Дзержинский Ф.Я., Гринцевичене Т.И., 2002. О возможных филогенетических связях гусеобразных птиц // Казарка. Т. 8. С. 19–39.
Зеленков Н.В., 2011. Нырковые утки из среднего миоцена Западной Монголии // Палеонтол. журн. № 2. С. 70–77.
Зеленков Н.В., 2012а. Новая утка из среднего миоцена Монголии и замечания по эволюции уток в неогене // Палеонтол. журн. № 5. С. 74–85.
Зеленков Н.В., 2012б. Неогеновые гуси и утки (Aves: Anatidae) из местонахождений Котловины Больших Озер (Западная Монголия) // Палеонтол. журн. № 6. С. 59–71.
Зеленков Н.В., 2014. Этапы формирования современного таксономического разнообразия птиц // Зоол. журн. Т. 93. № 10. С. 1173–1185.
Зеленков Н.В., 2015а. Устойчивые морфологические типы и мозаичность в макроэволюции птиц (Neornithes) // Журн. общ. биол. Т. 76. № 4. С. 266–279.
Зеленков Н.В., 2015б. Примитивная поганка в нижнем миоцене Байкала (Восточная Сибирь) // Палеонтол. журн. № 5. С. 69–77.
Зеленков Н.В., 2016. Ревизия неворобьиных птиц Полгарди (Венгрия, верхний миоцен). 1. Anseriformes // Палеонтол. журн. № 5. С. 83–86.
Зеленков Н.В., 2017. Находки фрагментов скелетов птиц в среднем миоцене Северного Кавказа // Докл. Акад. Наук. Т. 477. № 3. С. 372–374.
Зеленков Н.В., 2018. Древнейшая утка (Anseriformes: Romainvilla) в Азии и происхождение утиных // Докл. Акад. Наук. Т. 483. № 2. С. 230–232.
Зеленков Н.В., Курочкин Е.Н., 2012. Речные утки (Aves: Anatidae) из среднего миоцена Монголии // Палеонтол. журн. № 4. С. 88–95.
Зеленков Н.В., Курочкин Е.Н., 2015. Класс Aves // Ископаемые рептилии и птицы. Часть 3 / Под ред. Курочкина Е.Н., Лопатина А.В., Зеленкова Н.В. М.: ГЕОС. С. 86–290.
Зеленков Н.В., Мартынович Н.В., 2013. Богатая фауна птиц из миоценового местонахождения Тагай (остров Ольхон, Байкал) // Тр. Мензбир. орнитол. об-ва. Вып. 2. С.73–93.
Изменение климата и ландшафтов за последние 65 миллионов лет (кайнозой: от палеоцена до голоцена), 1999. Под ред. Величко А.А. М.: ГЕОС. 260 с.
Ковальчук А.Н., Горобец Л.В., Сыромятникова Е.В. и др., 2017. Позвоночные из понтических отложений Шкодовой Горы (Северо-Западное Причерноморье, верхний миоцен) // Палеонтол. журн. № 4. С. 78–92.
Курочкин Е.Н., 1968. Новые олигоценовые птицы Казахстана // Палеонтол. журн. № 1. С. 92–101.
Курочкин Е.Н., 1985. Птицы Центральной Азии в плиоцене. Совместная Советско-Монгольская палеонтологическая экспедиция. Вып. 26. М.: Наука. 119 с.
Курочкин Е.Н., Ганя И.М., 1972. Птицы среднего сармата Молдавии // Позвоночные неогена и плейстоцена Молдавии. Кишинев: Штиинца. С. 45–70.
Невесская Л.А., 1999. Этапы развития бентоса фанерозойских морей. Мезозой. Кайнозой. Тр. Палеонтол. ин-та. Т. 274. М.: Наука. 503 с.
Попов С.В., Ахметьев М.А., Лопатин А.В. и др., 2009. Палеогеография и биогеография бассейнов Паратетиса. Часть I. Поздний эоцен-ранний миоцен. М.: Научный мир. 194 с.
Поповкина А.Б., Поярков Н.Д., 2002. История исследований филогенетических отношений и построения систем гусеобразных (Anseriformes) // Казарка. Т. 8. С. 41–77.
Тарасенко К.К., Лопатин А.В., Зеленков Н.В. и др., 2014. Новые местонахождения наземных и морских позвоночных позднего миоцена в Адыгее (Россия, Северный Кавказ) // Докл. Акад. Наук. Т. 459. № 6. С. 726–729.
Тесаков А.С., Сыромятникова Е.В., Данилов И.Г. и др., 2014. Успехи изучения миоценовых позвоночных местонахождения Тагай (остров Ольхон, Прибайкалье) // Палеонтология Центральной Азии и сопредельных регионов: к 45-летию Совм. Сов.-Монгол. палеонтол. экспед. Тез. докл. М.: ПИН РАН. С. 75–77.
Тугаринов А.Я., 1940. Новые данные для третичной орнитофауны СССР // Докл. АН СССР. Т. 26. № 3. С. 314–316.
Agnolin F., 2004. Revisión sistemática de algunas aves deseadenses (Oligocene Medio) descriptas por Ameghino en 1899 // Rev. Mus. Argent. Cienc. Nat. Nueva Ser. V. 6. № 2. P. 239–244.
Agnolin F.L., Egli F.B., Chatterjee S., Marsà J.A.G., Novas F.E., 2017. Vegaviidae, a new clade of southern diving birds that survived the K/T boundary // Sci. Nat. V. 104. № 11–12. https://doi.org/10.1007/s00114-017-1508-y
Bosboom R., Mandic O., Dupont-Nivet G. et al., 2017. Late Eocene palaeogeography of the proto-Paratethys sea in Central Asia (NW China, southern Kyrgyzstan and SW Tajikistan) // Geol. Soc. Lond. Spec. Publ. V. 427. № 1. P. 565–588.
Cheneval J., 1984. Les oiseaux aquatiques (Gaviiformes a Ansériformes) du gisement aquitanien de Saint-Gérand-le-Puy (Allier, France): Révision systématique // Palaeovertebrata. V. 14. № 2. P. 33–115.
Cheneval J., 1987. Les Anatidae (Aves, Anseriformes) du Miocene de France. Revision systematique et evolution // Docum. Labor. Geol. Univ. Lyon. № 99. P. 137–156.
Cheneval J., 2000. The avifauna of Sansan // Mem. Mus. Nat. Hist. Natur. Paris. V. 183. P. 321–388.
Dickinson E.C., Remsen J.V., Jr., (eds.), 2013. The Howard and Moore complete checklist of the birds of the World. 4th Ed. V. 1. Non-passerines. Eastbourne, U.K.: Aves Press. 461 p.
Ericson P.G.P., 2000. Systematic revision, skeletal anatomy, and paleoecology of the New World Early Tertiary Presbyornithidae (Aves: Anseriformes) // PaleoBios. V. 20. № 2. P. 1–23.
Filippelli G.M., 1997. Intensification of the Asian monsoon and a chemical weathering event in the late Miocene–early Pliocene: Implications for late Neogene climate change // Geology. V. 25. № 1. P. 27–30.
Flower B.P., Kennett J.P., 1994. The middle Miocene climatic transition: East Antarctic ice sheet development, deep ocean circulation and global carbon cycling // Palaeogeogr. Palaeoclimat. Palaeoecol. V. 108. № 3–4. P. 537–555.
Frith H.J., Davies S.J.J.F., 1961. Ecology of the Magpie Goose, Anseranas semipalmata Latham (Anatidae) // Wildl. Res. V. 6. № 2. P. 91–141.
Göhlich U.B., 2002. The avifauna of the Miocene fossil-lagerstatte Sandelzhausen (Bavaria, Southern Germania) // Zitteliana. V. 22. P. 169–190.
Gonzalez J., Düttman H., Wink M., 2009. Phylogenetic relationships based on two mitochondrial genes and hybridization patterns in Anatidae // J. Zool. V. 279. № 3. P. 310–318.
Hayashi T., Krebs W.N., Saito-Kato M., Tanimura Y., 2018. The turnover of continental planktonic diatoms near the middle/late Miocene boundary and their Cenozoic evolution // PLoS One. V. 13. № 6. P. e0198003.
Hilgen F.J., Lourens L.J., Dam J.A., van, et al., 2012. The Neogene Period // The Geologic Time Scale. Boston: Elsevier. P. 923–978.
Hoyo J., del, Collar N., 2014. HBW and BirdLife International Illustrated Checklist of the Birds of the World. V. 1: Non-passerines. Barcelona: Lynx Edicions. 904 p.
Jánossy D., 1991. Late Miocene bird remains from Polgárdi (W-Hungary) // Aquila. V. 98. P. 13–35.
Kurochkin E.N., Dyke G.J., 2010. A large collection of Presbyornis (Aves, Anseriformes, Presbyornithidae) from the late Paleocene and early Eocene of Mongolia // Geol. J. V. 45. № 4. P. 375–387.
Liu L., Eronen J.T., Fortelius M., 2009. Significant mid-latitude aridity in the middle Miocene of East Asia // Palaeogeogr. Palaeoclimat. Palaeoecol. V. 279. № 3–4. P. 201–206.
Livezey B.C., Martin L.D., 1988. The systematic position of the Miocene anatid Anas [?] blanchardi Milne-Edwards // J. Vertebr. Paleontol. V. 8. № 2. P. 196–211.
Louchart A., Vignaud P., Likius A. et al., 2005. A new swan (Aves: Anatidae) in Africa, from the latest Miocene of Chad and Libya // J. Vertebr. Paleontol. V. 25. № 2. P. 384–392.
Mayr G., 2008. Phylogenetic affinities and morphology of the late Eocene anseriform bird Romainvillia stehlini Lebedinsky, 1927 // N. Jahrb. Geol. Paläontol. Abh. Bd. 248. № 3. S. 365–380.
Mayr G., 2009. Paleogene Fossil Birds. Berlin, Heidelberg: Springer-Verlag. 262 p.
Mayr G., 2017. Avian Evolution: The Fossil Record of Birds and its Paleobiological Significance. Chichester, West Sussex: John Wiley & Sons, Inc. 293 p.
Mayr G., De Pietri V.L., 2013. A goose-sized anseriform bird from the late Oligocene of France: The youngest record and largest species of Romainvilliinae // Paläontol. Zeitschr. V. 87. № 3. P. 423–430.
Mayr G., Smith T., 2017. First Old World record of the poorly known, swan-sized anseriform bird Paranyroca from the late Oligocene/early Miocene of France // N. Jahrb. Geol. Paläontol. Abh. Bd. 286. № 3. S. 349–354.
Miller A.H., Compton L.V., 1939. Two fossil birds from the Lower Miocene of South Dakota // Condor. V. 41. P. 153–156.
Miller K.G., Kominz M.A., Browning J.V. et al., 2005. The Phanerozoic record of global sea-level change // Science. V. 310. № 5752. P. 1293–1298.
Mirzaie Ataabadi M., Liu L., Eronen J., Bernor R.L., Fortelius M., 2013. Continental-scale patterns in Neogene mammal community evolution and biogeography: a Europe-Asia perspective // Fossil Mammals of Asia: Neogene Biostratigraphy and Chronology. N.Y.: Columbia Univ. Press. P. 629–655.
Mlíkovský J., 2002. Cenozoic Birds of the World. Part 1: Europe. Praha: Ninox Press. 406 p.
Mlíkovský J., Švec P., 1986. Review of the tertiary waterfowl (Aves: Anseridae) of Asia // Vĕst. Čs. Společ. Zool. V. 50. P. 249–272.
Molnar P., Boos W.R., Battisti D.S., 2010. Orographic controls on climate and paleoclimate of Asia: Thermal and mechanical roles for the Tibetan plateau // Ann. Rev. Earth Planet. Sci. V. 38. № 1. P. 77–102.
Mourer-Chauviré C., 2008. Birds (Aves) from the Early Miocene of the Northern Sperrgebiet, Namibia // Memoir Geol. Surv. Namibia. V. 20. P. 147–167.
Mourer-Chauviré C., Berthet D., Hugueney M., 2004. The late Oligocene birds of the Créchy quarry (Allier, France), with a description of two new genera (Aves: Pelecaniformes: Phalacrocoracidae, and Anseriformes: Anseranatidae) // Senckenberg. Lethaea. V. 84. № 1–2. P. 303–315.
Olson S.L., 1989. Aspects of global avifaunal dynamics during the Cenozoic // Acta XIX Congressus Internationalis Ornithologici. Ottawa: Univ. Ottawa Press. P. 2023–2029.
Olson S.L., Feduccia A., 1980. Presbyornis and the origin of the Anseriformes (Aves: Charadriomorphae) // Smiths. Contrib. Zool. № 323. P. 1–24.
Prum R.O., Berv J.S., Dornburg A. et al., 2015. A comprehensive phylogeny of birds (Aves) using targeted next-generation DNA sequencing // Nature. V. 526. № 7574. P. 569–573.
Stidham T.A., Ni X.-J., 2014. Large anseriform (Aves: Anatidae: Romainvilliinae?) fossils from the Late Eocene of Xinjiang, China // Vertebr. PalAsiat. V. 52. № 1. P. 98–111.
Stidham T.A., Zelenkov N.V., 2017. North American–Asian aquatic bird dispersal in the Miocene: Evidence from a new species of diving duck (Anseriformes: Anatidae) from North America (Nevada) with affinities to Mongolian taxa // Alcheringa. V. 41. P. 222–230.
Sun Z., Pan T., Hu C. et al., 2017. Rapid and recent diversification patterns in Anseriformes birds: Inferred from molecular phylogeny and diversification analyses // PLoS One. V. 12. № 9. P. e0184529.
Tambussi C.P., Degrange F.J., Mendoza R.S., de, 2019. A stem anseriform from the early Palaeocene of Antarctica provides new key evidence in the early evolution of waterfowl // Zool. J. Linn. Soc. https://doi.org/10.1093/zoolinnean/zly085
Worthy T.H., 2009. Descriptions and phylogenetic relationships of two new genera and four new species of Oligo-Miocene waterfowl (Aves: Anatidae) from Australia // Zool. J. Linn. Soc. V. 156. № 2. P. 411–454.
Worthy T.H., Lee M.S.Y., 2008. Affinities of Miocene waterfowl (Anatidae: Manuherikia, Dunstanetta and Miotadorna) from the St Bathans Fauna, New Zealand // Palaeontology. V. 51. № 3. P. 677–708.
Worthy T.H., Degrange F.J., Handley W.D., Lee M.S.Y., 2017. The evolution of giant flightless birds and novel phylogenetic relationships for extinct fowl (Aves, Galloanseres) // R. Soc. Open Sci. V. 4. № 10. https://doi.org/10.1098/rsos.170975
Worthy T.H., Tennyson A.J.D., Jones C. et al., 2007. Miocene waterfowl and other birds from central Otago, New Zealand // J. Syst. Palaeontol. V. 5. № 1. P. 1–39.
Worthy T.H., Tennyson A.J.D., Hand S.J., Scofield R.P., 2008. A new species of the diving duck Manuherikia and evidence for geese (Aves: Anatidae: Anserinae) in the St Bathans Fauna (Early Miocene), New Zealand // J. Royal Soc. New Zeland. V. 38. № 2. P. 97–114.
Zelenkov N.V., 2013. New finds and revised taxa of Early Pliocene birds from Western Mongolia // Paleornithological Research 2013. Proc. 8th Intern. meet. Soc. Avian Paleontol. Evol. Wien: Verl. Naturhist. Mus. Wien. P. 153–170.
Zelenkov N.V., 2016a. The first fossil parrot (Aves, Psittaciformes) from Siberia and its implications for the historical biogeography of Psittaciformes // Biol. Lett. V. 12. № 10. https://doi.org/10.1098/rsbl.2016.0717
Zelenkov N.V., 2016b. Evolution of bird communities in the Neogene of Central Asia, with a review of the Neogene fossil record of Asian birds // Paleontol. J. V. 50. № 12. P. 1421–1433.
Zelenkov N.V., 2017. The revised avian fauna of Rudabanya (Hungary, Late Miocene) // Paleontología y evolución de las Aves. Contrib. Museo Argentino Cienc. Natur. № 7. P. 253–266.
Zelenkov N.V., 2019. A swan-sized anseriform bird from the late Paleocene of Mongolia // J. Vertebr. Paleontol. P. e1531879. https://doi.org/10.1080/02724634.2018.1531879
Zelenkov N.V., Panteleyev A.V., 2015. Three bird taxa (Aves: Anatidae, Phasianidae, Scolopacidae) from the late Miocene of the Sea of Azov // Paläontol. Zeitschr. V. 89. № 3. P. 515–527.
Zelenkov N.V., Stidham T.A., 2018. Possible filter-feeding in the extinct Presbyornis and the evolution of Anseriformes (Aves) // Зоол. журн. Т. 97. № 8. С. 943–956.
Zelenkov N.V., Stidham T.A., Martynovich N.V. et al., 2018. The middle Miocene duck Chenoanas (Aves, Anatidae): New species, phylogeny and geographical range // Papers Paleontol. V. 4. № 3. P. 309–326.
Zweers G., Gerritsen A.F.C., Kranenburg-Voogd P.J., van, 1977. Mechanics of feeding of the mallard (Anas platyrhynchos L.; Aves, Anseriformes). The lingual apparatus and the suction-pressure pump mechanism of straining // Contrib. Vertebr. Evol. V. 3. P. 1–109.
Дополнительные материалы отсутствуют.
Инструменты
Журнал общей биологии


