Журнал общей биологии, 2019, T. 80, № 5, стр. 334-347
Роль педоморфоза в становлении структурного типа черепа осетрообразных (Acipenseriformes, Actinopterygii)
А. А. Цессарский *
Институт проблем экологии и эволюции им. А.Н. Северцова РАН
119071 Москва, Ленинский просп., 33, Россия
* E-mail: sturiones@gmail.com
Поступила в редакцию 07.08.2018
После доработки 27.01.2019
Принята к публикации 06.06.2019
Аннотация
>Осетрообразные (Acipenseriformes, Actinopterygii) рассматриваются в качестве сестринского таксона по отношению к Neopterygii и наряду с Polypterus (Polypteriformes) занимают наиболее базальное положение на кладограмме рецентных лучеперых. Такое положение в системе определяет ключевое значение осетрообразных для понимания эволюционной истории не только лучеперых, но и костных рыб в целом. Вместе с тем уникальная морфология и отсутствие сколько-нибудь надежных гомологий – в первую очередь для этмоидной области черепа и челюстной дуги – не позволяют в полной мере использовать этих рыб для тестирования филогенетических гипотез и реконструкции эволюции Osteichthyes. В настоящей статье представлены результаты сравнительно-анатомического анализа челюстной дуги и этмоидной области головы осетрообразных, установлены гомологии всех основных морфологических элементов этих отделов головы и предложен эволюционный сценарий преобразования челюстной дуги и этмоидного отдела черепа при переходе от палеонискоидных предков к структурному типу головы современных осетров и полиодонтид. Показано, что в основе этих преобразований лежали процессы педоморфоза, который обусловил недоразвитие нижней челюсти и привел к высвобождению передних концов ветвей верхней челюсти и всего этмоидного отдела от функциональных ограничений, связанных с работой челюстного аппарата.
Осетровые (Acipenseridae: Acipenser, Huso, Scaphirhynchus, Pseudoscaphirhynchus) и полиодонтиды (Polyodontidae: Psephurus, Polyodon) вместе с двумя ископаемыми семействами (Chondrosteidae, Peipiaosteidae) составляют краун-группу Acipenseriformes, которой принято приписывать ранг отряда (Bemis et al., 1997). В современных системах Acipenseriformes рассматриваются в качестве сестринского таксона по отношению к Neopterygii (Amia, Lepisosteus, Teleostei) и наряду с Polypterus занимают наиболее базальное положение на кладограмме рецентных лучеперых (Grande, Bemis, 1996; Cloutier, Arratia, 2004; Gardiner et al., 2005; Hilton, Forey, 2009; Near et al., 2012; Friedman, 2015; Hughes et al., 2018).
Такое положение в системе определяет ключевое значение осетрообразных для понимания эволюционной истории не только лучеперых, но и костных рыб в целом. Вместе с тем уникальная морфология и отсутствие сколько-нибудь надежных гомологий – в первую очередь для этмоидной области черепа и челюстной дуги – не позволяют в полной мере использовать этих рыб для тестирования филогенетических гипотез и реконструкции эволюции Osteichthyes (Hilton, Forey, 2009; Hilton et al., 2011).
В отличие от всех других лучеперых, у осетрообразных ветви верхней челюсти не сочленяются с этмоидным отделом черепа, а вместо этого смыкаются своими передними концами, образуя синдесмозный симфиз под основанием глазничного отдела черепа. Соответственно, в противоположность тому, что наблюдается у остальных лучеперых рыб (рис. 1а), весь этмоидный отдел черепа у осетрообразных (рис. 1б) занимает экстраоральное положение и никак не связан с ротовой полостью. Эта уникальная для Osteichthyes конструкция является главной загадкой морфологии осетрообразных и главным препятствием для гомологизации скелетных элементов этмоидной области и челюстной дуги этих рыб (Allis, 1919; Sewertzoff, 1923, 1926, 1928; Jollie, 1980; Hilton et al., 2011).
Рис. 1.
Соотношения между челюстной дугой и осевым черепом: а – у всех лучеперых за исключением осетрообразных; б – у осетрообразных. Границы ротовой полости заштрихованы.
Настоящая работа представляет собой попытку установить гомологии основных элементов этмоидного отдела черепа и челюстной дуги осетрообразных и на этой основе предложить эволюционный сценарий происхождения структурного типа черепа этой группы.
МАТЕРИАЛЫ И МЕТОДЫ
Морфологические описания в настоящей статье основаны на исследовании личиночных и дефинитивных стадий развития головы следующих видов осетрообразных: Acipenser baerii, A. gueldenstaedtii, A. stellatus, A. nudiventris, A. schrenkii, Huso huso, Pseudoscaphirhynchus kaufmanni и Polyodon spathula. В качестве сравнительного материала послужили личинки, молодь и взрослые особи Amia calva и Polypterus senegalus.
Морфологию и развитие скелета исследовали по серийным срезам из гистологической коллекции лаборатории проблем эволюционной морфологии (Институт проблем экологии и эволюции им. А.Н. Северцова РАН), а также на тотальных препаратах, окрашенных ализарином и альцианом по стандартным методикам (Walker, Kimmel, 2007; Rigueur, Lyons, 2014). Периферическое распределение нервных ветвей изучали как на реконструкциях по серийным срезам, так и на тотальных препаратах, окрашенных суданом черным B (Filipski, Wilson, 1984).
СОСТАВ ВЕРХНЕЙ ЧЕЛЮСТИ
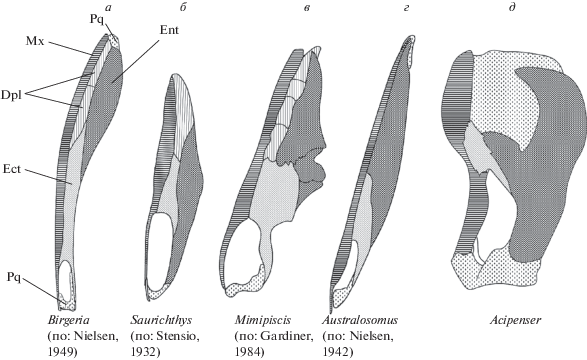
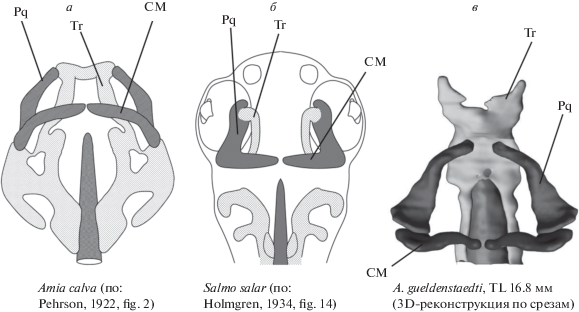
По составу и взаимному расположению элементов верхняя челюсть осетрообразных близка к таковой у палеонисков (рис. 2), что отмечали многие авторы (Stensio, 1925, 1932; Nielsen, 1942, 1949; Цессарский, 2001). Однако, как предположил Стеншио, в составе верхней челюсти Acipenser, возможно, отсутствует самая передняя часть (pars autopalatinum), которая у палеонисков сочленялась с этмоидным отделом нейрокраниума (Stensio, 1925). Подтвердить и детализировать это предположение позволяет исключительная сохранность верхнедевонских палеонисков Moythomasia durgaringa и Mimipiscis toombsi, описанных Гардинером (Gardiner, 1984).
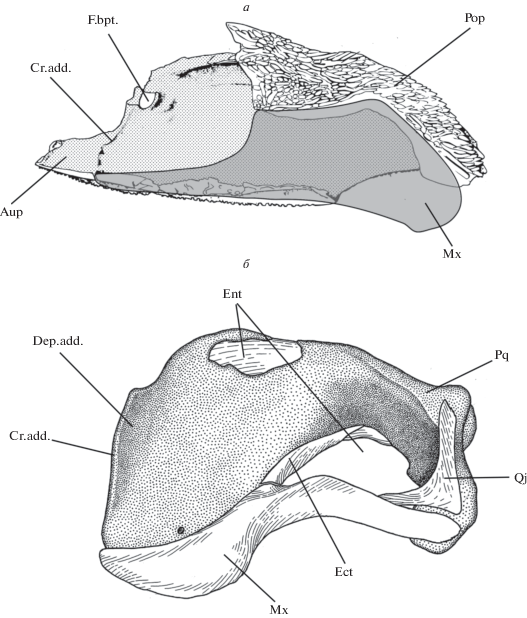
Как и у палеонисков (Schaeffer, Rosen, 1961; Lauder, Liem, 1983; Gardiner, 1984), челюстной аддуктор у осетрообразных целиком располагается на верхней челюсти (M.add., рис. 3а). Область его прикрепления представлена пологим углублением на аборальной стороне palatoquadratum (Dep.add.) и ограничена медиально отчетливым гребнем (Cr.add.), который также служит местом прикрепления связки, соединяющей верхнюю челюсть с нейрокраниумом. Эта связка (Lig.bas., рис. 4а) представляет собой тонкую соединительно-тканную ленту, область прикрепления которой на осевом черепе тянется от вентральной поверхности задненосовой стенки (Lig.ep., рис. 4б) до каудального конца базиптеригоидного отростка (Proc.bpt., рис. 4г). Латерально от нее проходят ramus maxillaris V и r. buccalis VII, а медиально – r. palatinus anterior VII. Таким образом, места прикрепления этой связки и ее расположение относительно ветвей тройничного и лицевого нервов позволяют гомологизировать ее переднюю часть с этмо-палатинной связкой, описанной у Polypterus (Pollard, 1892; Allis, 1922), Amia (Allis, 1897) и многих костистых (Walther, 1883; Bertmar, 1959), тогда как задняя часть этой связки осетрообразных вполне соответствует соединительно-тканной ленте, соединяющей palatoquadratum с орбитальным отделом черепа у Amia (Bjerring, 1972; Arratia, Schultze, 1991), Polypterus (Allis, 1922), Lepisosteus (Jollie, 1984) и костистых (Holmgren, 1943), а также у латимерии (Millot, Anthony, 1958).
Рис. 3.
Верхнечелюстной комплекс сибирского осетра A. baerii Brandt, 1869. а – вид спереди и сбоку, б – вид снизу и сзади.
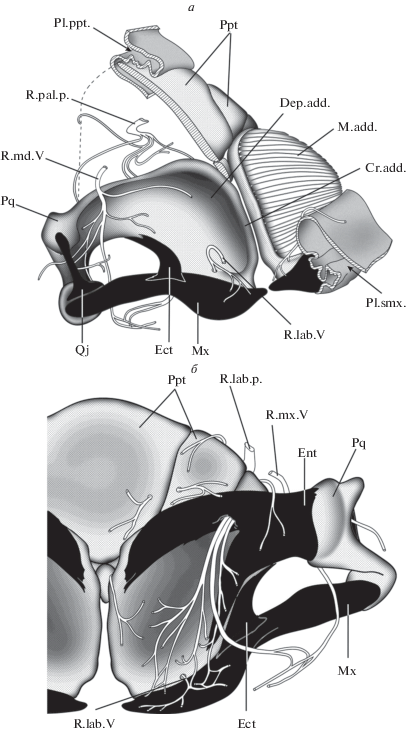
Рис. 4.
A. gueldenstaedtii (TL 42.5 мм). а – связка между верхней челюстью и нейрокраниумом, вид сбоку. Поперечные срезы головы на уровне задненосовой стенки (б), середины глазницы (в), задних концов базиптеригоидных отростков (г).
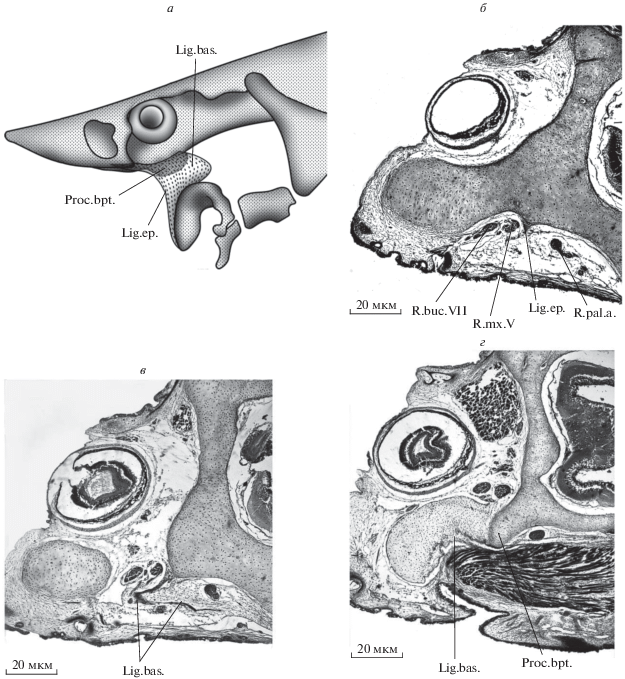
У Moythomasia и Mimipiscis (Gardiner, 1984) место прикрепления челюстного аддуктора маркировано пологим углублением на поверхности palatoquadratum, которое спереди обрамлял отчетливый гребень (Cr.add.). Согласно Гардинеру, на уровне этого гребня к palatoquadratum крепилась этмо-палатинная связка (Gardiner, 1984).
Таким образом, передний край области прикрепления аддуктора у палеонисков (рис. 5а) точно совпадает с таковым у осетрообразных (рис. 5б). Разница заключается в том, что у первых эта зона маркирует границу между pars autopalatinum и остальной (более задней) частью palatoquadratum, тогда как у осетрообразных аддуктор и этмо-палатинная связка крепятся непосредственно к переднему краю palatoquadratum. Это неизбежно приводит к заключению о том, что, как и предполагал Стеншио, в составе palatoquadratum этих рыб отсутствует часть, соответствующая небному отделу palatoquadratum палеонисков. Этот результат вполне согласуется с тем фактом, что у осетрообразных, как можно заключить из рис. 2, отсутствует и dermopalatinum, которая в норме у лучеперых связана именно с небной частью palatoquadratum (Arratia, Schultze, 1991). Согласно альтернативной и крайне сомнительной точке зрения на гомологию dermopalatinum, эта кость у осетрообразных заняла положение максиллы (Bemis et al., 1997; Findeis, 1997; Grande et al., 2002).
АНАСТОМОЗЫ ТРОЙНИЧНОГО И ЛИЦЕВОГО НЕРВОВ И ГОМОЛОГИЯ PARS AUTOPALATINUM
Если верхняя челюсть осетрообразных не имеет в своем составе pars autopalatina, то какова судьба этого элемента?
У осетровых на нижней стороне рострума имеется две пары усиков (Bemis et al., 1997). Оба усика одной стороны возникают из единого зачатка, который позднее разделяется на два (Holmgren, 1943). Внутри усика имеется хрящевой стержень – тентакулярный хрящ (Parker, 1882; Weisel, 1979; Saadatfar, Shahsavani, 2007). В онтогенезе тентакулярные хрящи происходят из мезенхимы переднего конца зачатка верхней челюсти (Holmgren, 1943; Bertmar, 1959), что, по мнению Хольмгрена, указывает на возможную принадлежность усиков осетрообразных к челюстной дуге (Holmgren, 1943). Логично предположить, что пара тентакулярных хрящей и есть отделившаяся от верхней челюсти pars autopalatina. Проверить эту гипотезу можно, если рассмотреть характер иннервации кожного покрова усиков у осетрообразных.
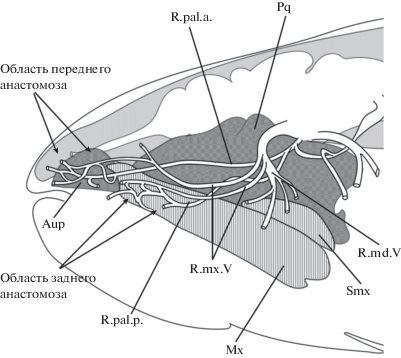
У Amia и Polypterus r. palatinus VII разделяется на переднюю и заднюю небные ветви (R.pal.a., R.pal.p.; рис. 6), которые образуют анастомозы с ветвями r. maxillaris V (Allis, 1897, 1922; Norris, 1925) – передний и задний анастомозы соответственно. Задний анастомоз расположен на уровне глазницы, его дистальные ветви иннервируют слизистую рта и верхнюю губу вдоль максиллы. Передний анастомоз приурочен к этмоидной области, его ветки идут к вкусовым почкам передней части неба, расположенным в слизистой на уровне передних концов верхней челюсти (pars autopalatina).
У осетра (рис. 2, 7) задний анастомоз без сомнения представлен соединением между r. palatinus posterior VII и веткой r. maxillaris V – так называемой r. labialis V. Как и у Amia и Polypterus, дистальные ветви этого анастомоза снабжают ткани вокруг максиллы.
Передний анастомоз у осетров также имеется. Он образован густой сетью волокон, соединяющих r. maxillaris V и r. palatinus anterior VII, расположенной на нижней стороне этмоидной области, позади усиков (рис. 7) (Norris, 1925; Kuratani et al., 2000). Ветви этого анастомоза иннервируют кожу и вкусовые почки усиков и проходят дальше вперед к переднему концу рострума.
Таким образом, иннервация кожи усиков осетрообразных в полной мере соответствует предположению о том, что тентакулярные хрящи представляют собой отделившуюся от верхней челюсти pars autopalatina.
ГОМОЛОГИЯ ПАРАСФЕНОИДА И ТИПОЛОГИЯ ЭТМОИДНОЙ ОБЛАСТИ ГОЛОВЫ
Тентакулярные хрящи расположены в этмоидной области головы, и если они представляют собой отделившиеся от верхней челюсти передние концы palatoquadratum, то следует ожидать, что их положение по отношению к элементам этмоидной области будет таким же, как положение pars autopalatina у “нормальных” лучеперых.
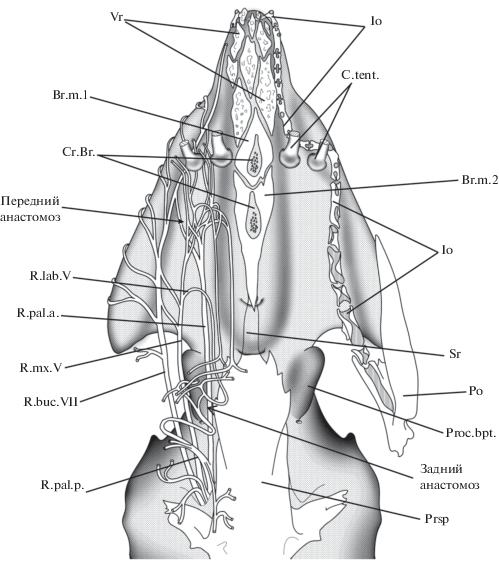
О том, что это действительно так, говорят результаты сравнения скелета этмоидной области головы осетрообразных с другими Osteichthyes (Цессарский, 1988). Ключевую роль в тестировании этой типологической схемы играет вопрос о гомологии серии окостенений (Sr, Br.m.1, Br.m.2, Vr; рис. 7), подстилающих у осетрообразных центральную часть этмоидного отдела и расположенных впереди от парасфеноида.
Согласно классическим представлениям, эта серия либо соответствуют сошникам (“vomerine series”; Parker, 1882), либо вообще не имеет гомологов в других группах позвоночных (Sewertzoff, 1926; Северцов, 1939; Patterson, 1975; Jollie, 1980; Grande, Bemis, 1991, 1996; Findeis, 1993). Что касается парасфеноида, то вопрос о гомологии этой кости осетрообразных в литературе не обсуждается.
Как известно, парасфеноид рыб состоит из переднего и заднего отделов, граница между которыми проходит в гипофизарной области (Jarvik, 1954). Передний (прехордальный) отдел лежит в основании орбитального и частично этмоидного отделов черепа. Его задний конец расположен между базиптеригоидными отростками нейрокрания (если они имеются) и отверстиями для внутренних сонных артерий. Задний отдел парасфеноида лежит позади гипофиза и подстилает отикоокципитальный отдел черепа. У разных представителей отделы парасфеноида развиты в разной степени (Jarvik, 1954; Patterson, 1975; Gardiner, 1984).
У Amia (Pehrson, 1940), Lepisosteus (Hammarberg, 1937) и хвостатых амфибий (Лебедкина, 1979) парасфеноид развивается в онтогенезе из двух частей (передней и задней). Передняя часть лежит впереди гипофиза в области переднего базикраниального окна, она непарная. Задняя располагается позади гипофиза, у амии и панцирной щуки она парная. Непарная передняя и парная задняя части топографически соответствуют переднему и заднему отделам дефинитивного парасфеноида костных рыб (Jarvik, 1954, 1980).
Так называемый парасфеноид осетра (Prsp; рис. 7) целиком расположен позади гипофиза и должен рассматриваться как задний отдел парасфеноида. В пользу такой интерпретации говорит и характер развития этой кости в онтогенезе. У осетрообразных (Цессарский, 2017а) парасфеноид возникает в виде парной костной закладки, целиком расположенной позади гипофиза и полностью соответствующей задней части парасфеноида личинок амии и панцирной щуки. Таким образом, “парасфеноид” осетрообразных действительно соответствует только заднему отделу этой кости других рыб. Что касается переднего отдела парасфеноида, то по топографии развития и дефинитивному положению ему соответствуют субрострале и базиростралии (Sr и Br.m.1, Br.m.2; рис. 7). Это всегда непарные окостенения, закладывающиеся под той частью трабекулярного отдела нейрокраниума, где у личинки расположено базикраниальное окно, т.е. там, где появляется передняя закладка парасфеноида у Amia и Lepisosteus.
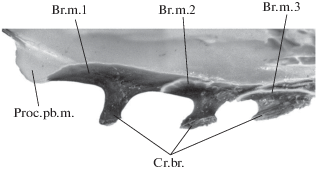
Дополнительным аргументом в пользу такой интерпретации служит так называемый киль рострума (Jollie, 1984) – непарный вентральный отросток, расположенный у многих видов осетров на базиростралиях (Cr.Br.; рис. 7, 8). Он имеет узкое основание и расширенную дистальную часть, которая выдается наружу, образуя в эпидермисе горизонтальную площадку, орнаментированную гребнями и бугорками. Морфологическое и функциональное значение этого костного выроста остается непонятным.
Между тем у многих костных рыб передний отдел парасфеноида несет непарную площадку, покрытую шагренью мелких зубчиков либо орнаментированную гребнями (Gardiner, 1984). Часто (Eusthenopteron, Polypterus, Latimeria) эта площадка бывает приподнята над поверхностью кости, имеет суженное основание и расширенную дистальную часть, выдающуюся в поверхностные слои слизистой рта. Имелась такая приподнятая площадка и у некоторых триасовых заурихтиид (Yelangichthys; Wu et al., 2013), которых традиционно сближают с предками осетрообразных (Stensio, 1932; Gardiner et al., 2005). Таким образом, если базиростралии осетров гомологичны переднему отделу парасфеноида, то присутствие на них описанных выше вентральных выростов является вполне закономерным и служит дополнительным свидетельством в пользу такой гомологизации.
Наконец, коль скоро базиростралии являются передней частью парасфеноида, то впереди от них должны располагаться парные элементы, соответствующие сошникам. Именно это и наблюдается у осетрообразных (Vr, рис. 7). Следует добавить, что и окостенения, связанные с инфраорбитальным каналом боковой линии (Po, Io), у осетрообразных удается гомологизировать с соответствующими окостенениями других рыб (Jollie, 1980; Hilton et al., 2011).
Таким образом, экзоскелет этмоидной области головы осетрообразных по всем существенным морфологическим чертам отвечает архетипу этого отдела черепа костных рыб. Главное отличие заключается во фрагментации и полимеризации переднего отдела парасфеноида и сошников (а также элементов инфраорбитальной серии), что, по-видимому, связано со значительным удлинением рострума и всего этмоидного отдела.
Что касается эндоскелета этмоидной области, то и здесь, как показано ранее (Цессарский, 1988), у осетрообразных наблюдается практически полное соответствие строению этого отдела черепа других костных рыб, включая и связь с pars autopalatina (тентакулярными хрящами).
ПЕДОМОРФОЗ И СТАНОВЛЕНИЕ СТРУКТУРНОГО ТИПА ЧЕРЕПА ОСЕТРООБРАЗНЫХ
Установленные выше гомологии элементов этмоидной области и верхней челюсти осетрообразных позволяют заключить, что у палеонискоидных предков этой группы передние концы ветвей верхней челюсти в ходе эволюции отделились от palatoquadratum и, сохранив свою исходную связь с этмоидной областью, превратились в опорные элементы усиков – специализированных органов вкусовой и тактильной чувствительности. При этом оставшиеся части верхнечелюстных ветвей развернулись своими концами медиально и соединились друг с другом, образовав синдесмозный симфиз. Одним из результатов этих преобразований и стало то, что бывшая передняя часть крыши ротовой полости, вплоть до задней границы этмоидной области, оказалась вне ротовой полости.
Обладая надежной типологической основой для подобных заключений, мы вправе задаться вопросом: что послужило главным фактором, определившим такие необычные структурные преобразования? Ответ обнаруживается при сравнении ранних стадий развития головы осетров и других рыб.
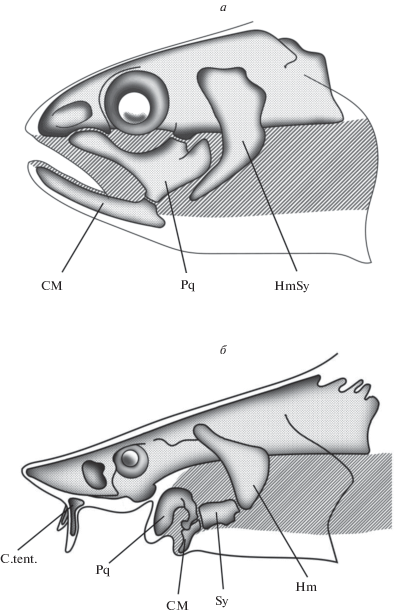
У личинки Salmo salar в возрасте 55 дней 6 часов (рис. 9б) скелет головы образован еще сгущениями мезенхимы, но очертания челюстной дуги и трабекул уже хорошо различимы. Обращает на себя внимание различное положение зачатков верхней и нижней челюстей (рис. 9). Ветви верхней челюсти (Pq) направлены рострально и контактируют с этмоидной областью, тогда как зачатки меккелевых хрящей (CM) располагаются поперечно. Точно такая же картина наблюдается в онтогенезе большинства, если не всех, других современных Osteichthyes: например, Polypterus (Daget et al., 1964, fig. 23 ), Amia (Pehrson, 1922, fig. 2, 4), Lepisosteus (Hammarberg, 1937, fig. 2), Teleostei (Holmgren, 1943, fig. 14 ; Bertmar, 1959, fig. 10, 21 ), Dipnoi (Fox, 1965, fig. 3).
Рис. 10.
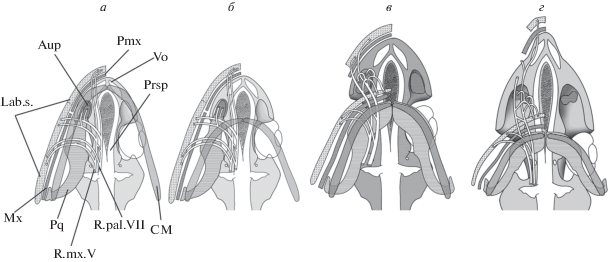
Эволюционный сценарий становления структурного типа головы осетрообразных: а – исходное, “палеонискоидное” состояние; б – начальная фаза педоморфоза, каудальное смещение нижней челюсти, “обнажение” передней части этмоидной области и передних концов верхней челюсти; в – отделение pars autopalatina от верхней челюсти, образование верхнечелюстного симфиза; г – преобразование pars autopalatina в тентакулярные хрящи, удлинение и расширение этмоидной области, формирование рострума.
У осетрообразных на ранних стадиях развития взаимное расположение верхней и нижней челюстей такое же, как и у других рыб (рис. 9; см. также Holmgren, 1943, fig. 26 ). Однако дальнейшее развитие у них резко отличается. У всех Osteichthyes меккелевы хрящи растут вперед, “догоняя” верхнюю челюсть, в результате чего устанавливается окклюзия челюстей, а этмоидный отдел черепа в конце концов оказывается лежащим в крыше ротовой полости. У осетрообразных же рост ветвей нижней челюсти вперед вообще не происходит. Наоборот, меккелевы хрящи сохраняют свою исходную поперечную ориентацию (Warth et al., 2017, 2018), а окклюзия челюстей достигается благодаря развороту верхнечелюстных ветвей медиально. В результате рот оказывается смещенным далеко назад, а весь этмоидный отдел приобретает экстраоральное положение.
Из сказанного ясно, что уникальные соотношения между верхней челюстью и осевым черепом, отличающие осетрообразных от всех других костных рыб, возникают благодаря сохранению в дефинитивном состоянии такого расположения нижней челюсти, которое наблюдается у других рыб только на ранних стадиях развития. Другими словами, наиболее фундаментальная черта конструктивного типа головы осетрообразных – экстраоральное положение этмоидного отдела – является прямым следствием сохранения у взрослой рыбы того состояния, которое у предковых форм было свойственно личиночным стадиям, т.е. педоморфоза.
Этот вывод хорошо согласуется с наличием у осетрообразных целого синдрома других явно педоморфных признаков, о которых писали многие авторы (Watson, 1925; Берг, 1948; Яковлев, 1977; Grande, Bemis, 1991; Цессарский, 1992, 2017б; Bemis et al., 1997).
ЭВОЛЮЦИОННЫЙ СЦЕНАРИЙ ФОРМИРОВАНИЯ ГОЛОВЫ ОСЕТРООБРАЗНЫХ
Вывод о педоморфной природе структурного типа головы осетрообразных позволяет в общих чертах смоделировать те эволюционные преобразования, которые в конечном итоге и привели к этому состоянию. Основные стадии этого процесса показаны на рис. 10.
Исходное состояние (рис. 10а) соответствует анцестральной (палеонискоидной) морфологии. Педоморфное недоразвитие нижней челюсти в эволюции этих рыб приводило ко все большему “обнажению” передней части неба (рис. 10б). Это освободило передние концы верхней челюсти от функциональных ограничений, связанных с работой челюстного аппарата, и позволило преобразовать участок кожного покрова этой области в специализированные органы тактильного и вкусового чувства. При этом за пределами ротовой полости остались передняя часть верхней губы, премаксиллы, сошники и передняя часть парасфеноида. На следующем этапе (рис.10в) произошли отделение передних концов palatoquadratum от верхней челюсти и разворот оставшихся частей медиально с образованием симфиза, что позволило восстановить окклюзию челюстей. Это изменение ориентации ветвей верхней челюсти зафиксировано, в частности, в совершенно необычном положении ветвей V и VII нервов, которые у осетрообразных отходят от основных стволов не латерально, как у других рыб, а медиально и тянутся назад к верхней челюсти (рис. 7). По-видимому, на этой же стадии инфраорбитальные каналы боковой линии сместились на вентральную сторону этмоидного отдела, где также произошло формирование многочисленных электрорецепторов. И то, и другое служило адаптацией к бентофагии.
Дальнейшие преобразования свелись, по сути, к удлинению и уплощению всего этмоидного отдела головы, что позволило вынести сенсорное вооружение в виде усиков дальше вперед от ротового отверстия (рис. 10г). Это сопровождалось полимеризацией элементов инфраорбитальной серии окостенений, а также сошников и переднего отдела парасфеноида. Последнее нередко наблюдается у рыб в случаях значительного удлинения тех или иных отделов головы (например, полимеризация инфраорбитальной серии у Lepisosteus; Hammarberg, 1937). Еще одним новшеством было развитие элементов медиального палатобазального отростка (Proc.pb.m.; рис. 8), образовавших своего рода направляющую для протракции верхних челюстей (Meinel, 1962). Формирование этого отростка обусловило и своеобразную суженную форму subrostrale (Цессарский, 2017a).
Предложенный эволюционный сценарий становления структурного типа головы осетрообразных можно рассматривать как тестируемую гипотезу, поскольку он позволяет вывести ряд доступных для проверки следствий. Например, методами микрокомпьютерной томографии и прижизненного мечения клеток энтодермы недавно было показано, что у осетров, в отличие от всех других позвоночных, кожный покров нижней поверхности этмоидного отдела головы, включая и покровы усиков, развивается в онтогенезе из энтодермы (Minarik et al., 2017). Именно этого и следует ожидать, коль скоро эта часть кожного покрова является дериватом слизистой оболочки крыши прежней ротовой полости.
Описанные трансформации челюстного аппарата предков осетрообразных ставят ряд непростых вопросов функционального характера. В частности, они предполагают, что эволюция осетрообразных сопровождалась сокращением объема ротовой полости, что неизбежно должно было снизить эффективность всасывания при питании и дыхании. Здесь нет возможности обсуждать этот и другие вопросы, однако следует отметить, что предки осетрообразных, по всей видимости, были не единственной группой мезозойских лучеперых, у которых происходило сокращение объема ротовой полости вследствие недоразвития нижней челюсти. Именно такой тренд реализовался у мезозойских палеонискоидных Redfieldiiformes (Schaeffer, 1967; Hutchinson, 1973; Schaeffer, McDonald, 1978). В разных линиях этих рыб наблюдается значительное укорочение нижней челюсти (рис. 11), в результате чего “обнажается” передняя часть неба, где, судя по рельефу дермальных окостенений, имелись мясистые губы, выполнявшие в том числе и сенсорные (вкусовые, тактильные) функции (Schaeffer, 1967).
Рис. 11.
Недоразвитие нижней челюсти и “обнажение” передней части неба у триасовых Redfieldiiformes (из Schaeffer, 1967).
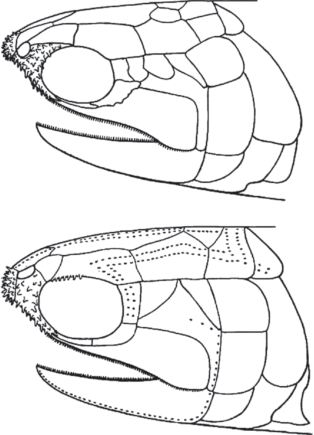
Является ли это несомненное сходство с осетрообразными проявлением гомоплазии, или оно указывает на возможную монофилию осетрообразных и Redfieldiiformes, – решение этого вопроса относится к сфере филогенетики, но не сравнительной анатомии. Так или иначе, недоразвитие нижней челюсти происходило среди мезозойских палеонисков и за пределами линии, ведущей к осетрообразным, но только у последних этот процесс захватил самые ранние стадии личиночного развития, что и привело к той радикальной перестройке соотношений между челюстной дугой и осевым черепом, которую мы видим у современных осетров и полиодонтид.
Настоящая работа выполнена при поддержке РФФИ, гранты № 17-04-01215 и № 18-04-00928.
Список литературы
Берг Л.С., 1948. О положении Acipenseriformes в системе рыб // Тр. Зоол. ин-та АН СССР. Т. 7. № 3. С. 7–57.
Лебедкина Н.С., 1979. Эволюция черепа амфибий. М.: Наука. 283 с.
Северцов А.Н., 1939. Морфологические закономерности эволюции. М.; Л.: Изд-во АН СССР. 609 с.
Цессарский А.А., 1988. Этмоидный отдел черепа осетровых с позиций сравнительной анатомии // Современные проблемы эволюционной морфологии / Под ред. Воробьевой Э.И. М.: Наука. С. 184–209.
Цессарский А.А., 1992. Развитие челюстного аппарата осетрообразных и происхождение полиодонтид // Докл. АН СССР. Т. 323. № 5. С. 957–960.
Цессарский А.А., 2001. К морфологии челюстного сустава палеонисков // Палеонтол. журн. № 1. С. 45–52.
Цессарский А.А., 2017a. Мнимая плезиоморфия: гетерохронии в развитии черепа Acipenseriformes // Эволюционная и функциональная морфология позвоночных. М.: Т-во науч. изд. КМК. С. 283–289.
Цессарский А.А., 2017б. Роль педоморфоза в становлении и диверсификации Acipenseriformes (Actinopterygii) // Современные проблемы биологической эволюции. М.: ГДМ. С. 359–361.
Яковлев В.Н., 1977. Филогенез осетрообразных // Очерки по филогении ископаемых рыб и бесчелюстных. М.: Наука. С. 116–143.
Allis E.P., 1897. The cranial muscles, cranial, first spinal nerves in Amia calva // J. Morphol. V. 12. № 3. P. 487–808.
Allis E.P., 1919. The homologies of the maxillary, vomer bones of Polypterus // Am. J. Anat. V. 25. № 4. P. 348–394.
Allis E.P., 1922. The cranial anatomy of Polypterus, with special reference to Polypterus bichir // J. Anat. V. 56. Pt. 3–4. P. 189–294.43.
Arratia G., Schultze H.-P., 1991. Palatoquadrate and its ossifications: Development, homology within osteichthyans // J. Morphol. V. 208. № 1. P. 1–81.
Bemis W.E., Findeis E.K., Grande L., 1997. An overview of Acipenseriformes // Environ. Biol. Fishes. V. 48. № 1–4. P. 25–72.
Bertmar G., 1959. On the ontogeny of the chondral skull in Characidae, with a discussion on the chondrocranial base, the visceral chondrocranium in fishes // Acta Zool. V. 40. № 2–3. P. 203–364.
Bjerring H.C., 1972. The rhinal bone and its evolutionary significance // Zool. Scr. V. 1. № 4. P. 193–201.
Cloutier R., Arratia G., 2004. Early diversification of actinopterygians // Recent Advances in the Origin, Early Radiation of Vertebrates / Eds Arratia G., Wilson M.V.H., Cloutier R. München, Germany: Verlag Dr. F. Pfeil. P. 217–270.
Daget J., Bauchot R., Arnoult J., 1964. Développement du chondrocrâne et des arcs aortiques chez Polypterus senegalus Cuvier // Acta Zool. V. 46. P. 201–244.
Filipski G.T., Wilson M.V.H., 1984. Sudan Black B as a nerve stain for whole cleared fishes // Copeia. № 1. P. 204–208.
Findeis E.K., 1993. Skeletal anatomy of the North American shovelnose sturgeon Scaphirhynchus platorynchus (Rafi-nesque, 1820) with comparisons to other Acipenseriformes. PhD Thesis. Massachusetts: Univ. Massachusetts Amherst. 1 p.
Findeis E.K., 1997. Osteology, phylogenetic interrelationships of sturgeons (Acipenseridae) // Sturgeon Biodiversity, Conservation / Eds Birstein V.J., Waldman J.R., Bemis W.E. Dordrecht, Netherlands: Springer. P. 73–126.
Fox H., 1965. Early development of the head, pharynx of Neoceratodus with a consideration of its phylogeny // J. Zool. V. 146. № 4. P. 470–554.
Friedman M., 2015. The early evolution of ray-finned fishes // Palaeontology. V. 58. № 2. P. 213–228.
Gardiner B.G., 1984. The relationships of the palaeoniscid fishes, a review based on new specimens of Mimia, Moythomasia from the Upper Devonian of Western Australia // Bull. Br. Mus. Nat. Hist. Geol. V. 37. P. 173–428.
Gardiner B.G., Schaeffer B., Masserie J.A., 2005. A review of the lower actinopterygian phylogeny // Zool. J. Linn. Soc. V. 144. № 4. P. 511–525.
Grande L., Bemis W.E., 1991. Osteology and phylogenetic relationships of fossil and recent paddlefishes (Polyodontidae) with comments on the interrelationships of Acipenseriformes // J. Vert. Paleontol. V. 1. № 11. P. 1–121.
Grande L., Bemis W.E., 1996. Interrelationships of Acipenseriformes, with comments on “Chondrostei” // Interrelationships of Fishes / Eds Stiassny M.L.J., Parenti L.R., Johnson G.D. Burlington: Acad. Press. P. 85–115.
Grande L., Jin F., Yabumoto Y., Bemis W.E., 2002. Protopsephurus liui, a well-preserved primitive paddlefish (Acipenseriformes: Polyodontidae) from the Lower Cretaceous of China // J. Vert. Paleontol. V. 22. № 2. P. 209–237.
Hammarberg F., 1937. Zur Kenntnis der Ontogenetischen Entwicklung des Schädels von Lepidosteus platystomus // Acta Zool. V. 18. № 1–2. P. 209–337.
Hilton E.J., Forey P.L., 2009. Redescription of Chondrosteus acipenseroides Egerton, 1858 (Acipenseriformes, Chondrosteidae) from the lower Lias of Lyme Regis (Dorset, England), with comments on the early evolution of sturgeons, paddlefishes // J. Syst. Palaeontol. V. 7. № 4. P. 427–453.
Hilton E.J., Grande L., Bemis W.E., 2011. Skeletal anatomy of the shortnose sturgeon, Acipenser brevirostrum Lesueur, 1818, the systematics of sturgeons (Acipenseriformes, Acipenseridae) // Fieldiana Life Earth Sci. № 3. P. 1–168.
Holmgren N., 1943. Studies on the head of fishes // Acta Zool. V. 24. № 1–3. P. 1–188.
Hughes L.C., Ortí G., Huang Y., Sun Y., Baldwin C.C. et al., 2018. Comprehensive phylogeny of ray-finned fishes (Actinopterygii) based on transcriptomic, genomic data // Proc. Natl. Acad. Sci. V. 115. № 24. P. 6249–6254.
Hutchinson P., 1973. A revision of the redfieldiiform, perleidiform fishes from the Triassic of Bekker’s Kraal (South Africa), Brookvale (New South Wales) // Bull. Br. Mus. Nat. Hist. V. 22. P. 233–254.
Jarvik E., 1954. On the Visceral Skeleton in Eusthenopteron with a Discussion of the Parasphenoid, Palatoquadrate in Fishes. Stockholm: Almqvist & Wiksells. 104 p.
Jarvik E., 1980. Basic Structures and Evolution of Vertebrates. V. 1. L.: Acad. Press. 575 p.
Jollie M., 1980. Development of head, pectoral girdle skeleton, scales in Acipenser // Copeia. № 2. P. 226–249.
Jollie M., 1984. Development of cranial, pectoral girdle bones of Lepisosteus with a note on scales // Copeia. № 2. P. 476–502.
Kuratani S., Nobusada Y., Saito H., Shigetani Y., 2000. Morphological characteristics of the developing cranial nerves, mesodermal head cavities in sturgeon embryos from early pharyngula to late larval stages // Zool. Sci. V. 17. № 7. P. 911–933.
Lauder G.V., Liem K.F., 1983. The evolution, interrelationships of the actinopterygian fishes // Bull. Mus. Comp. Zool. V. 150. P. 95–197.
Meinel W., 1962. Zur Morphologie und Funktion des Splanchnocranium von Acipenser // Z. Morphol. Ökol. Tiere. V. 51. № 1. P. 1–62.
Millot J., Anthony J., 1958. Anatomie de Latimeria chalumnae. V. 1: Squelette, muscles et formations de soutien. Paris: Centre National de la Recherche Scientifique. 120 p.
Minarik M., Stundl J., Fabian P., Jandzik D., Metscher B.D. et al., 2017. Pre-oral gut contributes to facial structures in non-teleost fishes // Nature. V. 547. № 7662. P. 209–212.
Near T.J., Eytan R.I., Dornburg A., Kuhn K.L., Moore J.A. et al., 2012. Resolution of ray-finned fish phylogeny, timing of diversification // Proc. Natl. Acad. Sci. V. 109. № 34. P. 13698–13703.
Nielsen E., 1942. Studies on Triassic Fishes from East Greenland: 1. Glaucolepis and Boreosomus // Palaeozoologica groenlandica. Bd. 1. S. 1–394.
Nielsen E., 1949. Studies on triassic fishes from East Greenland: 2. Australosomus, Birgeria // Meddel. Grønland. V. 146. № 1. P. 1–309.
Norris H.W., 1925. Observations upon the peripheral distribution of the cranial nerves of certain ganoid fishes (Amia Lepidosteus, Polyodon, Scaphirhynchus, Acipenser) // J. Comp. Neurol. V. 39. № 3. P. 345–432.
Parker W.K., 1882. On the structure, development of the skull in sturgeons (Acipenser ruthenus, A. sturio) // Phil. Trans. R. Soc. Lond. V. 173. P. 139–185.
Patterson C., 1975. The braincase of pholidophorid, leptolepid fishes, with a review of the actinopterygian braincase // Phil. Trans. R. Soc. Lond. B. Biol. Sci. V. 269. № 899. P. 275–579.
Pehrson T., 1922. Some points in the cranial development of teleostomian fishes // Acta Zool. V. 3. № 1. P. 1–63.
Pehrson T., 1940. The development of dermal bones in the skull of Amia calva // Acta Zool. V. 21. № 1–3. P. 1–50.
Pollard H.B., 1892. On the anatomy, phylogenetic position of Polypterus // Zool. Jahrb. V. 5. P. 387–428.
Rigueur D., Lyons K.M., 2014. Whole-mount skeletal staining // Methods Mol. Biol. V. 1130. P. 113–121.
Saadatfar Z., Shahsavani D., 2007. Structure of barbel in sturgeon (Acipenser percicus) // J. Appl. Anim. Res. V. 32. № 1. P. 65–67.
Schaeffer B., 1967. Late Triassic fishes from the western United States // Bull. Am. Mus. Nat. Hist. V. 135. P. 285–342.
Schaeffer B., McDonald N.G., 1978. Redfieldiid fishes from the Triassic-Liassic Newark Supergroup of eastern North America // Bull. Am. Mus. Nat. Hist. V. 159. P. 129–174.
Schaeffer B., Rosen D.E., 1961. Major adaptive levels in the evolution of the actinopterygian feeding mechanism // Am. Zool. V. 1. № 2. P. 187–204.
Sewertzoff A.N., 1923. The place of the cartilaginous Ganoids in the system and the evolution of the Osteichthyes // J. Morphol. V. 38. № 1. P. 105–145.
Sewertzoff A.N., 1926. Studies on the bony skull of fishes. I. Structure, development of the bony skull of Acipenser ruthenus // Q. J. Microsc. Sci. V. 70. P. 451–540.
Sewertzoff A.N., 1928. The head skeleton, muscles of Acipenser ruthenus // Acta Zool. V. 9. № 1–2. P. 193–319.
Stensio E.A., 1925. Triassic fishes from Spitzbergen, Part II // Kungl. Svenska Vetenskapsakademiens Handlingar. V. 2. № 1. P. 1–261.
Stensio E.A., 1932. Triassic fishes from East Greenland collected by the Danish expeditions in 1929–1931 // Meddel. Gronland. V. 83. № 3. P. 1–305.
Walker M., Kimmel C., 2007. A two-color acid-free cartilage, bone stain for zebrafish larvae // Biotech. Histochem. V. 82. № 1. P. 23–28.
Walther J., 1883. Die Entwickelung der Dockknochen am Kopfskelet des Hechtes // Jenaische Zeitschrift Naturwiss. V. 16. P. 1–87.
Warth P., Hilton E.J., Naumann B., Olsson L., Konstantinidis P., 2017. Development of the skull, pectoral girdle in Siberian sturgeon, Acipenser baerii, Russian sturgeon, Acipenser gueldenstaedtii (Acipenseriformes: Acipenseridae) // J. Morphol. V. 278. № 3. P. 418–442.
Warth P., Hilton E.J., Naumann B., Olsson L., Konstantinidis P., 2018. Development of the muscles associated with the mandibular, hyoid arches in the Siberian sturgeon, Acipenser baerii (Acipenseriformes: Acipenseridae) // J. Morphol. V. 279. № 2. P. 163–175.
Watson D.M.S., 1925. The structure of certain palaeoniscids, the relationships of that group with other bony fishes // Proc. Zool. Soc. Lond. V. 54. P. 815–870.
Weisel G.F., 1979. Histology of the feeding, digestive organs of the shovelnose sturgeon, Scaphirhynchus platorynchus // Copeia. № 3. P. 518–525.
Wu F., Mee-mann C., Sun Y., Xu G., 2013. A new Saurichthyiform (Actinopterygii) with a crushing feeding mechanism from the Middle Triassic of Guizhou (China) // PLoS One. V. 8. № 12. P. e81010.
Дополнительные материалы отсутствуют.
Инструменты
Журнал общей биологии