Журнал общей биологии, 2019, T. 80, № 5, стр. 386-400
Механизм гипераккумуляции цезия: как растения противостоят питательным дисбалансам в условиях загрязнения
О. С. Железнова 1, *, С. А. Тобратов 1
1 Рязанский государственный университет им. С.А. Есенина
390000 Рязань, ул. Свободы, 46, Россия
* E-mail: zheleznova_rzn@mail.ru
Поступила в редакцию 06.09.2018
После доработки 04.02.2019
Принята к публикации 21.06.2019
Аннотация
Изложены результаты теоретических, полевых и лабораторных исследований по выявлению растений-гипераккумуляторов радиоцезия (137Cs) в экосистемах центра Русской равнины и изучению ключевых черт их физиологии, определяющих способность к повышенному накоплению 137Cs в надземной фитомассе (в первую очередь в наиболее физиологически активных органах – листьях и годичных побегах). Исследования проведены в смешанных лесах дальней зоны радиоактивных выпадений спустя 30 лет после аварии на Чернобыльской АЭС (юго-запад Мещерской низменности в пределах Рязанской обл. РФ). На основе измерений удельной активности 137Cs и 40К в образцах фитомассы и почв рассчитывались коэффициенты дискриминации 40К/137Cs. Установлено, что 137Cs, в отличие от его геохимического аналога 40К, накапливается преимущественно в корневых системах. Однако некоторым видам, наоборот, свойственна гипераккумуляция 137Cs, характерная для зеленых мхов (роды Polytrichum, Dicranum, Pleurozium) и папоротников (Pteridium aquilinum), а также для Calluna vulgaris, листьев и тонких ветвей Quercus robur, Populus tremula, Betula pubescens. Интерпретация полученных данных осуществлена с привлечением результатов исследований в области радиоэкологии, биохимии минерального питания растений и физиологии мембранного транспорта. Разработана концептуальная модель вовлечения 137Cs в физиологические процессы. Установлено, что существует специфичная группа гипераккумуляторов 137Cs, не обладающая филогенетическим единством, но объединяемая общностью механизмов минерального питания. Ключевая особенность гипераккумуляторов 137Cs – способность к интенсивному питанию нитратной формой азота и ее восстановлению в надземных органах. Она характерна как для видов, происходящих из аридных областей низких широт (Q. robur, представители Amaranthaceae, Chenopodioideae, Asteraceae), с ариданитным типом питания, так и для гумидокатных пионерных видов (P. tremula, B. pubescens) с быстрыми темпами роста и высокой нитратредуктазной активностью в листьях. Такие растения могут быть использованы в целях фиторемедиации загрязненных 137Cs почв при невысоком уровне загрязнения.
Биологические особенности растений – один из факторов, определяющих интенсивность поглощения цезия (Cs) и его радиоактивного изотопа 137Cs, а также их накопления в фитомассе подземных и надземных органов (Willey et al., 2005; Watanabe et al., 2007). В настоящее время влияние генотипических факторов (т.е. биологических особенностей вида) на биопоглощение элементов изучено недостаточно (Nimis, 1996; Романцова, 2012; Alsaffar et al., 2015). По-видимому, это связано в первую очередь с тем, что основное внимание в исследованиях традиционно уделяется более “сильным” факторам, к числу которых относятся почвенные свойства. Так, установлено, что накопление 137Cs древесными растениями в зависимости от типа почвы изменяется в 20–200 раз, от режима увлажнения – в 3–70 раз, а в зависимости от видовой принадлежности растений – только в 2–3 раза (Calmon et al., 2009). Тем не менее в ряде случаев поглощение элементов растением под влиянием генотипического фактора может изменяться в 10–30 или даже в 100 и более раз (Ковалевский, 2010). Кроме того, для современного – квазиравновесного – этапа радиоактивного загрязнения лесных экосистем в результате аварии на Чернобыльской АЭС типичны медленные изменения в биологической доступности 137Cs в почве (Calmon et al., 2009) и, следовательно, возрастание относительной роли генотипического фактора в поглощении и аккумуляции данного радионуклида.
Влияние биологических особенностей растений на их химический состав проявляется в существовании закрепленных наследственностью альтернативных стратегий устойчивости растений к поллютантам: индикации, избегания (исключения) и истинной толерантности (гипераккумуляции) (Ernst, 2006; Серегин, 2009; Maestri et al., 2010; Sofo et al., 2012).
Феномен гипераккумуляции – накопления элементов в надземных органах (как правило, в листьях) в концентрациях, превышающих их содержание в корневых системах и в почве, – достаточно активно изучается в отношении тяжелых металлов, особенно в связи с перспективами фиторемедиации загрязненных почв (Cappa, Pilon-Smits, 2013; Liu et al., 2013; Lu et al., 2014). Поиски гипераккумуляторов 137Cs также ведутся (Radionuclide contamination…, 2014; Gupta et al., 2016), однако технология фиторемедиации в данном случае менее эффективна, поскольку не обеспечивает удаления значительных количеств радионуклида, сопоставимых с санационными возможностями радиоактивного распада. Тем не менее фитоэкстракция 137Cs может быть полезной для мелиорации больших территорий с низким уровнем его удельной активности; при этом приближение загрязнения к фоновому уровню произойдет в среднем на 30 лет раньше, чем при отсутствии каких-либо мероприятий по очистке почвы (Dushenkov et al., 1999; Dushenkov, 2003). Подчеркнем, что в случае низкого уровня загрязнения территории радиоцезием его воздействие на растения может быть связано не столько с гамма-излучением, сколько с возможными питательными дисбалансами и нарушением гомеостаза организма. Известно, что даже небольшие (в том числе сезонные) флуктуации концентраций элементов в почвенном растворе существенны для растений и вызывают разнообразные приспособительные реакции (в том числе изменение кинетики поглощения элементов); при этом даже незначительные отклонения от фоновых концентраций, особенно при дефиците эссенциальных элементов, могут вызывать питательные дисбалансы (Nutrient acquisition…, 2005; Marschner’s mineral…, 2012). Установлено, что Cs, добавленный в питательную среду, способен изменять стабильность SH-групп, влиять на активность ферментов, снижать интенсивность роста и деления клеток (Sahr et al., 2004), уменьшать внутриклеточные концентрации сахарозы, глюкозы, аланина, малата и фосфата (Le Lay et al., 2006). При этом закономерности биопоглощения и транспорта, установленные в исследованиях со стабильным Cs, аналогичны таковым для его радиоактивного изотопа 137Cs (Wiesel, 2010).
Негативное воздействие 137Cs (как и стабильного Cs) на растения усугубляется тем, что он является геохимическим аналогом важнейшего биофильного элемента – калия (Hampton et al., 2005). Поглощаясь через калиевые транспортные системы, 137Cs конкурирует с калием за биохимические функции, но не может заменить его в метаболизме (Wiesel, 2010). При этом токсичное воздействие на побеги растений может быть связано не с избытком цезия, а с недостатком калия, что особенно актуально при дефиците питательных элементов в условиях песчаных почв и кислой реакции среды: коэффициенты накопления 137Cs в таком случае часто превышают 1 (Zhu, Smolders, 2000; Le Lay et al., 2006). Таким образом, виды, гипераккумулирующие 137Cs, способны сохранять гомеостаз организма и противостоять питательным дисбалансам, тогда как возможное мутагенное влияние поглощенного 137Cs гипераккумуляцией не устраняется.
К настоящему времени установлено, что гипераккумуляция 137Cs наиболее часто встречается среди амарантовых (Amaranthaceae) и маревых (Chenopodiaceae) (Lasat et al., 1998; Zhu, Smolders, 2000; Willey, Tang, 2006; Wiesel, 2010), а также характерна для Calluna vulgaris (Bystrzejewska-Piotrowska et al., 2005). При этом избыточное накопление Cs (в том числе и радиоактивного 137Cs) в надземной фитомассе, как правило, связывается со степенью калиефильности растений и их способностью использовать нитратный азот (Willey, Tang, 2006; Calmon et al., 2009). Однако на основе лишь этих признаков, характерных для большого числа самых разнообразных растений, прогнозировать их гипераккумуляционные свойства в отношении 137Cs невозможно. Очевидно, что для эффективного поиска растений-гипераккумуляторов 137Cs необходимо более четко представлять, какие черты их физиологии определяют способность к повышенному накоплению данного элемента в надземной фитомассе.
Цель настоящей работы – изучить особенности аккумуляции 137Cs разными видами растений лесных экосистем дальней зоны чернобыльских выпадений на этапе квазиравновесного состояния радиоактивного загрязнения и дать объяснение механизма гипераккумуляции 137Cs.
МАТЕРИАЛЫ И МЕТОДЫ
Территория исследования – ландшафты южной части Мещерской провинции, расположенные в центре Восточно-Европейской равнины (Рязанская обл. РФ) и относящиеся к зоне хвойно-широколиственных лесов (Природа Рязанской области, 2008).
Характерная особенность Южной Мещеры – малоконтрастный рельеф влажных, сырых и заболоченных песчаных равнин. Затрудненный дренаж и бедные элементами минерального питания песчаные субстраты, являющиеся наследием четвертичных оледенений, определяют специфику почвенно-растительных условий района исследований (Железнова, Тобратов, 2017). Автоморфные дерново-подзолы песчаные в условиях ослабления дренажа сменяются дерново-подзолами глеевыми и органогенными почвами, приуроченными к заболоченным котловинам и плейстоценовым эрозионным ложбинам. Поскольку биодоступность 137Cs обратно пропорциональна содержанию тонких гранулометрических фракций (Nimis, 1996), крайне низкое содержание в песчаных и супесчаных почвах Мещеры глинистых минералов приводит к повышенной интенсивности перехода 137Cs в растения; аналогичные процессы свойственны и органогенным почвам. К видам-эдификаторам растительных сообществ относятся Pinus sylvestris, Betula pubescens, B. pendula, Populus tremula, в условиях повышенной трофности субстрата – также Quercus robur, Picea abies, Alnus glutinosa.
В результате аварии на Чернобыльской АЭС территория исследования подверглась загрязнению техногенными радионуклидами, в том числе 137Cs. Характерной особенностью почвенного загрязнения 137Cs в пределах района исследований является высокая пространственная мозаичность значений его удельной активности, зависящая от ландшафтных особенностей территории и траектории радиоактивных выпадений (Кривцов и др., 2011). Согласно нашим данным, удельная активность 137Cs в почвах района исследований варьирует в пределах 6.6–138.6 Бк/кг для минеральных почв и 23.1–225.0 Бк/кг для торфяных почв. При этом максимальные значения удельной активности 137Cs в биообъектах могут достигать 2000 Бк/кг (в плодовых телах грибов), но в высших растениях, как правило, не превышают 360 Бк/кг (Железнова, 2017). Таким образом, только максимальные поглощенные дозы гамма-излучения в условиях Южной Мещеры, характерные для представителей царства Fungi, в настоящее время приближаются к пороговому уровню, при котором может наблюдаться увеличение цитогенетических аномалий (0.8 мкГр/ч, что соответствует удельной активности 2100 Бк/кг растительных тканей) (Geras’kin et al., 2013; Geras’kin, 2016). Но для наиболее радиочувствительных видов (например, P. sylvestris) такие значения поглощенной дозы не фиксируются, поэтому на первое место выходят негативные эффекты от возможных дисбалансов минерального обмена.
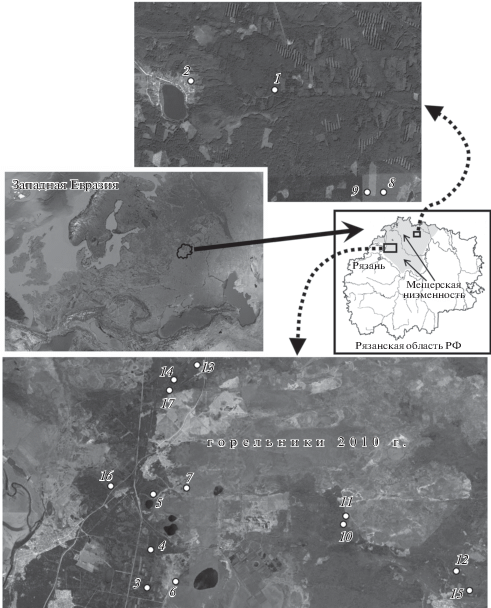
Сезонный отбор образцов почв (горизонт А1) и различных структурных компонентов фитоценозов (надземные и подземные органы деревьев и растений нижних ярусов) осуществлялся в 2013–2014 гг. в соответствии с классическими методиками изучения биологического круговорота (Базилевич и др., 1978). Были отработаны 17 ключевых участков, различных по условиям произрастания и видовой структуре сообществ (табл. 1, рис. 1). Образцы фитомассы измельчали и высушивали до воздушно-сухой массы. Корни тщательно отмывали и высушивали.
Таблица 1.
Краткая характеристика ключевых участков почвенно-биогеохимического опробования
| № | Растительное сообщество | Возраст древостоя (лет) | Подтип почвы* | h**, м |
|---|---|---|---|---|
| 1 | Посадки сосны: 7С2Б1Е***. В подросте и подлеске – дуб (Quercus robur), можжевельник (Juniperus communis), рябина (Sorbus aucuparia), ива (Salix caprea). Верхняя часть пологого склона | 60–65 | Дерново-подзол глеевый иллювиально-железистый | 121.5 |
| 2 | Злаково-разнотравный луг – постагрогенное сообщество: пижма обыкновенная (Tanacetum vulgare), тимофеевка луговая (Phleum pratense), мятлик луговой (Poa pratensis), щавель конский (Rumex confertus) с отдельными куртинами ивы. Влажная плоская песчаная равнина | – | Агродерново-подзол глеевый иллювиально-железистый | 121.2 |
| 3 | Посадки сосны (7С3Б+Ос) со значительным видовым разнообразием в кустарниковом и травяном ярусах. Влажная плоская песчаная слабонаклонная равнина | 20–40 | Дерново-подзол глееватый | 119.1 |
| 4 | Сосновый лес: 9С1Б. Свежая песчаная бугристо-волнистая равнина, водораздельное положение | 90 | Дерново-подзол псевдофибровый | 118.2 |
| 5 | Разреженный сосново-березовый лес V класса бонитета: 5С5Б. Верховое болото в термокарстовом понижении. Травяно-кустарничковый ярус: багульник болотный (Ledum palustre), голубика обыкновенная (Vaccinium uliginosum), мирт болотный (Chamaedaphne calyculata), пушица влагалищная (Eriophorum vaginatum). В наземном ярусе – преобладание сфагнума (р. Sphagnum) с участием зеленых мхов (р. Polytrichum) | 5–45 (возобновление после пожара 1972 г.) | Торфяная олиготрофная типичная | 116.6 |
| 6 | Постпирогенное травяное сообщество (пожар 2010 г.) с преобладанием кипрея (Chamerion angustifolium) и вереска (Calluna vulgaris). Плоская сырая песчаная равнина на периферии верхового болота | – | Дерново-подзол глеевый оруденелый | 116.3 |
| 7 | Постпирогенное травяное сообщество (пожар 2010 г.): кипрей, орляк обыкновенный (Pteridium aquilinum), вейник наземный (Calamagrostis epigejos). Влажная плоская песчаная равнина | – | Дерново-подзол глееватый | 115.1 |
| 8 | Березняк в условиях слабой дренированности: 10Б+С. Влажная плоская песчаная равнина | 48–51 | Дерново-подзол глеевый иллювиально-железистый | 115.1 |
| 9 | Дубово-осиновый лес в полуболотных условиях: 7Ос3Д+С+Е. Сырая плоская песчаная равнина | в среднем 45 | Дерново-подзол глеевый оруденелый | 114.7 |
| 10 | Ельник в верхней части склона долины р. Белой: 8Е1Б1С. Сырая песчаная сильноволнистая равнина | 50–60 | Подзол глеевый иллювиально-железистый | 112.9 |
| 11 | Заболоченный сосняк: 8С2Б. Заторфованная эрозионная форма 2-го порядка | 60–80 | Торфяно-подзол глеевый оруденелый | 112.4 |
| 12 | Сосняк зеленомошный: 4С2Е2Б2Д. Зеленые мхи представлены родами Polytrichum, Dicranum, Pleurozium. Влажная и сырая слабоволнистая равнина | 50–70 | Дерново-подзол глееватый | 111.4 |
| 13 | Сосняк брусничный в полуболотных условиях: 8С1Б1Е. Окраина термокарстовой депрессии относительной глубиной до 1.5 м | 85 | Дерново-подзол глеевый оруденелый | 110.5 |
| 14 | Сосняк зеленомошный (с орляком) в трансэлювиальном положении: 10С+Б+Е+Д. Зеленые мхи представлены родами Polytrichum, Dicranum, Pleurozium. Влажная песчаная бугристая равнина | 120–130 | Дерново-подзол глееватый | 108.8 |
| 15 | Сосново-дубовый лес: 3С4Д2Ос1Е. Влажная песчаная слабоволнистая наклонная равнина | 90–100 | Подзол глеевый иллювиально-железистый | 107.7 |
| 16 | Крапивный ольшаник: 10Ол; низинное болото. Депрессия на границе трансгрессирующей поймы р. Оки | 45–50 | Торфяная эутрофная типичная | 106.8 |
| 17 | Березово-ольховый лес: 7Ол3Б. Травяной ярус – таволга вязолистная (Filipendula ulmaria), крапива двудомная (Urtica dioica). Низинное болото в староречье | 35–50 | Торфяная эутрофная иловато-торфяная | 105.9 |
Примечание. * Типизация дана в соответствии с Классификацией и диагностикой почв России (Шишов и др., 2004). ** h – абсолютная высота точек биогеохимического опробования. *** Формула древостоя включает название древесного вида (С – сосна, Е – ель, Б – береза, Ос – осина, Д – дуб, Ол – ольха) и коэффициент, определяющий степень его участия (по запасу) в образовании древостоя; сумма всех коэффициентов формулы равняется десяти. Латинские названия растений подлеска и нижних ярусов даются при их первом упоминании в табл. 1. Растения нижних ярусов упомянуты в том случае, если для них рассчитывались величины DF.
Определение удельной активности 137Cs и 40К в отобранных образцах произведено с использованием сцинтилляционного гамма-спектрометра МКС-01А “МУЛЬТИРАД-гамма” с программным обеспечением “Прогресс” (пятикратная повторность измерений с предваряющим каждое измерение контролем фона). 40К – долгоживущий радионуклид, входящий в состав природного калия в количестве 0.012% (Alsaffar et al., 2015) и являющийся индикатором содержания этого важнейшего макроэлемента. Данные о содержании 40К широко применяются для выявления специфики биогеохимических циклов 137Cs и его поведения в биообъектах (Романцова, 2012; Мамихин и др., 2014; Kobayashi et al., 2016).
На основе сезонных значений удельной активности 137Cs и 40К в образцах фитомассы и весовых коэффициентов, соответствующих продолжительности каждого сезона, вычисляли среднегодовые значения удельной активности радионуклидов. Для каждого биообъекта (фракции фитомассы) рассчитан коэффициент дискриминации (DF) 40К/137Cs (по: Zhu, Smolders, 2000):
Величина DF позволяет судить о том, как и на сколько изменяется почвенное соотношение 40К/137Cs в растительном организме по сравнению с почвой. Значения DF > 1 свидетельствуют об активном избирательном поглощении 40К растением. Концентрируя 40К, растение, по сути, “увеличивает разрыв” в почвенном соотношении 40К/137Cs в пользу 40К. Величина DF, близкая к 1, является индикатором пассивного характера поглощения 40К и 137Cs. Отсутствие избирательности мембранного транспорта приводит к тому, что в растительных тканях сохраняется соотношение 40К/137Cs, близкое к таковому в почвах. Значения DF < 1 свидетельствуют о преимущественном, по сравнению с почвой, накоплении в растении 137Cs.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Коэффициенты дискриминации 40К/137Cs как индикатор селективности биологического поглощения элементов – геохимических аналогов
В табл. 2 представлены значения DF, рассчитанные для биообъектов района исследований. Как показано на рис. 2, гистограмма распределения величин DF бимодальна и представлена двумя обособленными совокупностями данных, граница между которыми может быть проведена по классовому промежутку с максимальным значением 8. Правая ветвь гистограммы лежит в области высоких значений DF: ее модальному классу соответствуют величины DF 20–30. Формирующие ее структурные компоненты фитоценозов избирательно концентрируют 40К. Несмотря на разнообразие концентрирующих 40К биообъектов, можно отметить две особенности данной выборки. Во-первых, именно в области высоких значений DF группируется большая часть (71%) всех биообъектов, произрастающих в условиях торфяных почв. Во-вторых, данная выборка представлена преимущественно структурными компонентами надземной фитомассы, а фракции подземных органов составляют лишь 5% (табл. 2).
Таблица 2.
Значения коэффициента дискриминации (DF) 40К/137Cs в биообъектах подтаежных сообществ Южной Мещеры
| Вид (сообщество) | Фракция фитомассы | DF | Вид (сообщество) | Фракция фитомассы | DF |
|---|---|---|---|---|---|
| Pinus sylvestris (1) | Т.К.-древ. | 0.02 | Quercus robur
20 лет (15) |
Древесина | 4.67 |
| Т.К.-кора | 4.17 | Кора | 1.82 | ||
| Тонкие корни | 2.79 | Тонкие ветви | 1.96 | ||
| Pinus sylvestris (4) | Древесина | 10.19 | Листья | 1.53 | |
| Кора | 3.07 | Quercus robur 81 и 20 лет (15) |
Т.К.-древ. | 1.14 | |
| Тонкие ветви | 6.31 | Т.К.-кора | 0.07 | ||
| Хвоя | 3.16 | Тонкие корни | 0.72 | ||
| Pinus sylvestris 40 лет (5) | Древесина | 22.19 | Populus tremula 8–20 лет (15) |
Тонкие ветви | 2.40 |
| Кора | 23.48 | Листья | 1.74 | ||
| Тонкие ветви | 6.63 | Т.К.-древ. | 0.81 | ||
| Хвоя | 12.84 | Т.К.-кора | 1.91 | ||
| Pinus sylvestris 5 лет (5) |
Тонкие ветви | 2.21 | Тонкие корни | 1.19 | |
| Хвоя | 8.71 | Alnus glutinosa (16) |
Древесина | 165.40 | |
| Betula pubescens 40 лет (5) |
Древесина | 38.81 | Кора | 9.95 | |
| Кора | 21.32 | Тонкие ветви | 18.24 | ||
| Тонкие ветви | 8.58 | Листья | 9.05 | ||
| Листья | 2.66 | Корни | 0.07 | ||
| Betula pubescens (8) | Т.К.-кора | 0.16 | Подлесок и нижние ярусы | ||
| Тонкие корни | 0.06 | Злаково-разнотравное сообщество (2) | Надземн. орг. | 13.25 | |
| Populus tremula (9) | Древесина | 3.01 | Подземн. орг. | 3.95 | |
| Кора | 0.68 | Отмерш. орг. | 3.86 | ||
| Тонкие ветви | 1.53 | Convallaria majalis (3) | Надземн. орг. | 33.22 | |
| Листья | 1.85 | Подземн. орг. | 3.06 | ||
| Picea abies (10) | Древесина | 9.37 | Травяно-кустарничковый ярус (5) | Надземн. орг. | 2.39 |
| Кора | 2.91 | ||||
| Тонкие ветви | 3.10 | ||||
| Хвоя | 3.14 | Calluna vulgaris (6) |
Надземн. орг. | 0.20 | |
| Pinus sylvestris (11) | Древесина | 69.23 | Подземн. орг. | 0.22 | |
| Кора | 27.95 | Pteridium aquilinum (7) | Надземн. орг. | 0.89 | |
| Тонкие ветви | 24.39 | Подземн. орг. | 1.90 | ||
| Хвоя | 29.83 | Chamaecytisus ruthenicus (12) | Надземн. орг. | 9.76 | |
| Betula pubescens (12) | Древесина | 0.02 | Подземн. орг. | 1.51 | |
| Кора | 2.38 | Convallaria majalis (12) | Подземн. орг. | 0.43 | |
| Тонкие ветви | 1.88 | ||||
| Листья | 1.89 | Зеленые мхи (14) | Надземн. орг. | 0.42 | |
| Т.К.-древ. | 2.89 | Vaccinium vitis-idaea (13) |
Надземн. орг. | 2.13 | |
| Т.К.-кора | 5.00 | Подземн. орг. | 2.47 | ||
| Тонкие корни | 0.04 | Pteridium aquilinum (14) | Надземн. орг. | 0.39 | |
| Quercus robur 81 год (15) | Древесина | 4.40 | Подземн. орг. | 0.03 | |
| Кора | 0.29 | Зеленые мхи (14) | Надземн. орг. | 0.42 | |
| Тонкие ветви | 1.88 | Травяное сообщество (17) | Надземн. орг. | 23.29 | |
| Листья | 1.93 | Подземн. орг. | 8.44 | ||
Примечание. В скобках указан номер ключевого участка опробования (см. табл. 1, рис. 1). Т.К.-древ. – древесина толстых корней; Т.К.-кора – кора толстых корней; Надземн. орг. – надземные органы растений; Подземн. орг. – подземные органы растений; Отмерш. орг. – побеги предыдущего вегетационного периода, отобранные в апреле–мае. Диаметр тонких ветвей и тонких корней ≤ 5 мм. Курсивом выделены значения DF < 1, полужирным курсивом – значения DF 1–3.
Рис. 2.
Распределение значений коэффициента дискриминации (DF) 40К/137Cs для биообъектов подтаежных сообществ Южной Мещеры.
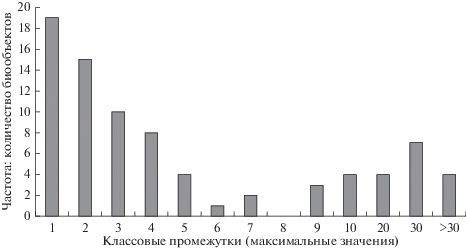
Первая из отмеченных особенностей – концентрирование 40К растениями торфяных почв, приводящее к существенному сдвигу почвенного соотношения 40К/137Cs в пользу 40К в растительных тканях, – вполне закономерна. Она объясняется способностью растений обеспечивать гомеостаз своего организма в условиях дефицита необходимого элемента питания. Степень концентрирования ионов в растении особенно высока при их недостатке в питательной среде (Физиология растений, 2005). При этом в условиях торфяных почв происходит повышенная аккумуляция в растениях не только 40К, но и техногенного 137Cs, что связано со значительной подвижностью данных элементов из-за отсутствия их обменного закрепления на глинистых минералах (Щеглов, 2000). Однако, благодаря избирательности мембранных транспортных систем, 137Cs накапливается в основном пассивно за счет его повышенной биодоступности в торфяной почве, а для 40К характерно ярко выраженное активное концентрирование.
Вторая из отмеченных закономерностей – тенденция преимущественного накопления 40К надземной фитомассой. Ряды относительного распределения 137Cs и 40К в структурных компонентах древесных растений Южной Мещеры выглядят следующим образом:
для 137Cs: корни > листья (хвоя) > тонкие ветви (диаметр ≤ 5 мм) > кора > древесина;
для 40К: листья (хвоя) > тонкие ветви (диаметр ≤ ≤ 5 мм) > кора > древесина > корни.
Как следует из приведенных рядов относительного распределения 137Cs и 40К, фундаментальное различие в характере аккумуляции данных элементов заключается в их контрастном распределении между фитомассой надземных и подземных органов. 40К активно поступает в побег, в то время как 137Cs накапливается преимущественно в корневых системах. Корневой барьер, препятствующий транспорту 137Cs в надземную фитомассу, обусловлен спецификой транспортных механизмов, обеспечивающих загрузку элементов в ксилему. Благодаря селективности выходных и входных ионных каналов клеток, окружающих сосуды ксилемы, обеспечивается, с одной стороны, ограниченное поступление 137Cs из корня в надземные органы и, с другой стороны, его эффективная транслокация в обратном направлении, что в совокупности препятствует аккумуляции 137Cs в побегах (Физиология растений, 2005).
Несмотря на различия в накоплении 137Cs и 40К фитомассой корней и побегов, распределение данных элементов по фракциям надземной фитомассы в целом аналогично. Максимальное содержание 137Cs и 40К характерно для фотосинтезирующих органов деревьев, минимальное – для древесины ствола. Способность 137Cs, как и 40К, аккумулироваться в наиболее физиологически активных органах показана в целом ряде исследований (Hornik et al., 2007; Yoshida et al., 2011; Nobori et al., 2014). Отметим, что эта способность в отношении 137Cs не может быть признана благоприятной, поскольку она обусловливает достаточно активное его участие в рецикличной миграции.
Левая часть гистограммы распределения на рис. 2 лежит в области сниженных значений DF. На эту часть выборки приходится 96% фракций подземных органов и лишь 29% биообъектов, произрастающих на торфяных почвах, что, исходя из вышеизложенного, является вполне закономерным. Модальным классом выборки является классовый промежуток со значениями DF < 1. Почвенное соотношение 40К/137Cs в биообъектах данного класса сдвигается в пользу 137Cs, что типично для растительных тканей, выполняющих барьерную функцию, например, корневых систем. Однако помимо подземных органов, на долю которых приходится 58% биообъектов модального класса, значения DF < 1 получены также для надземной фитомассы Pteridium aquilinum, Calluna vulgaris и зеленых мхов (роды Polytrichum, Dicranum, Pleurozium).
Повышенная аккумуляция 137Cs мхами хорошо известна и обусловлена их упрощенной анатомической дифференциацией (Ковалевский, 2010). У мхов, как наиболее древних и примитивных организмов, отсутствуют органы и ткани, выполняющие функции антиконцентрационных физиологических барьеров. Поэтому для мхов характерно безбарьерное накопление не только 137Cs, но и, как указывает А.Л. Ковалевский (2010), ряда других элементов: урана, молибдена, свинца, серебра, золота, селена, циркония, олова.
Избыточное накопление 137Cs надземными органами P. aquilinum, как и другими видами папоротников (Polypodiophyta), – также достаточно универсальная закономерность, проявляющаяся в широком спектре экологических условий ближней и дальней зон воздействия аварии на Чернобыльской АЭС (Щеглов, 2000). При этом повышенная аккумуляция 137Cs в вайях папоротников объясняется, как правило, расположением их корневой системы в подстилке и верхнем слое почвы, где активность 137Cs максимальна (Butkus, Konstantinova, 2005). Аналогичные объяснения, касающиеся ряда других видов с поверхностной корневой системой, приводятся в других работах (Nimis, 1996; Vinichuk et al., 2010). Однако, на наш взгляд, причину повышенной аккумуляции 137Cs папоротником P. aquilinum – древним организмом, представителем палеофита – следует искать не только в особенностях расположения его подземных органов, но и в специфике его мембранных транспортных систем. Данное предположение косвенно подтверждается результатами исследований Arabidopsis thaliana и ряда сельскохозяйственных культур (Hampton et al., 2005; Kobayashi et al., 2016).
Особого внимания заслуживают также биообъекты, имеющие близкие к 1 (1–3) значения DF. Такие величины DF, как следует из рис. 2, часто встречаются в мещерских сообществах. При этом подземные органы составляют лишь 30.3% биообъектов данных классов. Остальные фракции фитомассы с DF 1–3: листья и тонкие ветви Quercus robur (независимо от возраста) и Populus tremula (из разных точек опробования), кора Q. robur, листья Betula pubescens, побеги Vaccinium vitis-idaea. Таким образом, для перечисленных биообъектов характерны относительно слабое концентрирование 40К и сохранение величины соотношения 40К/137Cs, близкой к почвенному. Следовательно, названные выше фракции фитомассы относительно обогащены 137Cs, хотя и не выполняют барьерных функций (подобно корневым системам). Закономерным в этой связи является вопрос о причинах слабой избирательности поглощения элементов – геохимических аналогов и аккумуляции техногенного 137Cs в надземных органах ряда растений.
Модель механизма гипераккумуляции 137Cs растениями
Для интерпретации результатов полевых и лабораторных исследований был необходим анализ и систематизация данных, полученных в области радиоэкологии, биохимии минерального питания и физиологии мембранного транспорта растений. За последние 5–15 лет фундаментальными исследованиями научных школ США, Японии, Великобритании и Швеции изучены механизмы поглощения и транспорта радиоизотопов цезия на клеточном и тканевом уровнях. Однако разработанность данных проблем, к сожалению, недостаточна: исследования проводятся на ограниченном спектре видов (в основном сельскохозяйственные растения), многие механизмы транспорта цезия и их генетическая регуляция до сих пор неизвестны, радиоэкологические эффекты на экосистемном уровне также слабо изучены (Geras’kin, 2016), что затрудняет интегральные оценки масштаба вовлечения 137Cs в биогенную миграцию.
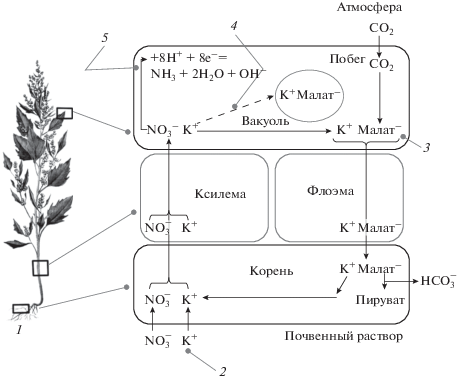
Тем не менее именно анализ опубликованных результатов эколого-биохимических исследований обеспечил переход от фиксации локальных пространственных и видовых особенностей биопоглощения радиоцезия в ландшафтах Южной Мещеры (эмпирический уровень научного познания) к их объяснению с позиции фундаментальных знаний (теоретический уровень). Тем самым полученные нами полевые данные послужили иллюстрацией проявления общефизиологических, универсальных закономерностей минерального питания растений. Результатом проведенного анализа, в частности, стала концептуальная модель механизма гипераккумуляции 137Cs растениями (рис. 3). Характеристика предложенной нами модели предполагает ответ на два основных вопроса:
Рис. 3.
Модель механизма гипераккумуляции цезия и его радиоактивного изотопа 137Cs растениями. 1 – растение, которое может восстанавливать нитратный азот в побеге; 2 – калий или химические аналоги калия, в том числе Cs и его радиоактивный изотоп 137Cs; 3 – органические кислоты (например, малат) синтезируются для нейтрализации гидроксид-ионов, образующихся в результате восстановления ${\text{NO}}_{3}^{ - }$; 4 – калий (или его геохимические аналоги) аккумулируется в вакуолях в случае, если почвы богаты калием (когда поглощение корнями катионов и анионов (K+ и ${\text{NO}}_{3}^{ - }$) сбалансировано); 5 – восстановление ${\text{NO}}_{3}^{ - }$ осуществляется с помощью ферментов нитрат- и нитритредуктаза.
1) Какими чертами должно обладать растение-гипераккумулятор любого элемента, например тяжелых металлов (ТМ) или радионуклидов?
2) Какова взаимосвязь гипераккумуляции 137Cs с физиологическими аспектами азотного и калийного питания растений?
Известно, что признаками растений-гипераккумуляторов ТМ являются: повышенная способность к корневому поглощению ТМ, активная транслокация из корней в надземные органы, способность к детоксикации и секвестрации ТМ в побегах (Verbruggen et al., 2009; Singh et al., 2016). Биохимические механизмы детоксикации избытка ТМ в побегах необходимы для поддержания элементного гомеостаза в растениях. Один из таких механизмов – комплексообразование ионов ТМ с лигандами, в роли которых могут выступать органические кислоты или хелаторы белковой природы (например, фитохелатины) (Cappa, Pilon-Smits, 2013; Lu et al., 2014; Nikalje, Suprasanna, 2018). Закономерным является вопрос о том, как названные признаки реализуются в отношении гипераккумуляторов Cs и 137Cs.
Первый признак – повышенное корневое поглощение 137Cs – предполагает наличие особых мембранных транспортных систем. Все растения имеют белки-транспортеры, селективно поглощающие жизненно необходимый элемент – калий, но различаются набором белков, катализирующих неспецифическое поглощение калия и цезия (Wiesel, 2010). Повышенная аккумуляция 137Cs, таким образом, может быть связана с повышенной активностью неспецифических белков-транспортеров. При этом неспецифический тип К-транспортной системы, LATS (low-affinity transport systems), обладающий низким сродством к иону, функционирует в корнях растений в условиях высокой концентрации ионов в окружающей среде (Coskun et al., 2017).
Второй признак – транслокация 137Cs из корней в надземные органы – предполагает, что у растений-гипераккумуляторов должен отсутствовать блокинг транспорта данного элемента на этапах загрузки в ксилему и поступления в листья. Отметим, что являющееся нормой преимущественное накопление 137Cs в корнях растений-негипераккумуляторов вовсе не означает, что данный элемент совсем не поступает в надземную фитомассу. Поступивший в побеги 137Cs транспортируется по флоэме, причем его флоэмный транспорт может быть даже более интенсивным, чем транспорт калия (Zhu, Smolders, 2000; Yan et al., 2013). При этом активное участие 137Cs в рециркуляции (и, как результат, его возвращение в корни у негипераккумуляторов) может быть следствием селективного поглощения калия клетками листьев.
Третий признак – способность к детоксикации и секвестрации в побегах – предполагает, что поступивший в листья Cs и 137Cs, вместо активного участия во флоэмном транспорте и возвращения в корни, должен переводиться в нетоксичное состояние. Возможным механизмом такой детоксикации может быть, по аналогии с натрием, изоляция 137Cs и Cs в вакуоли (Schroeder et al., 2013; Akamatsu et al., 2014).
Растения, произрастающие в условиях избытка почвенных катионов (в том числе К+), характеризуются, как правило, нитратным (${\text{NO}}_{3}^{ - }$) источником азотного питания. Еще в 1960-е – начале 1970-х годов была предложена модель внутренней циркуляции ионов в сосудах растений (Marschner’s mineral…, 2012). Согласно данной модели, у растений, восстанавливающих ${\text{NO}}_{3}^{ - }$ в побеге, для его транспорта в ксилеме в качестве противоиона используется К+. В побеге судьба данных ионов различна: ${\text{NO}}_{3}^{ - }$ восстанавливается, а К+ посредством флоэмного транспорта в комплексе с органическими кислотами поступает в корни. После декарбоксилирования органических кислот К+ снова участвует в качестве противоиона в транспорте ${\text{NO}}_{3}^{ - }$ в побеги. При этом в условиях, когда поглощение катионов и анионов (К+ и ${\text{NO}}_{3}^{ - }$) корнями сбалансировано (т.е. при отсутствии дефицита калия), вместо флоэмного транспорта калия наблюдается аккумуляция его комплексов с органическими кислотами в вакуолях клеток побега (Coskun et al., 2017). Накопление органических кислот, способных образовывать комплексы с К+ и его аналогами, может быть, помимо их наследственно высокого уровня у ряда видов, также следствием восстановления ${\text{NO}}_{3}^{ - }$ (López-Bucio et al., 2000; Liu et al., 2014). Образование органических кислот в присутствии ${\text{NO}}_{3}^{ - }$ согласуется с представлениями о функционировании у растений биохимического рН-стата как механизма нейтрализации токсичных гидроксид-ионов – продуктов ассимиляции ${\text{NO}}_{3}^{ - }$ (Попова, 2009).
Подчеркнем, что модель внутренней циркуляции ионов в сосудах растений, объясняющая совместный ксилемный транспорт ${\text{NO}}_{3}^{ - }$ и K+, применима только к видам, способным восстанавливать ${\text{NO}}_{3}^{ - }$ в побеге. Это очевидно, поскольку если восстановление ${\text{NO}}_{3}^{ - }$ осуществляется в корнях, то в ксилемный ток поступают уже продукты данного процесса – аминокислоты, не нуждающиеся, в отличие от ${\text{NO}}_{3}^{ - }$, в K+ как противоионе. В восстановлении ${\text{NO}}_{3}^{ - }$ принимает участие фермент нитратредуктаза (NR), локализованный в цитозоле, причем у большинства видов (в том числе древесных растений) – как в корнях, так и в листьях (Smirnoff et al., 1984; Kozlowski, Pallardy, 1997; Black et al., 2002). При этом процент ${\text{NO}}_{3}^{ - }$, восстановленного в подземной или надземной фитомассе, варьирует в зависимости от экологических условий (температуры, освещенности, уровня доступного ${\text{NO}}_{3}^{ - }$ в почве) и генетического фактора (видовых и сортовых особенностей растений).
Рассмотрев различные аспекты азотного и калийного питания растений, попытаемся применить их для объяснения механизма гипераккумуляции 137Cs.
На богатых почвах с повышенным содержанием элементов минерального питания растениям местных флор в процессе эволюции не требовалось идти по пути развития высокой специализации корневых транспортных систем, чтобы “уловить” дефицитные элементы. Поэтому у таких растений функционирует неспецифический тип К-транспортной системы (LATS), способный к эффективному поглощению не только калия, но и его химических аналогов, в том числе стабильного Cs и 137Cs. Повышенное содержание солей в наибольшей степени свойственно почвам аридных ландшафтов, автоморфные позиции которых характеризуются непромывным типом водного режима. Растения местных флор аридных ландшафтов – это, как правило, ариданитные виды, характеризующиеся активным поглощением анионогенных элементов (в том числе NO3–), обладающих повышенной биодоступностью в щелочной среде (Перельман, Касимов, 1999). Наряду с ${\text{NO}}_{3}^{ - }$, ариданитные растения с помощью LATS интенсивно поглощают и его противоион – K+, а также его геохимические аналоги, в том числе 137Cs (в случае его наличия в почве). При этом рециркуляция калия, активная в К-дефицитных условиях, у ариданитных видов снижена: формируя комплексы с органическими кислотами, калий (и, следовательно, “идущий по его пути” 137Cs) аккумулируется в побегах, образуя вакуолярный пул. Таким образом, такие аспекты физиологии растений, как корневое поглощение ${\text{NO}}_{3}^{ - }$ и K+, восстановление ${\text{NO}}_{3}^{ - }$ в надземной фитомассе, образование повышенных количеств органических кислот в побегах и гипераккумуляция 137Cs, являются звеньями единого процесса – нитратного питания ариданитных видов растений (рис. 3).
С этих позиций находит объяснение тот факт, что подавляющая часть известных к настоящему времени гипераккумуляторов 137Cs (амарантовые (Amaranthaceae) и маревые (Chenopodiaceae)) – это представители порядка Caryophyllales. Значительная часть видов в этом порядке – ариданитные растения, приспособленные к произрастанию в условиях повышенной солености почв и засушливого климата тропических и субтропических пустынь и полупустынь (Жизнь растений, 1980). Известно, что именно для тропических и субтропических видов характерно восстановление ${\text{NO}}_{3}^{ - }$ преимущественно в надземных органах (Andrews, 1986).
Среди других таксономических групп именно ариданитные растения накапливают в побегах 137Cs в повышенных количествах. Так, согласно Ф.Р. Зайдельману (2013), пионерными видами пожарищ, поверхность которых покрыта пирогенными образованиями (продуктами сгорания торфа с экстремально щелочными условиями), являются Artemisia vulgaris и Calamagrostis epigeios. Способность этих видов произрастать в условиях экстремально высоких рН позволила нам предположить, что они, возможно, могут гипераккумулировать 137Cs. Примечательно, что данное предположение полностью подтверждается результатами ряда исследований (Ефремов и др., 2005; Рахимова, 2014); кроме того, другие упоминаемые авторами растения, сорбирующие 137Cs (Tanacetum vulgare и Achillea millefolium), – это, так же как и A. vulgaris, ариданитные представители сем. Asteraceae, поэтому избыточное накопление 137Cs в их надземных органах вполне ожидаемо. Закономерным является также установленный нами факт повышенной аккумуляции 137Cs в листьях и тонких ветвях дуба. Quercus robur – ариданитный вид, предпочитающий почвы с нейтральной или слабощелочной реакцией и даже переносящий умеренную солонцеватость (Биологическая флора…, 1990). Даже в условиях гумидных подтаежных экосистем Q. robur активно поглощает анионогенные элементы, в первую очередь ${\text{NO}}_{3}^{ - }$ (Кривцов и др., 2011). Одним из звеньев этого поглощения является повышенная аккумуляция 137Cs в листьях и тонких ветвях (табл. 2).
Помимо ариданитного дуба, сниженные значения DF получены нами также для листьев Populus tremula и Betula pubescens – гумидокатных видов, происходящих из гумидных областей и активно поглощающих катионогенные элементы (Перельман, Касимов, 1999). Это, однако, не противоречит изложенному выше механизму гипераккумуляции 137Cs ариданитными видами, поскольку ключевым моментом в нашем объяснении является не ариданитность как таковая, а способность растения к усиленному питанию нитратной формой азота и ее восстановлению в побеге. Ариданитность – лишь одна из предпосылок эффективного поглощения ${\text{NO}}_{3}^{ - }$. Другая предпосылка, определяющая темпы поглощения ${\text{NO}}_{3}^{ - }$, связана с особенностями жизненной стратегии растений. Виды с рудеральной стратегией роста по Грайму (быстрорастущие, часто сорные растения) (Plant strategies…, 2001) характеризуются усиленным поглощением нитратной формы азота, которое сопровождается повышенным синтезом NR в листьях (Havill et al., 1974). Это является адаптацией к ускоренной ассимиляции ${\text{NO}}_{3}^{ - }$, что соответствует требованиям быстрого роста рудеральных видов. Характерные для начальных стадий восстановительной сукцессии пионерные виды деревьев (береза и осина) также являются рудералами и имеют повышенную способность к восстановлению ${\text{NO}}_{3}^{ - }$ в листьях по сравнению с видами поздних стадий сукцессий (Clough et al., 1989; Stewart et al., 1989). Таким образом, предложенная нами модель гипераккумуляции 137Cs применима и для гумидокатных растений – B. pubescens и P. tremula, аккумуляция 137Cs которыми определяется их рудеральностью.
Гипераккумулятором 137Cs является также представитель сем. Ericaceae – Calluna vulgaris (DF < 1, табл. 2). На первый взгляд, способность вереска накапливать повышенное количество 137Cs в побегах достаточно неожиданна. Данный вид не относится ни к рудералам, ни к ариданитным растениям: его современный ареал занимает большую часть Европы, за исключением засушливых регионов Средиземноморья и юго-востока Восточно-Европейской равнины (Санников и др., 2013). На основе метода почвенной подкормки растений ${\text{NO}}_{3}^{ - }$ установлено, что для большинства представителей сем. Ericaceae активность NR в листьях не обнаруживается ни до, ни после подкормки (Havill et al., 1974). Таким образом, NR, являясь субстрат-индуцибельным энзимом, имеет конститутивно низкую активность у ряда видов, в первую очередь у большинства вересковых. Низкие темпы их роста и предпочтение ими кислых, бедных элементами минерального питания почв сопровождаются ограниченной индуцибельностью NR в листьях, несмотря на почвенную подкормку ${\text{NO}}_{3}^{ - }$. Примечательно, что исключением из этого правила является C. vulgaris, а также Arbutus unedo (Smirnoff et al., 1984). У этих видов, в отличие от остальных вересковых, активность NR существенно повышалась при подкормке ${\text{NO}}_{3}^{ - }$. Следовательно, C. vulgaris и A. unedo, в отличие от других представителей их семейства, способны использовать нитратный азот, восстанавливая его в листьях и образуя при этом органические кислоты, которые, в свою очередь, могут формировать комплексы с К или 137Cs. Таким образом, нахождение C. vulgaris в ряду гипераккумуляторов 137Cs может быть объяснено с рассмотренных выше позиций.
Причину, определяющую способность C. vulgaris усваивать ${\text{NO}}_{3}^{ - }$, следует, на наш взгляд, искать в особенностях палеоареала данного вида. Вереск – наиболее эвривалентный среди всех представителей своего семейства, так как его палеоареал включает наиболее разнообразные природные условия и охватывает не только гумидные (умеренные и субарктические), но и аридные (субтропики средиземноморского сектора) регионы Европы, в том числе Канарские, Азорские острова и северо-запад Марокко (Санников и др., 2013). Из-за изначальной приспособленности к обитанию в регионах как с высокими, так и с низкими значениями коэффициента увлажнения, у вереска сохранилась способность усваивать ${\text{NO}}_{3}^{ - }$ как доминирующий источник неорганического азота в условиях нейтральной и щелочной реакции среды. Это отличает вереск от иных представителей сем. Ericaceae, которые обитают в существенно более узких интервалах геохимических параметров (преимущественно в гумидных областях) и приспособлены к питанию не нитратным, а аммонийным азотом. Поэтому именно у вереска проявляется способность к гипераккумуляции 137Cs – процессу, связанному с питанием ${\text{NO}}_{3}^{ - }$.
Факторы гипераккумуляции 137Cs C. vulgaris, очевидно, определяют также способность относительно близкого вида, Vaccinium vitis-idaea, накапливать повышенное количество данного радионуклида в побегах. Однако в последнем случае, по полученным нами данным, тенденция гипераккумуляции является неустойчивой, проявляясь лишь для одного сезона пробоотбора (начало июня). Это согласуется с представлением о сезонной динамике активности NR в листьях растений. Известно, что максимальная активность данного фермента в фотосинтезирующих органах большинства видов приходится на начало–первую половину вегетационного периода и совпадает, следовательно, с периодом максимальной интенсивности ростовых процессов (Clough et al., 1989). В этой связи оправданным является предположение о сезонно обусловленном проявлении активности NR в побегах V. vitis-idaea и связанной с данным фактором сезонной тенденции к гипераккумуляции 137Cs.
ЗАКЛЮЧЕНИЕ
На этапе квазиравновесного состояния радиоактивного загрязнения лесных экосистем в результате аварии на Чернобыльской АЭС, когда существенные изменения в биологической доступности 137Cs в почве отсутствуют, видовые особенности растений могут быть важным фактором, определяющим темпы поглощения 137Cs из почвы и его вовлечения в биологический круговорот.
Фундаментальное различие в характере аккумуляции элементов – геохимических аналогов (137Cs и 40К) заключается в их контрастном распределении между фитомассой надземных и подземных органов. 40К активно поступает в побег, в то время как 137Cs аккумулируется преимущественно в корневых системах.
В то же время в изученных нами подтаежных экосистемах Южной Мещеры существуют и растения-гипераккумуляторы 137Cs, накапливающие его повышенные количества не в корнях, а во фракциях надземной фитомассы. Гипераккумуляторами 137Cs являются зеленые мхи (роды Polytrichum, Dicranum, Pleurozium) и папоротники (Pteridium aquilinum) – древние организмы с отсутствием барьерных тканей. Также в условиях песчаных, супесчаных и органогенных почв Южной Мещеры признаки гипераккумуляторов 137Cs проявляют Calluna vulgaris, Quercus robur, Populus tremula, Betula pubescens. Виды-гипераккумуляторы могут быть использованы для фиторемедиации почв при невысоком уровне радиоактивного загрязнения, когда основное негативное воздействие 137Cs связано с возможными питательными дисбалансами и нарушением гомеостаза растительного организма из-за геохимического подобия 137Cs биофильному калию.
На основании анализа физиологических аспектов азотного и калийного питания растений нами дано возможное объяснение механизма гипераккумуляции 137Cs растениями. Корневое поглощение ${\text{NO}}_{3}^{ - }$ и K+, восстановление ${\text{NO}}_{3}^{ - }$ в надземной фитомассе, образование избыточных количеств органических кислот в побегах и гипераккумуляция 137Cs – это, по сути, звенья единого процесса – эффективного нитратного питания растений. Такое питание характерно как для ариданитных видов (Q. robur, представители Amaranthaceae, Chenopodioideae, Asteraceae), активно поглощающих анионогенные элементы (в том числе ${\text{NO}}_{3}^{ - }$), так и для гумидокатных пионерных видов (P. tremula, B. pubescens), характеризующихся высокой нитратредуктазной активностью в листьях.
Дальнейшие исследования планируется направить на изучение экологических закономерностей биопоглощения радиоактивных элементов, в частности на анализ зависимости накопления 137Cs и 40К одним и тем же видом в разных эдатопах, а также на оценку интегральных экосистемных эффектов рецикличной миграции и долговременного накопления радионуклидов в фитомассе. Считаем необходимым определить степень пространственной (внутриландшафтной) устойчивости обсуждавшихся выше закономерностей биопоглощения 137Cs. Кроме того, следует провести количественные экосистемные оценки миграции радиоцезия: определить удельную интенсивность массопотоков и вклад разных видов, формирующих экосистемы Мещеры, в его биогенную мобилизацию.
Авторы выражают глубокую благодарность С.А. Гераськину и Рецензенту за обстоятельные и ценные критические замечания.
Список литературы
Базилевич Н.И., Титлянова А.А., Смирнов В.В., 1978. Методы изучения биологического круговорота в различных природных зонах. М.: Мысль. 183 с.
Биологическая флора Московской области, 1990. Под ред. Павлова В.Н., Работнова Т.А., Тихомирова В.Н. М.: Изд-во МГУ. 272 с.
Ефремов И.В., Рахимова Н.Н., Янчук Е.Л., 2005. Особенности миграции радионуклидов цезия-137 и стронция-90 в системе почва–растение // Вестн. ОГУ. № 12. С. 42–46.
Железнова О.С., 2017. Комплексная оценка биогеохимической устойчивости экосистем в условиях техногенеза (на примере подтаежных лесов Южной Мещеры). Дисс. … канд. биол. наук. М.: РУДН. 297 с.
Железнова О.С., Тобратов С.А., 2017. Опыт ландшафтного анализа пространственных закономерностей продуктивности зональных экосистем Южной Мещеры // Изв. РАН. Сер. геогр. № 6. С. 47–62.
Жизнь растений, 1980. Под ред. Федорова А.А. Т. 5. Ч. 1. М.: Просвещение. 430 с.
Зайдельман Ф.Р., 2013. Минеральные и торфяные почвы полесских ландшафтов: Генезис, гидрология, агроэкология, мелиорация, защита от пожаров торфяников и лесов, рекультивация. М.: КРАСАНД. 440 с.
Ковалевский А.Л., 2010. Биогеохимия урановых месторождений и методические основы их поисков. Новосибирск: Академ. изд-во “Гео”. 362 с.
Кривцов В.А., Тобратов С.А., Водорезов А.В., Комаров М.М., Железнова О.С., Соловьева Е.А., 2011. Природный потенциал ландшафтов Рязанской области. Рязань: Изд-во РГУ им. С.А. Есенина. 768 с.
Мамихин С.В., Манахов Д.В., Щеглов А.И., 2014. Распределение 137Cs, 90Sr и их химических аналогов в компонентах надземной части сосны обыкновенной в квазиравновесном состоянии // Радиац. биология. Радиоэкология. Т. 54. № 1. С. 72–76.
Перельман А.И., Касимов Н.С., 1999. Геохимия ландшафта. М.: Астрея-2000. 768 с.
Попова Н.Ф., 2009. Роль оксалата в формировании ионного гомеостаза в листьях Amaranthus cruentus L. Дис. … канд. биол. наук. СПб.: С.-П. гос. ун-т. 124 с.
Природа Рязанской области, 2008. Под ред. Кривцова В.А. Рязань: Ряз. гос. ун-т им. С.А. Есенина. 407 с.
Рахимова Н.Н., 2014. Восстановление почв загрязненных радионуклидами методом фитомелиорации // Университетский комплекс как региональный центр образования, науки и культуры. Мат-лы Всерос. науч.-метод. конф. Оренбург. С. 997–1002.
Романцова Н.А., 2012. Особенности биогеохимических циклов цезия-137 в травянистых экосистемах на радиоактивно загрязненной территории Тульской области. Дис. … канд. биол. наук. М.: ФГБУ “Ин-т глобального климата и экологии Росгидромета и РАН”. 126 с.
Санников С.Н., Петрова И.В., Черепанова О.Е., 2013. Палеогеографический очерк истории формирования ареала вереска обыкновенного в Притоболье // Изв. Оренбург. гос. аграр. ун-та. № 6. С. 185–187.
Серегин И.В., 2009. Распределение тяжелых металлов в растениях и их действие на рост. Дисс. … докт. биол. наук. М.: Ин-т физиол. раст. им. К.А. Тимирязева РАН. 333 с.
Физиология растений, 2005. Под ред. Ермакова И.П. М.: Изд. центр “Академия”. 640 с.
Шишов Л.Л., Тонконогов В.Д., Лебедева И.И., Герасимова М.И., 2004. Классификация и диагностика почв России. Смоленск: Ойкумена. 342 с.
Щеглов А.И., 2000. Биогеохимия техногенных радионуклидов в лесных экосистемах: По материалам 10-летних исследований в зоне влияния аварии на ЧАЭС. М.: Наука. 268 с.
Akamatsu M., Komatsu H., Mori T., Adams E., Shin R. et al., 2014. Intracellular imaging of cesium distribution in Arabidopsis using Cesium Green // ACS Appl. Mater. Interfaces. V. 6. № 11. P. 8208–8211.
Alsaffar M.S., Jaafar M.S., Kabir N.A., Ahmad N., 2015. Distribution of 226Ra, 232Th, and 40K in rice plant components and physico-chemical effects of soil on their transportation to grains // J. Radiat. Res. Appl. Sci. V. 8. № 3. P. 300–310.
Andrews M., 1986. The partitioning of nitrate assimilation between root and shoot of higher plants // Plant Cell Environ. V. 9. № 7. P. 511–519.
Black B.L., Fuchigami L.H., Coleman G.D., 2002. Partitioning of nitrate assimilation among leaves, stems and roots of poplar // Tree Physiol. V. 22. № 10. P. 717–724.
Butkus D., Konstantinova M., 2005. Studies of 137Cs transfer in soil-fern system // J. Environ. Eng. Landsc. Manag. V. 13. № 3. P. 97–102.
Bystrzejewska-Piotrowska G., Drożdż A., Stęborowski R., 2005. Resistance of heather plants (Calluna vulgaris L.) to cesium toxicity // Nukleonika. V. 50. № 1. P. 31–35.
Calmon P., Thiry Y., Zibold G., Rantavaara A., Fesenko S., Orlov O., 2009. Radionuclide transfer in forest ecosystems // Quantification of Radionuclide Transfer in Terrestrial and Freshwater Environments for Radiological Assessments. Vienna: International atomic energy agency. P. 330–381.
Cappa J.J., Pilon-Smits E.A.H., 2013. Evolutionary aspects of elemental hyperaccumulation // Planta. V. 239. № 2. P. 267–275.
Clough E.C.M., Pearson J., Stewart G.R., 1989. Nitrate utilization and nitrogen status in English woodland communities // Ann. For. Sci. V. 46. P. 669–672.
Coskun D., Britto D.T., Kronzucker H.J., 2017. The nitrogen–potassium intersection: membranes, metabolism, and mechanism // Plant Cell Environ. V. 40. № 10. P. 2029–2041.
Dushenkov S., 2003. Trends in phytoremediation of radionuclides // Plant Soil. V. 249. № 1. P. 167–175.
Dushenkov S., Mikheev A., Prokhnevsky A., Ruchko M., Sorochinsky B., 1999. Phytoremediation of radiocesium-contaminated soil in the vicinity of Chernobyl, Ukraine // Environ. Sci. Technol. V. 33. № 3. P. 469–475.
Ernst W.H.O., 2006. Evolution of metal tolerance in higher plants // For. Snow Landsc. Res. V. 80. № 3. P. 251–274.
Geras’kin S.A., 2016. Ecological effects of exposure to enhanced levels of ionizing radiation // J. Environ. Radioact. V. 162–163. P. 347–357.
Geras’kin S., Evseeva T., Oudalova A., 2013. Effects of long-term chronic exposure to radionuclides in plant populations // J. Environ. Radioact. V. 121. P. 22–32.
Gupta D.K., Chatterjee S., Datta S., Voronina A.V., Walther C., 2016. Radionuclides: Accumulation and transport in plants // Rev. Environ. Contam. Toxicol. V. 241. P. 139–160.
Hampton C.R., Broadley M.R., White P.J., 2005. Short review: the mechanisms of radiocaesium uptake by Arabidopsis roots // Nukleonika. V. 50. P. 3–8.
Havill D.C., Lee J.A., Stewart G.R., 1974. Nitrate utilization by species from acidic and calcareous soils // New Phytol. V. 73. № 6. P. 1221–1231.
Hornik M., Pipiška M., Sekačova J., Augustin J., 2007. Determination of long distance transport of Cs+, Co2+ and Zn2+ ions in vascular plants by autoradiography and gamma-spectrometry // Nova Biotechnol. V. 7. № 1. P. 33–40.
Kobayashi N.I., Sugita R., Nobori T., Tanoi K., Nakanishi T.M., 2016. Tracer experiment using 42K+ and 137Cs+ revealed the different transport rates of potassium and caesium within rice roots // Funct. Plant Biol. V. 43. № 2. P. 151–160.
Kozlowski T.T., Pallardy S.G., 1997. Physiology of Woody Plants. San Diego: Acad. Press. 411 p.
Lasat M.M., Fuhrmann M., Ebbs S.D., Cornish J.E., Kochian L.V., 1998. Phytoremediation of a radiocesium-contaminated soil: Evaluation of cesium-137 bioaccumulation in the shoots of three plant species // J. Environ. Qual. V. 27. № 1. P. 165–169.
Le Lay P., Sarry J.-E., Isaure M.-P., Kuhn L., 2006. Metabolomic, proteomic and biophysical analyses of Arabidopsis thaliana cells exposed to a caesium stress. Influence of potassium supply // Biochimie. V. 88. № 11. P. 1533–1547.
Liu W.T., Ni J.C., Zhou Q.X., 2013. Uptake of heavy metals by trees: Prospects for phytoremediation // Mater. Sci. Forum. V. 743–744. P. 768–781.
Liu X.X., Zhou K., Hu Y., Jin R., Lu L.L. et al., 2014. Oxalate synthesis in leaves is associated with root uptake of nitrate and its assimilation in spinach (Spinacia oleracea L.) plants // J. Sci. Food Agric. V. 95. № 10. P. 2105–2116.
López-Bucio J., Nieto-Jacobo M.F., Ramírez-Rodríguez V., Herrera-Estrella L., 2000. Organic acid metabolism in plants: From adaptive physiology to transgenic varieties for cultivation in extreme soils // Plant Sci. V. 160. № 1. P. 1–13.
Lu L., Liao X., Labavitch J., Yang X., Nelson E. et al., 2014. Speciation and localization of Zn in the hyperaccumulator Sedum alfredii by extended X-ray absorption fine structure and micro-X-ray fluorescence // Plant Physiol. Biochem. V. 84. P. 224–232.
Maestri E., Marmiroli M., Visioli G., Marmiroli N., 2010. Metal tolerance and hyperaccumulation: Costs and trade-offs between traits and environment // Environ. Exp. Bot. V. 68. № 1. P. 1–13.
Marschner’s Mineral Nutrition of Higher Plants, 2012. Ed. Marschner P. L.: Acad. Press. 672 p.
Nikalje G.C., Suprasanna P., 2018. Coping with metal toxicity – cues from halophytes // Front. Plant Sci. V. 9. https://doi.org/10.3389/fpls.2018.00777
Nimis P.L., 1996. Radiocesium in plants of forest ecosystems // Studia Geobotanica. V. 15. P. 3–49.
Nobori T., Kobayashi N.I., Tanoi K., Nakanishi T.M., 2014. Effects of potassium in reducing the radiocesium translocation to grain in rice // J. Soil Sci. Plant Nutr. V. 60. № 6. P. 772–781.
Nutrient Acquisition by Plants: An Ecological Perspective, 2005. Ed. BassiriRad H. Ecological Studies. V. 181. Berlin: Springer. 347 p.
Plant Strategies, Vegetation Processes, and Ecosystem Properties, 2001. Ed. Grime J.P. Chichester, UK: John Wiley & Sons Ltd. 411 p.
Radionuclide Contamination and Remediation Through Plants, 2014. Eds Gupta D.K., Walther C. Switzerland: Springer. 314 p.
Sahr T., Voigt G., Paretzke H.G., Schramel P., 2004. Caesium-affected gene expression in Arabidopsis thaliana // New Phytol. V. 165. № 3. P. 747–754.
Schroeder J.I., Delhaize E., Frommer W.B., Guerinot M.L., Harrison M.J. et al., 2013. Using membrane transporters to improve crops for sustainable food production // Nature. V. 497. № 7447. P. 60–66.
Singh S., Parihar P., Singh R., Singh V.P., Prasad S.M., 2016. Heavy metal tolerance in plants: Role of transcriptomics, proteomics, metabolomics, and ionomics // Front. Plant Sci. V. 6. https://doi.org/10.3389/fpls.2015.01143
Smirnoff N., Todd P., Stewart G.R., 1984. The occurrence of nitrate reduction in the leaves of woody plants // Ann. Bot. V. 54. № 3. P. 363–374.
Sofo A., Scopa A., Remans T., Vangronsveld J., Cuypers A., 2012. Biochemical and functional responses of Arabidopsis thaliana exposed to cadmium, copper and zinc // The Plant Family Brassicaceae: Contribution Towards Phytoremediation / Eds Anjum N.A., Ahmad I., Pereira M.E., Duarte A.C., Umar S., Khan N.A. N.Y.: Springer. P. 239–263.
Stewart G.R., Pearson J., Kershaw J.L., Clough E.C.M., 1989. Biochemical aspects of inorganic nitrogen assimilation by woody plants // Ann. Sci. For. V. 46. P. 648–653.
Verbruggen N., Hermans C., Schat H., 2009. Molecular mechanisms of metal hyperaccumulation in plants // New Phytol. V. 181. № 4. P. 759–776.
Vinichuk M., Johanson K.J., Rydin H., Rosen K., 2010. The distribution of 137Cs, K, Rb and Cs in plants in a Sphagnum-dominated peatland in eastern central Sweden // J. Environ. Radioact. V. 101. № 2. P. 170–176.
Watanabe T., Broadley M.R., Jansen S., White P.J., Takada J. et al., 2007. Evolutionary control of leaf element composition in plants // New Phytol. V. 174. № 3. P. 516–523.
Wiesel L., 2010. Influence of arbuscular mycorrhizal fungi and the expression of K+/Cs+ transporters on the accumulation of caesium by plants. PhD thesis. Nottingham: Univ. Nottingham. 263 p.
Willey N., Tang S., 2006. Some effects of nitrogen nutrition on caesium uptake and translocation by species in the Poaceae, Asteraceae and Caryophyllidae // Environ. Exp. Bot. V. 58. № 1–3. P. 114–122.
Willey N., Tang S., Watt N.R., 2005. Predicting inter-taxa differences in plant uptake of cesium-134/137 // J. Environ. Qual. V. 34. № 5. P. 1478–1489.
Yan D., Zhao Y., Lu A., Wang S., Xu D., Zhang P., 2013. Effects of accompanying anions on cesium retention and translocation via droplets on soybean leaves // J. Environ. Radioact. V. 126. P. 232–238.
Yoshida S., Watanabe M., Suzuki A., 2011. Distribution of radiocesium and stable elements within a pine tree // Radiat. Prot. Dosimetry. V. 146. № 1–3. P. 326–329.
Zhu Y-G., Smolders E., 2000. Plant uptake of radiocaesium: A review of mechanisms, regulation and application // J. Exp. Bot. V. 51. № 351. P. 1635–1645.
Дополнительные материалы отсутствуют.
Инструменты
Журнал общей биологии